修回日期: 2013-07-09
接受日期: 2013-07-31
在线出版日期: 2013-09-08
目的: 探讨外周血中调节性T细胞来源的转化生长因子β(transforming growth factor-β, TGF-β)在肝细胞癌转移中的作用及临床意义.
方法: 选择原发性肝细胞癌无远端脏器转移患者48例, 伴有远端脏器转移的患者32例(其中肺部转移17例、脑部转移15例), 健康对照54例, 通过检测各组患者血清中白介素-10(interleukin-10, IL-10)、IL-17、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、TGF-β及外周血中调节性T细胞分泌TGF-β的水平来分析细胞因子在肝细胞癌转移中作用.
结果: 通过酶联免疫实验(ELISA)发现发生转移的肝癌患者血清中TNF-α、TGF-β水平明显升高, 跟健康对照组比较, 差异有统计学意义(P<0.05); 同时发现发生转移的肝癌患者血清中TGF-β水平与未转移的肝癌患者比较差异也具有统计学意义(P<0.05). 通过实时定量PCR以及流式细胞仪进一步确认发生转移的肝癌患者血清中高水平TGF-β主要来源于外周调节性T细胞.
结论: TGF-β在肿瘤发生、发展中具有双重作用: 在肿瘤发生的起始阶段TGF-β扮演着肿瘤抑制者的角色, 而在进展期TGF-β起着促使肿瘤细胞浸润转移的作用, 本研究通过检测外周血中调节性T细胞分泌的TGF-β水平发现只有在发生转移的肝癌患者体内明显升高, 可为肝细胞癌转移的筛选与诊断提供指导信息.
核心提示: 肝细胞癌转移患者外周血中调节性T细胞分泌的转化生长因子β(transforming growth factor-β, TGF-β)水平明显升高, 通过流式细胞仪检测外周血中调节性T细胞分泌的TGF-β水平可作为筛查肝细胞癌转移的一种简便经济方法.
引文著录: 张颖慧, 董向前, 邹玉, 乌剑利, 白丽萍, 刘晶华, 王敏. TGF-β在肝细胞癌转移中的作用. 世界华人消化杂志 2013; 21(25): 2508-2514
Revised: July 9, 2013
Accepted: July 31, 2013
Published online: September 8, 2013
AIM: To investigate the role of transforming growth factor-b (TGF-β) derived from regulatory T cells in metastasis of hepatocellular carcinoma.
METHODS: Forty-eight primary liver cancer patients without metastasis, 32 liver cancer patients with distant metastasis (17 cases of lung metastasis and 15 cases of brain metastasis), and 54 healthy subjects were included in this study. Serum concentrations of interleukin-10 (IL-10), IL-17A, tumor necrosis factor-α (TNF-α) and TGF-β were measured by ELISA. Levels of TGF-β in peripheral blood mononuclear cells (PBMCs) and regulatory T cells were determined by flow cytometry and RT-PCR, respectively.
RESULTS: Serum levels of TNF-α and TGF-β were significantly increased in liver cancer patients with metastasis compared with normal controls. Serum level of TGF-β was significantly higher in liver cancer patients with metastasis than in liver cancer without metastasis and normal controls (both P < 0.05). Furthermore, we confirmed that TGF-β in liver cancer patients with metastasis was derived from regulatory T cells by quantitative real-time PCR and flow cytometry.
CONCLUSION: TGF-β has a dual role in tumorigenesis; it acts as a tumor suppressor in early stage but promotes tumor cell invasion and metastasis in advanced stage. High level of TGF-β was found only in liver cancer patients with metastasis.
- Citation: Zhang YH, Dong XQ, Zou Y, Wu JL, Bai LP, Liu JH, Wang M. Role of TGF-β in metastasis of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(25): 2508-2514
- URL: https://www.wjgnet.com/1009-3079/full/v21/i25/2508.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i25.2508
原发性肝癌是世界范围内最常见的恶性肿瘤之一, 其中以肝细胞癌(hepatocellular carcinoma, HCC)最为常见, 约占原发性肝癌的90%-95%[1-6]. HCC早期临床症状及体征不明显, 大多数患者就诊时已发生转移, 故疗效不理想, 治愈率低, 即使肝癌根治性切除术后5年内仍有60%-70%的患者出现转移复发, 转移性肝癌的早期诊断和可能的化学干预是提高患者长期生存率的关键之一, 术后随访、定期复查必不可少.目前临床上常用方法是B超和定期甲胎蛋白(α-fetoprotein, AFP)及甲胎蛋白异质体(lectinreactive alpha-fetoprotein, AFP-L3)检测, 但诊断与预测的准确性不高, 临床尚迫切需要一些生物学预后指标来监测肝癌患者术后转移复发的可能[7-15]. 转化生长因子β(transforming growth factor-β, TGF-β)是一类功能复杂的细胞因子, TGF-β对多种上皮性肿瘤细胞的体外增殖起负调控作用, 导致肿瘤的发生. 随着研究的深入, 最近又发现TGF-β在肿瘤进展期能够促进肿瘤侵袭和转移[16-22]. 目前对TGF-β的研究主要集中在检测肿瘤组织中的表达以及肿瘤微环境中细胞因子的水平, 这种检测方法主要是在给患者手术切除后进行的检测, 并不能作为一种简便、 经济的方法进行推广[23-25]. 本文通过ELISA法, 对患者血清中细胞因子进行筛选, 发现发生转移的肝癌患者血清中TGF-β水平明显升高, 通过进一步的研究发现主要是患者外周血中调节性T细胞分泌的TGF-β升高, 因此通过流式细胞仪检测外周血中调节性T细胞胞内TGF-β的水平能够为肝细胞癌的转移提供指导信息.
研究对象为我院2011-02/2012-02收治的原发性肝细胞癌未见远端脏器转移患者48例, 已发生远端脏器转移者32例, 其中肺部转移17例, 脑部转移15例, 正常对照组为健康体检54例. 肝癌诊断依据2009年中国抗癌协会肝癌专业委员会制订的标准, 所有患者均经病理学确诊. 三组受检者的性别、年龄等一般情况间差异无统计学意义(P>0.05)(表1), 具有可比性. APC-anti-human IL-10 mAbs、APC-anti-human IL-17A mAbs、APC-anti-human TNF-α mAbs、APC-anti-human TGF-β mAbs PE-anti-human CD4、PE-anti-human CD8、PE-anti-human CD14、FITC-anti-human foxp3 mAbs、流式细胞仪用破膜剂、穿孔剂购自eBioscience公司; RPMI 1640、DMEM细胞基础培养基购自Gbico BRL公司; RNA提取试剂盒购自QIAGEN公司; 人细胞因子白介素-10(interleukin-10, IL-10)、IL-17A、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和TGF-β试剂盒购自BioLegend公司; CD4+CD25+ Regulatory T Cell Isolation Kit购自MiltenyiBiotec公司.
| 分组 | n | 男/女 | 年龄(岁) | 肺转移(n) | 脑转移(n) |
| 未转移组 | 48 | 32/16 | 63.0±8.9 | 0 | 0 |
| 转移组 | 32 | 24/8 | 65.0±9.5 | 17 | 15 |
| 健康组 | 54 | 30/24 | 59.0±5.9 | 0 | 0 |
1.2.1 血清采集及细胞因子测定: 所有患者均在就医确诊后取30 mL外周静脉血, 室温下静置1 h, 离心后收集上清血清液贮存于-80 ℃冰箱内备用, 应用双抗体夹心ELISA法测定IL-10、IL-17A、TNF-α、TGF-β.
1.2.2 外周血单个核细胞的制备和调节性T细胞的分选: 无菌抽取人静脉血20 mL, 肝素抗凝, 将抗凝血加到人淋巴细胞分层液上(保持界面清晰), 室温2000 r/min, 离心20 min; 用毛细吸管轻轻吸出乳白色的单个核细胞, 加入适量PBS, 混匀, 室温1500 r/min, 离心10 min, 弃上清, 重复洗涤1次; 用基础RPMI 1640 1 mL定容, 计数细胞, 调整细胞浓度至1×107/mL. 按照调节性T细胞分选试剂盒说明书, 从制备的单核细胞分离、 纯化调节性T细胞.
1.2.3 流式细胞仪检测胞内细胞因子TGF-β的分泌: 制备的单个核细胞和纯化的调节性T细胞接种到24孔板, 1×106细胞/孔, 加2 mL RPMI 1640 完全培养基. 加入PMA(50 ng/mL)、ionomycin(1 μg/mL)和golgiplug(1:1000)培养5 h, 收获细胞然后用PE-anti-human CD4、PE-anti-human CD8、PE-anti-human CD14、APC-anti-human foxp3 mAbs分别与细胞在4 ℃孵育0.5 h, 洗去未结合的抗体3次. 破膜剂37 ℃孵育20 min, 离心收集细胞, 洗去破膜剂. 分别加入穿孔剂稀释的FITC-anti-human TGF-β mAbs孵育30 min, 收集细胞, 洗3次, 上机检测荧光细胞百分比.
1.2.4 RT-PCR检测IL-10、IL-17A、TNF-α和TGF-β的表达: 用制备的单个核细胞和调节性T细胞, 依照RNA提取试剂说明书, 提取RNA, 然后逆转录成cDNA, 以合成的CDNA为模版, 进行实时定量PCR检测. 细胞因子的引物如下, 同时以GAPDH作为内参: GAPDH-F 5'-ACCACAGTCCATGCCATCAC-3'; GAPDH-R 5'-TCCACCACCCTGTTGCTGTA-3'; IL-17-F 5'-TGCCCCAACTCCTTCCGGCT-3'; IL-17-R 5'-GGGTTCCTGAGGGGCTGGGT-3'; IL-10-F 5'-TACGGCGCTGTCATCGATTT-3'; IL-10-R 5'-AAGGTTTCTCAAGGGGCTGG-3'; TNF-α-F 5'-CTGGGCAGGTCTACTTTGGG-3'; TNF-α-R 5'-CTGGAGGCCCCAGTTTGAAT-3'; TGF-β-F 5'-TCTTCCCCTCCGAAAATGCC-3'; TGF-β-R 5'-CAATAGGCCGCATCCAAAGC-3'.
统计学处理 采用SPSS11.0统计软件进行统计学处理, 指标行正态性检验符合近似正态分布. 计量资料采用mean±SD表示, 多组间比较采用单因素方差分析, 组内两两比较采用q检验, 计数资料采用χ2检验, P<0.05认为差异有统计学意义.
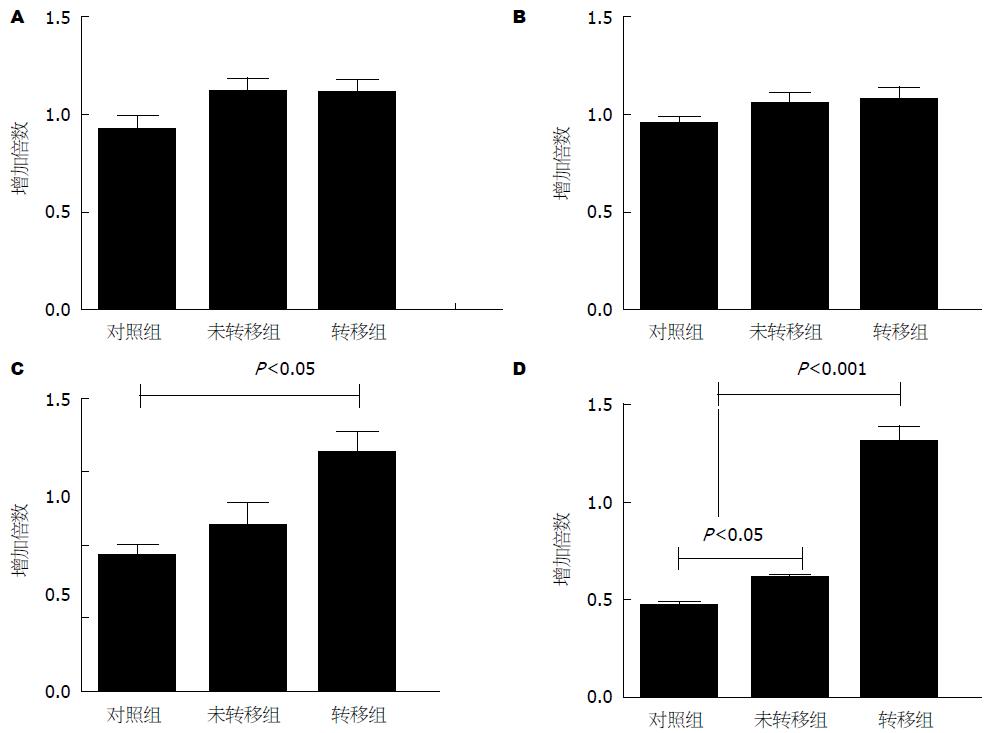
通过ELISA法检测患者血清中细胞因子水平, 发现在发生转移的肝癌患者血清中TNF-α、TGF-β明显增高, 与健康对照组相比有统计学意义, 而抑制性细胞因子IL-10和IL-17的水平并没有明显升高. 与未转移的肝癌患者比较, 发现TGF-β在转移的肝癌患者体内升高的更加明显, 且具有统计学意义(表2).
在患者外周血清中发现了TNF-α和TGF-β水平升高, 为了进一步明确这些细胞因子是否来源于外周血单个核细胞, 通过分离单个核细胞, 提取RNA, 然后进行实时定量PCR检测, 与ELISA结果相对应, 在发生转移的肝癌患者单个核细胞中TNF-α, TGF-β表达明显增高, TGF-β升高最为明显, 跟未转移和健康对照组比都具有统计学意义(图1).
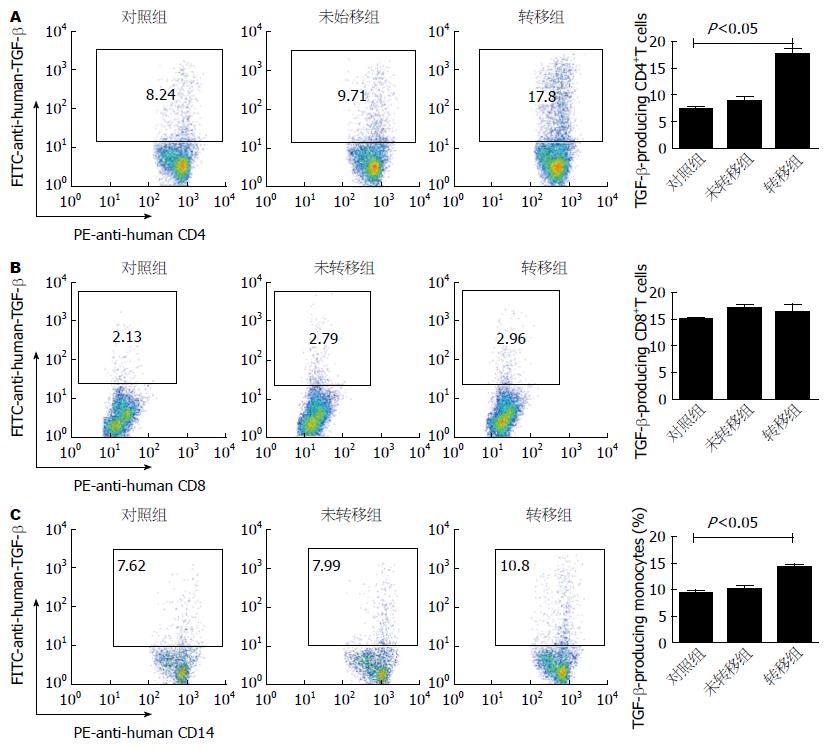
通过上述实验发现TGF-β在发生转移的肝癌患者体内显著增强, 为了进一步明确TGF-β的细胞来源, 通过流式细胞仪检测外周血单个核细胞不同亚群细胞分泌TGF-β的水平, 发现主要是CD4阳性T细胞和单核细胞分泌TGF-β, 特别是发生转移的肝癌患者CD4阳性T细胞分泌TGF-β显著增强(图2).
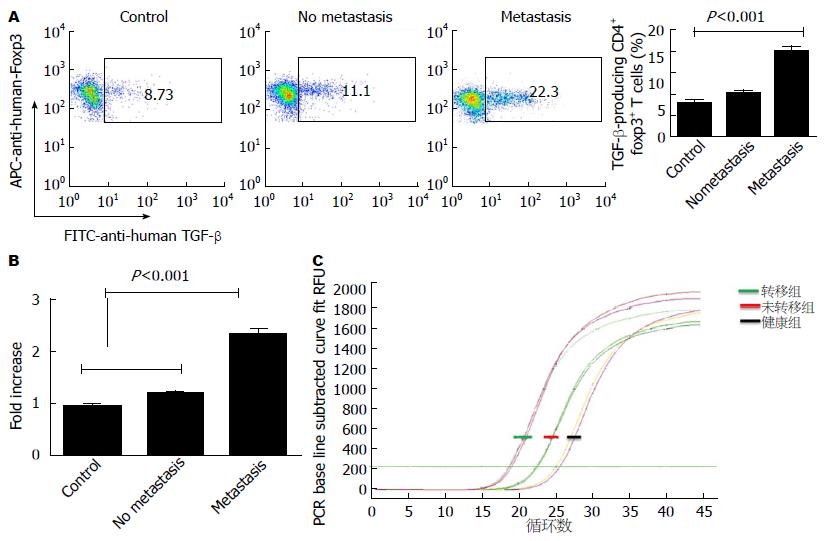
因为CD4阳性T细胞又分为辅助性T细胞和调节性T细胞, 为了进一步弄清TGF-β的来源, 首先通过流式细胞仪把CD4阳性T细胞圈门, 然后再通过FOXP3确定调节性T细胞, 测定其中TGF-β的表达, 发现在发生转移的肝癌患者中TGF-β明显增强(图3A), 而在辅助性T细胞中TGF-β并未有明显变化(数据未显示). 为了从另个角度验证试验结果, 我们通过试剂盒分选了调节性T细胞, 然后通过RT-PCR检测TGF-β的表达, 同流式结果一致, RT-PCR结果再次验证在发生转移的肝癌患者中TGF-β明显增强, 跟未发生转移的肝癌患者相比有统计学意义(图3B).
恶性肿瘤之所以成为致命性疾病, 主要是因为肿瘤细胞具有对临近正常组织的浸润和远处转移的能力, 因此如何能早期诊断肿瘤是否转移对于提高患者的生存率具有重要意义. 肝癌为常见的恶性肿瘤, 其中肝细胞癌占肝癌发病率的80%. 肝细胞癌容易复发、转移, 治疗效果差, 其总体5年生存率<5%[2,17,25-28]. 目前针对肝细胞癌的血清学诊断应用最广泛的肿瘤标志物包括AFP及甲胎蛋白异质体(lectinreactive alpha-fetoprotein, AFP-L3)等. 肿瘤患者免疫防御损伤及免疫功能在疾病的早期已经开始发生变化, 已发现很多细胞因子的表达都与肿瘤的发生发展有关, 如TNF-α对肿瘤细胞有高度特异性, 能选择性地抑制其DNA合成; 通过受体介导性细胞内吞作用进入细胞, 然后进入溶酶体, 引起一系列生化反应, 发挥直接细胞毒效应; 损伤或阻塞肿瘤血管, 引起出血性或缺血性坏死; 增强免疫功能, 使辅助T细胞活化和B细胞分化并激活NK细胞作用. 同时也有研究认为TNF-α在肿瘤患者血清中水平升高, 提示肿瘤已经发生转移[29-32]; IL-10是一种公认的介导免疫抑制的细胞因子, 以同源二聚体形式发挥效应, 可抑制Thl细胞应答及其细胞因子合成, 抑制巨噬细胞的抗原提呈功能及其细胞因子合成, 促进B细胞增殖分化及抗体产生. IL-10是某些肿瘤细胞的生长因子, 如骨髓瘤细胞, IL-10可维持其生长和增殖. 大量研究已证实许多癌组织或细胞均可产生IL-10, 如在恶性黑色素瘤、卵巢癌和结肠癌细胞、基底细胞癌、肺癌组织、脑胶质瘤组织、结直肠癌的瘤组织、淋巴结和癌旁组织中, IL-10可能还与肿瘤转移有关[29,33]. IL-17参与了直结肠癌的发生, 同时也加剧了肿瘤的临床和病理进展, 可能是结直肠癌患者预后较差、死亡率较高和生存期较短的重要影响因素之一. 大量文献报道IL-17在肿瘤发生发展过程中发挥双刃剑的作用: 一方面, IL-17可以通过促进血管生成和肿瘤细胞的迁移促进肿瘤的生长; 另一方面, IL-17亦可促进细胞毒性T细胞的免疫应答抑制肿瘤的生长[34,35]. 在肿瘤发生转移过程中TGF-β有利于浸润转移的基质环境形成、促进血管新生和抑制宿主抗肿瘤免疫反应等[21,25,36,37]. 已有研究报道如: 肝硬化患者血清IL-1β、IL-6、TNF-α、TGF-β、IL-17和IL-10水平增高, 提示发生肝癌的可能性大[19,38]. 本文选择了4种细胞因子进行筛选, 发现发生转移的肝癌患者外周血清中TNF-α和TGF-β明显升高, 特别是TGF-β在发生转移的肝癌患外周血中升高更加明显, 跟未转移的肝癌和健康对照组相比都具有统计学意义.我们通过实验设计明确了主要是调节性T细胞来源的TGF-β在发生转移的肝癌患者体内升高, 当然我们也发现单核细胞分泌TGF-β的能力在发生转移的肝癌患者体内也有明显增加, 但增加的幅度与调节性T细胞相比不是很明显, 因此选择调节性T细胞进行研究, 对于发生转移的肝癌患者更具有特异性. 因此通过流式细胞仪检测肝癌患者外周血中调节性T细胞分泌的TGF-β水平, 如果发现持续升高, 结合其他生物学标志物和检查可为肝细胞癌转移的筛选与诊断提供指导信息.
转化生长因子β(transforming growth factor-β, TGF-β)是一类功能复杂的细胞因子, TGF-β对多种上皮性肿瘤细胞的体外增殖起负调控作用, 导致肿瘤的发生. 最近又发现TGF-β在肿瘤进展期能够促进肿瘤侵袭和转移. 肝细胞癌(hepatocellular carcinoma, HCC)早期临床症状及体征不明显, 大多数患者就诊时已发生转移, 故疗效不理想, 治愈率低, 即使肝癌根治性切除术后5年内仍有60%-70%的患者出现转移复发, 转移性肝癌的早期诊断是提高患者长期生存率的关键之一. TGF-β在肿瘤的浸润转移中扮演何种角色, 目前研究并不清楚.
李孟森, 教授, 海南医学院/海南省肿瘤发生和干预重点实验室
目前对TGF-β的研究主要集中在检测肿瘤组织中的表达以及肿瘤微环境中细胞因子的水平, 这种检测方法主要是在给患者手术切除后进行的检测, 并不能作为一种简便, 经济的方法进行推广.
在肿瘤发生转移过程中TGF-β进有利于浸润转移的基质环境形成、促进血管新生和抑制宿主抗肿瘤免疫反应等. 已有研究报道如: 肝硬化人群血清IL-1β、IL-6、TNF-α、TGF-β、IL-17和IL-10水平增高, 提示发生肝癌的可能性大.
本文通过ELISA法, 对患者血清中细胞因子进行筛选, 发现发生转移的肝癌患者血清中TGF-β水平明显升高, 创新之处在于首次通过流式细胞仪这种方便 经济的方法确定了患者外周血中调节性T细胞分泌的TGF-β升高与肝癌的转移有一定的联系.
本研究通过检测外周血中调节性T细胞分泌的TGF-β水平发现只有在发生转移的肝癌患者体内明显升高, 可为肝细胞癌转移的筛选与诊断提供指导信息. 此方法可在临床应用中很快得到推广.
本文研究内容比较完整, 结果有一定临床参考价值.
编辑: 田滢 电编: 鲁亚静
| 4. | Hao MZ, Lin HL, Chen Q, Ye YB, Chen QZ, Chen MS. Efficacy of transcatheter arterial chemoembolization combined with cytokine-induced killer cell therapy on hepatocellular carcinoma: a comparative study. Chin J Cancer. 2010;29:172-177. [PubMed] |
| 5. | Capone F, Costantini S, Guerriero E, Calemma R, Napolitano M, Scala S, Izzo F, Castello G. Serum cytokine levels in patients with hepatocellular carcinoma. Eur Cytokine Netw. 2010;21:99-104. [PubMed] [DOI] |
| 6. | Qiu Y, Xu MB, Yun MM, Wang YZ, Zhang RM, Meng XK, Ou-Yang XH, Yun S. Hepatocellular carcinoma-specific immunotherapy with synthesized α1,3- galactosyl epitope-pulsed dendritic cells and cytokine-induced killer cells. World J Gastroenterol. 2011;17:5260-5266. [PubMed] [DOI] |
| 8. | 朱 薇, 葛 君琍, 张 利强, 高 海锋, 赵 秋剑. AFP、CEA、CA199、CA-125联合检测对肝癌、肝硬化诊断的临床价值. 国际检验医学杂志. 2012;33:1902-1904. |
| 12. | Hsu ML, Chen SW, Lin KH, Liao SK, Chang KS. Cytokine regulation of HIV-1 LTR transactivation in human hepatocellular carcinoma cell lines. Cancer Lett. 1995;94:41-48. [PubMed] |
| 13. | Chung RT. Cytokine polymorphisms and hepatocellular carcinoma: to B or not to B. Cancer. 2005;103:654-656. [PubMed] |
| 14. | Zhao M, Wu PH, Zeng YX, Xia JC, Zhang FJ, Xian LJ, Zhang YP, Zhou K, Fan WJ, Zhang L. [Cytokine-induced killer cell fusion to lower recurrence of hepatocellular carcinoma after transcatheter arterial chemoembolization sequentially combined with radiofrequency ablation: a randomized trial]. Zhonghua Yixue Zazhi. 2006;86:1823-1828. [PubMed] |
| 15. | Cheng KS, Tang HL, Chou FT, Chou JW, Hsu CH, Yu CJ, Kao ST, Li TC. Cytokine evaluation in liver cirrhosis and hepatocellular carcinoma. Hepatogastroenterology. 2009;56:1105-1110. [PubMed] |
| 17. | 赵 峰, 许 顺良, 林 坚, 郑 继爱. 26例混合细胞性肝癌的CT和MRI诊断. 中国临床医学影像杂志. 2010;21:804-806. |
| 18. | 李 洁羽, 黎 巧连, 彭 峰, 谷 伟伟, 黄 传钟, 汤 志伟, 陈 强, 叶 韵斌. 流式细胞微球阵列术检测肝癌组织中细胞因子水平及其意义. 中华临床医师杂志(电子版). 2011;5:6657-6661. |
| 20. | Kiyono K, Suzuki HI, Matsuyama H, Morishita Y, Komuro A, Kano MR, Sugimoto K, Miyazono K. Autophagy is activated by TGF-βeta and potentiates TGF-βeta-mediated growth inhibition in human hepatocellular carcinoma cells. Cancer Res. 2009;69:8844-8852. [PubMed] [DOI] |
| 21. | Baek JY, Morris SM, Campbell J, Fausto N, Yeh MM, Grady WM. TGF-βeta inactivation and TGF-alpha overexpression cooperate in an in vivo mouse model to induce hepatocellular carcinoma that recapitulates molecular features of human liver cancer. Int J Cancer. 2010;127:1060-1071. [PubMed] [DOI] |
| 22. | Yang P, Li QJ, Feng Y, Zhang Y, Markowitz GJ, Ning S, Deng Y, Zhao J, Jiang S, Yuan Y. TGF-β-miR-34a-CCL22 signaling-induced Treg cell recruitment promotes venous metastases of HBV-positive hepatocellular carcinoma. Cancer Cell. 2012;22:291-303. [PubMed] [DOI] |
| 23. | Fransvea E, Mazzocca A, Antonaci S, Giannelli G. Targeting transforming growth factor (TGF)-betaRI inhibits activation of beta1 integrin and blocks vascular invasion in hepatocellular carcinoma. Hepatology. 2009;49:839-850. [PubMed] [DOI] |
| 24. | Lin GH, Wang J, Li SH, Wang J, Xu L, Li SP. Relationship and clinical significance of TGF-βeta1 expression with Treg cell infiltration in hepatocellular carcinoma. Chin J Cancer. 2010;29:403-407. [PubMed] |
| 25. | Mazzocca A, Antonaci S, Giannelli G. The TGF-β signaling pathway as a pharmacological target in a hepatocellular carcinoma. Curr Pharm Des. 2012;18:4148-4154. [PubMed] |
| 26. | 姚 登福. 炎症性细胞因子介导的信号通路与肝癌. 南通大学学报(医学版). 2010;23:1-5. |
| 27. | Giannelli G, Mazzocca A, Fransvea E, Lahn M, Antonaci S. Inhibiting TGF-β signaling in hepatocellular carcinoma. Biochim Biophys Acta. 2011;1815:214-223. [PubMed] [DOI] |
| 28. | Peng BG, Liu SQ, Kuang M, He Q, Totsuka S, Huang L, Huang J, Lu MD, Liang LJ, Leong KW. Autologous fixed tumor vaccine: a formulation with cytokine-microparticles for protective immunity against recurrence of human hepatocellular carcinoma. Jpn J Cancer Res. 2002;93:363-368. [PubMed] |
| 29. | Yang Y, Luo C, Feng R, Bi S. The TNF-α, IL-1B and IL-10 polymorphisms and risk for hepatocellular carcinoma: a meta-analysis. J Cancer Res Clin Oncol. 2011;137:947-952. [PubMed] [DOI] |
| 30. | Chen X, Zhang L, Chang Y, Shen T, Wang L, Zhuang H, Lu F. Association of TNF-αlpha genetic polymorphisms with hepatocellular carcinoma susceptibility: a case-control study in a Han Chinese population. Int J Biol Markers. 2011;26:181-187. [PubMed] [DOI] |
| 31. | Babu LH, Perumal S, Balasubramanian MP. Myrtenal, a natural monoterpene, down-regulates TNF-α expression and suppresses carcinogen-induced hepatocellular carcinoma in rats. Mol Cell Biochem. 2012;369:183-193. [PubMed] [DOI] |
| 32. | Yang Y, Qiu XQ, Yu HP, Zeng XY, Bei CH. TNF-α -863 polymorphisms and the risk of hepatocellular carcinoma. Exp Ther Med. 2012;3:513-518. [PubMed] |
| 33. | Nieters A, Yuan JM, Sun CL, Zhang ZQ, Stoehlmacher J, Govindarajan S, Yu MC. Effect of cytokine genotypes on the hepatitis B virus-hepatocellular carcinoma association. Cancer. 2005;103:740-748. [PubMed] |
| 34. | Kuang DM, Peng C, Zhao Q, Wu Y, Zhu LY, Wang J, Yin XY, Li L, Zheng L. Tumor-activated monocytes promote expansion of IL-17-producing CD8+ T cells in hepatocellular carcinoma patients. J Immunol. 2010;185:1544-1549. [PubMed] |
| 35. | Gu FM, Li QL, Gao Q, Jiang JH, Zhu K, Huang XY, Pan JF, Yan J, Hu JH, Wang Z. IL-17 induces AKT-dependent IL-6/JAK2/STAT3 activation and tumor progression in hepatocellular carcinoma. Mol Cancer. 2011;10:150. [PubMed] [DOI] |
| 36. | Reichl P, Haider C, Grubinger M, Mikulits W. TGF-β in epithelial to mesenchymal transition and metastasis of liver carcinoma. Curr Pharm Des. 2012;18:4135-4147. [PubMed] |
| 37. | Shi M, Yao L, Wang FS, Lei ZY, Zhang B, Li WL, Liu JC, Tang ZR, Zhou GD. [Growth inhibition of human hepatocellular carcinoma xenograft in nude mice by combined treatment with human cytokine-induced killer cells and chemotherapy]. Zhonghua Zhongliu Zazhi. 2004;26:465-468. [PubMed] |