修回日期: 2013-07-22
接受日期: 2013-08-13
在线出版日期: 2013-09-08
目的: 检测胆囊癌患者血清及肿瘤组织中microRNA的差异表达, 筛选关键microRNA并阐明其与患者临床特征的相关性及其对胆囊癌细胞侵袭迁移能力的影响.
方法: 收集2010-09/2012-04于武汉同济医院胆胰外科进行根治性手术的胆囊癌病例12例; 每例患者均采集术前外周血, 术中收集手术切除肿瘤标本. 同时收集同期入院的胆囊结石/健康志愿者血清14例. 利用Real-time PCR对12例胆囊癌患者及14例对照血清标本中的10条microRNA表达水平进行检测; 在12对胆囊癌和癌旁组织中对筛选出的差异microRNA进行验证; 结合患者临床病例资料进行相关性分析. 利用慢病毒载体转染, 验证miR-141上调后在体外对胆囊癌GBC-SD细胞侵袭、迁移能力的影响.
结果: Real-time PCR结果提示, 相对于正常对照组, 胆囊癌患者血清中筛选出3条差异表达循环microRNA, 其中miR-141呈显著低表达, 差异具有统计学意义(P<0.05); miR-141在胆囊癌组织中表达显著低于正常胆囊及癌旁组织, 胆囊癌中miR-141水平较癌旁组织中低16.68倍±0.64倍, 差异具有统计学意义(P<0.05); 再发或转移胆囊癌患者循环miR-141表达水平较术前明显降低, 差异具有统计学意义(P<0.05); miR-141上调组GBC-SD细胞侵袭细胞较阴性对照组细胞数下降10.83倍±0.37倍, 迁移率下降3.48倍±0.62倍, 差异具有统计学意义(P<0.01).
结论: 胆囊癌患者血清中miR-141表达具有差异性, miR-141在胆管癌组织中呈显著低表达, 且其可在体外显著抑制胆管癌细胞侵袭迁移能力, 可作为胆囊癌早期诊断及预后判断的潜在血清标志物.
核心提示: 胆囊癌患者循环型miR-141表达具有差异性, 且与患者远处转移及复发相关, 其可在体外显著抑制胆管癌细胞侵袭迁移能力, 可作为胆囊癌早期诊断及预后判断的潜在血清标志物.
引文著录: 彭丰, 王敏, 江建新, 田锐, 李旭, 徐盟, 郭兴军, 秦仁义. 循环型miR-141在胆囊癌侵袭转移和复发中的影响及其临床意义. 世界华人消化杂志 2013; 21(25): 2500-2507
Revised: July 22, 2013
Accepted: August 13, 2013
Published online: September 8, 2013
AIM: To screen differentially expressed microRNAs in serum and tissues of patients with gallbladder cancer and explore their effect on the migration and invasion ability of gallbladder cancer cells.
METHODS: The expression of 11 microRNAs was detected in serum of 12 patients with gallbladder cancer and 14 normal controls to screen differentially expressed microRNAs. Differential expression of screened microRNAs in human gallbladder cancer tissues was verified by real-time PCR. The effect of miR-141 mimic transfection on the invasion and migration ability of human gallbladder cancer GBC-SD cells was detected by Transwell assay and wound-healing assay.
RESULTS: Compared to the control group, two microRNAs (miR-141 and miR-200a) were significantly down-regulated, and one up-regulated in serum of patients with gallbladder cancer. The expression of miR-141 in human gallbladder cancer tissues was also significantly lower than that in normal gallbladder tissues (P < 0.05). Expression of miR-141 in human gallbladder cancer tissues was related with distant metastasis. The invasion and migration abilities of GBC-SD cells were declined after lentivirus-mediated miR-141 up-regulation.
CONCLUSION: Some microRNAs are differentially expressed in serum and tissues between patients with gallbladder cancer and healthy people. MiR-141 is probably involved in invasion and migration of gallbladder cancer.
- Citation: Peng F, Wang M, Jiang JX, Tian R, Li X, Xu M, Guo XJ, Qin RY. Effect of circulating miR-141 on invasion and migration of gallbladder cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(25): 2500-2507
- URL: https://www.wjgnet.com/1009-3079/full/v21/i25/2500.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i25.2500
胆囊癌是胆道系统常见的恶性疾病之一, 由于其早期易发生肝脏及周围脏器的浸润和远处转移, 导致其确诊后失去根治性手术的机会, 术后5年生存率较低[1,2]. 因此, 探寻胆囊癌早期诊断的方法及标准、提高患者的诊断率对突破现阶段胆囊癌的综合诊疗瓶颈具有非常重要的意义. 目前, 国内外学者对胆囊癌发生发展的分子生物学机制进行了深入的探讨, 并探寻可能存在的特异性分子标志或潜在的治疗靶点[3,4], 但大多数研究仍处于基础阶段, 无法将所得成果向临床应用转化. 因此, 寻找将现有基础分子生物学研究与临床应用的联系, 是目前的研究重点之一.
MicroRNA是一类广泛的存在于真核生物中的小分子, 长度约为22个核苷酸. 其不直接编码蛋白而通过与目的基因结合, 形成RNA诱导沉默复合体(RNA induced silencing complex, RISC), 降解mRNA和/或抑制其翻译[5,6]. 研究发现miRNA不仅对细胞的增殖、分化、凋亡和周期等生物学行为起到极为重要的调控作用[7], 而且和肿瘤的多项恶性生物学效应密切相关[8]. 尤其是近来关于分泌型microRNA和循环性microRNA的研究, 更是将microRNA与肿瘤的相关性以及其在肿瘤临床综合诊治中的角色明朗化[9,10]. 但目前胆囊癌相关的microRNA研究仍为数不多[11], 其研究成果也未能达成共识. 我们通过长期在胆道恶性肿瘤中进行microRNA研究后发现, 特定的microRNA在胆囊癌中具有关键的生物学行为调节功能, 因此开展本次研究, 拟筛选出胆囊癌中差异性的循环microRNA并初步阐明其临床相关性.
选取2010-09/2012-04于武汉同济医院胆胰外科中心进行根治性切除手术的胆囊癌病例12例设置为实验组, 收集同期入院胆囊结石/健康志愿者14例设置为对照组. 12例患者均由术后病理证实为胆囊癌. 人胆囊癌细胞系GBC-SD购自中国科学院上海生物化学与生物学研究所; 1640培养液、特级胎牛血清、双抗溶液、OPTI-MEM均购自Gibco公司; 逆转录及Real-time PCR试剂均购自TAKARA公司; miR-141逆转录及Real-time PCR引物均由广州锐博生物公司设计并合成; miR-141过表达慢病毒载体由上海吉凯公司设计并合成; Lipo2000试剂购自Invitrogen公司; 基质胶(Matrigel)购自BD公司; Transwell小室购自Costar公司.
1.2.1 患者血清及手术标本收集: 每例患者/对照组成员术前均采集外周血2 mL, 迅速转入EDTA抗凝管中, 涡旋混匀, 在1 h内4 ℃, 820 g离心10 min. 取约1 mL上清转至洁净的1.5 mL离心管中, 16000 g, 4 ℃, 离心10 min, 小心吸取上清到新的离心管中, 并置于-80 ℃中储存. 收集手术切除胆囊癌标本12例, 同时收集配对正常胆囊/癌旁组织. 所有标本离体30 min内迅速切至0.5 cm×0.5 cm×0.5 cm大小, 并置于液氮中快速冷却, 后置于-80 ℃中储存. 12例手术患者中有4例患者在术后3 mo出现肝脏及远处转移再次入院, 按上述方法再次收集血清标本.
1.2.2 RNA提取及Real-time PCR检测: 采用采用mirVana PARIS试剂盒(Ambion)提取血清总RNA. 采用TRIzol法提取12例胆囊癌患者手术切除标本+对应癌旁组织总RNA, 所用microRNA逆转录及Real-time PCR引物均由广州锐博生物设计并合成. 逆转录方法根据引物说明采用两步法完成, 反应条件为: 70 ℃ 10 min, 冰浴2 min, 42 ℃ 60 min, 70 ℃ 10 min. 逆转录所得cDNA暂置于-80 ℃冰箱保存. Real-time PCR采用Sybr Green染料法, 以RNU6B为内参. 反应条件为: 95 ℃ 20 s, 95 ℃ 10 s, 60 ℃ 20 s, 70 ℃ 10 s, 共进行40个循环. 每个实验均重复试验3次.
1.2.3 细胞侵袭及划痕实验: GBC-SD细胞转染miR-141过表达慢病毒载体, 转染前1 d接种适当细胞于六孔板中, 次日按产品说明进行慢病毒载体转染, 取MOI值为25. 转染完成后3 d于荧光显微镜下观察转染情况并进行定量PCR检测, 转染后稳定细胞株按常规方法进行Transwell及划痕实验, 设置miR-141上调组、阴性对照及空白对照3个组. 所有实验均重复3次.
统计学处理 应用SPSS19.0统计学软件包进行数据分析, 计量资料采用t检验, 计数资料采用χ2检验, P<0.05为差异具有统计学意义.
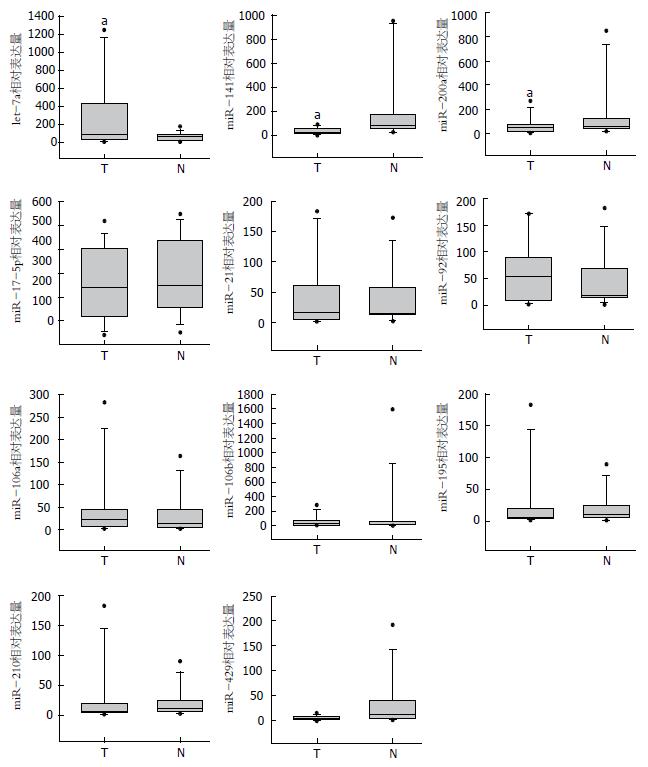
对全部12例胆囊癌患者及14例对照组成员血清中循环microRNA进行检测, 检测指标如下: miR-210、miR-21、miR-200a、miR-141、miR-429、let-7a、miR-92、miR-195、miR-17-5p、miR-106a和miR-106b. RT-PCR结果显示, 相对于正常对照组, 胆囊癌组患者血清中let-7a呈显著高表达, miR-200a、miR-141呈显著低表达, 差异均具有统计学意义(P<0.05), 余microRNA表达水平差异无统计学意义(P>0.05, 图1).
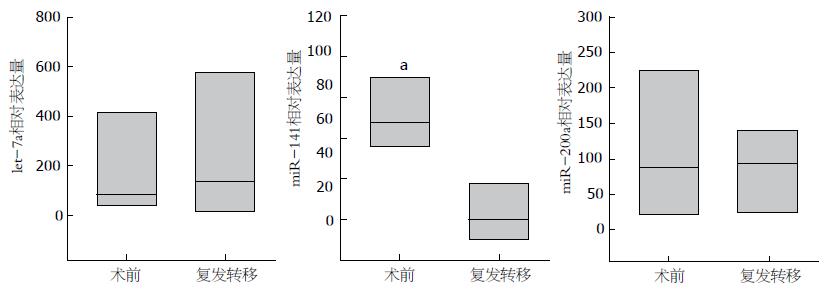
根据初步筛查结果, 对4例因再发远处转移而再次入院的胆囊癌患者的血清标本进行miR-200a/miR-141/let-7a水平检测, 并与手术前血清标本结果比较, 结果发现再发远处转移胆囊癌患者血清中miR-141水平均较术前有明显降低. 综合4例患者再发远处转移前后血清miR-141水平表达, 差异具有统计学意义(P<0.05), miR-200a、let-7a表达水平较术前差异无统计学意义(P>0.05, 图2).
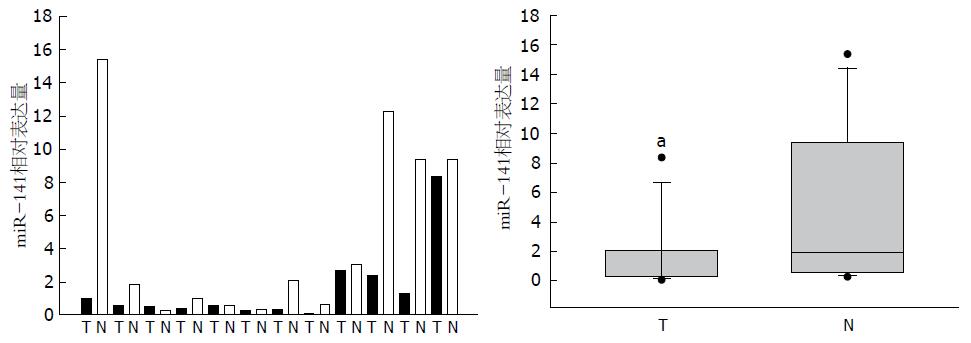
结合前期研究结果, 对全部12对胆囊癌及对应癌旁标本中miR-141表达水平进行检测, 结果提示miR-141在胆囊癌组织中表达水平显著低于癌旁组织, 其表达较癌旁组织低16.68倍±0.64倍. 综合全部12对胆囊癌标本及对应癌旁表达情况, miR-141差异具有统计学意义(P<0.05, 图3).
根据胆囊癌患者术前循环miR-141表达水平, 进行临床特征的相关性分析, 结果发现, 胆囊癌患者循环型miR-141的表达水平与患者的年龄、性别、病理分化程度无明显相关(P>0.05), 而与患者的远处转移相关(P<0.05, 表1).
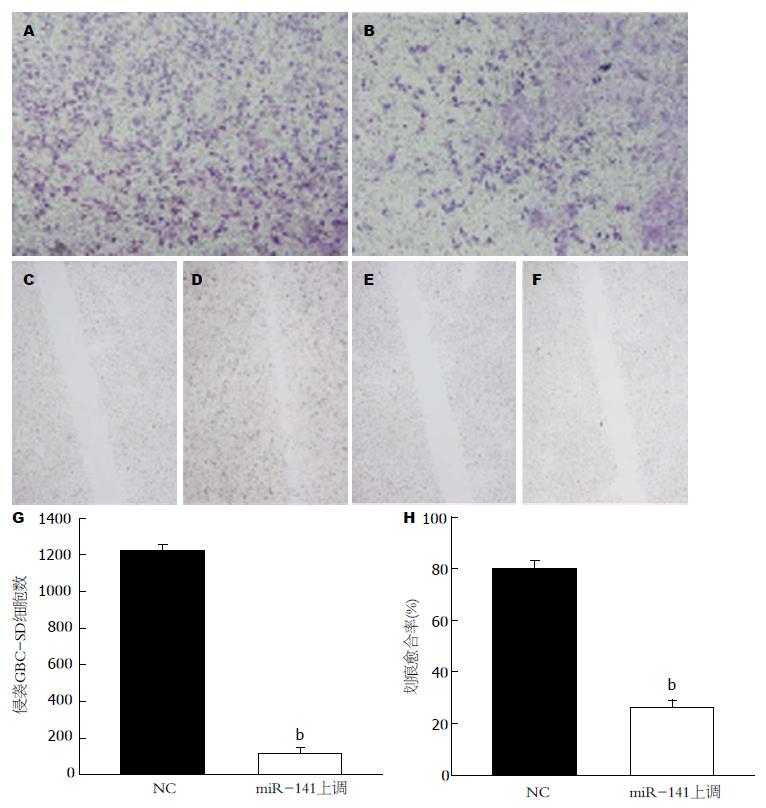
转染miR-141过表达慢病毒载体后RT-PCR结果显示, GBC-SD细胞内miR-141水平上调986.20倍±2.365倍. 侵袭实验结果表明miR-141过表达干预后, 下室面迁移GBC-SD细胞数明显减少, 对比阴性对照组细胞数差异为10.83倍±0.37倍, 具有统计学意义(P<0.05, 图4). 划痕实验结果表明miR-141过表达干预后, GBC-SD细胞迁移速率明显降低, 对比阴性对照组迁移率差异为3.48倍±0.62倍, 具有统计学意义(P<0.05, 图4).
胆囊癌是常见的胆道系统恶性肿瘤之一, 具有较高的死亡率. 由于胆囊癌具有较强的侵袭性, 往往随着病情的发展产生局部的浸润、淋巴结转移、血管侵犯甚至远处转移等[12]. 目前手术切除是唯一可治愈胆囊癌的治疗方法. 但胆囊癌患者早期症状不明显, 导致确诊后失去根治性手术的机会[13]. 因此虽然近年来在外科手术以及辅助放化疗等方面均取得了长足的进步[14], 但胆囊癌的综合诊治仍处于一个明显的瓶颈阶段. 因此, 探讨胆囊癌发生发展的分子机制, 寻找可能的关键位点和作用靶点, 是突破现有瓶颈的重要途径之一.
近期血浆、血清等体液样本中循环miRNAs(circulating miRNAs, cir-miRNAs)的发现及其作为疾病标志物的潜质引起了广泛的研究兴趣. Ratajczak等[15]首先证实了miRNA的水平传播. 该作者发现来自胚胎干细胞的微泡可通过传递mRNA诱导造血祖细胞的改变. Mitchell等[16]通过传统的小RNA分子cDNA文库构建及克隆策略, 发现血浆或血清中绝大部分小RNA分子为miRNAs. Chen等[17]对血清小分子RNA进行了提纯、扩增并检测, 发现血清中大部分分子RNA的长度均为22 nt左右, 恰好与miRNAs的平均长度相符. 上述研究证实循环miRNAs是一大类稳定存在于血浆/血清中的新型分子. 进一步的研究表明miR-92[18]、miR-195[19]、let-7a[20]、miR-17-5p[21]、miR-21[22,23]、miR-106a[24]、miR-144[25]和miR-106b[26]等循环miRNAs的表达水平在结直肠癌(colorectal cancer, CRC)、乳腺癌(breast cancer)、胃癌(gastric cancer, GC)等患者的血浆、血清中显著升高. 因此, 循环miRNAs的发掘有望为肿瘤的诊断提供新的切入点[27,28]. 针对这一研究现状, 我们拟通过检测胆囊癌患者血清中循环microRNA的表达情况, 结合患者手术切除标本及临床资料, 筛选出胆囊癌特异性循环microRNA. 我们首先通过在12例胆囊癌患者的血清中进行相关的microRNA表达水平的筛查, 通过和同期入院胆囊结石患者/健康志愿者对照, 确定了在胆囊癌患者中差异表达的3条microRNA-miR-200a、miR-141及let-7a. 我们进而在胆囊癌患者手术组织标本中对筛选出的差异microRNA进行了表达水平的验证, 发现miR-141在胆囊癌患者血清及肿瘤组织中均呈明显的低表达. 我们将4例术后复发或发生远处转移的患者血清中miR-141表达水平进行检测, 发现其相对术前表达水平也呈显著降低趋势. 综合12例胆囊癌患者临床病例资料分析后发现, 胆囊癌患者循环型miR-141的表达水平与患者的年龄、性别、病理分化程度无明显相关, 而与患者的转移/再发相关. 我们继而在体外实验中利用慢病毒载体验证, 发现上调细胞内源性miR-141表达水平后, 对胆囊癌GBC-SD细胞的侵袭及迁移能力有明显的抑制作用, 初步证实了我们前期的筛选及验证结果.
总之, 循环型miR-141是胆囊癌患者血清中特异性microRNA之一. miR-141是miR-200家族的成员之一, 其与TGF-β介导的上皮间质转化(epithelial-to-mesenchymal transition, EMT)密切相关[29,30]. 虽然miR-200家族在大多数肿瘤中的表达及其与肿瘤侵袭转移的关系均已被研究证实[29,31], 但miR-200尤其是循环性miR-200家族和胆囊癌相关的研究目前仍为数不多. 我们通过本次研究证实了miR-141在胆囊癌患者血清中的差异性表达, 且其表达水平随着患者复发/转移明显降低. 说明循环型miR-141可作为潜在的胆囊癌血清标志物之一, 并可作为判断患者预后及远处转移发生率的标准进行推广; 同时我们的体外实验初步证实了miR-141在胆囊癌中具有抑制侵袭转移的生物学功能, 也为后续的胆囊癌分子生物学研究打下了基础.
miR-141属于miR-200家族, 被证实在多种肿瘤细胞及正常细胞的生长、分化和转移方面发挥重要的调控作用, 已成为最受关注microRNA家族之一.
江建新, 副主任医师, 贵阳医学院附属医院肝胆外科
miR-141已被证实在肿瘤细胞的上皮间质转化过程中起负向调控作用, 但其对肿瘤远处转移的调控作用尚存在一定争议, 循环型miR-141由于其所处环境的特殊性, 其临床相关性及生物学效应尚需进一步研究证明.
有研究证实循环型miR-141可以作为一种新型标志物, 与癌胚抗原互补预测结肠癌患者的远处转移及预后.
本文首次证实循环型miR-141是在胆囊癌患者差异表达microRNA, 并初步证实了其临床相关性与生物学的效应调节功能.
本文为在胆囊癌中进一步探讨循环型miR-141的作用靶点及功能提供了理论基础, 并为其作为胆囊癌患者血清标志物的应用提供了初步的理论依据.
本文选题较为新颖, 实验设计合理, 实验数据可靠, 具有一定临床指导意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Jones RS. Carcinoma of the gallbladder. Surg Clin North Am. 1990;70:1419-1428. [PubMed] |
| 2. | Yee K, Sheppard BC, Domreis J, Blanke CD. Cancers of the gallbladder and biliary ducts. Oncology (Williston Park). 2002;16:939-946, 949; discussion 949-950, 952-953, 956-957. [PubMed] |
| 3. | Zhai G, Yan K, Ji X, Xu W, Yang J, Xiong F, Su J, McNutt MA, Yang H. LAPTM4B allele *2 is a marker of poor prognosis for gallbladder carcinoma. PLoS One. 2012;7:e45290. [PubMed] [DOI] |
| 4. | Liu C, Sun B, An N, Tan W, Cao L, Luo X, Yu Y, Feng F, Li B, Wu M. Inhibitory effect of Survivin promoter-regulated oncolytic adenovirus carrying P53 gene against gallbladder cancer. Mol Oncol. 2011;5:545-554. [PubMed] [DOI] |
| 5. | Baer C, Claus R, Plass C. Genome-wide epigenetic regulation of miRNAs in cancer. Cancer Res. 2013;73:473-477. [PubMed] [DOI] |
| 6. | DeSano JT, Xu L. MicroRNA regulation of cancer stem cells and therapeutic implications. AAPS J. 2009;11:682-692. [PubMed] [DOI] |
| 7. | He J, Zhang W, Zhou Q, Zhao T, Song Y, Chai L, Li Y. Low-expression of microRNA-107 inhibits cell apoptosis in glioma by upregulation of SALL4. Int J Biochem Cell Biol. 2013;45:1962-1973. [PubMed] [DOI] |
| 8. | Olivieri F, Rippo MR, Monsurrò V, Salvioli S, Capri M, Procopio AD, Franceschi C. MicroRNAs linking inflamm-aging, cellular senescence and cancer. Ageing Res Rev. 2013; May 17. [Epub ahead of print]. [PubMed] [DOI] |
| 9. | Eichelser C, Flesch-Janys D, Chang-Claude J, Pantel K, Schwarzenbach H. Deregulated Serum Concentrations of Circulating Cell-Free MicroRNAs miR-17, miR-34a, miR-155, and miR-373 in Human Breast Cancer Development and Progression. Clin Chem. 2013; Jun 7. [Epub ahead of print]. [PubMed] [DOI] |
| 10. | Li A, Yu J, Kim H, Wolfgang CL, Canto MI, Hruban RH, Goggins M. MicroRNA Array Analysis Finds Elevated Serum miR-1290 Accurately Distinguishes Patients with Low-Stage Pancreatic Cancer from Healthy and Disease Controls. Clin Cancer Res. 2013;19:3600-3610. [PubMed] [DOI] |
| 11. | Kono H, Nakamura M, Ohtsuka T, Nagayoshi Y, Mori Y, Takahata S, Aishima S, Tanaka M. High expression of microRNA-155 is associated with the aggressive malignant behavior of gallbladder carcinoma. Oncol Rep. 2013;30:17-24. [PubMed] [DOI] |
| 12. | Reid KM, Ramos-De la Medina A, Donohue JH. Diagnosis and surgical management of gallbladder cancer: a review. J Gastrointest Surg. 2007;11:671-681. [PubMed] [DOI] |
| 13. | Dutta U. Gallbladder cancer: can newer insights improve the outcome? J Gastroenterol Hepatol. 2012;27:642-653. [PubMed] [DOI] |
| 14. | Abahssain H, Afchain P, Melas N, Ismaili N, Rahali R, Rabti HM, Errihani H. [Chemotherapy in gallbladder carcinoma]. Presse Med. 2010;39:1238-1245. [PubMed] [DOI] |
| 15. | Ratajczak J, Miekus K, Kucia M, Zhang J, Reca R, Dvorak P, Ratajczak MZ. Embryonic stem cell-derived microvesicles reprogram hematopoietic progenitors: evidence for horizontal transfer of mRNA and protein delivery. Leukemia. 2006;20:847-856. [PubMed] [DOI] |
| 16. | Mitchell PS, Parkin RK, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, Peterson A, Noteboom J, O'Briant KC, Allen A. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci USA. 2008;105:10513-10518. [PubMed] [DOI] |
| 17. | Chen X, Ba Y, Ma L, Cai X, Yin Y, Wang K, Guo J, Zhang Y, Chen J, Guo X. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res. 2008;18:997-1006. [PubMed] [DOI] |
| 18. | Gandhi R, Healy B, Gholipour T, Egorova S, Musallam A, Hussain MS, Nejad P, Patel B, Hei H, Khoury S. Circulating MicroRNAs as biomarkers for disease staging in multiple sclerosis. Ann Neurol. 2013;73:729-740. [PubMed] [DOI] |
| 19. | Long G, Wang F, Duan Q, Yang S, Chen F, Gong W, Yang X, Wang Y, Chen C, Wang DW. Circulating miR-30a, miR-195 and let-7b associated with acute myocardial infarction. PLoS One. 2012;7:e50926. [PubMed] [DOI] |
| 20. | Zuo Z, Calin GA, de Paula HM, Medeiros LJ, Fernandez MH, Shimizu M, Garcia-Manero G, Bueso-Ramos CE. Circulating microRNAs let-7a and miR-16 predict progression-free survival and overall survival in patients with myelodysplastic syndrome. Blood. 2011;118:413-415. [PubMed] [DOI] |
| 21. | Jia SZ, Yang Y, Lang J, Sun P, Leng J. Plasma miR-17-5p, miR-20a and miR-22 are down-regulated in women with endometriosis. Hum Reprod. 2013;28:322-330. [PubMed] [DOI] |
| 22. | Yamada H, Suzuki K, Ichino N, Ando Y, Sawada A, Osakabe K, Sugimoto K, Ohashi K, Teradaira R, Inoue T. Associations between circulating microRNAs (miR-21, miR-34a, miR-122 and miR-451) and non-alcoholic fatty liver. Clin Chim Acta. 2013;424C:99-103. [PubMed] [DOI] |
| 24. | Heegaard NH, Schetter AJ, Welsh JA, Yoneda M, Bowman ED, Harris CC. Circulating micro-RNA expression profiles in early stage nonsmall cell lung cancer. Int J Cancer. 2012;130:1378-1386. [PubMed] [DOI] |
| 26. | Dickinson BA, Semus HM, Montgomery RL, Stack C, Latimer PA, Lewton SM, Lynch JM, Hullinger TG, Seto AG, van Rooij E. Plasma microRNAs serve as biomarkers of therapeutic efficacy and disease progression in hypertension-induced heart failure. Eur J Heart Fail. 2013;15:650-659. [PubMed] [DOI] |
| 27. | Sun Y, Zhang K, Fan G, Li J. Identification of circulating microRNAs as biomarkers in cancers: what have we got? Clin Chem Lab Med. 2012;50:2121-2126. [PubMed] [DOI] |
| 28. | Allegra A, Alonci A, Campo S, Penna G, Petrungaro A, Gerace D, Musolino C. Circulating microRNAs: new biomarkers in diagnosis, prognosis and treatment of cancer (review). Int J Oncol. 2012;41:1897-1912. [PubMed] [DOI] |
| 29. | Guo L, Chen C, Shi M, Wang F, Chen X, Diao D, Hu M, Yu M, Qian L, Guo N. Stat3-coordinated Lin-28-let-7-HMGA2 and miR-200-ZEB1 circuits initiate and maintain oncostatin M-driven epithelial-mesenchymal transition. Oncogene. 2013; Jan 14. [Epub ahead of print]. [PubMed] [DOI] |
| 30. | Feng B, Wang R, Chen LB. Review of miR-200b and cancer chemosensitivity. Biomed Pharmacother. 2012;66:397-402. [PubMed] [DOI] |
| 31. | Liu Y, Sánchez-Tilló E, Lu X, Huang L, Clem B, Telang S, Jenson AB, Cuatrecasas M, Chesney J, Postigo A. Sequential inductions of the ZEB1 transcription factor caused by mutation of Rb and then Ras proteins are required for tumor initiation and progression. J Biol Chem. 2013;288:11572-11580. [PubMed] [DOI] |