修回日期: 2013-07-12
接受日期: 2013-07-31
在线出版日期: 2013-08-28
目的: 探讨经人动力素(kinectin)融合蛋白刺激的人外周血B细胞诱导效应T细胞杀伤肝癌细胞的效果.
方法: 取健康人外周血, 分离出单个核细胞, 加B细胞刺激因子及kinectin麦芽糖融合蛋白进行体外培养, 尔后用尼龙毛柱分离T细胞, 将其与肝癌细胞株7404混合培养. 用乳酸脱氢酶法检测杀伤肝癌细胞的活性.
结果: T细胞对肝癌细胞的杀伤率: 空白对照组: 3.40%±0.27%; 实验组: 38.48%±2.64%; 阴性对照组: 13.03%±2.38%. 经统计软件分析, 实验组杀伤率与其他组有明显差异.
结论: 经kinectin融合蛋白刺激的人外周血B细胞诱导的效应T细胞在体外对肝癌细胞株7404有杀伤的作用.
核心提示: kinectin蛋白作为肝癌相关抗原有较强免疫原性, 在体外可致敏B淋巴细胞, 从而诱导出效应T细胞发挥杀伤肝癌细胞株7404的作用.
引文著录: 何少健, 韦力嘉, 宋琼, 肖瑞雪, 晁耐霞, 陈芳, 莫发荣, 农蔚霞. 经kinectin融合蛋白刺激的人B细胞诱导效应T细胞对肝癌细胞的杀伤. 世界华人消化杂志 2013; 21(24): 2418-2423
Revised: July 12, 2013
Accepted: July 31, 2013
Published online: August 28, 2013
AIM: To investigate whether human B lymphocytes stimulated with kinectin protein induces effector T lymphocytes to kill hepatocellular carcinoma cells.
METHODS: Mononuclear cells were separated from healthy human peripheral blood and cultured in vitro. During cultivation, B cell activating factor (BAFF) and MBP-kinectin were added. After being disassociated from cultured mononuclear cells using the method of nylon wool column, T lymphocytes were incubated together with hepatocellular carcinoma cell strain 7404. The killing effect of T lymphocytes on hepatocellular carcinoma cells was detected by LDH release assay.
RESULTS: The percentage of hepatocellular carcinoma cells killed by T lymphocytes was as follows: 3.40% ± 0.27% in the normal control group, 38.48% ± 2.64% in the experimental group, and 13.03% ± 2.38% in the negative control group. The percentage of hepatocellular carcinoma cells killed by T lymphocytes was significantly higher in the experimental group than in the normal control group and negative control group.
CONCLUSION: Human B lymphocytes stimulated with kinectin fusion protein are able to induce effector T lymphocytes to kill hepatocellular carcinoma cells in vitro.
- Citation: He SJ, Wei LJ, Song Q, Xiao RX, Chao NX, Chen F, Mo FR, Nong WX. Human B lymphocytes stimulated with kinectin protein induces effector T lymphocytes to kill hepatocellular carcinoma cells in vitro. Shijie Huaren Xiaohua Zazhi 2013; 21(24): 2418-2423
- URL: https://www.wjgnet.com/1009-3079/full/v21/i24/2418.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i24.2418
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的恶性肿瘤之一[1]. 目前, 用肝细胞癌相关抗原致敏抗原提呈细胞, 再诱导出具有抗肿瘤活性的免疫细胞, 用于杀伤肝癌细胞, 这是治疗肝细胞癌的一个新尝试. 本课题组2000年使用重组表达cDNA克隆的血清学分析技术(serological analysis of recombinantly expressed cDNA clone)成功地从广西HCC的cDNA文库中筛查出多个肝癌相关抗原的克隆, 测序结果显示, 其中的5个片段基本上与人动力素(kinectin)羧基末端同源[2]. 对其中编号为1-8a的克隆进行了不同血清的kinectin抗体初步检测, 发现HCC患者血清中的kinectin抗体阳性率为68%[3]. 并已制备并分离纯化kinectin麦芽糖基因重组融合蛋白[4,5]. 本研究用此蛋白作为抗原来致敏人外周血B细胞, 期望致敏的B细胞将抗原提呈给T细胞, 并诱导出具有抗肝细胞癌活性的效应T细胞而发挥杀伤肝癌细胞的作用.
健康人外周血; 肝癌细胞株7404; 课题组自存的kinectin麦芽糖融合蛋白; 1640培养基(上海生物工程技术公司); 胎牛血清(HyClone公司); 人淋巴细胞分离液(天津美德太平洋科技公司); 白介素(interleukin, IL)-2、IL-4、B细胞刺激因子(B cell activating factor belong to the TNF family, BAFF)(美国PEPROTECH公司); MTT(美国Sigma公司); 乳酸脱氢酶试剂盒(Promega公司); 尼龙毛(Gerlinde kisker GbR); APC标记的抗人CD19、PE标记的抗人CD80、PE标记的抗人CD86、FITC标记的抗人HLA-DR(eBioscience公司).
1.2.1 人外周血单个核细胞的分离培养: 取人外周血50 mL(抗凝), 用Hanks液稀释1倍, 混匀. 加至等量淋巴细胞分离液上面, 20 ℃, 2000 r/min, 离心20 min. 吸取分离液中的白膜层, 用Hanks液洗涤、离心(1000 r/min, 5 min)2次后, 用1640培养液[10%胎牛血清、IL-2(200 U/mL)、IL-4(100 ng/mL)及BAFF(100 ng/mL)]重悬, 制成细胞密度为1.5×106个/mL的细胞悬液, 于37 ℃、5%CO2培养箱中培养, 待用.
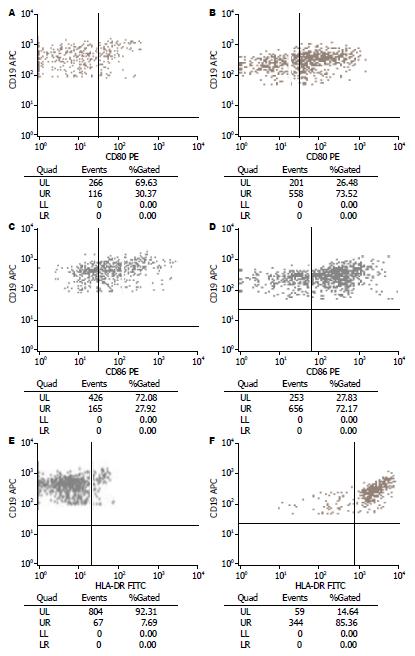
1.2.2 经kinectin抗原与BAFF刺激后, B细胞抗原提呈能力的检测: 在1.2.1制备的细胞悬液中加入kinectin融合蛋白(100 µg/mL), 培养48 h后吸取悬浮细胞, 流式细胞术检测B细胞表面CD80、CD86和HLA-DR分子的表达, 并与未加kinectin融合蛋白和BAFF的组比较.
1.2.3 经kinectin抗原与BAFF刺激后, 淋巴细胞增殖的检测: 将1.2.1制备的细胞悬液置于24孔板, 分成3组(每组复设8孔). 第1组为空白对照组, 即只用含10%胎牛血清及IL-2(200 U/mL)、IL-4(100 ng/mL)、BAFF(100 ng/mL)的1640培养液培养. 第2组为实验组, 即每孔加入kinectin融合蛋白(100 µg/mL). 第3组为阴性对照组, 即每孔加入麦芽糖蛋白(100 µg/mL). 培养至第4 d, 吸取悬浮细胞(即淋巴细胞)置于96孔板, 分3组, 每组复设5孔. 用MTT法检测细胞增殖情况.
1.2.4 效应T细胞杀伤肿瘤效靶比的选择: 将1.2.1制备的细胞悬液置24孔板中, 每孔加入kinectin融合蛋白(100 µg/mL)培养至第7 d, 吸取悬浮细胞即淋巴细胞, 用尼龙毛柱分离出T细胞, 作为效应细胞. 取处于对数生长期生长状态良好的肝癌细胞株7404作为靶细胞(细胞数量为2×104个), 接种于96孔板, 设3组, 每组复设3孔. 3组分别按效靶比10:1, 25:1, 60:1加入T细胞. 采用乳酸脱氢酶(lactate dehydrogenase, LDH)4 h释放法测算3组效应细胞的杀伤活性.
1.2.5 人外周血B细胞经kinectin融合蛋白致敏后, 再由其诱导效应T细胞杀伤肝癌细胞的检测: 将1.2.1制备的细胞悬液置24孔板中, 设4个组. 第一组为空白对照组, 即只用含10%胎牛血清、IL-2(200 U/mL)、IL-4(100 ng/mL)及BAFF(100 ng/mL)的1640培养液培养. 第2组为实验组, 即每孔加入kinectin融合蛋白(100 µg/mL). 第3组为阴性对照组1, 即每孔加入麦芽糖蛋白(100 µg/mL). 第4组为阴性对照组2, 即培养液中不加入BAFF, 每孔加入kinectin融合蛋白(100 µg/mL). 培养至第7 d, 吸取悬浮细胞(即淋巴细胞), 用尼龙毛柱分离出T细胞置于96孔板, 每组复设3孔. 按效靶比60:1与处于对数生长期生长状态良好的肝癌细胞株7404混合. 采用LDH 4 h释放法分别检测4组T细胞杀伤肝癌细胞的活性.
统计学处理 采用SPSS13.0统计软件对数据进行统计学处理. 计量资料数据用mean±SD表示, 组间差异采用多个样本均数比较及两两比较, 检验水准α = 0.05, P<0.05为差异有统计学意义.
用流式细胞术"设门"于CD19阳性淋巴细胞, 分析实验组与对照组B细胞表面CD80、CD86和HLA-DR分子的表达情况, 结果以阳性细胞百分比表示. 经kinectin抗原与BAFF刺激后的B细胞表面CD80、CD86和HLA-DR分子的表达均明显高于对照组(图1, 表1).
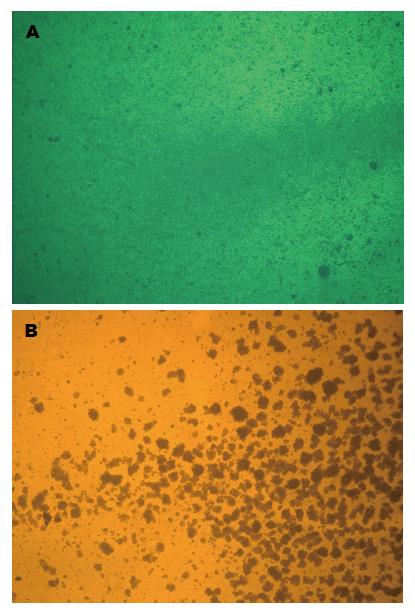
培养24 h, 实验组与阴性对照组的淋巴细胞呈大小不等的团簇状悬浮生长(图2), 且随培养时间延长而增多. 将培养4 d的3组淋巴细胞置于96孔板, 每组复设5孔. 用MTT法检测其增殖. 结果实验组经kinectin融合蛋白致敏的B细胞刺激的淋巴细胞增殖能力最强, 该组的增殖指数明显高于其他组(表2).
效靶比在60:1的杀伤肿瘤的效果明显高于其他两种效靶比(表3).
目前, 肿瘤过继性细胞免疫治疗成为肿瘤治疗的研究热点. 寻找肝癌相关抗原成为肝癌过继性细胞免疫治疗中重要的一步.
本课题组前期对kinectin全氨基酸序列进行了生物信息学分析, 从表位预测分析发现, kinectin 1-8a含有一个得分较高的T细胞表位, 5个B细胞表位[5]. 推测kinectin 1-8a蛋白抗原有较强的免疫原性. 且用该蛋白致敏的树突状细胞对具有很强的刺激自体T细胞增殖的能力[6]. 本研究中淋巴细胞增殖情况的实验结果显示, 实验组的淋巴细胞增殖率最高, 明显高于空白对照组(无抗原)及阴性对照组(麦芽糖蛋白作为抗原), 这说明kinectin蛋白免疫原性强于麦芽糖蛋白. 可用该融合蛋白作为抗原刺激人外周血淋巴细胞, 以诱导出具有抗肝细胞癌活性的效应T细胞.
T细胞参与的是细胞免疫, 但其无法识别抗原. 他依赖抗原提呈细胞(antigen-presenting cells, APC)获取抗原信息. 作为专职抗原提呈细胞之一的B细胞, 由于其在外周血中大量存在、获取途径简单以及抗原提呈效能高等优点正在被人们逐渐认识和利用. BAFF是TNF家族中的一员[7,8], 又称为B淋巴细胞刺激因子, 由单核细胞和巨噬细胞合成和分泌. BAFF以膜结合和可溶性两种形式存在. 膜结合型BAFF由285个氨基酸组成, 经蛋白酶水解膜外区的133-134氨基酸残基肽链后, 可产生由152个氨基酸组成的可溶性活性多肽. 在体内外, 可溶性BAFF均具有特异地刺激B淋巴细胞的作用, 是B细胞发育存活所必需的[9-11]. BAFF可与B淋巴细胞表面的相应受体BCMA、TACI[12-15]、BAFF-R[16-18]结合. 作为一种B细胞的共刺激因子, BAFF对活化的B细胞有强烈的促进增殖和刺激分泌作用[19]. 在anti-IgM或IL-4的存在下能够专一的刺激B细胞的增殖和分化[20]. 本实验的抗原提呈能力检测结果显示, 未经活化的B细胞表面HLA-DR、黏附分子CD80、CD86均呈低水平表达, 而与抗原kinectin及BAFF共培养的B细胞表面HLA-DR、黏附分子CD80、CD86的表达显著增加. 本实验的阴性对照组2(培养液中加入kinectin融合蛋白, 但不加入BAFF)对肝癌细胞的杀伤率明显低于实验组(培养液中同时加入kinectin融合蛋白与BAFF), 这一结果表明, 经kinectin抗原与BAFF刺激后, B细胞已经活化并对kinectin抗原提呈能力大为增强, 对T细胞的活化能力也同时增强.
B细胞将肝癌相关抗原kinectin麦芽糖融合蛋白以抗原肽/MHC分子复合物的形式提呈给T细胞. T细胞通过TCR与抗原肽/MHC分子复合物特异性结合, 并通过CD3分子向细胞内传递信号, 从而被激活和发生增殖, 进而分化为效应性T细胞. 效应T细胞杀伤肝癌细胞株7404的实验结果显示, 实验组对肝癌细胞株7404的杀伤率明显高于空白对照组, 说明实验中淋巴细胞中的NK细胞等对肝癌细胞的非特异性杀伤对本研究的实验结果影响不大. 实验组对肝癌细胞株7404的杀伤率明显高于阴性对照组1(麦芽糖蛋白作为抗原), 说明实验组的效应T细胞对肝癌细胞株7404的有杀伤作用.
肝细胞癌是人类常见的恶性肿瘤. 近年来, 肿瘤免疫治疗已经发展成为继手术、放疗和化疗之后的新型模式. 使用免疫原性较强的肝癌相关抗原激发机体抗肝癌免疫反应是肝癌免疫治疗的重要环节. 目前研究发现人动力素(kinectin)是肝癌相关抗原. 可望用此蛋白抗原在体外激发免疫反应并诱导出具有抗肝细胞癌活性的效应T细胞而发挥杀伤肝癌细胞的作用.
张火俊, 副教授, 副主任医师, 长海医院放射科
T淋巴细胞需要抗原提呈细胞提呈抗原和辅助分子双信号才能有效地活化为具有抗肿瘤活性的效应T细胞. 作为抗原提呈细胞之一的B淋巴细胞其致敏及活化是在肿瘤免疫应答中起关键作用. B细胞激活因子是一种B细胞的共刺激因子, 对活化的B细胞有强烈的促进增殖和刺激分泌作用, 目前这方面有不少研究成果.
赵飞兰等研究发现肝癌相关抗原kinectin可致敏树突细胞并诱导出细胞毒性T淋巴细胞, 该T淋巴细胞对肝癌细胞株7404有杀伤作用.
本研究发现在体外经肝癌相关抗原kinectin融合蛋白可致敏B淋巴细胞, 从而诱导的效应T细胞对肝癌细胞株7404有杀伤的作用. 这为肝细胞癌的免疫治疗提供了实验依据, 为临床肿瘤的免疫治疗提供了一个可行性方案.
kinectin蛋白: 一种与囊泡转运相关的膜受体蛋白, 其最早发现定位于鸡胚脑细胞的内质网膜上, 主要参与了细胞内囊泡的转运.
本文以肝癌过继性细胞免疫治疗做为研究方向, 抗原合成等方面有一定创新性, 实验严谨、数据可信, 具有一定的指导意义.
编辑: 田滢 电编: 闫晋利
| 2. | Stenner-Liewen F, Luo G, Sahin U, Tureci O, Koslovski M, Kautz I, Liewen H, Pfreundschuh M. Definition of tumor-associated antigens in hepatocellular carcinoma. Cancer Epidemiol Biomarkers Prev. 2000;9:285-290. [PubMed] |
| 4. | 黄 天明, 黄 绍明, 莫 发荣, 何 少健, 周 素芳, 邓 琼英, 李 松峰, 黄 敏丽, 李 山, 薛 慧琴. 肝癌相关抗原kinectin基因片段的重组表达. 广西医科大学学报. 2006;23:345-347. |
| 5. | 黄 健. 肝癌相关抗原KINECTIN蛋白的生物信息学分析及KINECTIN基因片段的原核表达. 中国优秀硕士学位论文全文数据库, 2009. . |
| 6. | 赵 飞兰, 晁 耐霞, 薛 慧琴, 吴 春林, 林 永达, 罗 彬, 陈 芳, 谢 小薰, 罗 国容. 肝癌相关抗原kinectin基因重组蛋白致敏的树突状细胞对T细胞增殖活化的影响. 山东医药. 2010;50:21-23. |
| 7. | Schneider P, MacKay F, Steiner V, Hofmann K, Bodmer JL, Holler N, Ambrose C, Lawton P, Bixler S, Acha-Orbea H. BAFF, a novel ligand of the tumor necrosis factor family, stimulates B cell growth. J Exp Med. 1999;189:1747-1756. [PubMed] [DOI] |
| 8. | Moore PA, Belvedere O, Orr A, Pieri K, LaFleur DW, Feng P, Soppet D, Charters M, Gentz R, Parmelee D. BLyS: member of the tumor necrosis factor family and B lymphocyte stimulator. Science. 1999;285:260-263. [PubMed] [DOI] |
| 10. | Vaux DL. The buzz about BAFF. J Clin Invest. 2002;109:17-18. [PubMed] [DOI] |
| 11. | Karpusas M, Cachero TG, Qian F, Boriack-Sjodin A, Mullen C, Strauch K, Hsu YM, Kalled SL. Crystal structure of extracellular human BAFF, a TNF family member that stimulates B lymphocytes. J Mol Biol. 2002;315:1145-1154. [PubMed] |
| 12. | Thompson JS, Schneider P, Kalled SL, Wang L, Lefevre EA, Cachero TG, MacKay F, Bixler SA, Zafari M, Liu ZY. BAFF binds to the tumor necrosis factor receptor-like molecule B cell maturation antigen and is important for maintaining the peripheral B cell population. J Exp Med. 2000;192:129-135. [PubMed] [DOI] |
| 13. | Yan M, Marsters SA, Grewal IS, Wang H, Ashkenazi A, Dixit VM. Identification of a receptor for BLyS demonstrates a crucial role in humoral immunity. Nat Immunol. 2000;1:37-41. [PubMed] [DOI] |
| 14. | Marsters SA, Yan M, Pitti RM, Haas PE, Dixit VM, Ashkenazi A. Interaction of the TNF homologues BLyS and APRIL with the TNF receptor homologues BCMA and TACI. Curr Biol. 2000;10:785-788. [PubMed] [DOI] |
| 15. | Gross JA, Johnston J, Mudri S, Enselman R, Dillon SR, Madden K, Xu W, Parrish-Novak J, Foster D, Lofton-Day C. TACI and BCMA are receptors for a TNF homologue implicated in B-cell autoimmune disease. Nature. 2000;404:995-999. [PubMed] [DOI] |
| 16. | Thompson JS, Bixler SA, Qian F, Vora K, Scott ML, Cachero TG, Hession C, Schneider P, Sizing ID, Mullen C. BAFF-R, a newly identified TNF receptor that specifically interacts with BAFF. Science. 2001;293:2108-2111. [PubMed] [DOI] |
| 17. | Yan M, Brady JR, Chan B, Lee WP, Hsu B, Harless S, Cancro M, Grewal IS, Dixit VM. Identification of a novel receptor for B lymphocyte stimulator that is mutated in a mouse strain with severe B cell deficiency. Curr Biol. 2001;11:1547-1552. [PubMed] [DOI] |
| 18. | Kayagaki N, Yan M, Seshasayee D, Wang H, Lee W, French DM, Grewal IS, Cochran AG, Gordon NC, Yin J. BAFF/BLyS receptor 3 binds the B cell survival factor BAFF ligand through a discrete surface loop and promotes processing of NF-kappaB2. Immunity. 2002;17:515-524. [PubMed] [DOI] |
| 19. | Khare SD, Sarosi I, Xia XZ, McCabe S, Miner K, Solovyev I, Hawkins N, Kelley M, Chang D, Van G. Severe B cell hyperplasia and autoimmune disease in TALL-1 transgenic mice. Proc Natl Acad Sci USA. 2000;97:3370-3375. [PubMed] [DOI] |
| 20. | Rolink AG, Melchers F. BAFFled B cells survive and thrive: roles of BAFF in B-cell development. Curr Opin Immunol. 2002;14:266-275. [PubMed] |