修回日期: 2013-07-19
接受日期: 2013-07-31
在线出版日期: 2013-08-28
目的: 探讨胃癌中与雌激素受体(estrogen receptor, ER)-α36有关的miRNA表达差异.
方法: 构建稳定转染低表达ER-α36和高表达ER-α36的SGC7901细胞系, 进行miRNA测序; 对20例人体胃癌组织行ER-α36免疫组织化学染色, 将其分为阳性组和阴性组后通过Real-time PCR检测miR-184和miR-143的表达.
结果: 与对照组SGC7901细胞相比, 高表达ER-α36的SGC7901细胞出现miR-184、miR-143等miRNA表达下调(miR-184下调2.78倍; miR-143下调2.95倍), 低表达ER-α36的SGC7901细胞反之(miR-184上调3.17倍; miR-143上调3.11倍). PCR结果显示人体胃癌组织中ER-α36阴性表达组与ER-α36阳性表达组相比, miR-184上调14.2倍, miR-143上调9.67倍.
结论: miR-184和miR-143可能是调控ER-α36的重要分子, 参与介导胃癌的发生与发展.
核心提示: 探讨胃癌中与雌激素受体(estrogen receptor α36, ER-α36)有关的miRNA表达差异, 发现miR-184和miR-143等小RNA与ER-α36的表达呈负相关, 可能参与介导胃癌的发生与发展.
引文著录: 邹丰, 王绪明, 刘丽江. ER-α36介导的胃癌中miRNA表达的研究. 世界华人消化杂志 2013; 21(24): 2373-2377
Revised: July 19, 2013
Accepted: July 31, 2013
Published online: August 28, 2013
AIM: To identify differentially expressed miRNAs involved in estrogen receptor-α36 (ER-α36)-mediated gastric carcinogenesis.
METHODS: SGC7901 cell lines with stable low or high expression of ER-α36 were developed. MiRNA gene sequencing was performed in the above cell lines. The expression of ER-α36 was detected by immunohistochemistry in 20 human gastric cancer specimens, and the expression of miR-184 and miR-143 in these specimens was detected by real-time PCR.
RESULTS: The expression of miR-184 and miR-143 was significantly decreased in the SGC7901 cell line with stable high expression of ER-α36 (2.78 and 2.95 folds, respectively), but was increased in the SGC7901 cell line with stable low expression of ER-α36 (2.78 and 9.67 folds, respectively). The expression of miR-184 and miR-143 was negatively correlated with ER-α36 expression in human gastric cancer tissues (miR-184 was up-regulated by 14.2 folds and miR-143 by 2.95 folds in ER-α36-negative tissues compared to ER-α36-positive tissues).
CONCLUSION: MiR-184 and miR-143 may mediate the occurrence and development of gastric cancer by regulating ER-α36 expression.
- Citation: Zou F, Wang XM, Liu LJ. Identification of miRNAs involved in ER-α36-mediated gastric carcinogenesis. Shijie Huaren Xiaohua Zazhi 2013; 21(24): 2373-2377
- URL: https://www.wjgnet.com/1009-3079/full/v21/i24/2373.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i24.2373
胃癌是全球常见的恶性肿瘤之一, 其发病率占恶性肿瘤的第4位, 死亡率第2位[1]. 现有流行病学资料显示, 男性胃癌的人数明显多于女性胃癌, 但与女性绝经期后发病率基本相同, 提示雌激素可能在胃癌的发生中起重要作用[2]. 雌激素通过雌激素受体(estrogen receptor, ER)发挥作用效应. 其亚型ER-α除了参与细胞增殖、分化和凋亡外, 也在冠心病及某些恶性肿瘤(如乳腺癌、结肠癌等)的发生中发挥一定的作用[3]. 本课题组前期研究发现, 经典ER-α受体ER-α66的同源异构体ER-α36能够介导胃癌的生长[4].
microRNA(miRNA)是长度为20-25 nt的一类具有高度保守的内源性非蛋白编码的小分子单链RNA, 其主要功能是通过对靶基因转录体的切割或对其翻译抑制两种途径来调控基因的表达[5]. 现已有大量文献证实miRNA在肿瘤的发生和发展中发挥着重要调控作用[6]. 本文在大量前期研究的基础上, 探寻与ER-α36调控胃癌生长中为之相关的miRNA的表达差异, 为进一步完善雌激素信号通路在胃癌发生中的作用机制提供重要的理论依据.
人胃癌细胞系SGC7901由华中科技大学同济医学院免疫学系惠赠, 为本实验室保存. 组织: 20例石蜡包埋的人体胃癌样本来源于江大病理诊断所, 患者术前均未接受过放疗及化疗. 主要试剂: ER-α36沉默质粒、ER-α36过表达质粒、ER-α36单克隆抗体均由美国Creighton大学医学院医学中心王兆一教授馈赠; Actin抗体购自美国Santa Cruz公司; miR-143、miR-184、U6的Taqman引物和探针均购自美国Life Science公司.
1.2.1 细胞培养: SGC7901细胞接种在含10%小牛血清的RPMI 1640培养基中, 于37 ℃、5%CO2培养箱中培养. 每2-3 d待细胞增长至约70%-80%左右融合时胰酶消化传代.
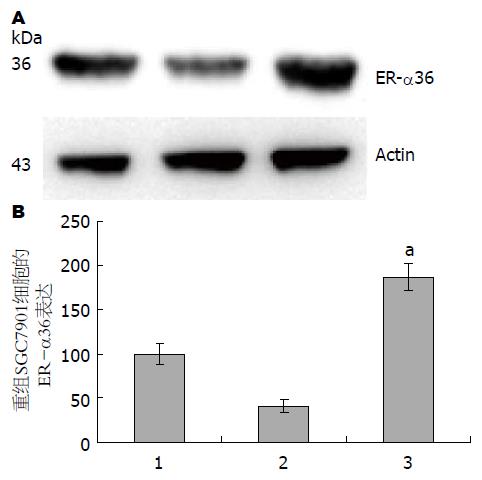
1.2.2 构建稳定转染低表达ER-α36和高表达ER-α36的SGC7901细胞系: 通过ER-α36有效靶序列[7]设计合成单链寡聚DNA重组慢病毒. ER-α36沉默质粒(pLKO.1-PURO-SP6-ER-α36-L)和ER-α36表达质粒(pLJM1-ER-α36-H): ER-α36 F: CCGGTTGATGCCAATAGGTACTGAACTCGAGTTCAGTACCTATTGGCATCAATTTTTTG; ER-α36 R: AATTCAAAAAATTGATGCCAATAGGTACTGAACTCGAGTTCAGTACCTATTGGCATCAA. 以Lipofectamine 2000TM细胞转染试剂盒转染给包装细胞293T细胞, 收集293T细胞的病毒悬液感染SGC7901细胞构建稳定低表达ER-α36(ER-α36 low)和稳定高表达ER-α36(ER-α36 high)的SGC7901转染细胞系. 同时建立空载体转染SGC7901细胞系pLKO.1-PURO-scremble shRNA(ER-α36 control). 采用Western blot检测ER-α36的蛋白表达来鉴定重组细胞系的构建是否成功.
1.2.3 Western blot检测: 提取细胞胞浆总蛋白. 按BCA蛋白含量测定试剂盒说明进行蛋白定量, SDS-PAGE后蛋白半干转印于PVDF膜, 封闭后一抗分开孵育: 分别加入ER-α36抗体和Actin抗体, 4 ℃过夜; 洗膜后孵育二抗, 室温1 h, 洗膜后于暗室中行ECL显色检测蛋白的表达, 采用数码凝胶图像处理系统扫描测定ER-α36和内参Actin的表达(用平均光密度值Density表示).
1.2.4 miRNA测序: 两株SGC7901重组细胞系(ER-α36 low、ER-α36 high)和对照组SGC7901系(ER-α36 control)送至深圳华大基因研究院进行miRNA测序. 其结果为相应的miRNA表达谱.
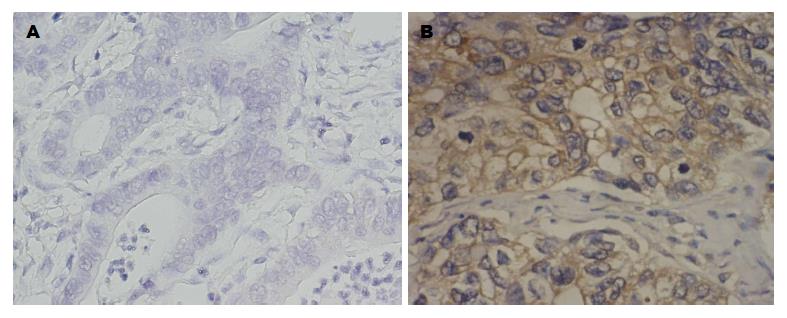
1.2.5 免疫组织化学染色: 常规石蜡切片脱蜡至水. 3%H2O2室温孵育5-10 min, 蒸馏水冲洗, PBS浸泡. 10%正常山羊血清(PBS稀释)封闭, 室温孵育10 min, 倾去血清. 滴加ER-α36工作液(1:500), 4 ℃过夜. 滴加适量生物素标记二抗工作液, 37 ℃孵育30 min. 滴加适量的辣根过氧化物酶工作液, 37 ℃孵育30 min. DAB显色剂显色, 自来水反复冲洗, 复染, 脱水, 透明, 封片, 显微镜下观察.
1.2.6 Real-time PCR检测: 石蜡包埋的人体胃癌样本首先常规石蜡切片脱蜡, 用Isolation Additive试剂提取总RNA, 定量, 取10 ng RNA用于逆转录. 逆转录和PCR反应均选用miR-184和miR-143的特异性TaqMan引物和探针. 仪器选用Step One Plus(美国Applied Biosystems公司). 实验结束后用Step One Plus System SDS software分析数据. U6基因用作内参基因, Ct值用来反映每个反应管内的荧光信号到达设定的域值时所经历的循环数, PCR结果用2-△△Ct的方式显示显示各组的倍数关系.
统计学处理 所有数据应用统计学分析应用软件SPSS13.0处理, 以t检验用于计量资料的组间比较, 其中P<0.05为差异具有统计学意义.
通过Western blot检测对构建好的两株重组细胞系进行鉴定, 结果显示低表达ER-α36的SGC7901细胞组(ER-α36 high)的ER-α36蛋白表达要明显低于对照的SGC7901细胞组(ER-α36 control); 高表达ER-α36的SGC7901细胞组(ER-α36 low)的ER-α36蛋白表达要明显高于对照组SGC7901细胞组(ER-α36 control)(图1).
与胃癌对照组SGC7901细胞(control 7901)相比, 高表达ER-α36的胃癌SGC7901细胞(ER-α36 high)中有52个miRNA发生差异变化, 低表达ER-α36 的SGC7901细胞(ER-α36 low)中有245个miRNA发生差异变化. 其中, 12个miRNA在两者的对比中呈相反的差异变化: 即在ER-α36 high组的SGC7901细胞表达下调, 同时又在ER-α36 low组中表达上调. 其中, 与control 7901组细胞相比, ER-α36 high组细胞的miR-184下调2.78倍, miR-143下调2.95倍; ER-α36 low组细胞的miR-184上调3.17倍, miR-143上调3.11倍(表1).
| miRNA | 倍数差异1 | 倍数差异2 |
| hsa-miR-130a | 1.0549022 | -1.2208654 |
| hsa-miR-143 | 3.1115631 | -2.9596145 |
| hsa-miR-15b | 2.1410931 | -1.6770794 |
| hsa-miR-184 | 3.1731173 | -2.7823983 |
| hsa-miR-199a-3p | 2.1584028 | -1.7071819 |
| hsa-miR-199b-3p | 2.152746 | -1.7071819 |
| hsa-miR-31 | 2.704662 | -1.1909115 |
| hsa-miR-424 | 1.2071274 | -1.2599222 |
| hsa-miR-450a | 1.8707823 | -1.2581486 |
| hsa-miR-455-3p | 2.439201 | -1.0381852 |
| hsa-miR-629 | 1.2830178 | -1.2763782 |
| hsa-miR-664 | 1.7611351 | -1.063114 |
人体胃癌组织(n = 20)的ER-α36免疫组织化学染色结果显示: 8例细胞膜及胞浆内未见黄色染色颗粒, 为ER-α36阴性组(图2A); 12例细胞膜及胞浆中可见明显的黄色染色颗粒, 为ER-α36阳性组(图2B).
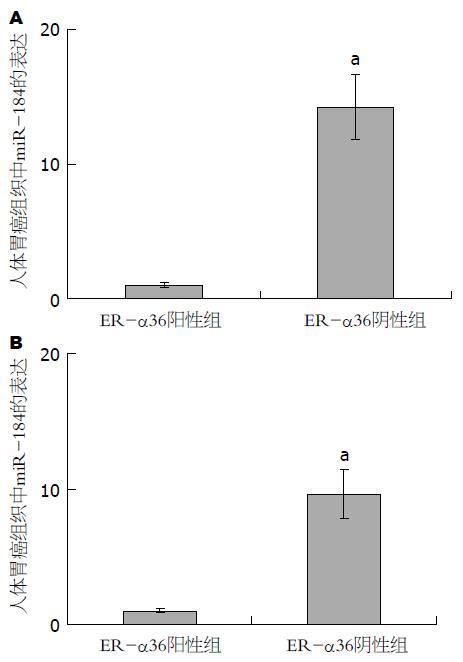
将上述经ER-α36免疫组织化学染色的人体胃癌组织分为ER-α36阴性组和ERα36阳性组. Real-time PCR检测miR-184和miR-143的表达. 结果显示, 人体胃癌组织中ER-α36阴性表达组与ER-α36阳性表达组相比, miR-184上调14.2倍, miR-143上调9.67倍(图3).
胃癌雌激素及ER的作用机制研究已有很长的历史. 1986年首次发现胃癌细胞中表达ER, 研究主要集中在ER-α66, 但其阳性率差异比较大, 约0%-50%[8]. 经典的ER-α受体主要包括ER-α66、ER-α46和ER-α36, 其中ER-α36是近些年来发现并克隆的, 其主要功能作用并不十分清楚. 但有研究证实, ER-α36的表达不完全依赖于ER-α66, 并可单独经细胞膜启动雌激素类信号转导[9].
miRNA是近几年被证明的一类具有高度保守的内源性非蛋白编码的小分子单链RNA, 其主要功能是通过对靶基因转录体的切割或对其翻译抑制两种途径来调控基因的表达. miR-143是一种高度保存的单拷贝基因, 位于人类5号染色体q33位置[10]. 已有文献证实miR-143表达的下调可以促进食管鳞状细胞癌的发生[11]. miR-143还能通过调控其靶基因DNA甲基转移酶3A蛋白来介导结肠癌的发生[12]. miR-184是一种高度保存的单拷贝基因, 其位于人类15号染色体q25.1位置, 或小鼠的第9号染色体[13,14]. 成熟的miR-184在哺乳动物的大脑、睾丸和角膜上皮中、在斑马鱼的孵化腺和表皮中均有丰富的表达[15]. 研究显示, 原癌基因MYCN通过抑制miR-184, 增加其靶基因蛋白激酶B2(Akt2)的表达, 从而激活磷脂酰肌醇3激酶途径来促进肿瘤的增值[16]. 在舌鳞状细胞癌(squamous cell carcinoma of tongue, SCC)中, miR-184在肿瘤患者的舌上皮细胞和血浆中均有高表达; 通过抑制miR-184的表达可以显著增加体外培养的SCC细胞的凋亡[17]. 从上述文献的内容来看, miR-143和miR-184的功能抑制均能促进肿瘤的发生, 然而两者在胃癌中的研究仍报道甚少.
我们通过基因测序的方法发现, 与ER-α36表达密切相关的miRNA, 我们对其中差异比较大的是miR-184和miR-143, 即高表达ER-α36的SGC7901细胞其miR-184和miR-143表达有着极显著的下调. 而低表达ER-α36的SGC7901细胞其miR-184和miR-143表达又有着极显著的上调. 因此我们推测ER-α36介导胃癌的发生可能受到miR-184和miR-143的调控. 在人体胃癌组织中的验证得到了进一步的数据, 即发现ER-α36表达与miR-184或miR-143表达呈负性相关, 这为我们的假说提供了论证. 但miR-184和miR-143调控ER-α36来介导胃癌的生长到底是以miR-184为主, 还是以miR-143为主, 或者是两者的协同作用以及还有那些基因参与都还需进一步的研究证实.
胃癌是全球常见的恶性肿瘤之一. 现有流行病学资料显示, 女性胃癌的人数明显少于男性胃癌, 但绝经期后发病率与男性基本相同, 提示雌激素可能在胃癌的发生中起到一定作用. 雌激素依赖雌激素受体发挥作用. 经典雌激素受体雌激素受体(estrogen receptor, ER)-α66的同源异构体ER-α36是近些年来发现并克隆的, 其表达不完全依赖于ER-α66, 并可单独经细胞膜启动雌激素类信号转导.
李淳, 副教授, 汕头大学医学院病理学教研室
经典雌激素受体ER-α66的同源异构体ER-α36能够介导胃癌的生长, 但具体机制不详. miRNA通过对靶基因转录体的切割或对其翻译抑制两种途径来调控基因的表达, 在肿瘤的发生和发展中均能发挥着重要调控作用. 探寻与ER-α36调控胃癌生长中为之相关的miRNA的表达差异, 完善雌激素信号通路在胃癌发生中的作用机制.
Deng等采用PCR、免疫印迹和免疫荧光等方法证实人体胃癌细胞系(BGC-823、AGS、MKN-45、SGC7901)均能在mRNA、蛋白质及细胞内定位的不同层面表达ER-α36蛋白, 并且对雌激素、选择性雌激素受体调节剂以及雌激素受体特异性阻断剂(ICI182, 780)产生应答; ER-α36蛋白在人体胃癌组织中也呈高表达, 并且与胃癌的生物学行为相关.
雌激素受体ER-α36是近些年来发现并克隆的, 能够调控胃癌的发生和发展. miR-143和miR-184的功能抑制均能促进肿瘤的发生, 但两者在胃癌中的研究仍报道甚少. 本研究提出miR-143和miR-184可能通过靶向ER-α36与胃癌的发生存在联系.
完善雌激素受体ER-α36介导胃癌中的雌激素信号研究通路; 建立miRNA靶向胃癌中的ER-α36的信号通路; 为胃癌的分子靶向治疗提供了重要线索, 具有一定的临床前景.
microRNA: 一类具有高度保守的内源性非蛋白编码的小分子单链RNA, 长度为20-25 nt. 其主要功能是通过对靶基因转录体的切割或对其翻译抑制两种途径来调控基因的表达.
本文从培养细胞和人体胃癌组织两层面对胃癌ER-α36表达与miR-184和miR-143表达的关系进行初步研究, 对了解胃癌发生发展的机制有一定意义. 实验设计合理, 图片清晰.
编辑: 黄新珍 电编: 闫晋利
| 1. | Hartgrink HH, Jansen EP, van Grieken NC, van de Velde CJ. Gastric cancer. Lancet. 2009;374:477-490. [PubMed] [DOI] |
| 2. | Sipponen P, Correa P. Delayed rise in incidence of gastric cancer in females results in unique sex ratio (M/F) pattern: etiologic hypothesis. Gastric Cancer. 2002;5:213-219. [PubMed] |
| 3. | Pedram A, Razandi M, Levin ER. Nature of functional estrogen receptors at the plasma membrane. Mol Endocrinol. 2006;20:1996-2009. [PubMed] |
| 4. | Deng H, Huang X, Fan J, Wang L, Xia Q, Yang X, Wang Z, Liu L. A variant of estrogen receptor-alpha, ER-alpha36 is expressed in human gastric cancer and is highly correlated with lymph node metastasis. Oncol Rep. 2010;24:171-176. [PubMed] |
| 5. | Lee Y, Kim M, Han J, Yeom KH, Lee S, Baek SH, Kim VN. MicroRNA genes are transcribed by RNA polymerase II. EMBO J. 2004;23:4051-4060. [PubMed] |
| 6. | Volinia S, Calin GA, Liu CG, Ambs S, Cimmino A, Petrocca F, Visone R, Iorio M, Roldo C, Ferracin M. A microRNA expression signature of human solid tumors defines cancer gene targets. Proc Natl Acad Sci USA. 2006;103:2257-2261. [PubMed] |
| 7. | Wang Z, Zhang X, Shen P, Loggie BW, Chang Y, Deuel TF. Identification, cloning, and expression of human estrogen receptor-alpha36, a novel variant of human estrogen receptor-alpha66. Biochem Biophys Res Commun. 2005;336:1023-1027. [PubMed] |
| 8. | Tokunaga A, Nishi K, Matsukura N, Tanaka N, Onda M, Shirota A, Asano G, Hayashi K. Estrogen and progesterone receptors in gastric cancer. Cancer. 1986;57:1376-1379. [PubMed] |
| 9. | Wang Z, Zhang X, Shen P, Loggie BW, Chang Y, Deuel TF. A variant of estrogen receptor-{alpha}, hER-{alpha}36: transduction of estrogen- and antiestrogen-dependent membrane-initiated mitogenic signaling. Proc Natl Acad Sci USA. 2006;103:9063-9068. [PubMed] |
| 10. | Cordes KR, Sheehy NT, White MP, Berry EC, Morton SU, Muth AN, Lee TH, Miano JM, Ivey KN, Srivastava D. miR-145 and miR-143 regulate smooth muscle cell fate and plasticity. Nature. 2009;460:705-710. [PubMed] [DOI] |
| 11. | Wu BL, Xu LY, Du ZP, Liao LD, Zhang HF, Huang Q, Fang GQ, Li EM. MiRNA profile in esophageal squamous cell carcinoma: downregulation of miR-143 and miR-145. World J Gastroenterol. 2011;17:79-88. [PubMed] [DOI] |
| 12. | Ng EK, Tsang WP, Ng SS, Jin HC, Yu J, Li JJ, Röcken C, Ebert MP, Kwok TT, Sung JJ. MicroRNA-143 targets DNA methyltransferases 3A in colorectal cancer. Br J Cancer. 2009;101:699-706. [PubMed] [DOI] |
| 13. | Weitzel RP, Lesniewski ML, Greco NJ, Laughlin MJ. Reduced methyl-CpG protein binding contributing to miR-184 expression in umbilical cord blood CD4+ T-cells. Leukemia. 2011;25:169-172. [PubMed] [DOI] |
| 14. | Nomura T, Kimura M, Horii T, Morita S, Soejima H, Kudo S, Hatada I. MeCP2-dependent repression of an imprinted miR-184 released by depolarization. Hum Mol Genet. 2008;17:1192-1199. [PubMed] [DOI] |
| 15. | Wienholds E, Kloosterman WP, Miska E, Alvarez-Saavedra E, Berezikov E, de Bruijn E, Horvitz HR, Kauppinen S, Plasterk RH. MicroRNA expression in zebrafish embryonic development. Science. 2005;309:310-311. [PubMed] |
| 16. | Foley NH, Bray IM, Tivnan A, Bryan K, Murphy DM, Buckley PG, Ryan J, O'Meara A, O'Sullivan M, Stallings RL. MicroRNA-184 inhibits neuroblastoma cell survival through targeting the serine/threonine kinase AKT2. Mol Cancer. 2010;9:83. [PubMed] [DOI] |
| 17. | Wong TS, Ho WK, Chan JY, Ng RW, Wei WI. Mature miR-184 and squamous cell carcinoma of the tongue. ScientificWorldJournal. 2009;9:130-132. [PubMed] [DOI] |