修回日期: 2013-07-24
接受日期: 2013-07-26
在线出版日期: 2013-08-18
目的: 评价不可切除的混合型肝癌患者进行肝动脉灌注化疗栓塞术(transcatheter arterial chemoembolization, TACE)临床的有效性和分析TACE治疗后患者生存及预后的因素.
方法: 回顾性分析50例接受TACE治疗不可切除混合型肝癌患者的临床资料, 分析并提炼出对患者临床疗效预及后有影响的重要因素.
结果: 经TACE治疗, 35(70%)例患者发生肿瘤坏死(坏死面积>50%), 15(30%)例患者无反应. 在10例乏血供肿瘤患者中有1例(10%), 在40例富血供肿瘤患者中有34例(85%)产生肿瘤坏死反应(P<0.001). 患者平均中位生存期为12.3 mo. 多变量Cox回归分析结果: 肿瘤大小(HR = 2.49, P = 0.028), 肿瘤的血供(HR = 4.19, P = 0.001), Child-Pugh分级(HR = 4.3, P = 0.001), 门静脉癌栓(HR = 6.45, P<0.001)是与TACE术后患者生存期相关的独立因素.
结论: TACE治疗对混合型肝癌是安全的, 与相同患者历史报道的生存率相比, 能有效地延长不可切除的混合型肝癌患者的生存时间. 肿瘤的血供情况与肿瘤反应高度相关.
核心提示: 肝动脉灌注化疗栓塞术(transcatheter arterial chemoembolization)治疗对混合型肝癌是安全的, 与相同患者历史报道的生存率相比, 能有效地延长不可切除的混合型肝癌患者的生存时间. 肿瘤的血供情况与肿瘤反应高度相关.
引文著录: 蒋天鹏, 王黎洲, 李兴, 宋杰, 吴晓萍, 周石. 肝动脉灌注化疗栓塞术对混合型肝癌的疗效分析50例. 世界华人消化杂志 2013; 21(23): 2349-2354
Revised: July 24, 2013
Accepted: July 26, 2013
Published online: August 18, 2013
AIM: To evaluate the clinical effectiveness of transcatheter arterial chemoembolization (TACE) in patients with nonresectable combined hepatocellular carcinoma (HCC) and cholangiocarcinoma and to analyze the prognostic factors affecting survival of patients after TACE.
METHODS: Clinical data for 50 patients who underwent TACE for nonresectable combined HCC-cholangiocarcinoma were retrospectively analyzed. The survival rate and the prognostic factors affecting patient survival were evaluated.
RESULTS: After TACE, 35 (70%) of the 50 patients were classified as responders having either a partial response or stable disease and 15 (30%) were classified as non-responders. Tumor response was significantly related to tumor vascularity. One (10%) of the 10 patients with hypovascular tumors and 34 (85%) of the 40 patients with hypervascular tumors were responders (P < 0.001). The median survival period was 12.3 months. Multivariable Cox regression analysis proved that tumor size (HR = 2.49, P = 0.028), tumor vascularity (HR = 4.19, P = 0.001), Child-Pugh class (HR = 4.3, P = 0.001), and portal vein invasion (HR = 6.45, P < 0.001) were independent factors associated with patient survival after TACE.
CONCLUSION: TACE is safe and effective in improving the survival of patients with nonresectable combined HCC-cholangiocarcinoma. Tumor vascularity is highly associated with tumor response.
- Citation: Jiang TP, Wang LZ, Li X, Song J, Wu XP, Zhou S. Nonresectable combined hepatocellular carcinoma and cholangiocarcinoma after transcatheter arterial chemoembolization: Therapeutic response and prognostic factors. Shijie Huaren Xiaohua Zazhi 2013; 21(23): 2349-2354
- URL: https://www.wjgnet.com/1009-3079/full/v21/i23/2349.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i23.2349
大多数肝脏原发性恶性肿瘤可分为两类: 肝细胞肝癌(hepatocellular carcinoma, HCC)和胆管癌[1]. 胆管癌合并肝细胞肝癌非常罕见, 因为其同时具有肝细胞和胆管上皮细胞异常分化的组织学特点, 所占比例不到原发性肝癌的5%[2,3]. Allen等[4]在1949年首次对肝癌合并胆管癌的病例进行了报道, 但是由于肝细胞肝癌又合并胆管癌的发生率低, 其人口统计学和临床特征、预后因素等仍然知之甚少. 目前仅有少数小规模的研究描述了肝癌合并胆管癌的临床特点[5]. 混合型肝癌即使通过手术切除, 因其复发率较高, 5年生存率不到30%[6]. 不适合手术切除的混合型肝癌患者预后更差, 还没有生存期超过18 mo患者的报道(中位生存期为6.5 mo)[7].
目前肝动脉灌注化疗栓塞术(transcatheter arterial chemoembolization, TACE)已被证明是可以延长混合型肝癌患者生存期的有效治疗手段[8-10]. 为了评估混合型肝癌患者接受TACE治疗的临床疗效并分析术后影响患者生存预后的因素, 就我科近年来收治的混合型肝癌患者的临床资料进行一个回顾性的总结, 现报告如下.
收集我院2002-01/2012-01接受TACE治疗的50例混合型肝癌患者的临床资料, 所有病例均在CT引导下行经皮肝穿刺活检后病理学以及免疫组织化学结果证实, TACE术前均进行头部、胸部及全腹部CT增强扫描来评估肿瘤的特点及是否存在肝外转移. 其中男41名, 女9名, 年龄31-79岁, 平均年龄56.3岁±9.7岁.
1.2.1 TACE手术: 手术采用Seldinger技术经股动脉插管, 常规行肝动脉及肠系膜上动脉造影确定病灶大小及血供状况, 同时间接门静脉造影观察有无门静脉侵犯及其程度. 尽可能超选择至肿瘤供血动脉并确认后, 在行肿瘤血管栓塞先前经导管注入奥沙利铂, 注射时间>15 min. 接下来将碘化油及吡柔比星混合乳剂缓慢经导管注入. 奥沙利铂剂量为130 mg/m2, 吡柔比星根据肿瘤肿瘤的血供情况剂量为25-40 mg/m2. 对于碘油用量超过20 mL仍未完全栓塞的肿瘤供血动脉则使用明胶海绵颗粒(规格直径1000-1200 μm)栓塞, 一直到肿瘤供血动脉发生血流淤滞时停止.
1.2.2 数据的定义和分析: 肿瘤反应的定义为在术后CT随访中发现肿瘤的最大直径至少减少30%(部分缓解)或不仅肿瘤的大小大幅下降而且出现超过50%坏死区域(肿瘤坏死面积>50%且患者病情稳定)[11,12]. 无反应的定义为患者病情稳定且肿瘤坏死区域低于50%或病情逐渐加重. 根据CT增强扫描获得肿瘤动脉期的强化程度将肿瘤的供血情况分为富血供肿瘤和乏血管肿瘤. 混合型肝癌病灶的分类与上面相似, 和邻近肝实质相比大面积强化或超过50%区域强化被归类为富血管性肿瘤. 混合型肝癌增强扫描动脉期病灶区域强化不到50%或强化程度小于或等于相邻肝实质定义为乏血供肿瘤[13,14]. 并发症的定义为TACE术后6 wk内发生有临床体征的亚急性肝功能衰竭(例如肝性脑病、新产生或增加的腹水肝脓肿, 急性肾功能衰竭和/或肝梗死)[15]. 栓塞后综合征包括短暂的发烧、恶心、呕吐、和/或腹部疼痛, 不视为TACE术后并发症, 并且死亡率的定义为TACE术后30 d内发生的死亡.
1.2.3 随访: 随访常规在术后1 mo进行, 内容包括体格检查和实验室检查(包括血细胞计数, 肝功能和甲胎蛋白(alpha-fetal protein, AFP), 癌胚抗原(carcino-embryonic antigen, CEA), 或CA19-9水平的测定). 因为单独的实体瘤疗效评价标准并不能全面反映TACE术后肿瘤的相关变化. 我们对肿瘤反应的评估是通过术后18-67 d复查腹部增强CT扫描来进行, 平均30.7 d±8.7 d. 由两名放射科医师使用CT机电子游标卡尺测量术前肿瘤的大小及术后肿瘤坏死区域(碘化油沉积或是缺少强化)的最大直径[16,17]. 其中肿瘤的坏死区域由两名具有副高级职称的放射科医师在TACE术后以术前CT扫描为基础进行评估[18]. 再次行TACE手术的指针为在CT随访中发现新的或残余肿瘤病灶, 且血清AFP、CEA、CA19-9浓度升高, 如果患者由于健康状况下降而不能耐受治疗, 立即停止TACE治疗.
统计学处理 数据运用SPSS19.0统计分析软件包进行分析. 所有变量均以(mean±SD)表示. 整体患者的生存期是在首次TACE治疗后以月为单位进行计算. 累积生存率曲线根据Kaplan-Meier法和Log-rank检验的结果进行比较. 为评估患者的生存期及预后我们对以下因素进行分析: 包括患者的年龄、性别、肿瘤大小、肿瘤数目、增强CT上观察到的肿瘤血管、辅助治疗(全身化疗或放疗)、门静脉癌栓、肝外转移、血清AFP; CEA和CA 19-9水平以及肝功能Child-Pugh分级. 根据肿瘤大小将患者分为两组, 直径为9 cm或更大的为一组, <9 cm的为另一组. 以中位生存率为基础将肿瘤的数量和血清AFP、CEA、CA 19-9水平分为2组. 进行单变量和多变量Cox回归分析以评估患者的生存时间. 包括在单变量模型中显著因素或显示一个趋势走向意义(P<0.2)进行相关因素分析. 在逐步向前的选择方式中设置变量, 也就是说, 设置并保留一个P值为0.05的变量来表明差异有统计学意义. 可变风险通过相应95%可信区间的危险比来表示. 使用Fisher精确检验来评估肿瘤血管和肿瘤反应之间的关系. P<0.05认为差异具有统计学意义.
40例患者(80%)病因为感染乙型肝炎病毒, 2例患者(4%)丙型肝炎病毒抗体阳性, 8例患者(16%)同时发现两种病毒感染. 27例患者(54%)有慢性肝炎, 19例患者(38%)有肝硬化, 4例患者(8%)既没有肝硬化也无慢性肝炎. 在31例患者(62%)中AFP水平升高(>20 ng/mL), 在8例患者(16%)中CEA水平升高(>6 ng/mL), 14例患者中(28%)CA 19-9水平升高(>37 U/mL). AFP, CEA和CA19-9水平的中位数和范围分别为37 ng/mL(1.2-43100 ng/mL), 2.7 ng/mL(0.4-50.6 ng/mL)和23.8 U/mL(范围1.5-641 U/mL). 11例患者(22%)发生了远处转移(淋巴结转移7例, 淋巴结和骨转移2例, 肺转移2例). 恶性肿瘤患者淋巴结短轴直径>1 cm认为是有肿瘤活性的[19]. 13例(26%)患者发生了门静脉癌栓, (门静脉主干癌栓7例, 门静脉分支癌栓1例, 节段性门静脉癌栓5例), 4例(8%)患者发生了胆管扩张. 6例患者进行了局部放疗, 2例患者接受了全身化疗, 2例患者既接受了局部放疗又进行了全身化疗. 2例患者和6例合并肝外转移(淋巴结或骨)的患者进行了全身放疗.
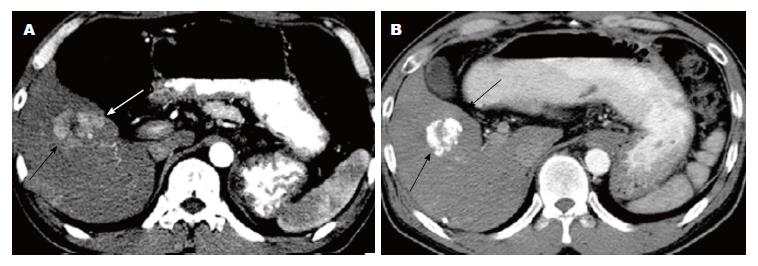
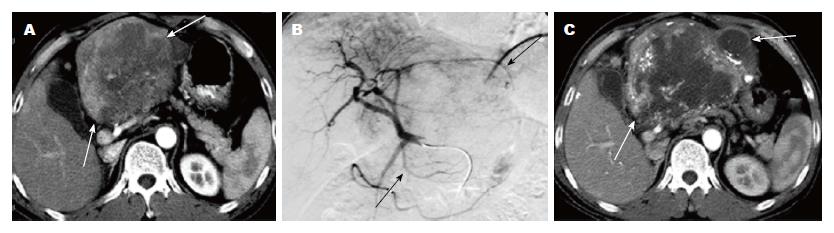
TACE治疗后, 7名患者表现为部分缓解(最大肿瘤直径减少>30%)(图1), 28例产生有效的肿瘤坏死(坏死面积>50%). 尽管经过TACE治疗, 10例患者术后病情无明显变化且肿块坏死面积低于50%, 其中5例患者肿瘤进一步增大(肿瘤最大直径增加>20%)(图2). 因此35例患者(70%)被列为有反应, 15患者(30%)被归为无反应. 肿瘤反应与肿瘤的血供显著相关: 在10例乏血供肿瘤患者中有1例(10%), 在40例富血供肿瘤患者中有34例(85%)产生肿瘤坏死反应(P<0.001).
21例(42%)患者发生了栓塞后综合征并在7 d内自动消失. 2例患者(4%)发生了TACE治疗相关的并发症. 1例患者发生了肝脓肿, 1例患者发生了急性肾功能衰竭, 发生肝脓肿的患者通过经皮肝脓肿穿刺引流和抗生素治疗后好转. 发生急性肾功能衰竭的患者最终在治疗后也肾功能也得到了恢复. 没有患者在TACE术后30 d之内死亡.
37例患者在随访期间死亡(平均10.8 mo; 范围1.4-57 mo). 中位生存期为12.3 mo(95%CI: 6.7-17.9). 1年生存率分别为52%, 2年为38%, 3年为16%, 4年为12%. 多变量Cox回归模型中单变量分析P<0.2: 肿瘤大小, 肿瘤的血供, Child-Pugh分级, 门静脉癌栓, 辅助治疗, 肝外转移, 血清CEA水平, 血清CA19-9水平. 多变量Cox回归分析证实肿瘤大小、肿瘤的血供, Child-Pugh分级和门静脉癌栓是与TACE治疗后患者生存期相关的独立因素. 肿瘤最大直径超过9 cm, 乏血供肿瘤, Child-Pugh分级B级或以上, 存在门静脉癌栓是患者的生存预后的不良因素.
从组织学的角度来说, 胆管癌可以发展成肝癌或肝脏肿瘤的原因可能是起源于可以分化成肝细胞和胆管上皮细胞的同一个干细胞[1]. 胆管癌是混合型肝癌其中的一部分可能是由部分肝癌组织的变异所产生, 混合型肝癌和肝细胞肝癌患者的临床病理诊断相似, 例如平均年龄(均为60岁), 都以男性患者居多, 在病毒性肝炎, AFP水平升高, 肝硬化等方面均为阳性[20]. 我们同样发现了类似的临床病理特点: 84%的患者乙型或丙型肝炎病毒抗体为阳性, 82%为男性, 62%的患者有AFP升高, 54%的患者已基本确诊为肝硬化. 然而混合型肝癌的显著特点是他既像肝细胞肝癌一样易形成门静脉癌栓, 又像胆管癌一样易发生淋巴结转移或包绕胆管[1]. 在目前的研究中26%的患者发生了门静脉癌栓, 18%的患者发生了淋巴结转移, 8%的患者发生了胆管扩张. 因此, 虽然混合型肝癌的临床特征与肝细胞肝癌相似, 但混合型肝癌患者的预后较差, 可能与淋巴结转移或侵犯胆管有关[6]. 目前TACE已成为治疗不可手术切除肝癌的首选[8-10]. TACE治疗相对于全身化疗的重要优势在于他增加了化疗药物在病灶的区域集中, 并通血管栓塞剥夺了癌组织的血液供应, 最大限度地杀死癌细胞, 同时保留健康的肝组织, 减少全身不良反应[21]. 富血供的肝肿瘤在TACE治疗后能产生稳定反应是因为化疗药物和栓塞材料的交叉使用在TACE治疗后能够产生更好地选择性和有效性. 然而, 在我们目前的研究中40(80%)名患者增强CT扫描动脉期显示为富血供肿块, 从而使化疗药物和栓塞材料能够选择性、交互地导致其中的34(85%)例患者在术后产生肿瘤反应. 因此, TACE能够减少不可切除混合型肝癌患者肿瘤显著病变区域的血供, 从而延迟患者病情的恶化和进展. 在所有患者中, TACE治疗的耐受性良好, 没有死亡率和低并发症发生率(4%; 1例发生肝脓肿, 1例发生急性肾功能衰竭). 在我们的研究中, 样本的数量太少应被视为一种局限性. 首先, 我们的研究有一个回顾性的设计但却没有对照组. 然而, 由于混合型肝癌的低发生率和医学伦理的原因, 进行前瞻性的随机对照试验也是很困难的; 其次, 由于研究时间过长(>10年), 在评估肿瘤血管的CT技术发生了许多改进. 然而, 我们相信我们的研究样本均充分地评估过病变血管. 由于我们研究是回顾性的, CT随访和TACE治疗之间的时间间隔并不均匀且变化很大; 最后, 我们并没有严格遵守适用于所有>1 cm病灶的实体瘤反应评价标准, 但是我们是在最大的靶病变的基础上评估肿瘤反应.
患者在TACE术后的中位生存期为12.3 mo, 比报道接受保守治疗的混合型肝癌患者6.5 mo的中位生存期[8,12]大大地延长. 在我们的多变量Cox回归分析模型显示: 肿瘤大小、肿瘤的血供、Child-Pugh分级、门静脉癌栓是与TACE治疗后患者生存期长短显著相关的预后因素. 在本研究中, 影响患者生存期的不良预后因素为肿瘤最大直径超过9 cm、乏血供的肿瘤、Child-Pugh分级为B级和合并门静脉癌栓. 我们相信TACE治疗后的混合型肝癌患者的存活率与肝细胞肝癌患者相似[22], 可能取决于肿瘤的负荷和潜在的肝脏功能. 此外, 由于肿瘤浸润门静脉造成门静脉阻塞后可能会减少正常肝组织的血液供应[23], 从而增加了肿瘤全肝广泛扩散的风险[24], 也可能是混合型肝癌患者TACE治疗后的一个减少生存时间的重要危险因素. 因为乏血供混合型肝癌患者与富血供混合型肝癌患者相比反应更差[10% vs 85%, P<0.001(Fisher精确检验)]和预后更差(中位生存期, 4 mo vs 16 mo, P<0.001)(Kaplan-Meier法, 使用Log-rank检验). 我们假定混合型肝癌的肿瘤供血情况取决于肿瘤的成分. 换句话说, 如果混合型肝癌的大部份组织为胆管癌, 他可能是乏血供的. 乏血供的混合型肝癌比富血混合型肝癌的不同可能是侵犯性更强. TACE可能无法有效地用于治疗乏血供的混合型肝癌, 因为与富血供病灶相比化疗药物或栓塞材料不能有效地并选择性地灌注并保留在病灶中. 最近使用钇90(90Y)对乏血供肝脏恶性肿瘤, 如肝内胆管细胞癌或大肠癌肝转移[25]患者进行放射栓塞的姑息治疗已显示出可喜的成果. 使用钇90放射栓塞治疗不可切除的乏血供混合型肝癌可能是一种有效的治疗选择.
总之, TACE治疗是安全, 与历史文献报告相比可有效地延长不可切除的混合型肝癌患者的生存期. 肿瘤的血供与肿瘤反应高度相关. TACE治疗混合型肝癌患者的生存益处在很大程度上取决于肿瘤大小, 肿瘤的血供, Child-Pugh分级, 是否合并门脉癌栓. 鉴于本研究的结果, 我们目前已经放弃使用TACE治疗乏血供混合型肝癌.
回顾性分析50例接受肝动脉灌注化疗栓塞术(transcatheter arterial chemoembolization, TACE)治疗不可切除混合型肝癌患者的临床资料, 分析并提炼出对患者临床疗效预及后有影响的重要因素.
王悦华, 副主任医师, 首都医科大学附属宣武医院外科
由于肝细胞肝癌又合并胆管癌的发生率低, 其人口统计学和临床特征、预后因素等仍然知之甚少. 目前仅有少数小规模的研究描述了肝癌合并胆管癌的临床特点. 混合型肝癌即使通过手术切除, 因其复发率较高, 5年生存率不到30%. 不适合手术切除的混合型肝癌患者预后更差.
Allen和Lisa在1949年首次对肝癌合并胆管癌的病例进行了报道, 但是由于肝细胞肝癌又合并胆管癌的发生率低, 其人口统计学和临床特征、预后因素等仍然知之甚少. 目前仅有少数小规模的研究描述了肝癌合并胆管癌的临床特点.
目前仅有少数小规模的研究描述了肝癌合并胆管癌的临床特点. 混合型肝癌即使通过手术切除, 因其复发率较高, 5年生存率不到30%. 目前TACE已被证明是可以延长混合型肝癌患者生存期的有效治疗手段. 本文评估混合型肝癌患者接受TACE治疗的临床疗效并分析术后影响患者生存预后的因素.
TACE治疗是安全, 与历史文献报告相比可有效地延长不可切除的混合型肝癌患者的生存期. 肿瘤的血供与肿瘤反应高度相关. TACE治疗混合型肝癌患者的生存益处在很大程度上取决于肿瘤大小, 肿瘤的血供, Child-Pugh分级, 是否合并门脉癌栓.
本文设计合理, 准确地评估分析了混合型肝癌患者接受TACE治疗的临床疗效并分析术后影响患者生存预后的因素.
编辑: 田滢 电编: 鲁亚静
| 1. | Kim KH, Lee SG, Park EH, Hwang S, Ahn CS, Moon DB, Ha TY, Song GW, Jung DH, Kim KM. Surgical treatments and prognoses of patients with combined hepatocellular carcinoma and cholangiocarcinoma. Ann Surg Oncol. 2009;16:623-629. [PubMed] [DOI] |
| 2. | Aoki K, Takayasu K, Kawano T, Muramatsu Y, Moriyama N, Wakao F, Yamamoto J, Shimada K, Takayama T, Kosuge T. Combined hepatocellular carcinoma and cholangiocarcinoma: clinical features and computed tomographic findings. Hepatology. 1993;18:1090-1095. [PubMed] [DOI] |
| 4. | Allen RA, Lisa JR. Combined liver cell and bile duct carcinoma. Am J Pathol. 1949;25:647-655. [PubMed] |
| 5. | Lin G, Toh CH, Wu RC, Ko SF, Ng SH, Chou WC, Tseng JH. Combined hepatocellular cholangiocarcinoma: prognostic factors investigated by computed tomography/magnetic resonance imaging. Int J Clin Pract. 2008;62:1199-1205. [PubMed] [DOI] |
| 6. | Jarnagin WR, Weber S, Tickoo SK, Koea JB, Obiekwe S, Fong Y, DeMatteo RP, Blumgart LH, Klimstra D. Combined hepatocellular and cholangiocarcinoma: demographic, clinical, and prognostic factors. Cancer. 2002;94:2040-2046. [PubMed] [DOI] |
| 7. | Tickoo SK, Zee SY, Obiekwe S, Xiao H, Koea J, Robiou C, Blumgart LH, Jarnagin W, Ladanyi M, Klimstra DS. Combined hepatocellular-cholangiocarcinoma: a histopathologic, immunohistochemical, and in situ hybridization study. Am J Surg Pathol. 2002;26:989-997. [PubMed] [DOI] |
| 8. | Llovet JM, Real MI, Montaña X, Planas R, Coll S, Aponte J, Ayuso C, Sala M, Muchart J, Solà R. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet. 2002;359:1734-1739. [PubMed] [DOI] |
| 10. | Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology. 2003;37:429-442. [PubMed] [DOI] |
| 11. | Kim JH, Yoon HK, Sung KB, Ko GY, Gwon DI, Shin JH, Song HY. Transcatheter arterial chemoembolization or chemoinfusion for unresectable intrahepatic cholangiocarcinoma: clinical efficacy and factors influencing outcomes. Cancer. 2008;113:1614-1622. [PubMed] [DOI] |
| 12. | Covey AM, Maluccio MA, Schubert J, BenPorat L, Brody LA, Sofocleous CT, Getrajdman GI, Fong Y, Brown KT. Particle embolization of recurrent hepatocellular carcinoma after hepatectomy. Cancer. 2006;106:2181-2189. [PubMed] [DOI] |
| 13. | Katyal S, Oliver JH, Peterson MS, Chang PJ, Baron RL, Carr BI. Prognostic significance of arterial phase CT for prediction of response to transcatheter arterial chemoembolization in unresectable hepatocellular carcinoma: a retrospective analysis. AJR Am J Roentgenol. 2000;175:1665-1672. [PubMed] [DOI] |
| 14. | Ebied OM, Federle MP, Carr BI, Pealer KM, Li W, Amesur N, Zajko A. Evaluation of responses to chemoembolization in patients with unresectable hepatocellular carcinoma. Cancer. 2003;97:1042-1050. [PubMed] [DOI] |
| 15. | Kothary N, Weintraub JL, Susman J, Rundback JH. Transarterial chemoembolization for primary hepatocellular carcinoma in patients at high risk. J Vasc Interv Radiol. 2007;18:1517-126; quiz 1527. [PubMed] [DOI] |
| 16. | Park JO, Lee SI, Song SY, Kim K, Kim WS, Jung CW, Park YS, Im YH, Kang WK, Lee MH. Measuring response in solid tumors: comparison of RECIST and WHO response criteria. Jpn J Clin Oncol. 2003;33:533-537. [PubMed] [DOI] |
| 17. | Georgiades CS, Hong K, D'Angelo M, Geschwind JF. Safety and efficacy of transarterial chemoembolization in patients with unresectable hepatocellular carcinoma and portal vein thrombosis. J Vasc Interv Radiol. 2005;16:1653-1659. [PubMed] [DOI] |
| 18. | Forner A, Ayuso C, Varela M, Rimola J, Hessheimer AJ, de Lope CR, Reig M, Bianchi L, Llovet JM, Bruix J. Evaluation of tumor response after locoregional therapies in hepatocellular carcinoma: are response evaluation criteria in solid tumors reliable? Cancer. 2009;115:616-623. [PubMed] [DOI] |
| 19. | Yoon YC, Lee KS, Shim YM, Kim BT, Kim K, Kim TS. Metastasis to regional lymph nodes in patients with esophageal squamous cell carcinoma: CT versus FDG PET for presurgical detection prospective study. Radiology. 2003;227:764-770. [PubMed] [DOI] |
| 20. | Maeda T, Adachi E, Kajiyama K, Sugimachi K, Tsuneyoshi M. Combined hepatocellular and cholangiocarcinoma: proposed criteria according to cytokeratin expression and analysis of clinicopathologic features. Hum Pathol. 1995;26:956-964. [PubMed] [DOI] |
| 21. | Liapi E, Geschwind JF. Transcatheter and ablative therapeutic approaches for solid malignancies. J Clin Oncol. 2007;25:978-986. [PubMed] [DOI] |
| 22. | Brown DB, Chapman WC, Cook RD, Kerr JR, Gould JE, Pilgram TK, Darcy MD. Chemoembolization of hepatocellular carcinoma: patient status at presentation and outcome over 15 years at a single center. AJR Am J Roentgenol. 2008;190:608-615. [PubMed] [DOI] |
| 23. | Takayasu K, Arii S, Ikai I, Omata M, Okita K, Ichida T, Matsuyama Y, Nakanuma Y, Kojiro M, Makuuchi M. Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients. Gastroenterology. 2006;131:461-469. [PubMed] [DOI] |
| 24. | Zhang XB, Wang JH, Yan ZP, Qian S, Du SS, Zeng ZC. Hepatocellular carcinoma with main portal vein tumor thrombus: treatment with 3-dimensional conformal radiotherapy after portal vein stenting and transarterial chemoembolization. Cancer. 2009;115:1245-1252. [PubMed] [DOI] |
| 25. | Jakobs TF, Hoffmann RT, Dehm K, Trumm C, Stemmler HJ, Tatsch K, La Fougere C, Murthy R, Helmberger TK, Reiser MF. Hepatic yttrium-90 radioembolization of chemotherapy-refractory colorectal cancer liver metastases. J Vasc Interv Radiol. 2008;19:1187-1195. [PubMed] [DOI] |