修回日期: 2013-06-20
接受日期: 2013-07-03
在线出版日期: 2013-08-18
目的: 建立小鼠放射性十二指肠炎模型.
方法: ♀Balb/c小鼠93只, 随机分为对照组(13只)、4.5 Gy组(13只)、6.0 Gy组(13只)、9.0 Gy组(13只)、12.0 Gy组(13只)、13.5 Gy组(13只)、15.0 Gy组(15只), 60Co射线对小鼠上腹部一次性照射, 在照射后第3.5、7天处死解剖取十二指肠组织做病理切片, 并取肠系膜淋巴结、脾和外周血血清检测细胞因子白介素-6(interleukin-6, IL-6)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α).
结果: 照射后3.5 d, 6个照射组促炎性因子IL-6、IL-1β、TNF-α均较对照组升高; 照射后3.5 d, 12.0、13.5、15.0 Gy 3个照射组小鼠十二指肠绒毛高度降低, 隐窝深度变浅、数目减少, 隐窝腔变大, 均出现放射性肠炎改变, 13.5、15.0 Gy组死亡较多, 12.0 Gy组更能模拟临床放射性十二指肠炎, 为研究提供模型.
结论: 60Co射线一次性腹部照射建立小鼠放射性十二指肠炎模型, 12 Gy照射剂量更为合适.
核心提示: 急性放射性十二指肠炎模型的建立, 采用60Co射线一次性腹部照射, 12 Gy照射剂量更为合适. 在放射性十二指肠炎模型中炎性因子白介素-6(interleukin-6, IL-6)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α)呈现高表达.
引文著录: 万芝清, 陈晓, 周平, 韩根成, 王济东, 夏廷毅. 小鼠放射性十二指肠炎模型的建立. 世界华人消化杂志 2013; 21(23): 2267-2274
Revised: June 20, 2013
Accepted: July 3, 2013
Published online: August 18, 2013
AIM: To develop a mouse model of radiation-induced duodenitis.
METHODS: Ninety-three female Balb/c mice were randomly divided into seven groups: a control group (n = 13), a 4.5 Gy group (n = 13), a 6.0 Gy group (n = 13), a 9.0 Gy group (n = 13), a 12.0 Gy group (n = 13), a 13.5 Gy group (n = 13) and a 15.0 Gy group (n = 15). Mice were sacrificed 3.5 or 7.0 d after abdominal irradiation with a single dose of Cobalt-60. Duodenal samples were taken for histopathological analysis, and blood, spleen and mesenteric lymph nodes were sampled to detect the levels of inflammatory factors interleukin-6 (IL-6), IL-1β and tumor necrosis factor-α (TNF-α).
RESULTS: The levels of inflammatory factors IL-6, IL-1β and TNF-α increased in all the irradiation groups compared to the control group. The length of villi and the number of crypt were significantly reduced in the 12.0, 13.5 and 15.0 Gy groups compared to the control group on day 3.5, which was consistent with the changes in radiation-induced enteritis. The 13.5 and 15.0 Gy groups had a high mortality, and the 12.0 Gy group was better in simulating clinical radioactive duodenitis.
CONCLUSION: A mouse model of radiation-induced duodenitis can be successfully developed by abdominal irradiation with a single dose (12.0 Gy) of 60Co.
- Citation: Wan ZQ, Chen X, Zhou P, Han GC, Wang JD, Xia TY. Development of a mouse model of radiation-induced duodenitis. Shijie Huaren Xiaohua Zazhi 2013; 21(23): 2267-2274
- URL: https://www.wjgnet.com/1009-3079/full/v21/i23/2267.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i23.2267
随着胰腺恶性肿瘤发病率日益升高, 现代放疗技术已成为胰腺癌主要治疗手段. 蔡晶、周桂霞、夏廷毅等[1-4]采用伽马刀立体定向放射治疗胰腺癌总有效率88.4%, Ⅱ-Ⅳ期1、2年总生存率分别为56.5%和23.1%, 已超过外科手术切除的效果. 胰腺癌的根治性放射治疗在考虑肿瘤自身放射生物学因素外, 应充分评估放疗可能危及周围正常组织器官及功能[5,6]. 由于与胰腺的解剖关系, 十二指肠放射性损伤不可避免. 既往放射性肠炎的研究多关注于空回肠及结直肠, 对十二指肠放射性损伤的研究报道较少. 为了便于开展十二指肠放射性损伤的研究, 本研究建立了接近临床需要的小鼠放射性十二指肠炎模型.
♀清洁级Balb/c小鼠93只, 6-8周龄, 体质量18-20 g, 由华阜康生物科技有限公司提供, 实验动物合格证许可证号: SLXK京2009-0007, 饲养于中国人民解放军军事医学科学院SPF级动物中心, 实验室条件: 温度21 ℃±2 ℃, 60%相对湿度, 自由饮水及实验室标准饲料喂养. PCR仪、实时定量PCR仪: 购自Bio-Rad公司; ELISA用酶标仪(MK3): 购自Thermo公司. Real-time PCR试剂盒: 购自TOYOBO公司(无水乙醇/异丙醇/三氯甲烷配套). 白介素-6(interleukin-6, IL-6)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)ELISA试剂盒: 购自eBioscience公司. IL-6、IL-1β、TNF-α抗体: 购自eBioscience公司(PBS洗液、1xAssy封闭液自制). mIL-1β、mIL-6、mTNF-α和mGAPDH引物购自北京天一辉远生物科技有限公司. 反转录试剂盒购自北京全式金生物技术有限公司.
1.2.1 照射条件: 军事医学科学院放射与辐射医学研究所60Co照射室给予照射. 各组小鼠照射前给予禁食水6-8 h, 于照射前30 min给予麻醉药物0.04 mL/只腹腔注射麻醉, 药物为自制麻药速眠新联合氯胺酮(速眠新:氯胺酮 = 1.5:2). 麻醉完成后将小鼠固定在自制的小鼠固定架上, 给予60Co射线小鼠上腹部一次性照射, 照射范围为从剑突至剑突下1 cm, 照射面积约为1.0 cm×2.0 cm, 照射部位距离60Co照射源4 m, 小鼠除了上腹部暴露外, 其余部位均有专门设置的挡铅设备给予屏蔽, 照射剂量率为137.31 cGy/min, 不同剂量组照射时间分别为4.5 Gy组3 min, 6 Gy组4 min 50 s, 9 Gy组6 min 16 s, 12 Gy组8 min 27 s, 13.5 Gy组9 min 32 s, 15 Gy组10 min 37 s, 照射后待小鼠苏醒送回动物中心.
1.2.2 实验动物分组及一般情况观察: 清洁级Balb/c♀小鼠93只, 6-8周龄, 体质量18-20 g, 按体质量随机分为: 0 Gy照射组(13只)、4.5 Gy照射组(13只)、6.0 Gy照射组(13只)、9 Gy照射组(13只)、12 Gy照射组(13只)、13.5 Gy照射组(13只)、15 Gy照射组(15只), 分组后放入军事医学科学院SPF级动物房内适应性喂养3 d, 白天黑夜12 h制, 温度21 ℃±2 ℃, 60%相对湿度, 自由饮水及实验室标准饲料喂养, 每日定时测量小鼠体质量, 观察小鼠精神状态、活动、进食水量. 小鼠健康状况评分按照Van Landefhem等制定的小鼠健康评分系统[7](表1). 并观察有无稀便、黏液脓血便等.
| 标准 | 分数 | |
| 活动 | 活跃 | 1 |
| 静止 | 0 | |
| 姿势 | 正常 | 1 |
| 蜷缩 | 0 | |
| 脱水 | 不脱水 | 1 |
| 脱水 | 0 | |
| 皮毛 | 光滑 | 1 |
| 粗糙 | 0 |
1.2.3 取材: 参考文献报道[8], 于照射后第3.5天眼球取血后颈椎脱臼法处死小鼠, 小鼠处死前12 h禁食, 不禁水, 腹正中垂直切口, 依次暴露胃、十二指肠、空肠、回肠, 取肠系膜淋巴结及脾置于盛有生理盐水的玻璃平皿中, 通过Real-time PCR方法检测细胞因子, 从胃幽门部向下取十二指肠1 cm, 生理盐水冲洗干净, 40 g/L甲醛固定. 摘眼球取血置于1.5 mL EP管中, 通过ELISA方法检测炎性因子的浓度.
1.2.4 小鼠一般状态观察: 照射后每天观察小鼠精神状态、活动情况、进食水量及大便、体质量情况, 用健康评分法给予评分.
1.2.5 脾和肠系膜淋巴结组织中细胞因子IL-6、IL-1β、TNF-α的表达分析: 将脾和肠系膜淋巴结, 研磨成组织匀浆, 2000 r/min, 离心5 min, 弃上清, 留底部沉淀物, TRIzol法提取细胞总RNA, 将总mRNA逆转录为cDNA, Real-time PCR, mIL-1β、mIL-6、mTNF-α和mGAPDH引物根据其引物总长进行设计, mIL-1β、mIL-6、mTNF-α和mGAPDH引物由北京天一辉远生物科技有限公司合成, 引物序列如表2. Real-time PCR扩增反应采用20 μL体系, RT-PCR扩增的条件: 第一步: 预变性95 ℃ 3 min, 反应1个循环; 第二步: 变性95 ℃ 10 s, 退火60 ℃ 15 s, 延伸72 ℃ 10 s(收集荧光), 反应50个循环; 第三步: 60 ℃ 30 s(收集溶解曲线), 反应71个循环. 扩增产物用实时定量PCR仪Bio-rad IQ5软件进行分析.
| 名称 | 序列(5'→3') | GC含量(%) | 溶解温度(℃) | 长度(bp) |
| GAPDH下游引物 | TCTTgggCTACACTgAggAC | 55 | 60 | 20 |
| GAPDH上游引物 | CATACCAggAAATgAgCTTgA | 42.8 | 60 | 21 |
| IL-6下游引物 | gATggATgCTACCAAACTggA | 45 | 60 | 21 |
| IL-6上游引物 | TCTgAAggACTCTggCTTTg | 47.6 | 60 | 20 |
| TNF-α下游引物 | CAgCCTCTTCTCATTCCTgC | 55 | 60 | 20 |
| TNF-α上游引物 | ggTCTgggCCATAgAACTgA | 55 | 60 | 20 |
| IL-1β下游引物 | TgAAgCAgCTATggCAACTg | 50 | 60 | 20 |
| IL-1β上游引物 | AggTCAAAggTTTggAAgCA | 45 | 60 | 20 |
1.2.6 外周血中细胞因子IL-6、IL-1β、TNF-α的表达变化: 取小鼠外周血于1.5 mL EP管中, 放于4 ℃离心机中8000 r/min, 离心5 min, 置于-20 ℃冰箱备用. ELISA双抗夹心法检测细胞因子IL-6、IL-1β、TNF-α浓度, 结果通过酶标仪Ascent software versiona软件进行分析.
1.2.7 十二指肠组织病理学观察: (1)病理标本肉眼观察: 肠管颜色, 有无充血、水肿和肠腔扩张; (2)十二指肠组织镜下观察: 十二指肠组织生理盐水清洗后40 g/L甲醛溶液固定, 将固定好的1 cm十二指肠乙醇脱水, 石蜡包埋, 切片, HE染色, 镜下观察病理形态学变化, 观察十二指肠绒毛高度、黏膜厚度、隐窝深度、炎性细胞浸润, 用改良的Chiu氏法[9]评价肠黏膜损伤程度, 于光镜下计算每单位长度肠壁的平均绒毛长度及肠隐深度.
统计学处理 使用SPSS13.0软件进行数据统计分析, 计量资料以mean±SD表示, 多组间比较采用单因素方差分析, 两组间比较采用t检验, 检验水准α = 0.05, P<0.05为差异有统计学意义.
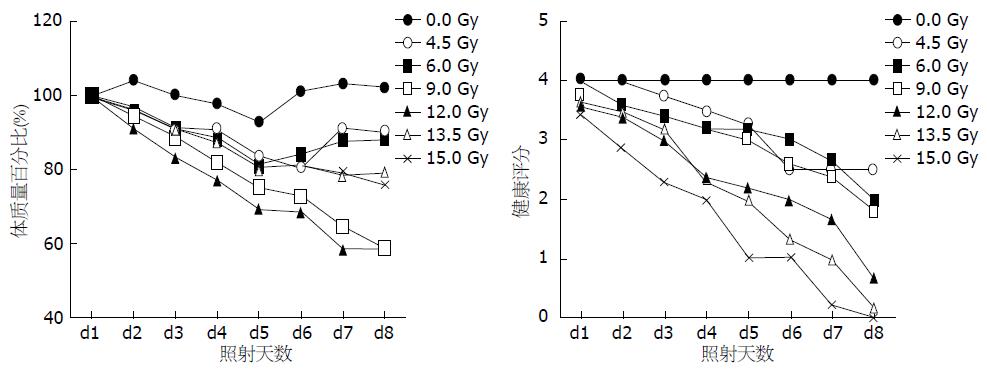
4.5、6.0、9.0 Gy照射组未见稀便, 照射后2 d出现不同程度的精神差, 食欲降低, 饮水量下降, 照射约5-7 d即可恢复正常, 12.0、13.5、15.0 Gy照射组照射后2 d出现精神极差、行动迟缓、皮毛粗糙、弓背行走及脱水现象, 均有程度不一的稀便, 偶有小鼠出现血便, 至照射后7 d仍未能好转, 其中13.5、15.0 Gy照射组出现小鼠死亡, 13.5 Gy组至第3.5天处死前, 共死亡4只, 总死亡率为30.1%, 15.0 Gy照射组至第3.5 d处死前, 共死亡6只, 总死亡率为40%. 各组小鼠体质量均有下降(图1), 4.5、6.0 Gy组在照射后5 d出现体质量回升, 余组持续下降, 以12.0、15.0 Gy组下降最为显著. 各组健康评分随照射后时间延长均有不同程度下降, 以12.0、13.5、15.0 Gy照射组最为明显, 三者与9.0 Gy组之间的差异有统计学意义(P<0.05), 但彼此之间的差异无统计学意义(P>0.05).
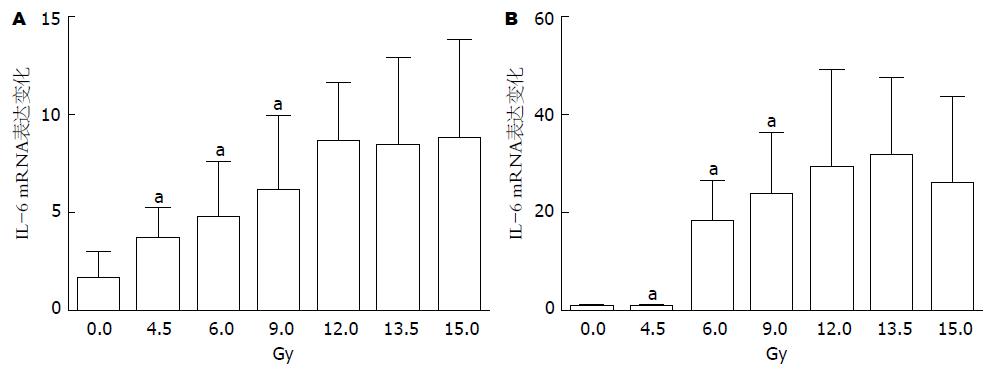
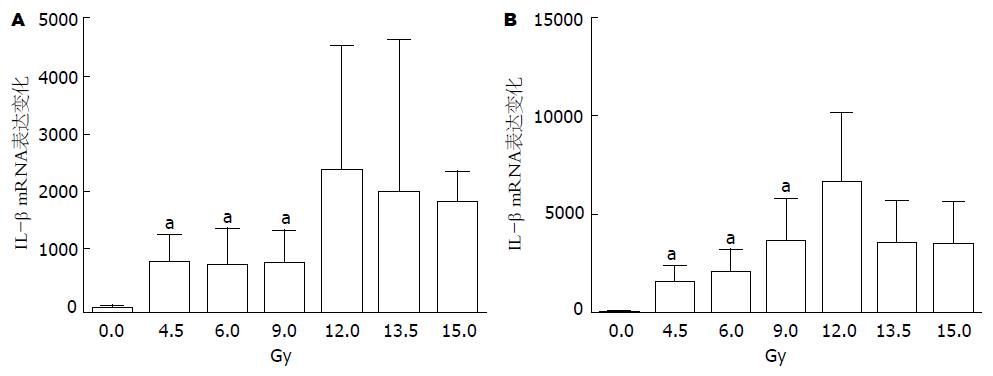
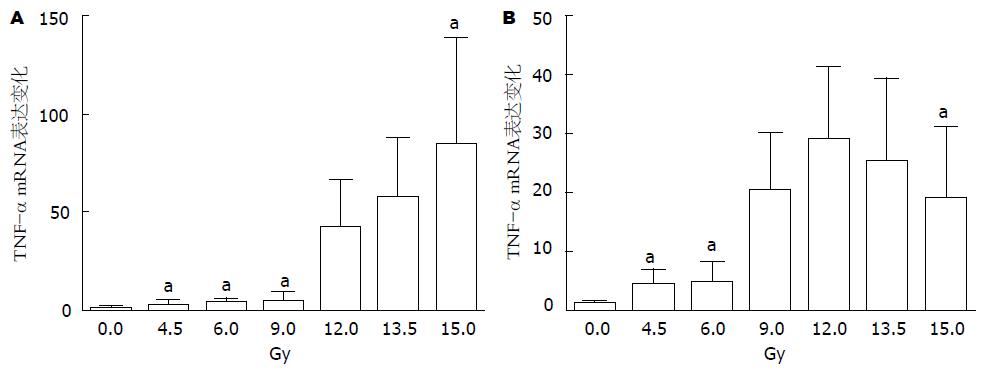
为了进一步证明IL-6、IL-1β、TNF-α与放射性肠损伤的关系, 我们检测了不同受照剂量下小鼠脾及淋巴结组织中IL-6、IL-1β、TNF-α的表达变化. 结果表明不同剂量组小鼠脾、肠系膜淋巴结组织中IL-6、IL-1β、TNF-α与空白对照组比较表达均有上升, 而且随着剂量的提升, 表达升高的趋势更为明显, 以12 Gy剂量组表达上升最为显著, 13.5、15 Gy剂量组升高趋势不如12 Gy剂量组明显, 如图2、图3、图4所示, 以上结果表明在放射性肠损伤中炎性因子IL-6、IL-1β、TNF-α表达上调, 参与炎症反应, 与既往研究基本一致.
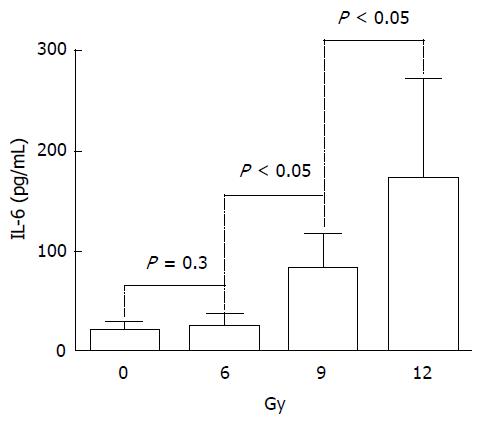
由于13.5、15.0 Gy组死亡率较高, 分别为30.1%(4/13)、40.0%(6/15), 所以我们仅通过ELISA双抗夹心法分别测定其余各剂量组及空白对照组血清中IL-6、IL-1β、TNF-α的浓度. 图5显示了不同剂量放射性十二指肠损伤诱导机体分泌IL-6升高, 组间产生差异, IL-1β、TNF-α结果与之相似, 在此未全给予图示. 其中9.0 Gy、12.0 Gy照射组与空白对照差异有统计学意义(P<0.05), 6.0 Gy组与之仅有升高趋势, 差异无统计学意义(P = 0.30).
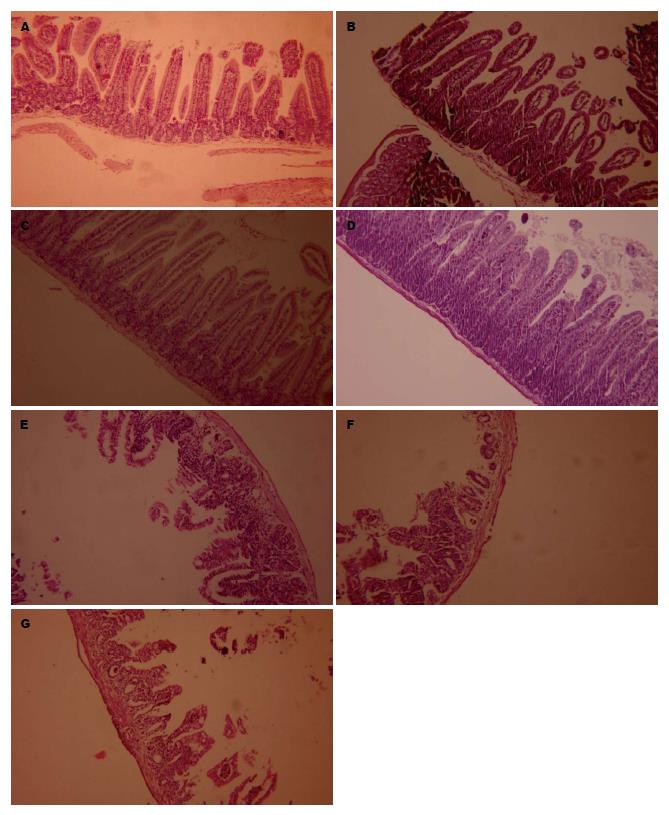
2.4.1 肉眼观察: 正常对照组小鼠肠管呈粉红色, 无充血、水肿、肠腔扩张. 4.5、6.0、9.0 Gy照射剂量组小鼠肠管呈粉红色, 可见轻度水肿, 无充血、肠腔扩张. 12.0、13.5、15.0 Gy剂量组肠管呈暗红色, 肠腔扩张、充血, 解剖时发现其肠壁脆性增高, 轻微碰触即可引起肠壁破裂, 有不同程度的肠壁变薄、黏膜出血.
2.4.2 镜下观察: 正常对照组肠绒毛长而整齐, 结构完整, 中央乳糜管清晰可见, 腺体结构正常. 4.5、6.0、9.0 Gy组肠绒毛结构尚完整, 绒毛轻度水肿, 中央乳糜管可见, 腺体结构基本正常, 炎性细胞少量浸润; 12.0、13.5 Gy组肠绒毛变短、稀疏, 上皮不完整, 腺体裸露, 形成糜烂, 隐窝腔缩小, 大量炎性细胞浸润; 15.0 Gy组肠绒毛几乎全部脱落, 只剩少量点状突起, 上皮不完整, 中央乳糜管结构不清, 腺体及黏膜下层裸露, 固有层隐窝减少, 隐窝腔变大, 固有层结缔组织大量炎细胞浸润. 12.0、13.5、15.0 Gy剂量组的病理表现均满足Guzman-Stein等[10]制定的放射性肠炎模型标准. 各剂量组病理组织图片如图6所示.
2.4.3 图像分析: 根据各剂量组十二指肠病理损伤变现和各组小鼠死亡率, 我们选取正常对照组、12 Gy剂量组和15 Gy剂量组, 测量其小鼠十二指肠平均绒毛高度和隐窝深度检测结果(表3): 12 Gy剂量组和15Gy剂量组十二指肠绒毛高度和隐窝深度均明显低于正常对照组, 差异有统计学意义(P<0.05). 12 Gy剂量组十二指肠绒毛高度较15 Gy剂量组高, 差异有统计学意义(P<0.05); 12 Gy剂量组十二指肠隐窝深度较15 Gy剂量组高, 差异无统计学意义(P = 0.80).
放射性十二指肠炎的发病机制复杂[11-14], 目前尚未完全清楚. 其病理生理学表现为: 放射线损伤肠道上皮细胞和血管内皮细胞, 使小肠绒毛变短, 肠黏膜变薄, 毛细血管扩张、水肿, 炎性细胞浸润, 形成肠黏膜的糜烂、溃疡, 肠壁增厚和肠腔狭窄, 使患者出现腹泻、腹痛、血便、脓血便或者肠梗阻等临床症状, 严重降低患者的生活质量, 目前治疗十分困难, 因此很有必要建立动物模型行进一步研究.
目前, 放射性肠炎模型的建立多见, 研究较多是空回肠及结直肠, 对十二指肠放射性损伤研究较少. 放射性肠炎模型, 造模时多采用大鼠腹部照射[15-18], 小鼠全身照射[19-22]. 腹部局部照射建立放射性十二指肠炎的模型, 文献未见报道. 本实验用小鼠上腹部局部照射造模, 能更好地模拟临床放射性十二指肠炎的形成过程.
文献报道, 小鼠全身造模的照射剂量最小为4 Gy[19], 最大为12 Gy[20], 小鼠全身接受12、15、16 Gy照射可以发生轻型肠型放射性损伤[23], 小鼠腹部造模的最大剂量为10 Gy[24]. 本实验分别取4.5、6.0、9.0、12.0、13.5、15.0 Gy较密梯度的剂量造模, 以确定用小鼠腹部局部照射建立放射性十二指肠炎的最佳剂量.
本实验研究结果显示, 各剂量照射组小鼠照射后均出现体质量下降, 健康评分降低, 4.5、6.0、9.0 Gy剂量组小鼠十二指肠大体观察和镜下组织形态学观察较正常对照组无明显变化. 12.0、13.5、15.0 Gy剂量组小鼠出现稀便、血便, 十二指肠大体观察见肠管呈暗红色, 肠腔扩张、充血; 镜下组织形态学观察见肠绒毛变短、稀疏, 上皮不完整, 中央乳糜管结构不清, 腺体裸露, 形成糜烂, 隐窝腔缩小, 大量炎性细胞浸润, 符合放射性肠炎的病理变化, 故用12.0、13.5、15.0 Gy剂量对小鼠腹部局部照射, 均能出现放射性十二指肠炎. 15 Gy剂量组十二指肠大体变现和镜下病理变化较12 Gy更明显, 更严重. 13.5 Gy剂量组和12.0 Gy剂量组十二指肠大体表现和镜下病理变化相似, 但13.5、15.0 Gy剂量组小鼠死亡率高, 很难用于进一步的实验研究.
既往文献报道, 细胞因子IL-6、IL-1β、TNF-α与放射性肠炎的发生、发展关系密切. IL-6、IL-1β、TNF-α均为促炎性因子[25-27], 由单核细胞和巨噬细胞产生, 在放射性肠炎中, 观察到放射治疗后6 h其开始高表达, 高转录水平一直要持续3 d. IL-6、IL-1β、TNF-α均为急性炎性因子在辐射损伤后短时间内较为活跃, 其中IL-1β、TNF-α更为显著, 而且IL-1β、TNF-α有可能与辐射损伤介导内毒素的释放有关[28]; IL-lβ的大量产生可以引起对中性粒细胞的趋化作用, 加重肠黏膜屏障的炎性损伤和组织破坏, 且促进肠黏膜细胞凋亡的过度发生, 影响肠上皮层的及时修复[29]. 另外大量产生的IL-lβ, 能够引发细胞内信号级联反应, 激活核因子-κB, 上调促炎症细胞因子的转录活性, 并提高其mRNA的稳定性, 从而引发炎症反应[30]. 而且研究发现, 当肠道发生炎症时, IL-lβ较其他炎症因子变化明显[31]. 细胞因子TNF-α可增强其他炎性细胞因子[26]. IL-6在各系统的炎症性疾病中都有其参与[32]. 另有研究表明, 减少促炎性细胞因子(IL-6、IL-1β、TNF-α)对局部组织的刺激, 可显著降低慢性炎症的风险[33]. 本实验结果显示, 各剂量组照射后, 细胞因子IL-6、IL-1β、TNF-α均有明显升高, 与既往研究报道结果一致, 促进十二指肠的炎症发生, 加重十二指肠的放射性损伤.
总之, 本实验结果表明4.5、6.0、9.0 Gy照射损伤较轻, 无法很好模拟放射性肠损伤临床症状, 12.0、13.5、15.0 Gy照射组体质量下降、健康评分下降、稀便、食水量减少等情况与临床较为吻合, 细胞因子IL-6、IL-1β、TNF-α的高表达及病理学改变与临床放射性十二指肠炎相似, 但13.5、15.0 Gy组小鼠存活差, 死亡率高, 且炎性因子升高与12.0 Gy组相比并无优势, 不能为实验研究提供模型. 选择12.0 Gy剂量组造模, 既出现放射性十二指肠炎, 且小鼠死亡率不高和临床相似, 符合模型成功的要求, 能够为下一步实验研究提供较好的动物模型.
胰腺癌发病率呈上升趋势, 放疗成为重要的治疗手段, 由于胰腺位置毗邻十二指肠, 使得胰腺癌放疗过程中十二指肠放射性的损伤不可避免.
刘杰民, 副主任医师, 贵州省人民医院消化内镜科
目前关于放射性损伤的具体机制的研究成为热点, 找到统一有效的防护药物成为亟待解决的问题.
目前关于放射性肠炎的模型建立, 发病机制和药物治疗研究较多.
本研究关注的十二指肠的放射性损伤, 和既往放射性肠炎多关注结直肠、空回肠不同.
本文通过建立急性放射性十二指肠炎小鼠模型的建立, 能够更好的研究放射性肠炎的发病机制, 并能够为以后药物研究提供稳定的模型基础.
本文建立接近临床需要的小鼠放射性十二指肠炎模型, 能够为下一步实验研究提供较好的动物模型, 具有重要价值.
编辑: 田滢 电编: 鲁亚静
| 6. | 殷 蔚伯, 谷 铣之. 肿瘤放射治疗学. 第3版. 北京: 中国协和医科大学出版社 2002; 776-781. |
| 7. | Van Landeghem L, Blue RE, Dehmer JJ, Henning SJ, Helmrath MA, Lund PK. Localized intestinal radiation and liquid diet enhance survival and permit evaluation of long-term intestinal responses to high dose radiation in mice. PLoS One. 2012;7:e51310. [PubMed] [DOI] |
| 8. | Carr KE, Hume SP, Nelson AC, O'Shea O, Hazzard RA, McCullough JS. Morphological profiles of neutron and X-irradiated small intestine. J Radiat Res. 1996;37:38-48. [PubMed] [DOI] |
| 9. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] [DOI] |
| 10. | Guzman-Stein G, Bonsack M, Liberty J, Delaney JP. Abdominal radiation causes bacterial translocation. J Surg Res. 1989;46:104-107. [PubMed] |
| 11. | Leadon SA. Repair of DNA Damage Produced by Ionizing Radiation: A Minireview. Semin Radiat Oncol. 1996;6:295-305. [PubMed] |
| 13. | Gremy O, Benderitter M, Linard C. Acute and persisting Th2-like immune response after fractionated colorectal gamma-irradiation. World J Gastroenterol. 2008;14:7075-7085. [PubMed] [DOI] |
| 14. | Crawford PA, Gordon JI. Microbial regulation of intestinal radiosensitivity. Proc Natl Acad Sci USA. 2005;102:13254-13259. [PubMed] [DOI] |
| 15. | 赵 元珍, 高 春芳. 谷氨酰胺全肠外营养对急性放射性肠炎大鼠消化道营养作用的研究. 中华放射医学与防护杂志. 2004;24:428-430. |
| 17. | Abbasoğlu SD, Erbil Y, Eren T, Giriş M, Barbaros U, Yücel R, Olgaç V, Uysal M, Toker G. The effect of heme oxygenase-1 induction by octreotide on radiation enteritis. Peptides. 2006;27:1570-1576. [PubMed] |
| 18. | Raguso CA, Leverve X, Pichard C. Protective effects of recombinant growth hormone on intestinal mucosa in rats receiving abdominal radiotherapy. Clin Nutr. 2002;21:487-490. [PubMed] |
| 20. | Kawashima R, Kawamura YI, Kato R, Mizutani N, Toyama-Sorimachi N, Dohi T. IL-13 receptor alpha2 promotes epithelial cell regeneration from radiation-induced small intestinal injury in mice. Gastroenterology. 2006;131:130-141. [PubMed] |
| 21. | Brook I, Tom SP, Ledney GD. Quinolone and glycopeptide therapy for infection in mouse following exposure to mixed-field neutron-gamma-photon radiation. Int J Radiat Biol. 1993;64:771-777. [PubMed] [DOI] |
| 22. | Williams JP, Brown SL, Georges GE, Hauer-Jensen M, Hill RP, Huser AK, Kirsch DG, Macvittie TJ, Mason KA, Medhora MM. Animal models for medical countermeasures to radiation exposure. Radiat Res. 2010;173:557-578. [PubMed] |
| 24. | Mollà M, Gironella M, Salas A, Closa D, Biete A, Gimeno M, Coronel P, Piqué JM, Panés J. Protective effect of superoxide dismutase in radiation-induced intestinal inflammation. Int J Radiat Oncol Biol Phys. 2005;61:1159-1166. [PubMed] [DOI] |
| 25. | 张 青, 徐 剑铖, 毛 宝龄, 钱 桂生, 陈 正堂, 李 琦. 内毒素致伤大鼠肺组织 TNF-a, IL-6的mRNA表达及NF-IL6 活化研究. 中国危重病急救医学. 2001;13:523-526. |
| 26. | Ishii S, Shimizu T. Platelet-activating factor (PAF) receptor and genetically engineered PAF receptor mutant mice. Prog Lipid Res. 2000;39:41-82. [PubMed] |
| 27. | Indaram AV, Visvalingam V, Locke M, Bank S. Mucosal cytokine production in radiation-induced proctosigmoiditis compared with inflammatory bowel disease. Am J Gastroenterol. 2000;95:1221-1225. [PubMed] |
| 28. | Kim K, McBride WH. Modifying radiation damage. Curr Drug Targets. 2010;11:1352-1365. [PubMed] |
| 29. | 吴 焕淦, 刘 慧荣, 施 茵, 杨 文英, 李 双, 张 琳珊, 华 雪桂. 隔药灸对溃疡性结肠炎大鼠结肠IL-1β, IGF-1表达影响的研究. 江西中医学院学报. 2004;16:56-60. |
| 33. | Toward R, Montandon S, Walton G, Gibson GR. Effect of prebiotics on the human gut microbiota of elderly persons. Gut Microbes. 2012;3:57-60. [PubMed] |