修回日期: 2013-06-24
接受日期: 2013-07-03
在线出版日期: 2013-08-08
目的: 观察克罗恩病(Crohn's disease, CD)患者应用英夫利昔单抗(类克)联合肠内营养(enteral nutrition, EN)为主的治疗方案的疗效.
方法: 选择12例中重度传统治疗无效的CD患者, 以类克5 mg/(kg•次)的剂量静脉输注6次, 同时加用EN治疗2 mo, 服用硫唑嘌呤作为维持治疗.
结果: (1)治疗后, 患者的体质量、体质量指数、血红蛋白及血清白蛋白均较治疗前显著提高(P<0.05); (2)治疗后, 患者的CD活动指数、血沉、C反应蛋白较前明显下降(P<0.05); 12例患者均治疗有效, 且其中10例患者达到临床缓解, 7例患者达到黏膜愈合; (3)随访2-30 mo, 1例患者发生恶性淋巴瘤, 1例患者自行停服硫唑嘌呤后复发, 其余10例患者无复发.
结论: 对于中重度CD, 采取类克、联合EN诱导缓解, 后期予硫唑嘌呤维持治疗, 可能更多地达到临床有效和/或黏膜愈合, 改善CD患者的预后.
核心提示: 本研究对于12例中重度难治性克罗恩病(Crohn's disease, CD)患者, 应用英夫利昔单抗联合肠内营养进行治疗, 并应用硫唑嘌呤作为维持治疗, 分析了患者营养状况、症状、CD活动指数、内镜表现、并发症、复发情况等的详细资料, 提示该治疗方法可能更多地达到临床有效和/或黏膜愈合, 改善CD患者的预后, 在CD治疗中具有较好的临床优势.
引文著录: 吴高珏, 龚镭, 胥明, 朱颖炜. 英夫利昔单抗联合肠内营养在治疗中重度克罗恩病中的临床优势. 世界华人消化杂志 2013; 21(22): 2221-2227
Revised: June 24, 2013
Accepted: July 3, 2013
Published online: August 8, 2013
AIM: To investigate the clinical efficacy of infliximab combined with enteral nutrition (EN) in the management of moderate to severe Crohn's disease (CD).
METHODS: Twelve patients with moderate to severe CD which showed no response to traditional treatment were treated with infliximab 6 times, EN for 2 mo and azathioprine for maintenance therapy.
RESULTS: After the treatment, the body weight, body mass index (BMI), hemoglobin and albumin were significantly improved in CD patients (all P < 0.05), and the Crohn's disease activity index (CDAI), erythrocyte sedimentation (ESR) and C-reaction protein (CRP) were significantly lower than pre-treatment values (all P < 0.05). All of the 12 patients showed clinical response to the treatment, of whom two achieved clinical remission and seven achieved mucosal healing. After 2 to 30 mo of follow-up, 1 patient developed lymphadenoma, and one patient developed recurrence after stopping taking azathioprine for 2 mo. The rest patients showed no recidivation until now.
CONCLUSION: Infliximab combined with EN, together with maintenance therapy with azathioprine, is effective in the management of moderate to severe CD in terms of improving clinical efficacy, mucosal healing and prognosis.
- Citation: Wu GJ, Gong L, Xu M, Zhu YW. Infliximab combined with enteral nutrition for management of moderate to severe Crohn's disease. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2221-2227
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2221.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2221
近年来, 我国克罗恩病(Crohn's disease, CD)的发病率呈逐年上升趋势, 该疾病临床表现多样化, 包括腹泻、腹痛、血便等消化系表现, 体质量减轻、发热、贫血等全身性表现, 瘘管、肠腔狭窄及梗阻、肛周病变等并发症, 病程迁延, 易反复发作. 该疾病的药物治疗以诱导缓解和维持缓解, 防治并发症, 改善生存质量为目的. 常用的药物有氨基水杨酸类、糖皮质激素及免疫抑制剂等. 但近年来, 激素依赖及激素抵抗的CD病例日益增多[1], 部分中重度CD患者对硫唑嘌呤等免疫抑制剂治疗无效或复发率高, 传统治疗对于许多难治性CD的疗效均不理想.
目前的研究提示, 许多细胞因子, 尤其是肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)以旁分泌或自分泌的方式在CD患者中发挥作用, 增强、放大炎症连锁反应, 最终导致一系列组织损伤和坏死. 英夫利昔单抗(inflxinab, 商品名类克, Remicade)是一种人-鼠嵌合型单克隆抗TNF-α抗体, 可有效地促进产TNF-α的炎症细胞凋亡, 从而抑制炎症反应[2]. 近年来, 英夫利昔单抗在中重度、传统治疗无效或有瘘管等并发症的CD患者治疗中的应用得到重视[3]. 同时, 许多中重度CD患者存在体质量下降、贫血、低蛋白血症等营养不良的表现, 肠内营养(enteral nutrition, EN)支持治疗可改善CD患者营养状态、促进病情缓解、改善生活质量. 本文观察了12例中重度传统治疗无效的CD患者应用英夫利昔单抗联合肠内营养为主的治疗方案的疗效.
1 材料与方法
以2010-12/2012-08在南京医科大学附属无锡第二医院消化内科住院治疗的传统治疗(美沙拉嗪、糖皮质激素、硫唑嘌呤)无效的12例中重度CD患者为研究对象.
1.2.1 传统治无效的CD患者的诊断: 所有患者依据2007年我国炎症性肠病诊断治疗规范的共识意见[4], 具有典型的临床表现、结肠镜检查及黏膜组织学检查结果, 部分患者有手术病理结果. 病情严重程度评价根据患者的CD活动指数(Crohn's disease activity index, CDAI)指数, 220-450为中度、>450为重度. 该12例患者均予美沙拉嗪1.0 qid+泼尼松(起始剂量0.75 mg/(kg•d), 症状缓解后逐渐减量)+硫唑嘌呤1.0-1.5mg/(kg•d)治疗3 mo以上(其中有2例患者分别由于合并慢性再生障碍性贫血及白细胞减少未使用硫唑嘌呤, 仅应用美沙拉嗪+泼尼松治疗2 mo), 治疗后患者CDAI下降<100, 或出现激素依赖或抵抗, 或复查肠镜无明显好转.
1.2.2 给药剂量及途径: 传统治疗治疗无效的患者按照每周减5 mg泼尼松的剂量逐渐减量并停用激素, 停用美沙拉嗪, 继续服用硫唑嘌呤1 mg/(kg•d)(合并慢性再生障碍性贫血及白细胞减少的2例患者除外), 并改用类克治疗. 类克以5 mg/(kg•次)的剂量静脉输注, 于0、2、6 wk作为诱导期治疗, 其后每8 wk给药一次巩固治疗×3次. 同时, 从第一次应用类克治疗起加用EN治疗, 其中3例置入螺旋式鼻肠管, 予百普力(荷兰Nutricia公司)1000 kcal/d(1000 mL/d) 夜间鼻饲×2 mo, 另9例患者口服百普素(荷兰Nutricia公司)1005 kcal/d(250 g/d)×2 mo; 本研究中所有应用类克和硫唑嘌呤治疗均签署知情同意书.
1.2.3 疗效观察: 患者于治疗前及每次类克治疗后都予以临床症状的评价, 并比较体质量、体质量指数(body mass index, BMI)、血红蛋白(hemoglobin, Hb)、白蛋白(albumin, ALB)、血沉(erythrocyte sedimentation, ESR)及C反应蛋白(C reaction protein, CRP)的变化, 同时计算CD活动指数(Crohn's disease activity index, CDAI), 并至少在治疗前及第3、4、6次类克治疗后内镜检查观察黏膜愈合情况. 以CDAI作为疗效评价标准, CDAI<150分为临床缓解, CDAI下降≥100分作为治疗有效, 治疗后内镜下溃疡消失为黏膜愈合; 经药物治疗进入缓解期后, CD相关临床症状再次出现, 并有实验室炎症指标、内镜检查及影像学检查的疾病活动证据, 且CDAI>150分且较前升高100分则为复发.
统计学处理 采用SPSS17.0软件进行分析, 应用配对t检验比较治疗前后患者体质量、BMI、Hb、ALB、ESR、CRP及CDAI的变化. P<0.05为差异有统计学意义.
本研究中的12例CD患者, 男5例, 女7例, 平均年龄40.5岁±13.02岁(20-62岁), 平均病程25.08 mo ± 35.60 mo(2-124 mo). 症状表现有腹痛的10例, 腹泻的7例, 血便的2例, 胸骨后疼痛的1例(该例病变部位为食道). 病情严重程度评价根据CDAI指数, 中度9例, 重度3例. 病变范围为结肠型的2例, 回肠型的3例, 回结肠型的5例, 食道的1例, 累及十二指肠、回肠、结肠的1例. 接受本方案治疗前, 由于克罗恩病导致肠梗阻或穿孔接受过手术的患者3例, 合并腹壁肠瘘的1例, 腹壁窦道的1例(该患者肠穿孔行手术后腹壁手术瘢痕处反复由于线结反应形成多发的窦道), 合并肠外表现的合并关节炎或关节痛2例, 口腔溃疡2例.
2.2.1 治疗前后患者营养情况评价: 治疗前12例患者中, BMI<18.5 kg/m2的患者7例, BMI在18.5-21.0 kg/m2的患者5例, 合并贫血的患者7例, 低蛋白血症的患者5例. EN治疗结束后及类克治疗结束后, 患者的体质量、BMI、Hb及ALB均较治疗前显著提高(P<0.05). 其中EN治疗结束后, 有3例患者BMI<18.5 kg/m2, 4例患者贫血, 2例患者低蛋白血症; 类克治疗结束后, 仅有2例患者BMI<18.5 kg/m2, 3例患者贫血, 所有患者均无低蛋白血症; EN治疗结束后与类克治疗结束后相比, 患者的体质量、BMI无显著差异(P>0.05), 而Hb及ALB在类克治疗结束后较EN治疗结束后显著升高(P<0.05, 表1).
| 体质量(kg) | BMI(kg/m2) | Hb(g/L) | ALB(g/L) | |
| 治疗前 | 52.04±7.64 | 18.44±1.98 | 105.42±20.62 | 35.70±5.90 |
| EN治疗结束后 | 56.00±8.27a | 19.83±2.06a | 119.00±15.97a | 40.05±4.86a |
| 类克治疗结束后 | 58.00±6.51a | 20.55±1.25a | 128.17±15.75ac | 42.67±4.08ac |
2.2.2 治疗前后临床及内镜评价: 本组12例患者, 在3次类克治疗后, CDAI较治疗前显著下降(144.75±77.29 vs 343.33±83.18, t = -12.49, P<0.05). 12例患者中, 11例患者治疗有效, 且其中6例患者达到临床缓解; 6次类克治疗后, CDAI较3次类克治疗后进一步显著下降(92.33±47.08 vs 144.75±77.29, t = -3.88, P<0.05), 12例患者均治疗有效, 且其中10例患者达到临床缓解.
经3次类克治疗后, ESR较治疗前显著下降(15.92±10.66 vs 49.00±29.74, t = -4.72, P<0.05), 经6次类克治疗后, ESR较3次类克治疗后进一步显著下降(10.08±4.17 vs 15.92±10.66, t = -2.54, P<0.05).
经3次类克治疗后, CRP较治疗前显著下降(6.43±3.98 vs 34.18±2949, t = -3.13, P<0.05), 经6次类克治疗后, ESR较3次类克治疗后无显著差异(6.06±2.86 vs 6.43±3.98, t = -0.45, P>0.05).
3次类克治疗后, 2例患者症状完全缓解, 10例患者症状部分缓解. 6次类克治疗后, 3例患者症状完全缓解, 9例患者症状部分缓解; 其中1例合并腹壁肠瘘的患者在3次类克治疗后瘘管明显缩小, 6次类克治疗后瘘管进一步缩小(治疗前腹壁瘘口50 mm×39 mm, 3次类克治疗后瘘口23 mm×12 mm, 6次类克治疗后瘘口20 mm×10 mm); 另1例合并腹壁窦道的患者在3次类克治疗后窦道明显变浅、部分愈合, 6次类克治疗后窦道完全愈合; 2例合并关节炎及2例口腔溃疡的患者在3次类克治疗后关节疼痛、活动受限、口腔反复溃疡的症状缓解, 6次类克治疗后上述症状进一步缓解.
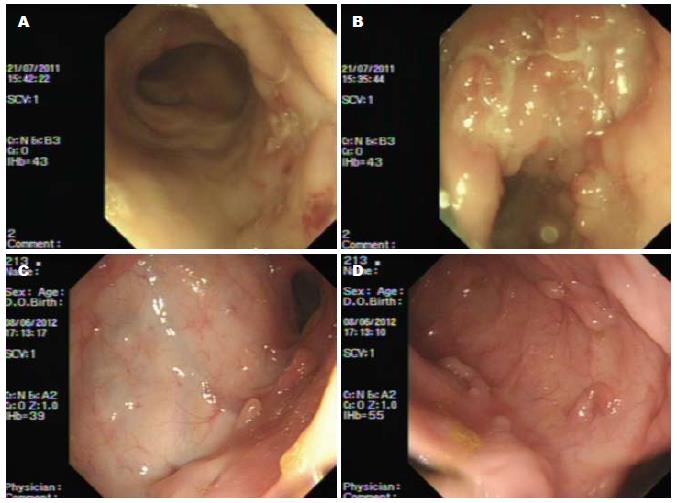
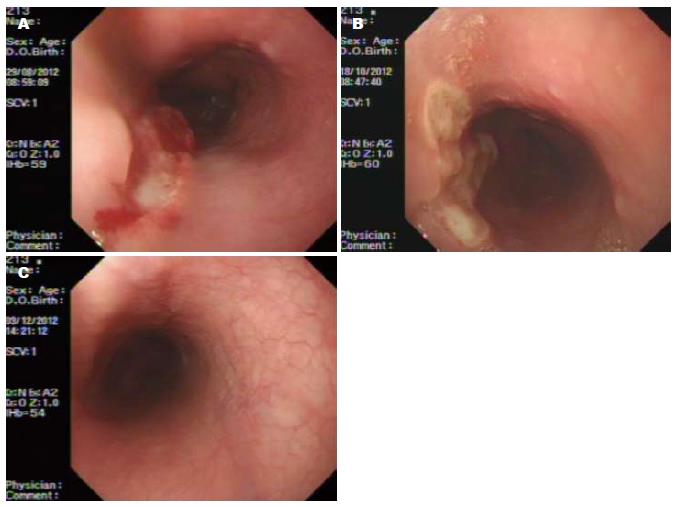
3次类克治疗后, 2例患者达到黏膜愈合; 6次类克治疗后, 7例患者达到黏膜愈合(图1). 尤其是其中1例病变部位在食道的CD患者, 在类克治疗前, 予埃索美拉唑+美沙拉嗪+糖皮质激素治疗2 mo(该患者白细胞计数低, 未予硫唑嘌呤治疗), 食道溃疡虽略有变浅, 病理见周边肉芽组织生成, 但溃疡大小无明显变化, 吞咽后胸骨后疼痛加剧, 遂接受类克治疗, 激素减量后逐渐撤除, 在第3次类克治疗前复查胃镜, 已达黏膜愈合(图2).
12例患者在本次治疗结束后, 继续服用硫唑嘌呤1.0-1.5 mg/(kg•d)(合并慢性再生障碍性贫血及白细胞减少的2例患者除外)至少2-4年后停药, 随访至今(2-30 mo). 其中1例患者在本次治疗结束后约6 mo(仍在继续服用硫唑嘌呤)再次出现腹痛症状、出现明显消瘦, 血沉、CRP明显升高, 腹部平片提示肠梗阻, 腹部B超及CT均提示腹腔多发淋巴结肿大, 予禁食、补液支持等治疗后腹痛缓解; 随访1 mo后腹痛又复加剧, 出现回肠穿孔, 予急诊手术治疗. 术中见距回盲部40 cm处回肠穿孔, 近端肠腔扩张, 远端肠腔水肿; 切除病变肠管见肠腔内一溃疡, 大小6 cm×4 cm×3 cm, 溃疡周边隆起, 少量黏膜成鹅卵石样改变, 切面灰白色, 溃疡中央见一穿孔3 cm×1 cm; 病理示肠壁全层炎细胞浸润, 溃疡中央大片肿瘤性坏死, 边缘区见肿瘤细胞呈圆形和多角形, 体积中等, 部分呈免疫母细胞样大细胞, 核扭曲、畸形; 瘤细胞免疫酶标: LCA(+), CD56(-), CD57(-), CD30(间质+), CD20(-), CD79a(-), CD3(+), CD45RO(+), CD43(-), CD5(+), Bcl-6(少数散在+), MUM-1(+), Ki67(+, >70%), PAX-5(-), EMA(-), 病理诊断为(回肠)恶性淋巴瘤, T细胞性, 非特殊型, 浸润肠壁全层; 术中切除2枚淋巴结未见转移; 该患者术后予ECHOP方案化疗, 目前仍在化疗中. 另一例患者在治疗结束后约4 mo后, 自行停服硫唑嘌呤, 在治疗结束后约6 mo, 腹痛加重, 瘘管较前扩大, 肠镜见右半结肠裂隙样溃疡, 诊断为CD复发, 患者考虑经济原因, 拒绝再次应用类克, 予环磷酰胺治疗5次后治疗有效, 但未达临床缓解, 但瘘管较前无明显缩小, 结肠裂隙样溃疡较前变浅. 其余10例患者随访至今尚未见复发.
CD的发病机制并不十分明确, 近年来的研究表明, 以细胞中介免疫反应为主的免疫应答异常在CD的发病中起重要作用. 硫唑嘌呤是一种非特异的免疫抑制剂, 可抑制DNA、RNA及蛋白质合成, 从而抑制基因复制和T细胞活化, 近年来成为了治疗CD的一线用药. 然而, 在临床CD的治疗中, 传统的应用硫唑嘌呤或联合应用糖皮质激素、美沙拉嗪, 仍有许多难治性CD病例无法得到缓解, 或反复发作, 手术及死亡率高.
英夫利昔单抗是一种合成的嵌合体单克隆抗TNF-α抗体, 可与单核巨噬细胞和活化的T细胞膜结合型TNF-α结合或与血浆中游离的TNF-α结合, 并将其中和, 可阻断免疫级联链的多个环节, 对CD有诱导缓解, 促进瘘管闭合等治疗作用. 类克是最早被美国FDA批准治疗瘘管型CD及常规治疗无效的中重度活动期CD的英夫利昔单抗, 2002年FDA将其适应证扩大至作为缓解期CD的维持治疗. 但由于类克价格昂贵, 作为维持治疗, 经济负担过重, 故本研究应用于传统治疗无效的中重度CD, 并用硫唑嘌呤作为维持治疗. 临床研究认为硫唑嘌呤在服用3 mo以上才可完全发挥作用, 从而早期使用英夫利昔单抗可更好地诱导缓解, 并降低激素用量, 减少其不良反应, 也降低了肠梗阻等并发症发生率. 本研究中12例患者中, 在治疗结束后, 58.3%(7例/12例)达到黏膜愈合; 其中有5例患者病程≤1年, 其治疗结束后, 其中4例患者达到黏膜愈合; 除1例由于出现T细胞性恶性淋巴瘤并发肠穿孔接受手术外, 无一例出现需要手术的并发症. 且对于肠外并发症, 其中1例合并腹壁肠瘘的患者治疗后瘘管明显缩小; 另1例合并腹壁窦道的患者治疗后窦道完全愈合; 2例合并关节炎及2例口腔溃疡的患者在3次类克治疗后关节疼痛、活动受限、口腔反复溃疡的症状缓解. 故早期应用包括类克在内的强有力的治疗方案(Top-down方案), 并以硫唑嘌呤维持治疗, 对于更快地诱导缓解及维持治疗具有良好的临床价值. 黏膜愈合是CD取得远期治疗效果的关键因素[5]. 有研究显示[6], 在第0、2、6周静注类克5 mg/kg后, 29%的患者达到黏膜愈合, 其中系统接受8 wk/次的静注类克5-10 mg/kg的患者, 1年后黏膜修复率达44%. 本研究中在6次类克治疗后, 黏膜愈合率达58.3%, 略高于上述报道, 除本研究的患者例数较少, 可能导致统计学的偏倚外, 与本研究的患者还同时接受肠内营养及硫唑嘌呤治疗可能有关.
在类克的不良反应方面, 最常见的为急性输液反应[7-9], 如头痛、胸闷、恶心、风疹、荨麻疹、气促, 在应用类克前应用糖皮质激素或免疫抑制剂可降低急性输液反应及类血清病样反应[10,11]; 本研究中, 有3例患者在前2-3次输液过程中出现胸闷气促, 予减慢滴速后可耐受, 部分患者予激素治疗后症状缓解. 此外, 由于在应用类克治疗前, 本研究组均对患者进行严格的检查, 排除结核、病毒性肝炎、艾滋病、肿瘤, 故在此12例患者中, 未出现严重感染. 但是, 由于TNF-α对肿瘤的生长有一定抑制作用, 所以抗TNF-α药物是否增加癌变是一个值得注意的问题. 从临床研究结果来看, 在最多长达102 wk的观察中, 接受类克治疗的1678例患者中有18例发生肿瘤, 与每年的基础流行病学资料相比无统计学差异[12], 但是仍有待更长的随访研究予以证实. 本研究组的12例患者中, 最早应用类克治疗的一例, 证实在随访6 mo后证实发生小肠恶性淋巴瘤(T细胞性), 但该患者除接受类克治疗外, 在接受类克治疗前后均接受免疫抑制剂-硫唑嘌呤的治疗5年以上, 其发生淋巴瘤是否与类克和/或免疫抑制剂治疗有关, 尚有待进一步研究.
CD患者由于摄入不足、吸收不良、肠道丢失、代谢率增高及药物的影响, 多数会出现不同程度的营养不良. 目前的研究认为, EN可有效改善CD患者的营养状态[13,14]、诱导CD的缓解[15]、延长缓解期[16], 减少并发症的发生. EN治疗CD的机制尚不十分明确, 目前主要认为与肠屏障功能相关. EN改善患者的营养状态, 促进肠上皮受损细胞愈合, 减少肠道通透性, 对抗促炎细胞因子的作用, 使肠道休息, 加强肠屏障功能. 本研究的12例患者在治疗前, CDAI指数均>220, 活动性较强, 因此, 选择了半要素膳-百普力或百普素作为EN的制剂, 由于百普力口感相对较差, 所以3例患者采用鼻肠管留置, 鼻饲百普力; 百普素口感相对较好, 对于能耐受百普素口感的另9例患者则采用口服百普素进行EN治疗. 百普力及百普素采用短肽及氨基酸预消化配方, 更快补充蛋白质和减少胃肠道负担, 且短肽刺激肠黏膜上皮生长, 促进肠道屏障结构及功能的恢复, 残渣极少, 其中的短肽成分不但不会作为抗原致敏肠道, 反而更接近于正常人的生理性蛋白吸收模式. 本研究的12例患者中, 在2 mo的EN治疗结束后, BMI、Hb、ALB均较治疗前明显升高, 且患者内镜下的黏膜溃疡较前变浅、减少或愈合, 提示在疾病活动期, 患者的消化系黏膜屏障功能受损的情况下, 应用类克为主的药物治疗联合肠内营养, 更有助于CD的缓解. 而2 mo后停止EN治疗, 继续类克为主的药物治疗后, 患者的体质量、BMI较EN治疗结束后无显著差异(P>0.05), 而Hb及ALB在类克治疗结束后较EN治疗结束后进一步显著升高, 提示随着CD的缓解, 患者的消化系屏障功能的恢复, 饮食摄入的增加, 吸收能力的改善, 即使停用了EN, 营养状况亦可随着CD的缓解进一步好转.
总之, 对于中重度CD患者而言, 采取包括类克、EN、免疫抑制剂等在内的强有力的治疗手段(Top-down方案)诱导缓解, 后期予硫唑嘌呤维持治疗, 可能更多地达到临床有效和/或黏膜愈合, 改善CD患者的预后. 但是, 本研究的研究数量及随访期限仍有限, 类克联合EN的远期疗效及不良反应仍有待进一步观察.
我国克罗恩病(Crohn'disease, CD)的发病率呈逐年上升趋势, 该疾病临床表现多样化, 并发症多. 以氨基水杨酸类、激素、免疫抑制剂为主的传统治疗, 对于一些中重度难治性CD的疗效不理想. 近年来, 英夫利昔单抗及肠内营养的应用在CD治疗中的作用受到重视, 与传统治疗的联合应用为CD的治疗带来了新的曙光.
冯志杰, 主任医师, 河北医科大学第二医院消化内科
近年来, 英夫利昔单抗在中重度、传统治疗无效、或有瘘管等并发症的CD患者治疗中的应用得到肯定. 同时, 肠内营养支持治疗可改善CD患者营养状态、促进病情缓解、改善生活质量. 两者在难治性CD的治疗中的联合应用方面的优势仍有待进一步大规模临床试验探讨.
早在1997年, Targan等的一项纳入108例CD患者的双盲对照研究显示, 在给药2 wk后观察到疗效, 在第4周, 英夫利昔单抗组有81%的患者被判为有效, 好转48%. 12 wk后, 仍有近半数的患者维持疗效. 近年来, 英夫利昔单抗在CD治疗中, 诱导缓解、维持治疗、降低并发症及手术率的作用得到进一步肯定.
肠内营养在CD治疗中切实可行, 疗效也得到多项研究的验证, 但目前仍缺乏可靠有据的临床实践指南, 临床普及率较低; 而英夫利昔单抗由于价格昂贵, 在临床应用中受到限制; 所以, 两者在难治性CD中的联合应用仍有待进一步临床大规模的研究.
对于中重度难治性CD患者而言, 采取包括英夫利昔单抗、肠内营养、免疫抑制剂等在内的强有力的治疗手段(Top-down方案)诱导缓解, 后期予硫唑嘌呤维持治疗, 可能更多地达到临床有效和/或黏膜愈合, 改善CD患者的预后. 但是, 本研究的研究数量及随访期限仍有限, 英夫利昔单抗联合肠内营养的远期疗效及不良反应仍有待进一步观察.
英夫利昔单抗: 一种人鼠嵌合体抗肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的单克隆抗体, 可以诱导表达TNF-α的炎症细胞凋亡, 阻断免疫级联链的多个环节, 从而抑制炎症过程. 目前主要应用于炎症性肠病、强直性脊柱炎、类风湿性关节炎的患者治疗.
本文总结了12例英夫利昔联合肠内营养治疗CD的病例, 资料较齐全, 对难治型CD患者治疗方案的选择, 具有一定临床应用价值.
| 1. | Faubion WA, Loftus EV, Harmsen WS, Zinsmeister AR, Sandborn WJ. The natural history of corticosteroid therapy for inflammatory bowel disease: a population-based study. Gastroenterology. 2001;121:255-260. [PubMed] |
| 2. | Rutgeerts P, Vermeire S, Van Assche G. Biological therapies for inflammatory bowel diseases. Gastroenterology. 2009;136:1182-1197. [PubMed] [DOI] |
| 3. | Riis A, Martinsen TC, Waldum HL, Fossmark R. Clinical experience with infliximab and adalimumab in a single-center cohort of patients with Crohn's disease. Scand J Gastroenterol. 2012;47:649-657. [PubMed] [DOI] |
| 5. | Frøslie KF, Jahnsen J, Moum BA, Vatn MH. Mucosal healing in inflammatory bowel disease: results from a Norwegian population-based cohort. Gastroenterology. 2007;133:412-422. [PubMed] [DOI] |
| 6. | Rutgeerts P, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, Rachmilewitz D, Wolf DC, Olson A, Bao W. Comparison of scheduled and episodic treatment strategies of infliximab in Crohn's disease. Gastroenterology. 2004;126:402-413. [PubMed] [DOI] |
| 7. | Colombel JF, Loftus EV, Tremaine WJ, Egan LJ, Harmsen WS, Schleck CD, Zinsmeister AR, Sandborn WJ. The safety profile of infliximab in patients with Crohn's disease: the Mayo clinic experience in 500 patients. Gastroenterology. 2004;126:19-31. [PubMed] [DOI] |
| 8. | Lichtenstein GR, Feagan BG, Cohen RD, Salzberg BA, Diamond RH, Chen DM, Pritchard ML, Sandborn WJ. Serious infections and mortality in association with therapies for Crohn's disease: TREAT registry. Clin Gastroenterol Hepatol. 2006;4:621-630. [PubMed] [DOI] |
| 9. | Hamzaoglu H, Cooper J, Alsahli M, Falchuk KR, Peppercorn MA, Farrell RJ. Safety of infliximab in Crohn's disease: a large single-center experience. Inflamm Bowel Dis. 2010;16:2109-2116. [PubMed] [DOI] |
| 10. | Clark M, Colombel JF, Feagan BC, Fedorak RN, Hanauer SB, Kamm MA, Mayer L, Regueiro C, Rutgeerts P, Sandborn WJ. American gastroenterological association consensus development conference on the use of biologics in the treatment of inflammatory bowel disease, June 21-23, 2006. Gastroenterology. 2007;133:312-339. [PubMed] [DOI] |
| 11. | Fidder H, Schnitzler F, Ferrante M, Noman M, Katsanos K, Segaert S, Henckaerts L, Van Assche G, Vermeire S, Rutgeerts P. Long-term safety of infliximab for the treatment of inflammatory bowel disease: a single-centre cohort study. Gut. 2009;58:501-508. [PubMed] [DOI] |
| 12. | Han PD, Cohen RD. Managing immunogenic responses to infliximab: treatment implications for patients with Crohn's disease. Drugs. 2004;64:1767-1777. [PubMed] |
| 13. | Lee JJ, Escher JC, Shuman MJ, Forbes PW, Delemarre LC, Harr BW, Kruijer M, Moret M, Allende-Richter S, Grand RJ. Final adult height of children with inflammatory bowel disease is predicted by parental height and patient minimum height Z-score. Inflamm Bowel Dis. 2010;16:1669-1677. [PubMed] [DOI] |
| 14. | Wiese DM, Lashner BA, Lerner E, DeMichele SJ, Seidner DL. The effects of an oral supplement enriched with fish oil, prebiotics, and antioxidants on nutrition status in Crohn's disease patients. Nutr Clin Pract. 2011;26:463-473. [PubMed] [DOI] |
| 15. | Nguyen GC, Laveist TA, Brant SR. The utilization of parenteral nutrition during the in-patient management of inflammatory bowel disease in the United States: a national survey. Aliment Pharmacol Ther. 2007;26:1499-1507. [PubMed] |
| 16. | Esaki M, Matsumoto T, Hizawa K, Nakamura S, Jo Y, Mibu R, Iida M. Preventive effect of nutritional therapy against postoperative recurrence of Crohn disease, with reference to findings determined by intra-operative enteroscopy. Scand J Gastroenterol. 2005;40:1431-1437. [PubMed] |