修回日期: 2013-05-27
接受日期: 2013-07-03
在线出版日期: 2013-08-08
目的: 构建pAd/CMV/V5-DEST-TNFα-scFv重组腺病毒载体, 通过病毒包装、纯化及滴定, 获得高纯度高感染性的病毒液, 并对TNFα-scFv进行表达、鉴定.
方法: 以携带TNFα-scFv基因的载体PUC57-Amp为模板, 扩增TNFα-scFv目的基因, 构建穿梭质粒pDONR221-TNFα-scFv, 测序证实质粒含有目的基因. 与骨架质粒pAd-CMV-V5-DEST腺病毒骨架载体进行同源重组, 形成表达克隆pAd/CMV/V5-DEST-TNFα-scFv. 表达克隆转染293细胞, 包装重组腺病毒, 并鉴定和病毒滴定.
结果: TNFα-scFv基因成功克隆到腺病毒载体中, 转染293细胞后成功包装出重组腺病毒, 病毒滴度为2.5×1011 TCID 50/mL, Western blot检测到TNFα-scFv基因在293细胞中高水平表达.
结论: 成功构建了带有TNFα-scFv基因的重组腺病毒载体, 为进一步研究提供实验基础.
核心提示: 以TNFα为核心的炎症反应, 在重型肝炎患者肝细胞继发性损伤中的作用早已引起人们高度重视. 近年来, scFv已越来越多地被研究和应用于医学的各个领域, 为多种疾病的诊断、治疗和预防提供基础. 本研究成功构建pAd/CMV/V5-DEST-TNFα-scFv重组腺病毒, 可在一定程度上阻止TNFα引起的重型肝炎, 旨在为重型肝炎的治疗提供一种新的方法和实验基础.
引文著录: 卓萌, 唐余燕, 余永胜, 周丽芹, 潘庆春, 王鹏, 臧国庆, 汤正好. 抗TNFα单链抗体复制缺陷型腺病毒载体的构建及表达. 世界华人消化杂志 2013; 21(22): 2192-2197
Revised: May 27, 2013
Accepted: July 3, 2013
Published online: August 8, 2013
AIM: To construct a recombinant replication-defective adenovirus vector carrying TNFα-scFv and to obtain high-purity virus solution by viral packaging, purification and titration.
METHODS: The TNFα-scFv gene was amplified from the PUC57-Αmp vector and cloned into the shuttle plasmid pDONR221. The resulting pDONR221-TNFα-scFv was identified by DNA sequencing and then co-transfected into bacteria carrying the adenoviral backbone plasmid pΑd-CMV-V5-DEST to generate an adenoviral plasmid carrying TNFα-scFv (pΑd/CMV/V5-DEST-TNFα-ScFv) by homologous recombination in bacteria. After the pΑd/CMV/V5-DEST-TNFα-ScFv vector was transfected into 293 cells, the transfected 293 cells were infected with adenoviruses. The expression of TNFα-ScFv was detected by cytopathic effect and Western blot.
RESULTS: PCR amplification, restriction analysis and DNA sequencing verified that both the recombinant shuttle plasmid pDONR221-TNFα -scFv and the recombinant adenovirus vector pΑd/CMV/V5-DEST-TNFα-scFv were correctly constructed. After amplification and purification, the titer of recombinant adenovirus was 2.5×1011 TCID 50/mL after proliferation in 293 cells. Western blot analysis demonstrated that TNFα-scFv was expressed efficiently in 293 cells after infection.
CONCLUSION: The recombinant adenovirus vector Αd/CMV/V5-DEST-TNFα-scFv has been successfully constructed, which lays a foundation for further study of gene function and therapy.
- Citation: Zhuo M, Tang YY, Yu YS, Zhou LQ, Pan QC, Wang P, Zang GQ, Tang ZH. Construction and identification of recombinant replication-defective adenovirus vector Αd/CMV/V5-DEST-TNFα-scFv. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2192-2197
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2192.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2192
肿瘤坏死因子α(tumor necrosis factor α, TNFα)属于TNF家族, 主要由巨噬细胞和活化的T细胞分泌产生. 近年来研究发现, TNFα在许多炎症性疾病、恶性肿瘤和自身免疫性疾病的发生发展过程中起着非常重要的作用[1,2]. TNFα作为一种多效细胞因子, 在维持肝脏组织稳态中起着举足轻重作用. 已有研究[3,4]证实, 在重型肝炎患者血清中TNFα含量明显升高, 且与病情轻重呈正相关, 提示TNFα参与了重型肝炎的发病过程. 其机制为高浓度的TNFα可作用于肝细胞表面的肿瘤坏死因子受体(TNF receptor, TNFR), 引起大量肝细胞炎性坏死[5]. 鉴于高浓度TNFα对机体的有害作用, 多年来人们一直致力于研制与开发能够阻断TNFα效应的生物制剂[6-10]. 其中包括单链抗体(single chain variable fragment, scFv), scFv是利用基因工程原理将抗体的轻链(VL)和重链(VH)可变区片段(Fv)用一条较短的连接肽(linker)连接在一起的小分子抗体. 近年来, scFv已越来越多地被研究和应用于医学的各个领域, 尤其是肿瘤、艾滋病等疾病的诊断、治疗和预防[11-14]. 为探讨抗TNFα的生物制剂对机体的保护作用, 本实验构建了抗TNFα单链抗体复制缺陷型腺病毒载体, 为开展重型肝炎的基因治疗提供实验基础.
带有TNFα-scFv目的基因载体pUC57-Amp由上海瑞赛公司提供; 中间载体pDONR221、腺病毒表达载体pAd/CMV/V5-DEST和包装细胞株293购自加拿大Mixcrobix-Biosystems公司; Taq酶为美国Invitrogen公司产品; 限制性内切酶、DNA连接酶为加拿大Fermentas公司产品;质粒抽提试剂盒、基因组DNA抽提试剂盒为Axygen公司产品; 蛋白提取试剂盒为美国Bio-Rad公司产品; PacⅠ酶为美国NEB公司产品; 感受态大肠杆菌DH5α购自美国Stratagene公司; 细胞培养基DMEM、胎牛血清FBS为美国Gibco公司产品.
1.2.1 目的基因的扩增: 参照TNFα-scFv基因片段序列, 设计BP重组引物, 上下游引物的5'端分别加上ATTB1和ATTB2重组序列, 引物序列如下. 下划线标记分别为ATTB1和ATTB2重组序列. TNFα-scFv-ATTB1: 5'-GGGGACAAGTTTGTACAAAAAAGCAGGCTTCGCCACCATGCCATCTTCTGTCTCGTG-3' TNFα-scFv-ATTB2: 5'-GGGGACCACTTTGTACAAGAAAGCTGGGTCTTACTTGTCATCGTCATCCTTGTAATC-3', 以携带TNFα-scFv基因的载体PUC57-Amp为模板, TNFα-scFv-ATTB1/ TNFα-scFv-ATTB2为引物, PCR扩增TNFα-scFv基因片段, 使目的片段两末端分别带上ATTB1和ATTB2序列. PCR反应参数为: 95 ℃预变性3 min, 再进行30个PCR循环(94 ℃ 30 s, 57 ℃ 30 s, 68 ℃ 90 s), 最后68 ℃延伸10 min. 1%琼脂糖凝胶电泳分离PCR产物, 并回收目的片段.
1.2.2 腺病毒穿梭质粒pDONR221-TNFα-scFv和骨架质粒pAd/CMV/V5-DEST同源重组构建pAd-TNFα-scFv: 将目的片段TNFα-scFv重组到中间载体pDONR221上, 转化大肠杆菌DH5α感受态细胞, 挑选阳性克隆, 以菌液为模板, TNFα-scFv-ATTB1/TNFα-scFv-ATTB2为引物进行菌落PCR, 将鉴定呈阳性的克隆接到LB液体培养基中, 摇菌过夜, 次日抽提质粒, 分别进行聚合酶链反应及测序鉴定. 将测序正确的pDONR221-TNFα-scFv穿梭质粒上携带的目的片段, 在LR克隆Ⅱ混合物作用下, 重组到骨架质粒pAd/CMV/V5-DEST上(目的基因在重组位点attR1和attR2之间), PCR参数为: 94 ℃预变性3 min, 再进行35个PCR循环(94 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 90 s), 最后72 ℃延伸5 min. 取测序正确的携带目的基因的腺病毒载体菌液, 用含氨苄青霉素LB琼脂选择性平板筛选. 挑取平板上生长的单克隆, 增殖细菌, 提取质粒. Thermo NanoDrop测定质粒浓度.
1.2.3 重组腺病毒TNFα-scFv的包装: 转染前1 d, 在6孔板内接入5×105个293细胞, 至转染时细胞融合度约50%-60%. 取质粒pAd/CMV/V5-DEST-TNFα-scFv 3.2 μg用PacⅠ酶切, 酚/氯仿抽提, 乙醇沉淀, 溶于250 μL Opti-MEM中, 再加Lipofectamine-2000 8 μL与250 μL Opti-MEM, 室温静置5 min, 轻轻混匀, 室温孵育15-20 min. 将其均匀滴加入293细胞中, 轻轻摇匀细胞培养板, 使加入的混合物均匀分布于培养液中, 转染8 h后, 弃去含Lipofectamine-DNA混合物的培养液上清, 换成新鲜DMEM+10%FBS培养基, 37 ℃培养箱中孵育过夜. 转染36-48 h后观察细胞状态, 将细胞传到10 cm细胞培养板, 此后每2-3 d换新鲜的培养基, 5-7 d可看到明显的病毒斑出现, 直到大量细胞崩解脱落, 收获病毒液.
1.2.4 重组腺病毒的扩增与滴度检测: 将293细胞均匀铺于10 cm培养瓶, 培养至细胞密度达到80%-90%时, 加入100 μL病毒初液进行病毒感染, 轻轻混匀, 继续培养箱中培养, 直至80%-90%细胞变圆并漂浮(约感染后2-3 d), 感染48 h后收样; 将收获的装有细胞培养上清及细胞碎片的离心管, -80 ℃/37 ℃反复冻融2次, 3000 r/min 离心15 min, 除去细胞碎片, 保留上清(含重组腺病毒). 取病毒上清, 在96孔板中以不同稀释梯度的病毒液感染293细胞, 显微镜下观察细胞(约10 d), 记数每排出现(细胞病变效应(cytopathic effect, CPE)的孔数, 阴性对照组不得有CPE出现.
1.2.5 重组腺病毒中TNFα-scFv的Western blot鉴定: 用蛋白提取试剂盒提取经重组腺病毒感染的293A细胞的蛋白, 使用BCA蛋白测定试剂盒测定上清液中的蛋白浓度, 进行免疫印迹实验. 即加入2×SDS-PAGE上样缓冲液, 100 ℃煮沸3 min, 10%SDS-PAGE电泳, 考马氏亮蓝染色; 电泳转印100 V 2 h, PBS洗涤3次, TTBS( 0.1%Tween-20的PBS)+3%BSA封闭1 h, 加入TTBS+1%BSA稀释的一抗(1:1000), 4 ℃过夜, TTBS洗涤3次, 加入酶标二抗(1:2000), 室温孵育2 h, TTBS洗涤3次, 加入底物DAB/H2O2显色.
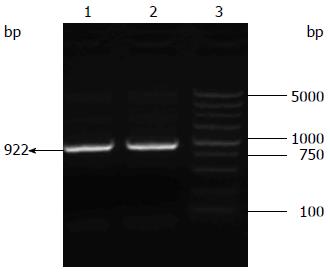
以携带TNFα-scFv基因的载体PUC57-Amp为模板, PCR扩增TNFα-scFv目的片段, 所扩增出的片段与预期922 bp(箭头所示)大小相符(图1).
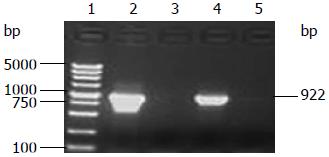
目的片段TNFα-scFv重组到中间载体pDONR221上, 转化大肠杆菌DH5α感受态细胞, 挑选阳性克隆, 提取质粒, 以质粒为模板, TNFα-scFv-ATTB1/TNFα-scFv-ATTB2为引物进行菌落PCR鉴定(图2). 阳性质粒送测序, PCR鉴定为阳性的克隆经质粒提取纯化后测序, 获得的序列完全正确. TNFα-scFv基因序列如下: ATGCCATCTTCTGTCTCGTGGGGCATCCTCCTGCTGGCAGGCCTGTGCTGCCTGGTCCCTGTCTCCCTGGCTATGGCCGAGGTGCAGCTGTTGGAGTCTGGGGG
AGGCTTGGTACAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCTTTAGCAGCTATGCCATGAGCTGGGTCCGCCAGGCTCCAGGGAAGG
GGCTGGAGTGGGTCTCAAGTATTTCTTCTACTGGTGCTTCTACAACTTACGCAGACTCCGTGAAGGGCAGGTTCACCATCTCCAGAGACAATTCCAAGAACACG
CTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCCGTATATTACTGTGCGAAAGGTGGTGCTGCTTTTGACTACTGGGGCCAGGGAACCCTGGTCAC
CGTCTCGAGCGGTGGAGGCGGTTCAGGCGGAGGTGGCAGCGGCGGTGGCGGGTCGACGGACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAG
GAGACAGAGTCACCATCACTTGCCGGGCAAGTCAGAGCATTAGCAGCTATTTAAATTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATAGT
GCATCCTATTTGCAAAGTGGGGTCCCATCAAGGTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCAAC
TTACTACTGTCAACAGGCTAATAATGCTCCTACTACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGGGCGGCCGCGGACTACAAAGACCATGACGGTGATT
ACAAGGATGACGATGACAAG.
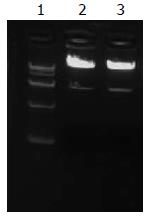
重组腺病毒质粒pAd/CMV/V5-DEST-TNFα-scFv用PacⅠ酶切, 获得条带与预期大小一致(图3).
重组腺病毒质粒pAd-TNFα-scFv转染293细胞, 获得重组腺病毒Ad-TNFα-scFv, 进一步感染293细胞扩增纯化后, 测得重组腺病毒滴度为2.5×1011 TCID 50/mL(图4).
含目的基因TNFα-scFv的重组腺病毒Ad-TNFα-scFv感染293细胞24 h后, 其目的蛋白在该细胞中得到了高表达(图5).
正常生理状况下, 体内TNFα活性极低, 对肝细胞不但无损伤作用, 反而会促进细胞的增殖及分化[15,16]. 然而, 在某些病理条件下, TNFα持续或大量释放至局部组织体液中, 或与其他细胞因子关系失调, 可介导致病因素对肝细胞的损伤, 从而引起不同程度的肝脏疾病[17,18]. 在病理生理状态下, TNF是机体最早释放的促炎性细胞因子, 在动物小鼠血清中大约30 min能够检测出[19]. Fong等[20]研究表明, 有效地阻断机体早期快速释放的TNFα, 可显著地抑制机体内其他一些炎性介质[如白介素-1(interleukin-1, IL-1)和IL-6]的进一步释放, 从而有效地阻止疾病的进展. 近年来, 用中和性TNFα单克隆抗体可阻止TNFα引起的许多疾病和炎症反应[21,22], 因此, 抗TNFα抗体具有非常广阔的临床应用前景. 然而抗TNFα单克隆抗体对人有很强的免疫原性, 临床长期反复多次给药时, 会使人体内产生较强的人抗鼠抗体反应, 使其临床疗效减弱甚至消失. 而本研究选用的scFv仅含有完整抗体的可变区, 不含天然抗体的恒定区, 因而其免疫原性较单克隆抗体明显减低, 从而最大限度地减轻了异种蛋白质引起的免疫变态反应. 由于scFv仍具有与抗原结合的活性区域, 因而保留了天然抗体的特异性和相似的亲和力[23]. 同时, 由于不含完整抗体的恒定区, 因而不与非靶细胞的Fc受体结合, 从而减少了抗体的非特异性结合, 更易于到达目标部位并可获得较高浓度的聚集[24].
基因治疗可将外源的目的基因片段插入合适的表达载体中, 再以载体导入机体靶细胞, 使目的基因在机体内高效表达, 达到临床治疗的效果. 肝脏作为基因治疗的主要靶器官, 目前其已被广泛应用各种肝脏疾病的研究[25]. 同时, 腺病毒载体因其宿主范围广、感染效率高、高性质稳定、包装容量大, 繁殖滴度高等优点, 使其在基因治疗领域得到了广泛应用[26-28]. 然而仍具备复制能力的重组腺病毒对靶细胞可产生一定的损伤, 课题组为了增加病毒转染的安全性, 在这次研究中选用设计更加合理的第二代重组腺病毒作为合适的载体. 第二代腺病毒载体已被不同程度的删除了E1、E2和/或E4基因, 这些基因编码的相关病毒蛋白可诱导大多数机体的免疫反应[28], 另外, Barry等[29]也研究表明, E1区基因可编码多种与病毒免疫逃避有关的蛋白质, 因而去除了相关的基因, 从而大大降低了腺病毒载体的免疫原性. 在第二代腺病毒载体中, pAd/CMV/V5-DEST为E1区和E3区缺失的复制缺陷型重组腺病毒载体, 由于E1区基因为腺病毒复制所必需, 因此需要一个能够产生E1蛋白(E1A和E1B)的293A细胞来提供反式补偿, 从而使得重组腺病毒能够复制和大量扩增. 同时他可以用两种抗生素筛选成功转化的质粒, 且带有V5表位标签, 表达出目的基因蛋白同时也携带V5融合蛋白, 便于检测. 这种复制缺陷型重组腺病毒仍具有感染靶细胞的能力但不可复制, 因而不会对靶细胞造成直接的损害, 有利于其在基因治疗研究中的应用[30].
鉴于既往传统的腺病毒载体构建过程繁琐, 费时费力, 稳定性差, 阻碍了实验的进展. 我们采用了He等[31]研究的质粒间同源重组方法, 即将外源基因整合进入腺病毒基因组中, 不仅可避免重组过程中目的基因产生突变, 而且可防止野生型病毒的混入, 因而显得安全可靠, 方法简便易行, 而且成功率高, 并大大简化并加快了重组腺病毒产生过程. 本次研究, 我们先把携带有目的基因(TNFα-scFv)的PUC57-Amp装入一个带有腺病毒基因组同源序列的穿梭质粒pDONR221中, 构建成转移质粒pDONR221-TNFα-scFv, 再将其与克隆了腺病毒基因组的质粒pAd/CMV/V5-DEST共转染293细胞, 通过转移质粒与腺病毒基因组的同源序列间发生同源重组, 目的基因便被转移到腺病毒基因组中, 形成一个在E1或E3缺失区带有目的基因的重组体腺病毒, 并在293细胞中复制和包装成病毒颗粒. 最终Western blot分析证实, 重组腺病毒能有效的携带TNFα-scFv基因在靶细胞中高水平表达. 这一初步研究结果为我们今后继续开展重型肝炎的基因治疗研究提供了实验基础.
重型肝炎是病毒性肝炎中病死率极高的一种临床类型, 主要病理特点为急剧发生的大面积肝细胞坏死, 预后极差. 目前, 重型肝炎的治疗尚无特效方法, 而常规内科治疗病死率极高, 达70%以上. 因此, 研究和探索一种有效和实用的治疗重型肝炎的新方法是目前亟待解决的问题.
周陶友, 副教授, 四川大学华西医院感染性疾病中心
为探讨抗TNFα的生物制剂对重型肝炎机体的保护作用, 本研究选用目前广泛应用的第二代复制缺陷型病毒, 通过病毒包装、纯化及滴定, 成功获得了较高滴度的pAd/CMV/V5-DEST-TNFα-scFv重组腺病毒.
Fong等研究表明, 有效地阻断机体早期快速释放的TNFα, 可显著地抑制机体内其他一些炎性介质(如IL-1和IL-6)的进一步释放, 从而有效地阻止疾病的进展. 在重型肝炎患者血清中TNFα含量也明显升高, 且与病情轻重呈正相关, 提示TNFα参与了重型肝炎的发病过程.
利用非复制型腺病毒载体构建抗TNFα-ScFv的真核表达载体, 介导抗TNFα-ScFv表达, 提高目的基因的表达效率, 并增加了应用的安全性; 将抗TNFα-ScFv研究与临床应用相结合, 研究其阻断内毒素诱导的肝细胞坏死作用, 以探索治疗重型肝炎、肝衰竭的新方法.
本文成功构建了抗TNFα单链抗体复制缺陷型腺病毒载体, 为进一步研究抗TNFα-scFv对内毒素诱导的肝细胞坏死的阻断效果奠定了良好的基础.
单链抗体: 利用基因工程原理将抗体的轻链(VL)和重链(VH)可变区片段(Fv)用一条较短的连接肽(linker)连接在一起的小分子抗体. 其基本结构为VH-linker-VL或VL-linker-VH. 由于其具有与抗原结合的活性区域, 因而保留了天然抗体的特异性和相似的亲和力.
本研究实验设计合理, 试验方法正确, 具有一定的学术价值, 为将来应用于临床重型肝炎的治疗提供新的思路和途径.
编辑: 黄新珍 电编:闫晋利
| 1. | Jadali Z, Amiri MM, Ravanbakhsh M. Apoptosis of peripheral blood mononuclear cells in patients with sepsis. Indian J Pathol Microbiol. 2010;53:646-650. [PubMed] [DOI] |
| 2. | Pérez-Fuentes R, López-Colombo A, Ordóñez-Toquero G, Gomez-Albino I, Ramos J, Torres-Rasgado E, Salgado-Rosas H, Romero-Díaz M, Pulido-Pérez P, Sánchez-Guillén MC. Correlation of the serum concentrations of tumour necrosis factor and nitric oxide with disease severity in chronic Chagas disease (American trypanosomiasis). Ann Trop Med Parasitol. 2007;101:123-132. [PubMed] [DOI] |
| 3. | Xing T, Li L, Cao H, Huang J. Altered immune function of monocytes in different stages of patients with acute on chronic liver failure. Clin Exp Immunol. 2007;147:184-188. [PubMed] |
| 4. | Singhal S, Chakravarty A, Das BC, Kar P. Tumour necrosis factor-alpha and soluble Fas ligand as biomarkers in non-acetaminophen-induced acute liver failure. Biomarkers. 2009;14:347-353. [PubMed] [DOI] |
| 5. | Papa S, Bubici C, Zazzeroni F, Franzoso G. Mechanisms of liver disease: cross-talk between the NF-kappaB and JNK pathways. Biol Chem. 2009;390:965-976. [PubMed] [DOI] |
| 6. | Lee TW, Fedorak RN. Tumor necrosis factor-α monoclonal antibodies in the treatment of inflammatory bowel disease: clinical practice pharmacology. Gastroenterol Clin North Am. 2010;39:543-557. [PubMed] [DOI] |
| 7. | Brunasso AM, Puntoni M, Gulia A, Massone C. Safety of anti-tumour necrosis factor agents in patients with chronic hepatitis C infection: a systematic review. Rheumatology (Oxford). 2011;50:1700-1711. [PubMed] [DOI] |
| 8. | Coffin CS, Fraser HF, Panaccione R, Ghosh S. Liver diseases associated with anti-tumor necrosis factor-alpha (TNF-α) use for inflammatory bowel disease. Inflamm Bowel Dis. 2011;17:479-484. [PubMed] [DOI] |
| 9. | Khokhar OS, Lewis JH. Hepatotoxicity of agents used in the management of inflammatory bowel disease. Dig Dis. 2010;28:508-518. [PubMed] [DOI] |
| 10. | Coffin CS, Fraser HF, Panaccione R, Ghosh S. Liver diseases associated with anti-tumor necrosis factor-alpha (TNF-α) use for inflammatory bowel disease. Inflamm Bowel Dis. 2011;17:479-484. [PubMed] [DOI] |
| 11. | Zhang MY, Borges AR, Ptak RG, Wang Y, Dimitrov AS, Alam SM, Wieczorek L, Bouma P, Fouts T, Jiang S. Potent and broad neutralizing activity of a single chain antibody fragment against cell-free and cell-associated HIV-1. MAbs. 2010;2:266-274. [PubMed] |
| 12. | Koh WW, Steffensen S, Gonzalez-Pajuelo M, Hoorelbeke B, Gorlani A, Szynol A, Forsman A, Aasa-Chapman MM, de Haard H, Verrips T. Generation of a family-specific phage library of llama single chain antibody fragments that neutralize HIV-1. J Biol Chem. 2010;285:19116-19124. [PubMed] [DOI] |
| 13. | Jafari R, Holm P, Sandegren J, Stigbrand T, Sundström BE. Localization of complexed anticytokeratin 8 scFv TS1-218 to HeLa HEp-2 multicellular tumor spheroids and experimental tumors. Cancer Biother Radiopharm. 2010;25:455-463. [PubMed] [DOI] |
| 14. | Pérez-Martínez D, Tanaka T, Rabbitts TH. Intracellular antibodies and cancer: new technologies offer therapeutic opportunities. Bioessays. 2010;32:589-598. [PubMed] [DOI] |
| 15. | Yamada Y, Kirillova I, Peschon JJ, Fausto N. Initiation of liver growth by tumor necrosis factor: deficient liver regeneration in mice lacking type I tumor necrosis factor receptor. Proc Natl Acad Sci U S A. 1997;94:1441-1446. [PubMed] [DOI] |
| 16. | Webber EM, Bruix J, Pierce RH, Fausto N. Tumor necrosis factor primes hepatocytes for DNA replication in the rat. Hepatology. 1998;28:1226-1234. [PubMed] [DOI] |
| 17. | Bradham CA, Plumpe J, Manns MP, Brenner DA, Trautwein CI. TNF-induced liver injury. Am J Physiol. 1998;275:G387-G392. |
| 18. | Diehl AM. Cytokine regulation of liver injury and repair. Immunol Rev. 2000;174:160-171. [PubMed] [DOI] |
| 19. | Tracey KJ, Fong Y, Hesse DG, Manogue KR, Lee AT, Kuo GC, Lowry SF, Cerami A. Anti-cachectin/TNF monoclonal antibodies prevent septic shock during lethal bacteraemia. Nature. 1987;330:662-664. [PubMed] [DOI] |
| 20. | Fong Y, Tracey KJ, Moldawer LL, Hesse DG, Manogue KB, Kenney JS, Lee AT, Kuo GC, Allison AC, Lowry SF. Antibodies to cachectin/tumor necrosis factor reduce interleukin 1 beta and interleukin 6 appearance during lethal bacteremia. J Exp Med. 1989;170:1627-1633. [PubMed] [DOI] |
| 21. | Brenndörfer ED, Weiland M, Frelin L, Derk E, Ahlén G, Jiao J, Bode JG, Sällberg M. Anti-tumor necrosis factor α treatment promotes apoptosis and prevents liver regeneration in a transgenic mouse model of chronic hepatitis C. Hepatology. 2010;52:1553-1563. [PubMed] [DOI] |
| 22. | Bragagni G, Lari F, Magenta G, Brogna R, Zoli G. [Echocardiographic evaluation of anti-tumor necrosis factor-alpha therapy with infliximab in patients without cardiac pathologies]. Recenti Prog Med. 2010;101:289-292. [PubMed] |
| 23. | Ohshima M, Inoue K, Hayashi H, Tsuji D, Mizugaki M, Itoh K. Generation of AcGFP fusion with single-chain Fv selected from a phage display library constructed from mice hyperimmunized against 5-methyl 2'-deoxycytidine. Protein Eng Des Sel. 2010;23:881-888. [PubMed] [DOI] |
| 24. | Bühler P, Wetterauer D, Gierschner D, Wetterauer U, Beile UE, Wolf P. Influence of structural variations on biological activity of anti-PSMA scFv and immunotoxins targeting prostate cancer. Anticancer Res. 2010;30:3373-3379. [PubMed] |
| 25. | Domvri K, Zarogoulidis P, Porpodis K, Koffa M, Lambropoulou M, Kakolyris S, Kolios G, Zarogoulidis K, Chatzaki E. Gene therapy in liver diseases: state-of-the-art and future perspectives. Curr Gene Ther. 2012;12:463-483. [PubMed] [DOI] |
| 26. | Wang L, Qi X, Sun Y, Liang L, Ju D. Adenovirus-mediated combined P16 gene and GM-CSF gene therapy for the treatment of established tumor and induction of antitumor immunity. Cancer Gene Ther. 2002;9:819-824. [PubMed] [DOI] |
| 28. | Vorburger SA, Hunt KK. Adenoviral gene therapy. Oncologist. 2002;7:46-59. [PubMed] [DOI] |
| 29. | Barry M, McFadden G. Apoptosis regulators from DNA viruses. Current opinion in immunology. 1998;10:422-30. [DOI] |
| 30. | Bett AJ, Haddara W, Prevec L, Graham FL. An efficient and flexible system for construction of adenovirus vectors with insertions or deletions in early regions 1 and 3. Proc Natl Acad Sci U S A. 1994;91:8802-8806. [PubMed] [DOI] |
| 31. | He TC, Zhou S, da Costa LT, Yu J, Kinzler KW, Vogelstein B. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci U S A. 1998;95:2509-2514. [PubMed] [DOI] |