修回日期: 2013-06-27
接受日期: 2013-07-15
在线出版日期: 2013-08-08
目的: 研究体外条件下脂多糖(lipopolysaccharide, LPS)刺激是否引起黏蛋白MUC5AC表达上调.
方法: 体外培养人肝内胆管上皮细胞, 并加入LPS干预, 分别于12和24 h检测MUC5AC mRNA和蛋白含量变化.
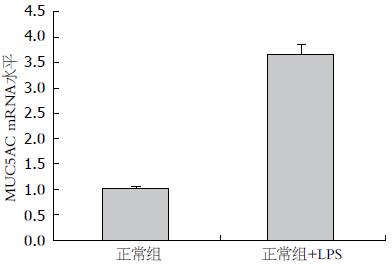
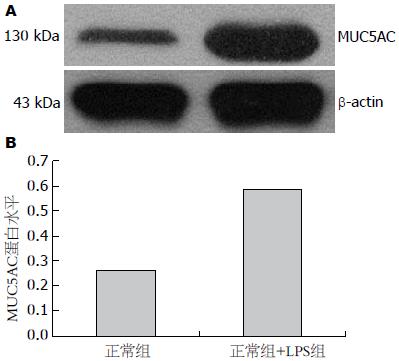
结果: LPS刺激导致MUC5AC mRNA表达. Ct值以2-△△Ct方法计算分别为正常细胞组1.00±0.05, LPS组3.67±0.22(P<0.05). 同时, LPS可刺激MUC5AC蛋白表达, Western blot灰度分析相对比分别为正常细胞组0.26, LPS干预组0.59.
结论: LPS可以诱导黏蛋白MUC5AC的高表达.
核心提示: 本文由临床常见的两个现象入手, 旨在发现脂多糖(lipopolysaccharide)与黏蛋白表达增高之间的关系, 近而希望发现肝内胆管结石治疗的新靶点.
引文著录: 李敏, 田雨, 吴硕东, 李勇男. 脂多糖对肝内胆管上皮细胞MUC5AC表达的影响. 世界华人消化杂志 2013; 21(22): 2181-2184
Revised: June 27, 2013
Accepted: July 15, 2013
Published online: August 8, 2013
AIM: To examine whether lipopolysaccharide (LPS) stimulates MUC5AC expression in human biliary epithelial cells.
METHODS: Human biliary epithelial cells were treated with LPS, and MUC5AC mRNA and protein expression was detected by real time-PCR, Western blot and immunohistochemistry 12 and 24 h after LPS treatment.
RESULTS: LPS stimulation significantly increased MUC5AC mRNA expression (3.67 ± 0.22 vs 1.00 ± 0.05, P < 0.05). MUC5AC protein expression was also increased after LPS treatment (0.26 vs 0.59, P < 0.05).
CONCLUSION: LPS can induce MUC5AC expression in human biliary epithelial cells.
- Citation: Li M, Tian Y, Wu SD, Li YN. LPS induces MUC5AC expression in human biliary epithelial cells. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2181-2184
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2181.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2181
肝胆管结石是严重威胁国人健康的常见病. 在肝胆管结石形成过程中, 分泌黏液的肝内大胆管的慢性增生性胆管炎是其病变的关键病变. 正常人胆汁是无菌的, 而在胆石症患者胆汁中产脂多糖(lipopolysaccharide, LPS)的G-杆菌, 尤其是大肠杆菌和克雷伯杆菌非常常见[1]. 黏蛋白MUC5AC是一种分泌型蛋白, 在正常肝内胆管中几乎不表达或仅少量表达, 而在肝胆管结石患者的胆汁中却大量表达[2]. 近年来关于LPS致黏蛋白表达上调的研究多集中于呼吸道上皮的研究, 而在胆道上皮鲜有报道. 本研究通过对正常肝内胆管上皮细胞予以LPS刺激, 初步探讨胆道系统中LPS与黏蛋白表达上调的关系, 为研究胆系感染与肝胆管结石关系的研究提供参考.
人肝内胆管上皮细胞(HIBEpiC)及上皮细胞专用培养基购自Sciencell公司, 置于37 ℃、50 mL/L CO2孵箱中培养, 细胞隔天更换培养基, 生长至融合度90%时以1:2-1:3比例传代. 以脂多糖(LPS, 提取自大肠杆菌, 血清型O55: B5, Sigma公司)以1 μg/mL[3]干预HIBEpiC(图1).
1.2.1 Real time-PCR: TRIzol法(购自Takara公司)抽提总RNA, 并用分光光度仪测定RNA浓度, PrimeScript RT reagent Kit with gDNA Eraser(Takara公司)将RNA反转为cDNA, SYBR Premix Ex Taq(Takara公司)进行荧光定量反应, 引物序列MUC5AC: F'-TGGACACCAAATACGCCAACAAG, R'-CTGCTCACAGATGCCAAAGCC; β-actin: F'-CTTAGTTGCGTTACACCCTTTCTTG, R'-CTGTCACCTTCACCGTTCCAGTTT, 反应体系如下: 95 ℃ 5 s, 60 ℃ 20 s, 72 ℃ 30 s, 共40个循环, 所得Ct值用2-△△Ct计算, 其中β-actin为内参.
1.2.2 Western blot检测细胞MUC5AC蛋白含量: 细胞以0.25%胰酶消化后PBS洗3遍, 加入细胞裂解液(碧云天)充分吹打细胞, 冰浴30 min, 4 ℃ 12000 g离心30 min, 取上清测定蛋白浓度. 取各组细胞蛋白20 μg, 8%SDS-PAGE电泳分离, 转膜至PVDF膜, 5%脱脂奶粉封闭1 h, 一抗(Santa)1:400倍稀释4 ℃封闭过夜, 二抗1:5000倍稀释, 室温孵育45 min后显色, β-actin为内参.
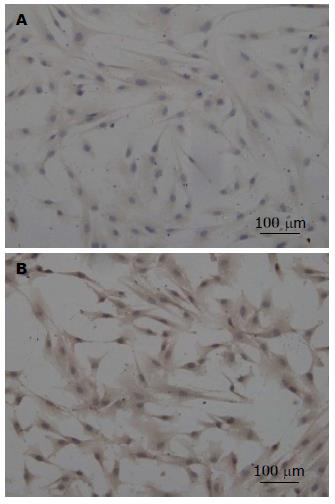
1.2.3 细胞免疫组织化学: 4%多聚甲醛固定细胞并以0.5%TritonX-100增加细胞膜通透性, 3%H2O2室温孵育15 min, 山羊血清室温孵育15 min, 一抗(Santa公司)1:400倍稀释, 4 ℃过夜, 二抗1:200倍稀释, 室温孵育30 min, 辣根酶标记室温孵育30 min后DAB显色, 苏木素复染, 镜下观察染色效果.
统计学处理 应用SPSS17.0统计软件进行统计学分析, 各组检测结果均以mean±SD表示, 数据进行方差齐性检验, 若符合正态方差齐性, 则应用两独立样本t检验, 若不满足则先进行数据转换, 使之满足正态方差齐性. P<0.05为差异有统计学意义.
以LPS(1 μg/mL)刺激HIBEpiC, 12 h后检测细胞MUC5AC mRNA表达水平, 并将所得Ct值用2-△△Ct计算, 正常细胞组为1.00±0.05, LPS干预组为3.67±0.22, 可见LPS干预组mRNA表达水平明显上调(图2).
肝内胆管结石是目前威胁我国人民群众健康的常见疾病, 治疗方法局限于结石所致萎缩肝段或叶的切除. 在组织学上, 肝胆管结石病中的胆管壁内和胆管周围腺体均呈现明显的伴有炎症和纤维化的增生性病理改变.
细菌LPS是革兰氏阴性菌的内毒素, 位于细胞壁的最外层, 覆盖于细胞壁的黏肽上, 在革兰氏阴性细菌感染及疾病演化中有重要作用, 其毒性成分主要为类脂质A. 正常人胆汁是无菌的, 而在胆石症患者的胆管胆汁中大都可以检出细菌, 且大都是革兰氏阴性菌, 其中最多见的是大肠杆菌, 其次是克雷伯杆菌[1], 关于胆石症患者胆汁中细菌的来源目前有以下几种观点, 一种观点认为胆汁中的细菌来源于十二指肠大乳头的逆流, 另一种观点认为胆汁中的细菌是肠道菌群移位进入门静脉从而进入胆汁, 还有人认为肠道菌群可以透过肠壁进入肠道淋巴结从而进入胆道.
黏蛋白广泛分布于机体各组织黏膜上皮表面, 对黏膜起保护和润滑作用, 目前已检测出20余种类型, 分布于机体不同器官, 具有组织学和细胞学特异性. 目前已经报道, 肝内胆管黏膜及周围腺体可表达6种黏蛋白(MUC1、MUC2、MUC3、MUC5AC、MUC5AB、MUC6). 其中MUC5AC是一种分泌型黏蛋白, 其基因位于染色体11p5.5[5]. 在正常肝内胆管组织中MUC5AC很少表达, 或仅在大胆管黏膜上皮细胞中灶状表达, 但在含结石的肝内胆管中其表达显著增高[2]. 随着胆汁黏蛋白中MUC5AC含量的增多, 胆汁变黏稠, 研究认为MUC5AC不仅参与的结石成核过程, 同时参与了结石增大的过程[6-8].
目前关于LPS刺激黏蛋白MUC5AC表达上调的研究大多集中于呼吸道, 另外在胃肠道和鼻上皮中偶有报道[9,10]. 研究表明黏蛋白的过量表达在肺泡纤维化、支气管哮喘、慢性阻塞性肺疾病的疾病过程中起重要作用. 目前认为, 呼吸道中可能存在EGFR-p38/JNK途径、PKC-NADPH-ROS-TGF-α途径调节LPS诱导的黏蛋白过表达. 同时, 细胞因子, 如肿瘤坏死因子-α(Tumor necrosis factor α, TNF-α)、白介素(interleukin, IL)-1β、IL-6、IL-8等也参与了此过程, 导致细胞和组织的损害[11-15]. 然而, 尽管在临床中可以在胆石症患者胆汁中检测到以大肠杆菌、克雷伯杆菌等为主的革兰氏阴性菌, 也发现胆石症患者胆管上皮黏蛋白MUC5AC表达升高, 但对于细菌刺激与MUC5AC表达上调是否存在因果关系目前在胆道中尚鲜有研究. 由于呼吸道上皮与肝内胆管上皮在胚胎学上具有同源性, 而本研究通过体外细胞培养的方法发现LPS刺激可导致MCU5AC在mRNA和蛋白水平表达均增高, 在胆道中是否存在相同或相似的分子通路或机制, 介导LPS上调黏蛋白MUC5AC的表达, 值得进一步探讨.
总之, LPS可以在体外诱导MUC5AC的高表达, 提示胆石症患者胆汁中细菌感染与黏蛋白MUC5AC表达增高可能存在因果关系, 研究LPS诱导MUC5AC高表达的分子机制, 可能对肝内胆管结石的防止提供新的思路.
脂多糖(lipopolysaccharide, LPS)导致黏蛋白表达增加在呼吸道中研究较多, 目前认为在肺泡纤维化、支气管哮喘等疾病过程中起重要作用, 但在胆道中研究甚少. 本研究采取体外环境下以LPS干预肝内胆管上皮细胞研究LPS在胆道系统中是否同样增加黏蛋白表达.
洪艳, 教授, 贵州省贵阳医学院组织胚胎学教研室
目前呼吸道中关于LPS与黏蛋白研究集中于离子通路、细胞因子等方面.
本文应用人肝内胆管上皮细胞进行体外干预, 研究LPS是否可增加胆道细胞黏蛋白表达.
本文由胆石症患者胆汁中检测到以大肠杆菌、克雷伯杆菌等为主的革兰氏阴性菌, 也发现胆石症患者胆管上皮黏蛋白MUC5AC表达升高这两个临床现象入手, 体外进行LPS干预, 希望能够发现细菌感染与黏蛋白表达升高, 甚至肝内胆管结石之间是否存在因果关系.
LPS可以增加肝内胆管上皮细胞MUC5AC表达, 说明在肝内胆管结石形成过程中, LPS感染可能是一个使动因素.
本文研究结果将对肝内胆管结石的防止提供新的思路, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Wu SD, Yu H, Sun JM. Bacteriological and electron microscopic examination of primary intrahepatic stones. Hepatobiliary Pancreat Dis Int. 2006;5:228-231. [PubMed] |
| 2. | Kim HJ, Kim SH, Chae GB, Lee SJ, Kang CD. Increased expression of mucin 5AC mRNA and decreased expression of epidermal growth-factor receptor mRNA in gallstone patients. Tohoku J Exp Med. 2008;214:139-144. [PubMed] [DOI] |
| 3. | Yang L, Junmin S, Hong Y, Shuodong W. PGE(2) induces MUC2 and MUC5AC expression in human intrahepatic biliary epithelial cells via EP4/p38MAPK activation. Ann Hepatol. 2013;12:479-486. [PubMed] |
| 4. | Wang Y, Shen Y, Li K, Zhang P, Wang G, Gao L, Bai C. Role of matrix metalloproteinase-9 in lipopolysaccharide-induced mucin production in human airway epithelial cells. Arch Biochem Biophys. 2009;486:111-118. [PubMed] [DOI] |
| 5. | Gosalia N, Leir SH, Harris A. Coordinate regulation of the gel-forming mucin genes at chromosome 11p15.5. J Biol Chem. 2013;288:6717-6725. [PubMed] [DOI] |
| 6. | Sasaki M, Nakanuma Y, Kim YS. Expression of apomucins in the intrahepatic biliary tree in hepatolithiasis differs from that in normal liver and extrahepatic biliary obstruction. Hepatology. 1998;27:54-61. [PubMed] |
| 7. | Kim YS, Gum J, Brockhausen I. Mucin glycoproteins in neoplasia. Glycoconj J. 1996;13:693-707. [PubMed] |
| 8. | Shoda J, Kano M, Asano T, Irimura T, Ueda T, Iwasaki R, Furukawa M, Kamiya J, Nimura Y, Todoroki T. Secretory low-molecular-weight phospholipases A2 and their specific receptor in bile ducts of patients with intrahepatic calculi: factors of chronic proliferative cholangitis. Hepatology. 1999;29:1026-1036. [PubMed] |
| 9. | Wang W, Xu X, Zheng M, Wan L. Lipopolysaccharides induces MUC5AC overproduction in human nasal epithelium. Eur Arch Otorhinolaryngol. 2013;270:541-547. [PubMed] [DOI] |
| 10. | Kim ST, Ye MK, Shin SH. Effects of Asian sand dust on mucin gene expression and activation of nasal polyp epithelial cells. Am J Rhinol Allergy. 2011;25:303-306. [PubMed] [DOI] |
| 11. | Shen Y, Chen Z, Wang Y, Song Z, Zhang Z, Jin M, Wang X, Bai C. Aquaporin 5 expression inhibited by LPS via p38/JNK signaling pathways in SPC-A1 cells. Respir Physiol Neurobiol. 2010;171:212-217. [PubMed] [DOI] |
| 12. | Ou XM, Wang BD, Wen FQ, Feng YL, Huang XY, Xiao J. Simvastatin attenuates lipopolysaccharide-induced airway mucus hypersecretion in rats. Chin Med J (Engl). 2008;121:1680-1687. [PubMed] |
| 13. | Li W, Yan F, Zhou H, Lin X, Wu Y, Chen C, Zhou N, Chen Z, Li JD, Shen H. P. aeruginosa lipopolysaccharide-induced MUC5AC and CLCA3 expression is partly through Duox1 in vitro and in vivo. PLoS One. 2013;8:e63945. [PubMed] [DOI] |
| 14. | Silva MA, Bercik P. Macrophages are related to goblet cell hyperplasia and induce MUC5B but not MUC5AC in human bronchus epithelial cells. Lab Invest. 2012;92:937-948. [PubMed] |
| 15. | Chand HS, Woldegiorgis Z, Schwalm K, McDonald J, Tesfaigzi Y. Acute inflammation induces insulin-like growth factor-1 to mediate Bcl-2 and Muc5ac expression in airway epithelial cells. Am J Respir Cell Mol Biol. 2012;47:784-791. [PubMed] [DOI] |