修回日期: 2013-05-26
接受日期: 2013-07-03
在线出版日期: 2013-07-28
目的: 观察由磷酸钙纳米颗粒介导的联合基因治疗体系pcDNA3.1(-)-shVEGF/yCDglyTK对胃癌细胞增殖的影响.
方法: 以磷酸钙纳米颗粒为载体, 介导pcDNA3.1(-)Null, pGenesil-1-hVEGF4-shRNA, pcDNA3.1(-)-CV-yCDglyTK, pcDNA3.1(-)-shVEGF/yCDglyTK转染胃癌细胞SGC7901, RT-PCR检测细胞中yCDglyTK及血管内皮生长因子(vascular endothelial growth factor, VEGF)mRNA的表达情况. Western blot分析yCDglyTK及VEGF蛋白的改变. MTT法检测融合基因对转染细胞的杀伤作用. 流式细胞术检测转染细胞的凋亡情况.
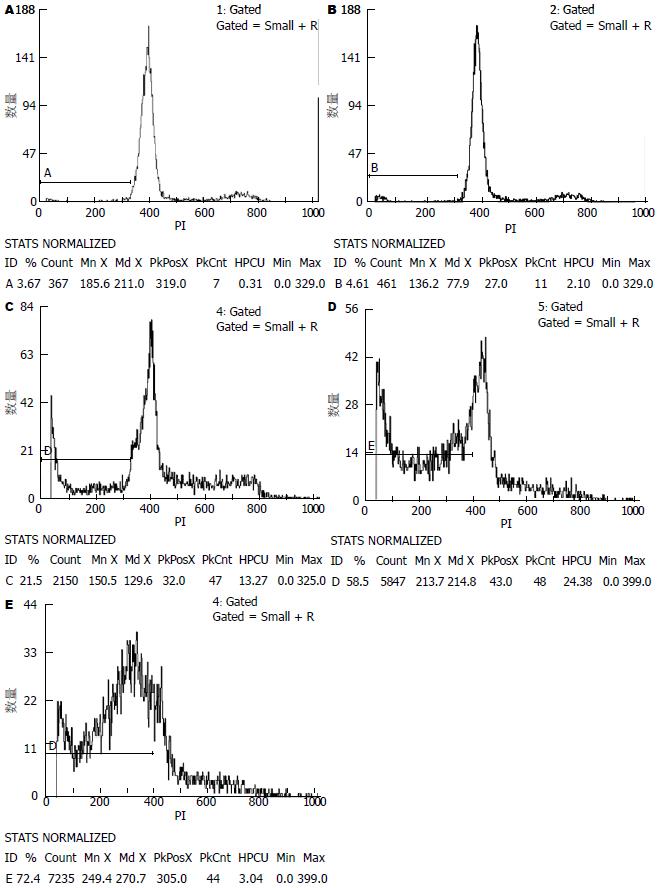
结果: SGC7901细胞转染pcDNA3.1(-)-shVEGF/yCDglyTK质粒后有yCDglyTK mRNA及相关蛋白表达, VEGF表达受抑制达30.3%. 相对于转染pcDNA3.1(-)-CV-yCDglyTK质粒组, 联合基因体系对胃癌细胞的抑制作用更强(P<0.05). pcDNA3.1(-)-shVEGF/yCDglyTK组细胞凋亡率达到67.9%±4.78%.
结论: 联合基因治疗体系pcDNA3.1(-)-shVEGF/yCDglyTK较单独的RNA干扰或自杀基因可更有效的杀伤胃癌细胞.
核心提示: 磷酸钙纳米颗粒介导的pcDNA3.1(-)-shVEGF/yCDglyTK联合基因治疗比单一的基因治疗更有优势, 将该基因治疗体系靶向导入胃癌细胞中, 能显著降低胃癌关键促癌基因的表达, 促进其凋亡.
引文著录: 陈选民, 叶玲, 冷爱民, 刘霆. 联合基因治疗体系pcDNA3.1(-)-shVEGF/yCDglyTK对胃癌细胞增殖的影响. 世界华人消化杂志 2013; 21(21): 2063-2069
Revised: May 26, 2013
Accepted: July 3, 2013
Published online: July 28, 2013
AIM: To observe the effect of combined gene therapy system pcDNA 3.1(-)-shVEGF/yCDglyTK, which is mediated by calcium phosphate nanoparticles, on the proliferation of human gastric cancer cells.
METHODS: Expression plasmid vectors pcDNA3.1(-) NULL, pGenesil-1-hVEGF4-shRNA, pcDNA3.1(-)-CV-yCDglyTK, or pcDNA3.1(-)-shVEGF/yCDglyTK were transfected into human gastric cancer cell line SGC7901. The mRNA and protein expression of yCDglyTK and VEGF was detected by RT-PCR and Western blot, respectively. The proliferation of transfected cells was analyzed by MTT assay. Apoptosis of SGC7901 cells was analyzed by flow cytometry.
RESULTS: After transfection with plasmid pcDNA3.1(-)-shVEGF/yCDglyTK, yCDglyTK mRNA and protein was detectable, and expression of VEGF was decreased by 30.3%. Compared to cells transfected with plasmid pcDNA3.1(-)-CV-yCDglyTK, cells treated with the combined gene therapy system showed more significant proliferation inhibition (P < 0.05) and apoptosis (apoptosis rate: 67.9% ± 4.78%).
CONCLUSION: The combined gene therapy system pcDNA3.1(-)-shVEGF/yCDglyTK has stronger killing effect on gastric cancer cells than RNA interference or suicide gene alone.
- Citation: Chen XM, Ye L, Leng AM, Liu T. Combined gene therapy system pcDNA 3.1(-)-shVEGF/yCDglyTK inhibits proliferation of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(21): 2063-2069
- URL: https://www.wjgnet.com/1009-3079/full/v21/i21/2063.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i21.2063
胃癌是人类常见的恶性肿瘤之一, 在全球范围内, 居恶性肿瘤的第4位, 病死率居恶性肿瘤的第2位[1]. 目前手术治疗、化疗等治疗方式效果有限, 胃癌的预后很差, 胃癌的5年生存率不足20%. 从恶性转化和肿瘤发展的分子遗传学来看, 胃癌是一种获得性的多阶段的基因病, 他的生长、侵袭、凋亡都和基因相关. 60%的临床实验证明, 基因治疗的最普遍的适应症是肿瘤[2]. 因此, 胃癌的基因治疗是当前的研究热点.
在胃癌的基因治疗策略中, 自杀基因治疗颇具临床应用潜力. RNA干扰(RNA interference, RNAi)是近几年来发现和发展起来的一门新兴的在转录水平上的基因阻断技术. 在联合基因治疗肿瘤研究中, 石华等[3]的研究显示, HPV-16 E6 siRNA与hIL-24基因分别转染宫颈癌Ca Ski细胞后, 均能抑制CaSki细胞中HPV-16 E6癌基因的表达, 使抑癌蛋白p53恢复活性, 诱导宫颈癌CaSki细胞凋亡; 两者联合则具有协同效应, 能显著提高肿瘤细胞凋亡率. 杨晓红等[4]的研究表明: RNA干扰技术可成为有效抑制非小细胞肺腺癌的治疗新方法, 联合抑癌基因p53可增强其对肺癌细胞的抑制作用. 为此, 本研究利用磷酸钙纳米颗粒为载体, 研究联合基因治疗体系pcDNA3.1(-)-shVEGF/yCDglyTK对胃癌细胞增殖的影响.
人胃癌细胞株SGC7901由中南大学湘雅医院医学实验研究中心保存, 培养于含10%小牛血清的RPMI 1640培养液中. 真核表达质粒pcDNA3.1(-)Null, pGenesil-1-hVEGF4-shRNA, pcDNA3.1(-)-CV-yCDglyTK, pcDNA3.1(-)-shVEGF/yCDglyTK均为本科室前期实验所构建[5]. 磷酸钙纳米颗粒为本科室前期实验所合成. TRIzol购自Promega公司, 逆转录试剂盒购自TOYOBO, 鼠抗β-actin购自Sigma公司, 兔抗yCDglyTK、鼠抗血管内皮生长因子(vascular endothelial growth factor, VEGF)及鼠二抗购自Sants Cruz, 兔二抗购自Amersham. 5-氟胞嘧啶(5-fluorocytosine, 5-FC), 二甲基亚砜(DMSO)等购自Sigma公司; 改良型RPMI 1640、小牛血清均购自Hyclone.
1.2.1 转染: 转染共分5组: (1)未转染的SGC7901组; (2)pcDNA3.1(-)Null组; (3)pGenesil-1-hVEGF4-shRNA组; (4)pcDNA3.1(-)-CV-yCDglyTK组; (5)pcDNA3.1(-)-shVEGF/yCDglyTK组. 按照磷酸钙纳米转染法进行转染[4]. 6孔板中, 每孔接种细胞2×105个, 待细胞生长至融合度为70%-80%时, 按照质粒DNA: 纳米颗粒 = 1 μg:15 μg混合, 用0.05 mol/L CaCl2修饰, 混合20 min后, 加入孔板中转染, 转染6 h后更换为含10%小牛血清的完全培养基, 转染48 h后收集细胞用于RT-PCR, 转染72 h后收集细胞用于Western blot检测.
1.2.2 RT-PCR检测转染后5组SGC7901细胞中yCDglyTK基因及VEGF基因的mRNA水平变化: 两步法进行RT-PCR. 第一步逆转录: 提取总RNA, 紫外分光光度仪测浓度, 取1 μg作为模板, 反应体系为20 μL: 5×RT-buffer 4 μL, dNTP(各10 mmol/L) 2 μL, RNase Inhibitor 1 μL, Rerertra Ace 1 μL, 用ddH2O补足体积至20 μL. 反应参数为: 42 ℃ 20 min, 85 ℃ 5 min, 4 ℃ 5 min. 第二步PCR扩增: 取cDNA 2 μL作为PCR反应模板, 反应体系为25 μL: Master Mix 12.5 μL, 上、下游引物(10 pmol/μL)各1 μL, ddH2O补足体积至25 μL; 所用引物如下: yCDglyTK基因引物: p1 5'-GGGAGATTAGAGGGAAAGTGT-3'; p2 5'-ACGGCGTCGGTCACGGCATAA-3', PCR产物长度707 bp. VEGF引物: p1 5'-TCTTCAAGCCATCCTGTGTG-3'; p2 5'-ATCCGCATAATCTGCATGGT-3', 产物长度112 bp. 内参β-actin引物: p1 5'-AGCGAGCATCCCCCAAAGTT-3'; p2 5'-GGGCACGAAGGCTCATCATT-3', 产物长度285 bp. 反应参数为: 95 ℃ 5 min; 98 ℃ 30 s, 55 ℃(其中VEGF基因退火温度为53 ℃)30 s, 72 ℃ 60 s, 32个循环; 72 ℃ 7 min. PCR产物进行1.5%琼脂糖凝胶电泳, 使用BandScan图像分析软件计算两个基因条带与内参条带光密度比值, 以其表示相应基因含量的相对强度.
1.2.3 Western blot分析转染后5组SGC7901细胞中yCDglyTK及VEGF基因表达水平的变化: 分别收集转染后72 h的SGC7901细胞裂解液, BCA法测定蛋白浓度, 15%聚丙烯酰胺凝胶电泳分离, 电转移至PVDF膜上, 室温封闭1 h, 4 ℃孵育一抗过夜, 二抗室温孵育1 h, 显色. 实验中以β-actin为内参, 用BandScan图像分析软件分析
结果.
1.2.4 MTT法测细胞相对存活率: (1)取对数生长期SGC7901细胞, 胰酶消化, 以每孔8×103个细胞接种于96孔培养板, 设4个复孔; (2)待细胞融合度达到70%-80%时, 以4种质粒转染之, 以不转染的SGC7901为对照, 转染6 h后更换为完全培养基; (3)24 h后更换为含5-FC终浓度为200 μg/mL的完全培养基; (4)分别于加药后第1、2、3、4、5和6天行MTT法检测细胞活力(每孔加入5 mg/mL的MTT 20 μL, 继续培养4 h后移去上清, 加DMSO 200 μL/孔, 避光振荡10 min后即在酶联免疫检测仪上测定吸光值). 以时间为横坐标, 吸光值为纵坐标绘制细胞生长曲线.
1.2.5 流式细胞仪分析转染后5组SGC7901细胞凋亡情况: 按2×105/孔将细胞种植于6孔板, 待细胞融合度达90%时, 用4种质粒转染6 h, 经200 μg/mL的5-FC作用48 h后, 收集上清及细胞, 离心, PBS漂洗后, 75 mL/L预冷乙醇固定24 h以上, 采用流式细胞仪检测细胞凋亡率.
统计学处理 应用SPSS13.0软件进行处理, 采用单因素方差分析, 对样本进行方差齐性检验, 方差齐时组间比较采用方差分析及LSD-t检验, 方差不齐时组间比较采用Kruskal-Wallis H检验及Nemenyi检验, P<0.05时认为差异有统计学意义.
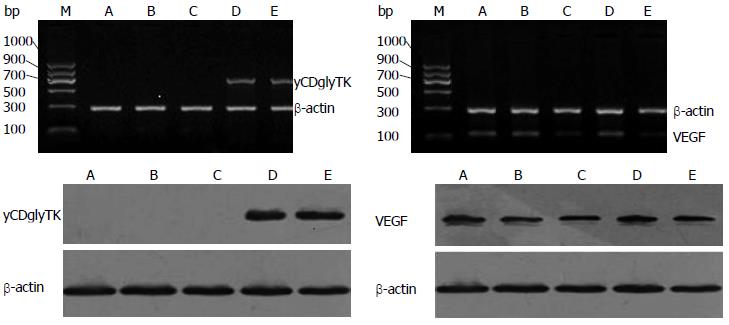
RT-PCR产物经琼脂糖凝胶电泳, 发现转染pcDNA3.1(-)-CV-yCDglyTK, pcDNA3.1(-)-shVEGF/yCDglyTK组有yCDglyTK基因表达, 未转染SGC7901组, 转染pcDNA3.1(-)Null组无表达; 转染pGenesil-1-hVEGF4-shRNA组及pcDNA3.1(-)-shVEGF/yCDglyTK组VEGF mRNA水平下降, 与未转染SGC7901组, 转染pcDNA3.1(-)Null组相比有统计学差异(P<0.05)(表1, 图1).
pcDNA3.1(-)-CV-yCDglyTK组和pcDNA3.1(-)-shVEGF/yCDglyTK组表达yCDglyTK蛋白, 未转染的SGC7901组, 转染pcDNA3.1(-)Null组中无表达, pGenesil-1-hVEGF4-shRNA组VEGF组及pcDNA3.1(-)-shVEGF/yCDglyTK组VEGF蛋白的水平下降, 与其余3组相比有统计学差异(P<0.05)(表1, 图1).
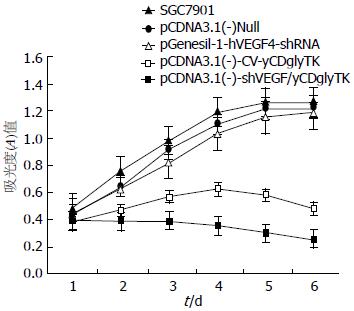
如图2所示, 5-FC对pcDNA3.1(-)-CV-yCDglyTK组、pcDNA3.1(-)-shVEGF/yCDglyTK组均有抑制作用, 但是对于后者的作用更强, 有统计学差异(P<0.05). 其余3组仍随时间推移而生长, 有相似的生长曲线.
胃癌的基因治疗中, 自杀基因是研究较多的一类抗肿瘤基因, 如自杀基因CD/5-FC、HSV-TK/GCV系统具有强大的杀伤肿瘤细胞, 抑制肿瘤生长的作用[6-9]. 融合基因yCDglyTK被转染进入细胞, 通过靶向表达启动子CEA的作用后, 能够将对细胞无毒性作用的前药5-FC转化为5-FU, 通过干扰细胞DNA的形成及旁观者效应等机制, 抑制肿瘤细胞增殖. 自Tsomoto等[10]提出肿瘤的生长具有血管形成依赖以来, 对实体瘤的血管形成及其相关微循环的研究及抗肿瘤血管生成已成为当今肿瘤研究的热点之一, VEGF是已经被证实具有促进血管生成的作用, 研究表明, VEGF在包括胃癌在内的多种实体肿瘤中存在过度表达, 并且其表达水平与肿瘤的浸润性, 微血管的密度, 肿瘤的转移与复发等密切相关[11]. RNA干扰, 是近几年来发现和发展起来的一门新兴的在转录水平上的基因阻断技术, 是一种双链RNA(double-stranded RNA, dsRNA)分子在mRNA水平上关闭相应序列基因的表达或使其沉默的过程[12,13], 他能与一种具有dsRNA特异性的RNA酶Ⅲ内切核酸酶Dicer结合为酶-dsRNA复合物, 随即被切割成21-23 nt的RNA片段, 即小干扰RNA(small interference RNA, siRNA). 研究表明, VEGF的RNA干扰技术是一种有效的抑制肿瘤细胞增殖、迁移、侵袭和血管生成的策略[14]. 为了探索更强大的胃癌治疗体系, 我们在pcDNA3.1(-)-CV-yCDglyTK骨架基础上, 将来自pGenesil-1-hVEGF4-shRNA的U6-shRNA表达框亚克隆至该骨架载体上, 通过两种机制的联合基因治疗体系, 达到我们的实验目的. 实验证实真核表达质粒pcDNA3.1(-)-shVEGF/yCDglyTK能够在磷酸钙纳米颗粒的介导下, 成功转染胃癌细胞SGC7901, 使其表达融合自杀基因yCDglyTK, 抑制其VEGF的表达30.3%, 在5-FC作用下, SGC7901细胞在48 h内凋亡率达到72.4%, 相比单纯转染质粒pGenesil-1-hVEGF4-shRNA, pcDNA3.1(-)-CV-yCDglyTK组, 联合质粒显示了更强的抑制作用, 证实该联合基因治疗系统存在协同作用, 能够增强疗效. 这与国内其他联合基因治疗的研究结果一致[3,4].
载体是基因治疗的关键. 目前载体可分为病毒载体和非病毒载体. 病毒载体主要包括腺病毒, 逆转录病毒, 腺相关病毒等, 但病毒载体在安全性方面存在潜在的危险, 如免疫原性比较强, 注射到机体后很快会被机体的免疫系统排斥; 非病毒载体目前常用的有脂质体及多聚阳离子聚合物. 但脂质体和阳离子聚合物介导基因转移缺乏组织的特异性和靶向性, 易被网状内皮系统吞噬, 基因表达时间短等缺点. 本研究采用的磷酸钙纳米颗粒, 成功介导联合基因转染, 利用了该类载体毒性低, 转染效率高, 保护目标DNA等特点[6], 使我们的联合基因治疗体系更有优势.
为了增强基因治疗的靶向性, 我们构建联合基因治疗体系时, 采用了具有靶向表达的pcDNA3.1(-)-CV-yCDglyTK骨架, 其由CEA启动子驱动, 能够使5-FC仅在CEA表达阳性的细胞中转化为5-FU[15,16], 对于高表达CEA的胃癌细胞来说, 这种杀伤作用具有专一性. 由于U6启动子缺乏靶向性, 使我们的联合基因不能专一抑制胃癌细胞VEGF的表达, 这是我们的联合基因的局限性, 也是下一步实验要重点攻克的问题. 虽然VEGF可以通过VEGF/VEGFR2自分泌环对肿瘤细胞的存活产生一定影响[17], 而我们的实验也证实转染pGenesil-1-hVEGF4-shRNA组胃癌细胞生长曲线不同于转染pcDNA3.1(-)Null组, 流式细胞仪也证实该组有21.5%的凋亡率. 但其主要作用还是在肿瘤组织刺激肿瘤血管的生成, 为肿瘤组织生长提供必要的血液供应, 从而促进肿瘤的进展. 因为在细胞实验中不存在对血管的抑制, 因此VEGF的RNA干扰效应有待动物实验进一步验证.
总之, 磷酸钙纳米颗粒介导的联合基因治疗比单一的基因治疗更有优势, 他能通过不同的作用机制抑制肿瘤细胞的增殖, 促进其凋亡, 将为胃癌的基因治疗提供新的思路.
肿瘤的发生是复杂的多因素、多步骤、涉及多基因事件发生的过程, 针对单一环节的转基因治疗常常不能达到满意的治疗效果, 大多数学者研究认为, 联合基因治疗都存在协同效应, 能够加强对肿瘤的杀伤作用.
李孟森, 教授, 海南医学院/海南省肿瘤发生和干预重点实验室; 刘亮明, 副教授, 副主任医师, 上海交通大学附属第一人民医院松江分院肝病科
本项目构建以血管内皮生长因子(vascular endothelial growth factor, VEGF)基因为靶向的RNA干扰质粒与肿瘤特异性启动子调控的融合自杀基因yCDglyTK相结合的治疗体系, 并以磷酸钙纳米为载体, 将该基因治疗体系靶向导入胃癌细胞中, 达到增强基因治疗靶向性及安全性的目的.
研究证明, 以PEG介导VEGF siRNA治疗体系, 能明显抑制前列腺肿瘤细胞中VEGF的表达, 显示很好的抗肿瘤活性. Schrijver等应用RNAi技术, 高度特异地沉默前列腺淋巴腺癌细胞中FASE的表达, FASE的沉默抑制了前列腺淋巴腺癌细胞的生长, 最终导致其凋亡.
以生物纳米材料磷酸钙纳米颗粒为载体与带有特异性启动子的pcDNA3.1(-)CVyCDglyTK/siRNA-VEGF基因治疗系统结合导入胃癌的治疗, 克服病毒载体的安全性差及肿瘤治疗靶向性差的缺点, 选择性杀伤肿瘤细胞, 达到胃癌靶向基因治疗的目的.
研制磷酸钙纳米-pcDNA3.1(-)CVyCDglyTK/siRNA-VEGF复合物, 使其能在靶细胞中特异表达, 选择性杀伤CEA阳性的胃癌细胞, 而对正常细胞无影响, 对机体无明显不良反应作用.
本文的技术和结果有一定的创新性, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Zhu X, Su D, Xuan S, Ma G, Dai Z, Liu T, Tang D, Mao W, Dong C. Gene therapy of gastric cancer using LIGHT-secreting human umbilical cord blood-derived mesenchymal stem cells. Gastric Cancer. 2013;16:155-166. [PubMed] [DOI] |
| 5. | 叶 玲, 张 桂英, 刘 霆, 陈 选民, 易 红, 肖 志强, 冷 爱民, 彭 杰. 表达血管内皮生长因子-siRNA及双自杀基因yCDglyTK的联合基因载体构建及其应用研究. 生物化学与生物物理进展. 2010;37:503-509. |
| 6. | Liu T, Tang A, Zhang G, Chen Y, Zhang J, Peng S, Cai Z. Calcium phosphate nanoparticles as a novel nonviral vector for efficient transfection of DNA in cancer gene therapy. Cancer Biother Radiopharm. 2005;20:141-149. [PubMed] [DOI] |
| 7. | Li XH, Zhou P, Wang LH, Tian SM, Qian Y, Chen LR, Zhang P. The targeted gene (KDRP-CD/TK) therapy of breast cancer mediated by SonoVue and ultrasound irradiation in vitro. Ultrasonics. 2012;52:186-191. [PubMed] [DOI] |
| 8. | Duarte S, Carle G, Faneca H, de Lima MC, Pierrefite-Carle V. Suicide gene therapy in cancer: where do we stand now? Cancer Lett. 2012;324:160-170. [PubMed] [DOI] |
| 9. | Boucher PD, Im MM, Freytag SO, Shewach DS. A novel mechanism of synergistic cytotoxicity with 5-fluorocytosine and ganciclovir in double suicide gene therapy. Cancer Res. 2006;66:3230-3237. [PubMed] [DOI] |
| 10. | Isomoto H, Ohtsuru A, Braiden V, Iwamatsu M, Miki F, Kawashita Y, Mizuta Y, Kaneda Y, Kohno S, Yamashita S. Heat-directed suicide gene therapy mediated by heat shock protein promoter for gastric cancer. Oncol Rep. 2006;15:629-635. [PubMed] |
| 11. | Holland EJ. Clinical and immunohistological studies of corneal rejection in the rat penetrating keratoplasty model. Cornea. 1991;10:374-379. [DOI] |
| 12. | Rosen LS. VEGF-targeted therapy: therapeutic potential and recent advances. Oncologist. 2005;10:382-391. [PubMed] [DOI] |
| 13. | Kurth EG, Peremyslov VV, Prokhnevsky AI, Kasschau KD, Miller M, Carrington JC, Dolja VV. Virus-derived gene expression and RNA interference vector for grapevine. J Virol. 2012;86:6002-6009. [PubMed] |
| 14. | Yan SD, Fu J, Soto C, Chen X, Zhu H, Al-Mohanna F, Collison K, Zhu A, Stern E, Saido T. An intracellular protein that binds amyloid-beta peptide and mediates neurotoxicity in Alzheimer's disease. Nature. 1997;389:689-695. [PubMed] [DOI] |
| 15. | Wang S, Liu H, Ren L, Pan Y, Zhang Y. Inhibiting colorectal carcinoma growth and metastasis by blocking the expression of VEGF using RNA interference. Neoplasia. 2008;10:399-407. [PubMed] |
| 16. | Ting L, Guiying Z, Yongheng C, Yu Xiang C, Jie P. Inhibition of Gastric Carcinoma Growth Mediated by Nanoparticles Delivered Tissue Specific Expression of yCDglyTK genes. Cancer Biology&Therapy. 2006;5:1683-1690. [DOI] |
| 17. | Dias S, Hattori K, Zhu Z, Heissig B, Choy M, Lane W, Wu Y, Chadburn A, Hyjek E, Gill M. Autocrine stimulation of VEGFR-2 activates human leukemic cell growth and migration. J Clin Invest. 2000;106:511-521. [PubMed] [DOI] |