修回日期: 2013-05-24
接受日期: 2013-06-05
在线出版日期: 2013-07-18
目的: 探讨肿瘤相关抗原基因(cancer associated antigen gene, CAGE)、黑色素瘤抗原基因-A1(melanoma antigen gene A1, MAGE-A1)、黑色素瘤抗原基因-A3(melanoma antigen gene A3, MAGE-A3)启动子区去甲基化与胃癌临床特点的关系和意义.
方法: 应用甲基化特异性PCR(methylation specific polymerase chain reaction, MSP)的方法检测30例胃癌和25例正常胃黏膜标本中CAGE、MAGE-A1和MAGE-A3基因启动子区的去甲基化状态, 并分析其与胃癌临床病例参数间的关系.
结果: 胃癌组CAGE、MAGE-A1和MAGE-A3基因启动子去甲基化阳性率(80.0%、60.0%、46.7%)均明显高于正常胃黏膜组(4.0%、0.0%、8.0%, P<0.05). 胃癌组中, CAGE基因启动子区去甲基化与淋巴转移和临床分期有关(P = 0.016; P = 0.026); MAGE-A1基因启动子区去甲基化与组织分化程度和临床分期有关(P = 0.042; P = 0.002); MAGE-A3基因启动子区去甲基化与淋巴转移和组织分化程度有关(P = 0.034; P = 0.026).
结论: CAGE、MAGE-A1和MAGE-A3基因启动子区去甲基化的检测可能有助于判断胃癌的组织分化程度、淋巴结转移和临床分期, 有可能成为胃癌治疗及判断预后的分子标志物.
核心提示: 胃癌组肿瘤相关抗原基因(cancer associated antigen gene)、黑色素瘤抗原基因-A1(melanoma antigen gene A1)、黑色素瘤抗原基因-A3(melanoma antigen gene A3)启动子去甲基化阳性率均明显高于正常胃黏膜组, 并与胃癌的临床特征存在联系. 对这3种基因启动子区去甲基化的检测可能有助于判断胃癌的组织分化程度、淋巴结转移和临床分期, 有可能成为胃癌治疗及判断预后的分子标志物.
引文著录: 王柏清, 刘文天, 刘应莉, 孙光斌. 胃癌中CAGE、MAGE-A1和MAGE-A3的去甲基化. 世界华人消化杂志 2013; 21(20): 1987-1991
Revised: May 24, 2013
Accepted: June 5, 2013
Published online: July 18, 2013
AIM: To investigate the relationship between the hypomethylation of cancer associated antigen gene (CAGE), melanoma antigen gene A1 (MAGE-A1) and melanoma antigen gene A3 (MAGE-A3) promoters and clinicopathological features of gastric carcinoma.
METHODS: The methylation status of CAGE, MAGE-A1 and MAGE-A3 promoter CpG islands was detected by MSP in 30 gastric carcinoma samples and 25 normal controls. The relationship between hypomethylation of CAGE, MAGE-A1 and MAGE-A3 promoters and clinicopathological features of gastric carcinoma was analyzed.
RESULTS: The rates of hypomethylation of CAGE, MAGE-A1 and MAGE-3 promoters in gastric carcinoma were significantly higher than those in normal controls (80.0% vs 4.0%, 60.0% vs 0.0%, 46.7% vs 8.0%, all P < 0.05). Hypomethylation of CAGE promoter was significantly correlated with lymphatic metastasis and TNM stage (P = 0.016, 0.026), hypomethylation of MAGE-A1 promoter was significantly correlated with tumor differentiation and TNM stage (P = 0.042, 0.002), and hypomethylation of MAGE-A3 promoter was significantly correlated with tumor differentiation and lymphatic metastasis (P = 0.034, 0.026).
CONCLUSION: The hypomethylation of CAGE, MAGE-A1 and MAGE-A3 promoter CpG islands may be used as a biomarker to estimate the differentiation, lymphatic metastasis and TNM stage of gastric carcinoma.
- Citation: Wang BQ, Liu WT, Liu YL, Sun GB. DNA hypomethylation of CAGE, MAGE-A1 and MAGE-A3 genes in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(20): 1987-1991
- URL: https://www.wjgnet.com/1009-3079/full/v21/i20/1987.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i20.1987
肿瘤相关抗原基因(cancer associated antigen gene, CAGE)、黑色素瘤抗原基因-A1(melanoma antigen gene A1, MAGE-A1)、黑色素瘤抗原基因-A3(melanoma antigen gene A3, MAGE-A3)基因的表达受甲基化/去甲基化机制的调节, 在一些肿瘤组织中发生启动子区的去甲基化而表达, 与肿瘤的发生、发展关系密切[1-4]. 尽管目前国内外有关3种基因在各种肿瘤中表达的研究已有多年, 但有关胃癌组织中CAGE、MAGE-A1和MAGE-A3基因启动子区去甲基化状态以及基因去甲基化与临床病理特征关系的研究则较少, 而且多是针对欧美等种族人群, 故本实验通过对国人胃癌组织中CAGE、MAGE-A1和MAGE-A3基因启动子区去甲基化状态的初步研究, 来探讨3种基因启动子区去甲基化在胃癌发生、发展中的作用, 以揭示胃癌发病机制并寻找可用于胃癌诊断、治疗及判断预后的分子标志物.
55例新鲜活检标本均取自天津医科大学总医院胃镜室. 活检标本经蒸馏水清洗, 液氮速冻后于-70 ℃冰箱保存. 胃癌标本30例, 男18例, 女12例, 平均年龄58岁. 胃癌组织依组织学类型分为腺癌组、印戒细胞癌组和未分化癌组, 依分化程度分为高分化组、中分化组和低分化组; 依淋巴转移情况分为有淋巴转移组和无淋巴转移组; 以临床分期分为Ⅰ+Ⅱ期组和Ⅲ+Ⅳ期组. 正常对照组25例, 其中男14例, 女11例, 平均年龄52岁.
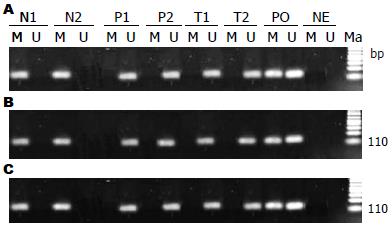
甲基化特异性PCR(methylation specific polymerase chain reaction, MSP): (1)组织DNA的提取: 按照基因组DNA提取试剂盒(博日科技)操作说明进行操作, 提取基因组DNA后经过紫外分光光度计及1%的琼脂糖凝胶检测DNA含量和纯度(A260/280>1.8). 经亚硫酸氢盐修饰和纯化回收的DNA进行MSP反应. 设立去甲基化阳性对照(采用经亚硫酸盐处理的睾丸组织DNA), 甲基化阳性对照(经SssⅠ甲基转移酶处理的正常人外周血DNA)和阴性对照(去离子水); (2)引物序列: CAGE、MAGE-A1和MAGE-A3基因甲基化(M)和去甲基化引物(U)的设计参照Kaneda等[5]和Cho等[6]报告的文献, 引物序列见表1; (3)MSP反应: 反应体系如下(总反应体积为25 μL): 10×Taq Buffer(含Mg2+)2.0 μL, 上游引物(20 μmol/L)1.0 μL, 下游引物(20 μmol/L)1.0 μL, dNTPs(2.5 μmol/L)2.0 μL, Taq酶(5 U/μL)0.2 μL, 亚硫酸氢钠修饰DNA 4 μL; 反应条件: CAGE-M及CAGE-U: 95 ℃预变性3 min. 循环步骤: 95 ℃, 30 s; 57 ℃, 30 s; 72 ℃, 60 s; 共35个循环. 循环结束后于72 ℃延伸7 min. MAGE-A1-M及MAGE-A1-U: 95 ℃预变性5 min. 循环步骤为: 95 ℃, 30 s; 0 ℃, 30 s; 72 ℃, 60 s; 共35个循环. 循环结束后于72 ℃延伸7 min; MAGE-A3-M及MAGE-A3-U: 95 ℃预变性5 min. 循环步骤为: 95 ℃, 30 s; 55 ℃, 45 s; 72 ℃, 60 s; 共35个循环. 后于72 ℃再延伸7 min. 反应结束后, 取5 μL PCR反应产物于1%琼脂糖凝胶中电泳, 于UVP凝胶成像系统内观察并拍摄结果(图1).
| 基因 | 状态 | 引物序列 |
| CAGE | M | 上游: 5'-TTTTATACGATTCGGAATTCGAC-3' |
| 下游: 5'-CAA ATCTACGACCTATTTCCCG-3' | ||
| U | 上游: 5'-GTTTTTTATATGATTTGGAATTTGAT-3' | |
| 下游: 5'-AATTCAAATCTACAACCTATTTCCCA-3' | ||
| MAGE-A1 | M | 上游: 5'-TTCGGGTGTTCGGATGTGAC-3' |
| 下游: 5'-CCTAAATCAAATTCTTCGACCG-3' | ||
| U | 上游: 5'-TTTGGGTGTTTGGATGTGAT-3' | |
| 下游: 5'-CCTAAATCAAATTCCTTCAACCA-3' | ||
| MAGE-A3 | M | 上游: 5'-TTTGTTCGGAATTTAGGGTAGTATC-3' |
| 下游: 5'-GTCGCTCGTTACTCAAAACG-3' | ||
| U | 上游: 5'-TGTTTGGAATTTAGGGTAGTATTGT-3' | |
| 下游: 5'-TGTTTGGAATTTAGGGTAGTATTGT-3' |
统计学处理 本研究采用SPSS13.0统计软件, 采用χ2检验或Fisher确切概率法对数据进行检验, P<0.05有统计学意义.
正常胃黏膜中的CAGE、MAGE-A1、MAGE-A3基因启动子区的去甲基化阳性率分别为4.0%、0.0%、8.0%. 胃癌组织中3种基因启动子区的去甲基化阳性率分别为80.0%、60.0%、46.7%, 两组间分别进行CAGE、MAGE-A1、MAGE-A3基因启动子区的去甲基化阳性率比较, 胃癌组明显高于正常对照组, 且差异均具有统计学意义(P<0.05).
由表2可知, CAGE、MAGE-A1、MAGE-A3基因启动子区甲基化阳性率与患者性别、年龄、胃癌的组织学类型无关(P>0.05). 胃癌组中, CAGE基因启动子区去甲基化与淋巴转移和临床分期有关; MAGE-A1基因启动子区去甲基化与组织分化程度和临床分期有关; MAGE-A3基因启动子区去甲基化与淋巴转移和组织分化程度有关(P<0.05).
| 临床病 | n | MAGE-A1 | P值 | MAGE-A3 | P值 | CAGE | P值 | |||
| 理指标 | UM+ | M+ | UM+ | M+ | UM+ | M+ | ||||
| 性别 | ||||||||||
| 男 | 18 | 12 | 6 | 0.458 | 8 | 10 | 0.45 | 15 | 3 | 0.66 |
| 女 | 12 | 6 | 6 | 6 | 6 | 9 | 3 | |||
| 年龄(岁) | ||||||||||
| ≥50 | 21 | 12 | 9 | 0.704 | 10 | 11 | 0.873 | 18 | 3 | 0.329 |
| <50 | 9 | 6 | 3 | 4 | 5 | 6 | 3 | |||
| 组织学类型 | ||||||||||
| 腺癌 | 20 | 11 | 9 | 0.571 | 9 | 11 | 0.791 | 17 | 3 | 0.248 |
| 印戒细胞癌 | 5 | 4 | 1 | 2 | 3 | 4 | 1 | |||
| 未分化癌 | 5 | 3 | 2 | 3 | 2 | 3 | 2 | |||
| 分化程度 | ||||||||||
| 高 | 8 | 2 | 6 | 0.0421 | 1 | 7 | 0.0341 | 5 | 3 | 0.305 |
| 中 | 11 | 7 | 4 | 5 | 6 | 9 | 2 | |||
| 低 | 11 | 9 | 2 | 8 | 3 | 10 | 1 | |||
| 淋巴转移 | ||||||||||
| 有 | 19 | 13 | 6 | 0.266 | 12 | 7 | 0.0261 | 18 | 1 | 0.0161 |
| 无 | 11 | 5 | 6 | 2 | 9 | 6 | 5 | |||
| 临床分期 | ||||||||||
| I+II期 | 12 | 3 | 9 | 0.0021 | 4 | 8 | 0.284 | 7 | 5 | 0.0261 |
| III+IV期 | 18 | 15 | 3 | 10 | 8 | 17 | 1 | |||
胃癌的发生同其他肿瘤一样, 有癌基因的过度表达和/或抑癌基因的失活. DNA的异常甲基化, 即抑癌基因的甲基化与癌基因的去甲基化被认为是抑癌基因失活和癌基因激活的主要机制, 可分为DNA高甲基化和DNA低甲基化, 前者指DNA不发生甲基化的位点被甲基化; 后者指DNA发生甲基化的位点未甲基化. 已有大量的研究证实, 在肿瘤的发生、发展过程中DNA低甲基化比高甲基化更为常见. DNA低甲基化具有肿瘤特异性, 是癌变过程中早期的分子异常之一, 可用来作为肿瘤诊断的生物学标志物[7,8]. 并且与其他类型的肿瘤标志物相比, 检测启动子区CpG岛异常甲基化的优点是方法灵敏度高, 特异性好, 样品容易获得且用量少. 因此, 肿瘤相关基因启动子区CpG岛异常甲基化的研究正日益成为一个热点.
癌/睾丸抗原(cancer-testis antigen, CTA)基因的表达与肿瘤相关. 通常在正常组织中, CTA基因启动子区处于甲基化状态, 抑制转录因子与该基因的结合, 致使其无法表达; 而在肿瘤细胞中, 该基因启动子区发生了去甲基化, 从而导致其蛋白表达. 此类基因所表达的蛋白质具有以下特征: 仅限于配子发育系统组织和肿瘤组织中; 表达其编码基因主要位于染色体上, 多数为多基因家族; 在肿瘤患者中具有免疫原性; 在不同的肿瘤组织中其表达率不同; 其表达与肿瘤的转移和恶化相关[9-11]. CAGE、MAGE-A1、MAGE-A3三者均属于癌/睾丸抗原基因. 此类基因是肿瘤特异性表达的基因, 被认为是肿瘤发生的早期事件. 因此, 可用于恶性肿瘤的早期诊断, 对监测肿瘤的转移与复发具有重要作用.
已有许多研究证实, CAGE基因启动子区的去甲基化与肿瘤的发生发展密切相关. Cho等[1]发现在乳腺癌、肺癌、肝癌、胃癌、结直肠癌中CAGE基因启动子区发生了去甲基化, 而正常前列腺、慢性肝炎、正常结肠黏膜组织中, 启动子区为甲基化表现; 在胃癌组织中, CAGE基因启动子区去甲基化阳性率为78%. Cho等[6]研究发现, 胃癌组织中CAGE基因的表达率为89%, 并且CAGE基因的表达与CAGE基因启动子区的去甲基化有关. 本实验的CAGE基因启动子区去甲基化阳性率与Cho等[1]报道的CAGE基因表达率有一定的差别, 提示CAGE基因启动子区去甲基化可能并非CAGE基因表达的唯一原因. 目前国内有关胃癌中CAGE基因启动子区去甲基化状态以及去甲基化与胃癌临床特征关系的研究则较少. 本次试验发现, CAGE基因启动子区去甲基化与胃癌有无淋巴结转移和临床分期密切相关, 这提示检测CAGE基因启动子区的去甲基化, 可能有助于判断胃癌的预后. CAGE基因启动子区去甲基化阳性率逐渐升高提示可能预示疾病正在进展, 预后不良. 由于DNA甲基化是一种可逆的遗传修饰方式, 因而可以对CAGE基因低表达的肿瘤患者给予去甲基化药物, 以提高CAGE基因的表达, 增强特异性CTL的杀伤活力, 可能有助于肿瘤的治疗.
MAGE-A1、MAGE-A3基因基因启动子区去甲基化同样被证实与肿瘤的发生发展关系密切. Zhang等[3]发现在结直肠癌细胞株和组织中MAGE-A1、MAGE-A3基因启动子区呈去甲基化, 而正常组织的启动子区为甲基化表现. 研究还发现, MAGE-A1基因启动子区去甲基化与结直肠癌的发生部位和性别有关, 远端结直肠癌和女性MAGE-A1基因启动子区去甲基化水平高, 女性MAGE-A3基因启动子区去甲基化水平高. 严茂军等[12]发现结直肠癌和腺瘤组织中MAGE-A1和MAGE-A3基因启动子区去甲基化阳性率明显高于正常组织, 并且MAGE-A1和MAGE-A3基因启动子区去甲基化都与肿瘤组织分化程度和有无淋巴结转移密切相关, 分化程度较低和有淋巴结转移的启动子区去甲基化阳性率高. 提示我们若采用MAGE-A1和MAGE-A3基因表达产物作为抗原进行免疫治疗, 那么治疗前患者病变部位的组织分化程度和有无淋巴转移是应该考虑的. 此外, 本次试验还发现MAGE-A1基因启动子区去甲基化与肿瘤的临床分期有关, 故综合多基因检测, 可以为肿瘤治疗方案的选择提供参考.
总之, 胃癌中CAGE、MAGE-A1、MAGE-A3基因启动子区存在去甲基化改变, 并与胃癌的临床病例特征之间存在联系, 提示这3种基因有可能作为胃癌早期诊断、治疗及判断预后的分子标志物. 同时, 值得注意的是, 基因启动子区低甲基化是癌基因活化的一种方式. 有关胃癌中DNA低甲基化的报道不多, 仍有许多问题有待解决, 如胃癌中有无特异性的分子标志物、有无特异性的低甲基化位点、基因启动子区去甲基化与转录表达的确切的机制等[3,13,14].
肿瘤相关抗原基因(cancer associated antigen gene, CAGE)、黑色素瘤抗原基因-A1(melanoma antigen gene A1, MAGE-A1)、黑色素瘤抗原基因-A3(melanoma antigen gene A3, MAGE-A3)的表达受甲基化/去甲基化机制的调节, 与肿瘤的发生、发展密切关系. 目前有关这3种基因启动子区去甲基化状态与临床病理特征关系的研究较少. 本实验通过对这3种基因启动子区去甲基化状态的初步研究,来探讨3种基因启动子区去甲基化在胃癌发生、发展中的作用.
陈国忠, 主任医师, 广西医科大学消化内科
肿瘤组织中普遍存在癌基因启动子区的低甲基化, 癌基因低甲基化可以作为肿瘤的生物学标志之一, 用于肿瘤的临床检测. 在众多肿瘤相关基因中, 癌/睾丸抗原基因是肿瘤特异性表达的基因, 被认为是肿瘤发生的早期事件,可用于恶性肿瘤的早期诊断, 对监测肿瘤的转移与复发具有重要作用.
Tao等研究发现化学致癌物诱发的大鼠肝癌结节中raf、c-myc、c-fos、c-H-ras、c-K-ras基因启动子区发生低甲基化. Braga等报道在上皮性肿瘤乳腺癌、肾细胞癌和卵巢癌中, 癌基因RHOA启动子区发生低甲基化. Nishiquki等采用芯片技术分析了1383个基因的甲基化状态, 发现在胃癌组织中包括癌基因ELK1、FRAT2、RHOB和RHO6等在内的159个基因启动子区发生了低甲基化.
本文应用MSP方法检测了CAGE、MAGE-A1和MAGE-A3基因启动子区去甲基化状态, 揭示了胃癌组这3种基因启动子去甲基化阳性率均明显高于正常胃黏膜组.
胃癌中CAGE、MAGE-A1、MAGE-A3基因启动子区存在去甲基化改变, 并与胃癌的临床病例特征之间存在联系,提示这3种基因有可能作为胃癌早期诊断、治疗及判断预后的分子标志物. 同时基因启动子区低甲基化是癌基因活化的一种方式, 仍有许多问题有待解决, 如胃癌中有无特异性的分子标志物、有无特异性的低甲基化位点等.
本文具有一定的创新性, 设计基本合理, 有一定科学意义和临床价值.
编辑: 田滢 电编:闫晋利
| 1. | Cho B, Lee H, Jeong S, Bang YJ, Lee HJ, Hwang KS, Kim HY, Lee YS, Kang GH, Jeoung DI. Promoter hypomethylation of a novel cancer/testis antigen gene CAGE is correlated with its aberrant expression and is seen in premalignant stage of gastric carcinoma. Biochem Biophys Res Commun. 2003;307:52-63. [PubMed] [DOI] |
| 2. | Lee TS, Kim JW, Kang GH, Park NH, Song YS, Kang SB, Lee HP. DNA hypomethylation of CAGE promotors in squamous cell carcinoma of uterine cervix. Ann N Y Acad Sci. 2006;1091:218-224. [PubMed] [DOI] |
| 3. | Zhang S, Zhou X, Yu H, Yu Y. Expression of tumor-specific antigen MAGE, GAGE and BAGE in ovarian cancer tissues and cell lines. BMC Cancer. 2010;10:163. [PubMed] [DOI] |
| 4. | Ogata K, Aihara R, Mochiki E, Ogawa A, Yanai M, Toyomasu Y, Ando H, Ohno T, Asao T, Kuwano H. Clinical significance of melanoma antigen-encoding gene-1 (MAGE-1) expression and its correlation with poor prognosis in differentiated advanced gastric cancer. Ann Surg Oncol. 2011;18:1195-1203. [PubMed] [DOI] |
| 5. | Kaneda A, Tsukamoto T, Takamura-Enya T, Watanabe N, Kaminishi M, Sugimura T, Tatematsu M, Ushijima T. Frequent hypomethylation in multiple promoter CpG islands is associated with global hypomethylation, but not with frequent promoter hypermethylation. Cancer Sci. 2004;95:58-64. [PubMed] [DOI] |
| 6. | Cho B, Lim Y, Lee DY, Park SY, Lee H, Kim WH, Yang H, Bang YJ, Jeoung DI. Identification and characterization of a novel cancer/testis antigen gene CAGE. Biochem Biophys Res Commun. 2002;292:715-726. [PubMed] [DOI] |
| 7. | Scanlan MJ, Chen YT, Williamson B, Gure AO, Stockert E, Gordan JD, Türeci O, Sahin U, Pfreundschuh M, Old LJ. Characterization of human colon cancer antigens recognized by autologous antibodies. Int J Cancer. 1998;76:652-658. [PubMed] [DOI] |
| 8. | Chen YT, Scanlan MJ, Sahin U, Türeci O, Gure AO, Tsang S, Williamson B, Stockert E, Pfreundschuh M, Old LJ. A testicular antigen aberrantly expressed in human cancers detected by autologous antibody screening. Proc Natl Acad Sci U S A. 1997;94:1914-1918. [PubMed] [DOI] |
| 9. | Lucas S, De Plaen E, Boon T. MAGE-B5, MAGE-B6, MAGE-C2, and MAGE-C3: four new members of the MAGE family with tumor-specific expression. Int J Cancer. 2000;87:55-60. [PubMed] [DOI] |
| 10. | Rimoldi D, Salvi S, Schultz-Thater E, Spagnoli GC, Cerottini JC. Anti-MAGE-3 antibody 57B and anti-MAGE-1 antibody 6C1 can be used to study different proteins of the MAGE-A family. Int J Cancer. 2000;86:749-751. [PubMed] [DOI] |
| 11. | Riener MO, Wild PJ, Soll C, Knuth A, Jin B, Jungbluth A, Hellerbrand C, Clavien PA, Moch H, Jochum W. Frequent expression of the novel cancer testis antigen MAGE-C2/CT-10 in hepatocellular carcinoma. Int J Cancer. 2009;124:352-357. [PubMed] [DOI] |
| 13. | Wang WX, Li YB, Xie XL, Shu XL, Ouyang XH. [Detection of tumor cells in peripheral blood of patients with gastric cancer using mRNA of MAGE genes as markers]. Zhonghua Weichang Waike Zazhi. 2009;12:611-614. [PubMed] |
| 14. | Akiyama Y, Maruyama K, Tai S, Komiyama M, Iizuka A, Takikawa M, Ohshita C, Yamamoto A, Yamazaki N, Kiyohara Y. Characterization of a MAGE-1-derived HLA-A24 epitope-specific CTL line from a Japanese metastatic melanoma patient. Anticancer Res. 2009;29:647-655. [PubMed] |