修回日期: 2013-05-21
接受日期: 2013-06-05
在线出版日期: 2013-07-18
目的: 通过分析超声内镜(endoscopic ultrasonography, EUS)、螺旋计算机断层扫描(computed tomography, CT)检查对食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)术前TN分期的准确性比较, 评价其临床应用价值.
方法: 2007-02/2012-12接受外科手术切除的91例经病理证实且临床资料完整的AEG患者纳入研究, 所有研究对象均于术前行EUS及螺旋CT检查, 结合术后病理分期进行对比分析.
结果: EUS对食管胃结合部腺癌术前T分期总准确率为81.3%, N分期准确率为86.8%; 螺旋CT的TN分期准确率分别为58.2%、58.3%; 前者明显高于后者, 二者之间的差异具有统计学意义.
结论: EUS较CT更能准确地判断食管胃结合部腺癌的TN分期, 有助于指导制订合理的手术方案.
核心提示: 食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)作为一类不同于食管癌和胃癌的独立疾病, 5年生存率低, TNM分期为影响术后存活率的独立影响因素. 本文通过超声内镜(endoscopic ultrasonography)、螺旋计算机断层扫描(computed tomography, CT)检查对AEG术前TN分期的准确性分析, 有助评价预后及治疗方式. 该研究具有一定的临床应用价值.
引文著录: 汪泳, 张方信, 常宗宏, 刘鑫, 邓尚新, 赵海霞. 超声内镜与CT检查在食管胃结合部腺癌术前TN分期中的临床对比. 世界华人消化杂志 2013; 21(20): 1977-1981
Revised: May 21, 2013
Accepted: June 5, 2013
Published online: July 18, 2013
AIM: To compare the accuracy of endoscopic ultrasonography (EUS) versus computed tomography (CT) in TN staging of the adenocarcinoma of the esophagogastric Junction (AEG).
METHODS: Ninety-one patients with pathologically proven AEG who received preoperative EUS and helical CT and surgical resection from February 2007 to December 2012 and had complete clinical data were included in this study. The accuracy of EUS versus CT in TN staging of AEG was compared.
RESULTS: The overall accuracy rates of preoperative T staging and N staging by EUS were 81.3% and 86.8%, respectively, significantly higher than those by helical CT (58.2% and 58.3%, respectively).
CONCLUSION: Compared with helical CT, EUS is associated with a higher accuracy in preoperative TN staging of AEG.
- Citation: Wang Y, Zhang FX, Chang ZH, Liu X, Deng SX, Zhao HX. EUS versus CT for preoperative TN staging of adenocarcinoma of the esophagogastric junction. Shijie Huaren Xiaohua Zazhi 2013; 21(20): 1977-1981
- URL: https://www.wjgnet.com/1009-3079/full/v21/i20/1977.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i20.1977
食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)作为一类不同于食管癌和胃癌的独立疾病的观点近年来已逐渐为多数学者所接受. 尤其是近年来, AEG的发病率在西方国家出现持续上升趋势[1,2], 5年生存率低, 更成为欧美医学界研究的热点领域, 国内学者近两年也开始重视AEG的研究. AEG的R0切除是相对于TNM分期影响术后存活率的独立影响因素[3], 所以术前分期的准确性对于治疗方法的选择至关重要. 研究表明超声内镜(endoscopic ultrasonography, EUS)能清晰显示消化道管壁解剖层次、肿瘤周边淋巴结的转移及与邻近脏器的关系, 是一种较好的消化系肿瘤术前分期方法. 螺旋计算机断层扫描(computed tomography, CT)扫描是目前公认的肿瘤术前临床分期指标之一. 本研究以术后组织病理作为金标准, 通过EUS与螺旋CT对AEG分期的准确性对比研究, 旨在评估EUS在AEG诊断和术前分期方面的应用价值.
选择兰州军区兰州总医院2007-02/2012-12接受外科手术切除的下段食管腺癌、贲门腺癌、胃底或胃体上部腺癌共469例, 其中将91例经组织病理证实且临床资料完整并符合AEG诊断的患者纳入本次研究. 其中男63例, 女28例; 年龄43-71岁, 中位年龄59.6岁. 91例中, 早期AEG 4例, 进展期87例. 入选病例术前均未行放、化疗. Olympus GIF-260胃镜、Olympus GF-UM2000超声内镜, 超声频率为5-20 MHz. TOSHIBA aquilion 16排螺旋CT.
1.2.1 EUS检查: 所有入选病例均先期已行胃镜加活检明确为AEG, 而后行EUS检查. 检查前准备同常规胃镜. 采用水囊法或水囊法加脱气水充盈法. 检查时用退镜法观察, 依次为胃窦、胃体、胃底、贲门、食管; 先观察消化道管壁情况, 再更超声换频率观察管壁外淋巴结及相邻脏器.
1.2.2 螺旋CT检查: 所有患者检查前饮水500 mL, 取仰卧位, 自气管隆突水平扫至腹主动脉分叉水平, 层厚5 mm, 间隔5 mm.
1.2.3 评定标准: (1)AEG诊断标准[4,5]: 跨越食管胃结合部(esophagogastric junction, EGJ)上下5 cm范围的腺癌, 不论其主体位于EGJ上方或下方, 均诊断为AEG. AEG按Siewert分3型[6], Ⅰ型: 远端食管癌, 肿瘤中心位于EGJ上1-5 cm; Ⅱ型: 贲门癌, 肿瘤中心位于EGJ上1 cm至下2 cm范围, 侵犯EGJ; Ⅲ型: 贲门下癌, 肿瘤中心位于EGJ下2-5 cm, 侵犯EGJ; (2)EUS诊断标准: EUS能清晰显示消化管管壁的5层结构并与组织学相对应, 即第1层高回声和第2层低回声为黏膜层, 第3层为高回声即黏膜下层, 第4层低回声为肌层, 第5层高回声为浆膜层或外膜. 癌肿侵犯深度的诊断标准[7]: T1期: 分为黏膜癌(第1、2层增厚呈不均质的中、低回声图像, 第3-5层结构完整)、黏膜下癌(第1-3层结构不清、增厚, 呈低回声改变, 第4-5层结构完整); T2期: 表现为第1-4层结构层次消失、增厚, 呈低回声改变或局限性突入管腔, 第5层完整; T3期: 管壁5层结构均消失、增厚, 呈低回声改变; T4期: 表现为低回声团块突破第5层, 侵入外周相邻脏器的征象. 淋巴结转移的判断标准为直径>1 cm、边界清楚的低回声结节影, 呈单个或多个融合状. 未转移淋巴结则为高回声, 边界模糊影; (3)CT诊断标准[8]: AEG在CT图像上表现为以贲门为中心的突向胃腔内的溃疡性肿块或增厚影; 由于该部位解剖学上的特殊性, AEG在食管胃结合部的横断面图像上, 溃疡常表现为尖端指向食管下端, 口部开向胃腔的较深的三角形或弓形凹陷, 凹陷的两侧壁及尖端形成癌性溃疡的底, 溃疡底不光滑. 溃疡两侧增厚的胃壁, 在与正常胃壁交界处向胃腔内隆起形成环堤, 有的似鸟嘴样结构; (4)病理TN分期标准: AEG的TNM分期标准参照2009年底AJCC/UICC第7版国际肿瘤TNM分期进行分类[9]即肿瘤主体位于食管侧的癌按食管癌的TNM分期标准进行分类. 肿瘤主体位于胃侧者按照胃肿瘤的TNM分期标准进行分类. 肿瘤大体类型按照Borrman分型标准进行划分.
统计学处理 本研究采用SPSS10.0统计软件. 两组计量资料比较用t检验, 计数资料采用χ2检验, 诊断一致性采用κ检验. P<0.05为差异有显著性意义.
按照Siewert分型标准各型的年龄、性别见表1, 患者的年龄、性别比方面在各组间差异无统计学意义(P>0.05). 91例AEG患者中, Siewert Ⅰ型8例(8.8%), Ⅱ型37例(40.7%), Ⅲ型46例(50.5%). Siewert各型的肿瘤大体类型情况详见表1, 其中早癌4例(4.2%), Borrman Ⅰ型13例(14.3%), Borrman Ⅱ型19例(20.9%), Borrman Ⅲ型55例(60.4%), Borrman Ⅳ型0例.
| Siewert分型 | n | 年龄(岁) | 性别(男:女, n) | Borrman分型[n(%)] | P值 | ||||
| 早期 | Ⅰ型 | Ⅱ型 | Ⅲ型 | Ⅳ型 | |||||
| I型 | 8 | 62.7 | 6:2 | 1(12.5) | 1(12.5) | 3(37.5) | 3(37.5) | 0 | |
| II型 | 37 | 60.0 | 26:11 | 3(8.1) | 8(21.6) | 3(8.1) | 23(62.1) | 0 | |
| III型 | 46 | 58.7 | 31:15 | 0 | 4(8.7) | 13(28.3) | 29(63.0) | 0 | |
| 合计 | 91 | 59.6 | 63:28 | 4(4.2) | 13(14.3) | 19(20.9) | 55(60.4) | 0 | 0.048 |
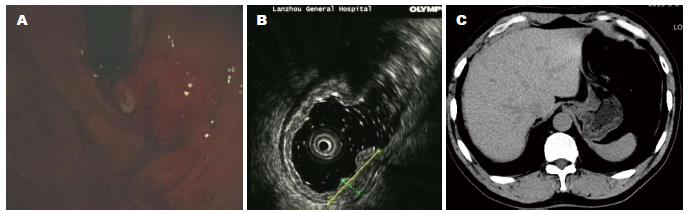
AEG在EUS中表现为胃壁层次结构破坏,呈低回声改变(图1A, B), 而在CT图像中表现为胃壁的增厚影,但对于T1、T2期较难分辨(图1C). EUS对于T分期的敏感度、特异度及准确度均高于螺旋CT, 尤其准确度差异更加明显, 详细结果见表2, 经配对χ2检验, 显示这一差异具有统计学意义(χ2 = 118.5, P = 0.000). 进一步分析计算联合CT和EUS两种方法对于T分期的敏感度、特异度及准确度, 结果分别为, T1期的敏感度、特异度及准确度分别为: 85.7%、19.0%、24.2%, T2期的敏感度、特异度及准确度分别为: 75.0%、17.7%、25.3%, T3期的敏感度、特异度及准确度分别为: 84.6%、21.2%、48.4%, T4期的敏感度、特异度及准确度分别为: 78.8%、17.2%、40.0%. 分析EUS和CT两组之间结果的一致性, 使用一致性检验P = 0.000, 由此说明两种方法检测结果的趋势相似, 但因κ = 0.59、<0.75, 提示其一致性中等. 由此提示这两种方法之间具有相互参考的意义.
| 病理 | n | EUS T分期 | 螺旋CT分期 | ||||||||||||
| T分期 | T1 | T2 | T3 | T4 | 敏感度(%) | 特异度(%) | 准确度(%) | T1 | T2 | T3 | T4 | 敏感度(%) | 特异度(%) | 准确度(%) | |
| T1 | 7 | 6 | 1 | 0 | 0 | 85.7 | 96.4 | 95.6 | 4 | 1 | 1 | 1 | 57.1 | 94.0 | 91.2 |
| T2 | 12 | 1 | 9 | 2 | 0 | 75.0 | 93.7 | 91.2 | 2 | 7 | 3 | 0 | 58.3 | 82.3 | 79.1 |
| T3 | 39 | 1 | 3 | 33 | 2 | 84.6 | 86.5 | 85.7 | 2 | 9 | 23 | 5 | 59.0 | 75.0 | 68.1 |
| T4 | 33 | 1 | 1 | 5 | 26 | 78.8 | 96.6 | 90.1 | 1 | 4 | 9 | 19 | 57.6 | 89.7 | 78.0 |
| 合计 | 91 | 9 | 14 | 40 | 28 | 81.3 | 9 | 21 | 36 | 25 | 58.2 | ||||
同样分析EUS与CT这两种方法对淋巴转移的判断, 结果显示EUS的敏感度、特异度、准确度均高于CT检查, 详细结果见表3, 使用配对计数资料χ2检验, χ2 = 18.675、P = 0.000, 显示两组之间的差异存在统计学意义; 分析计算联合CT和EUS两种方法对于淋巴结转移的判断, 其敏感度、特异度及准确度分别为: 89.7%、60.9%、82.4%. 进一步进行两组结果之间的一致性, 使用一致性检验, κ = 0.414、P = 0.000, 说明2种方法检查的结果有一致性, 但因κ = 0.414、<0.75, 其一致性属于中等偏下, 提示两种方法具有相互参考的价值, 但意义较小.
| 病理 | n | EUS N分期 | 螺旋CT N分期 | ||||||||
| N分期 | N0 | N1 | 敏感度(%) | 特异度(%) | 准确度(%) | N0 | N1 | 敏感度(%) | 特异度(%) | 准确度(%) | |
| N0 | 23 | 18 | 5 | 78.3 | 89.7 | 86.8 | 14 | 9 | 60.9 | 57.4 | 58.3 |
| N1 | 68 | 7 | 61 | 89.7 | 78.3 | 29 | 39 | 57.4 | 60.9 | ||
| 合计 | 67 | 25 | 66 | 43 | 48 | ||||||
EGJ是指食管下端纵行栅栏状血管末梢或胃黏膜皱襞的近侧缘[4]. 而此连接线(齿状线)上下5 cm范围内的区域出现的腺癌称为AEG[5]. 目前对于AEG的属区划分国内外虽然存有争议, 但由于其解剖处于胸腹交界处这一特殊部位, 有着相对独立的临床病理特征, 越来越多的文献资料显示其在流行病学、病因学、影像学、临床治疗及预后等方面具有独立的特征和独特的生物学行为, 更倾向作为一种不同于食管癌和胃癌的特殊类型癌肿进行研究[10]. AEG的浸润、进展以及淋巴结转移的不同, 导致手术选择如手术入路、切除范围、淋巴结清扫等方面在临床上出现较多分歧, 且术后5年存活率仅34.0%-52.3%. 因此, 对AEG进行充分术前分期评估, 并遵循个体化治疗原则, 对提高患者生存率有着重要的临床意义.
食管癌、胃癌术前评估常用的检查方法包括CT、MRI、PET-CT、EUS等. 而AEG的术前评估目前国内外文献报道较少[11]. EUS是将内镜与超声相结合, 不但可以通过胃镜直接观察黏膜表面病变形态, 同时又可通过超声扫描来判断病变侵犯的范围、深度及淋巴结转移的情况, 为临床治疗方案的选择提供重要的依据. 大量临床研究表明, EUS检查是目前胃癌术前分期的重要手段. 而对于食管胃结合部这一特殊部位, EUS通过水囊法或水囊法加脱气水充盈法对病灶处进行扫描, 避免了脂肪的衰减及胃肠道气体和骨骼等的干扰, 不断采用进镜或退镜方法实时获得管道壁层癌组织浸润深度及管壁外肿大淋巴结情况, 尤其是对于交界部的T分期可以比较准确地鉴别黏膜内癌(T1a)和黏膜下癌(T1b)[12], 并以此指导内镜下黏膜切除术和内镜黏膜下剥离术. 我们通过EUS对AEG进行术前评估与术后病理的比较发现, EUS对于AEG的TN分期准确性明显优于CT, 对于T分期的总准确度为81.3%, 这与文献报道相类似[4]. 而且我们在本次研究中还发现对于食管胃结合部肿瘤的纵行范围判断(即长度)EUS也明显优于CT, 可直视下测量病灶长度及周径, 为手术范围的确定做好预案. EUS对淋巴结转移的判断标准为直径>1 cm、边界清楚的低回声结节影, 呈单个或多个融合状. 未转移淋巴结则为高回声, 边界模糊影. 通过实时切换超声频率5-12 MHz, EUS可动态、连续观察到食管壁、胃壁外淋巴结转移情况, 本研究结果同样也显示出对AEG术前N分期总准确率为86.8%, 与文献报道接近[12,13], 但对于远处淋巴结转移及远处脏器转移EUS有其局限性.
由于螺旋CT扫描仍是目前公认的肿瘤术前临床分期指标之一, 而且无创伤及痛苦, 在患者耐受程度、扫查范围广泛等方面具有EUS无法比拟的优势.
但AEG为食管胃交界部的空腔脏器肿瘤, 邻近脏器较多、结构复杂且走行迂曲, 又穿过膈肌, 而且AEG淋巴引流也相对复杂, 转移途径包括上方、水平和下方3个方向, CT检查较难获得满意图像, 并且CT对肿瘤的T1、T2期较难分辨, 容易出现误诊、漏诊. 本研究结果同样显示这样的趋势, CT的T分期和淋巴结转移诊断的敏感性、特异性、准确度均较EUS差. 相信随着近年来螺旋CT设备的不断更新及影像学医师技术的不断提高, 同时结合冠矢状位成像的处理, 可使得CT在AEG中的检出率得到提高.
总之, 我们认为EUS对AEG术前分期具有较高的临床应用价值. 在临床诊断过程中, 我们还发现对于AEG患者EUS联合CT检查, 可起到互补的作用, 能最大限度地提高肿瘤TNM分期的诊断水平, 为患者获得最佳最合理的治疗方案提供较大帮助.
1987年, 德国学者Siewert等首次提出了食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)这一概念, 将位于食管胃连接线(齿状线)上下5 cm范围内的腺癌统称为AEG, 并根据癌肿的主体部位与齿状线的关系将AEG分为Siewert Ⅰ、Ⅱ、Ⅲ型. 近年来, AEG的发病率持续上升, 受到越来越多的关注. 已有的文献表明AEG在流行病学、病因学、影像学、病理学临床治疗以及预后等诸多方面具备独立特征和独特的生物学行为, 倾向于作为一类独立疾病进行研究.
李健丁, 教授, 山西医科大学第一医院放射科CT室; 杨薇, 副教授, 副主任医师, 北京大学肿瘤医院超声科
近年来, AEG发病率呈上升趋势, 手术仍为该病的主要治疗手段, 但目前国人对该病概念较模糊, 导致手术选择(包括手术入路、切除范围、淋巴结清扫范围等方面)多样, 甚至存有争议. 对肿瘤进行充分的分型、分期评估, 遵循个体化治疗原则, 是为患者选择科学合理的术式的前提和基础. AEG常用的术前评估检查方法包括CT、MRI、PET-CT、胃镜、超声内镜(endoscopic ultrasonography, EUS)和腹腔镜探查等. 何种检查方式可早期发现AEG并准确进行TNM分期评估是目前研究的热点和难点.
AEG作为一类不同于食管癌和胃癌的独立疾病, 5年生存率低, TNM分期为影响术后存活率的独立影响因素. 本文通过EUS、螺旋CT检查对AEG术前TN分期的准确性分析, 有助评价预后及治疗方式. 该研究具有一定临床应用价值.
EUS对AEG术前分期具有较高的临床应用价值. 在临床应用过程中可进一步联合螺旋CT检查, 起到互补的作用, 能最大限度地提高肿瘤TNM分期的诊断水平, 为患者获得最佳最合理的治疗方案提供较大帮助.
本文结构及结论合理, 方法及结果可信, 具有一定临床应用价值.
编辑: 田滢 电编:闫晋利
| 1. | Keeney S, Bauer TL. Epidemiology of adenocarcinoma of the esophagogastric junction. Surg Oncol Clin N Am. 2006;15:687-696. [PubMed] [DOI] |
| 2. | Hasegawa S, Yoshikawa T. Adenocarcinoma of the esophagogastric junction: incidence, characteristics, and treatment strategies. Gastric Cancer. 2010;13:63-73. [PubMed] [DOI] |
| 3. | Meyer W, Popp M, Klinger L, Awad-Allah A, Gebhardt C. Results of surgical therapy of adenocarcinomas of the esophagogastric junction according to a standardized surgical resection technique. Dig Surg. 2002;19:269-274; discussion 275. [PubMed] [DOI] |
| 4. | Siewert JR, Feith M. Adenocarcinoma of the esophagogastric junction: competition between Barrett and gastric cancer. J Am Coll Surg. 2007;205:S49-S53. [PubMed] [DOI] |
| 5. | Siewert JR, Hölscher AH, Becker K, Gössner W. [Cardia cancer: attempt at a therapeutically relevant classification]. Chirurg. 1987;58:25-32. [PubMed] |
| 6. | Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction. Br J Surg. 1998;85:1457-1459. [PubMed] [DOI] |
| 9. | Sobin LH, Gospodarowicz MK, Wittekind C. TNM classification of malignant tumours. Oxford: Willey-Blackwell 2009; 63-77. |
| 11. | Blackshaw G, Lewis WG, Hopper AN, Morgan MA, Al-Khyatt W, Edwards P, Roberts SA. Prospective comparison of endosonography, computed tomography, and histopathological stage of junctional oesophagogastric cancer. Clin Radiol. 2008;63:1092-1098. [PubMed] [DOI] |
| 12. | Räsänen JV, Sihvo EI, Knuuti MJ, Minn HR, Luostarinen ME, Laippala P, Viljanen T, Salo JA. Prospective analysis of accuracy of positron emission tomography, computed tomography, and endoscopic ultrasonography in staging of adenocarcinoma of the esophagus and the esophagogastric junction. Ann Surg Oncol. 2003;10:954-960. [PubMed] [DOI] |
| 13. | Wallace MB, Nietert PJ, Earle C, Krasna MJ, Hawes RH, Hoffman BJ, Reed CE. An analysis of multiple staging management strategies for carcinoma of the esophagus: computed tomography, endoscopic ultrasound, positron emission tomography, and thoracoscopy/laparoscopy. Ann Thorac Surg. 2002;74:1026-1032. [PubMed] [DOI] |