修回日期: 2013-05-26
接受日期: 2013-06-05
在线出版日期: 2013-07-18
目的: 探讨角质细胞生长因子(keratinocyte growth factor, KGF)对胰腺癌细胞生物学功能的影响.
方法: 运用免疫印迹和聚合酶链反应(polymerase chain reaction, PCR)检测6株胰腺癌细胞系(CaPan-2、BxPc-3、MIAPaca-2、ASPc-1、SW-1990、PANC-2)中KGF蛋白的表达和角质细胞生长因子受体(keratinocyte growth factor-receptor, KGFR) mRNA的表达水平. 并运用MTT、细胞迁移及侵袭实验检测KGF对胰腺癌细胞株(BxPC-3)增殖、迁移及侵袭的影响.
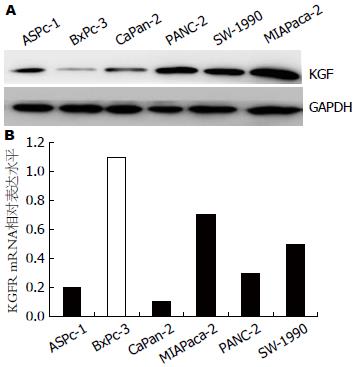
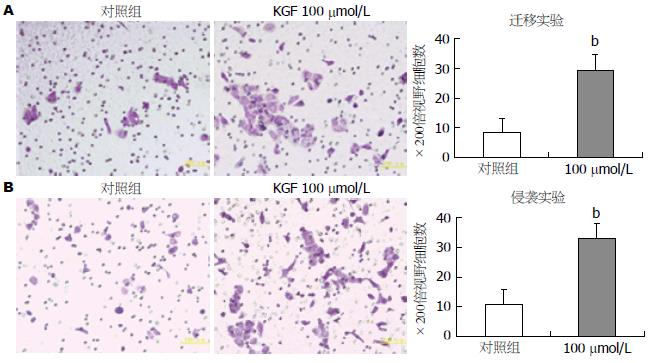
结果: 免疫印迹和PCR显示, KGF在BxPC-3中的表达水平明显低于其他5株细胞系, 而其受体mRNA在BxPC-3细胞中的表达水平明显高于其余5株细胞系. KGF能够明显促进BxPC-3细胞的增殖(P<0.01). 并且能够明显增加BxPC-3细胞的迁移及侵袭能力(P<0.01).
结论: 在部分胰腺癌细胞系中, KGF能够促进细胞的增殖, 并能够增加其迁移及侵袭能力.
核心提示: 角质细胞生长因子(keratinocyte growth factor, KGF)及其受体在不同胰腺癌细胞系中表达程度不一. KGF能够促进胰腺癌细胞的增殖, 并能够增加其迁移及侵袭能力. 为胰腺癌患者评价预后及应用于抗肿瘤靶向治疗提供新的思路.
引文著录: 金益峰, 周建平, 盛伟伟, 张丹华, 董明. 角质细胞生长因子对胰腺癌细胞生物学行为的影响. 世界华人消化杂志 2013; 21(20): 1961-1965
Revised: May 26, 2013
Accepted: June 5, 2013
Published online: July 18, 2013
AIM: To examine the role of keratinocyte growth factor (KGF) in regulating the biological behavior of pancreatic cancer cells.
METHODS: Immunoblotting (IB) and polymerase chain reaction (PCR) were used to detect the protein and mRNA levels of KGF and its receptor in six pancreatic cancer cell lines (CaPan-2, BxPc-3, MIAPaca-2, ASPc-1, SW-1990, and PANC-2). MTT, migration and invasion assays were used to detect the role of KGF in regulating cell proliferation, migration and invasion in pancreatic cancer cell line BxPC-3.
RESULTS: The protein level of KGF was lower in BxPC-3 cells than in other five pancreatic cancer cell lines, while the mRNA level of KGFR was higher in BxPC-3 cells than in other five cell lines. KGF could significantly promote BxPc-3 cell proliferation, migration and invasion (all P < 0.01).
CONCLUSION: KGF can promote cell proliferation, migration and invasion in some pancreatic cancer cell lines.
- Citation: Jin YF, Zhou JP, Sheng WW, Zhang DH, Dong M. Role of KGF in regulating biological behavior of pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(20): 1961-1965
- URL: https://www.wjgnet.com/1009-3079/full/v21/i20/1961.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i20.1961
胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)是一种常见的恶性肿瘤, 其发病率有明显增高的趋势. 40岁以上好发, 男性多于女性. 尽管近十年来对PDAC患者的干预及治疗有了巨大改善, 但是90%的患者仍在诊断后1年内死亡, 其5年生存率仅为1%-3%. 胰腺癌常见淋巴转移和癌浸润, 还可以发生癌肿远端的胰管内转移和腹腔种植转移、血行转移等. 其不良预后与该病早期诊断困难以及早期即出现的浸润和转移, 手术切除率低, 术后复发率高有关, 而且PDAC对于化疗和放疗都不敏感[1].
近年来, 随着肿瘤微环境与肿瘤发生发展关系的相关研究不断深入. 角质细胞生长因子(keratinocyte growth factor, KGF)在肿瘤中的作用也逐步受到重视. KGF可以刺激不同类型上皮来源的肿瘤细胞的迁移和侵袭, 表明了其与肿瘤发生的密切关系. 肿瘤间质分泌的KGF可能与肿瘤的恶性程度有关, 是肿瘤转移进展的重要分子[2]. KGF mRNA及其受体在人乳腺癌细胞、胰腺癌、胃腺癌细胞以及前列腺癌细胞系中均有发现[3-5]. 而在胰腺癌研究中报道较少[6-9]. 本研究旨在探讨KGF对胰腺癌细胞生物学功能的影响及可能机制.
胰腺癌细胞系AsPC-1、BxPC-3、SW-1990及PANC-2购自中科院上海细胞库; Capan-2细胞购自美国ATCC公司; Miapaca-2来自我校细胞生物实验室馈赠; 细胞以10%胎牛血清1640培养液进行培养(HyClone, 美国); KGF羊抗人多克隆抗体购自美国Santa Cruz公司sc-1366); KGF购自美国R&D公司; MTT及DMSO购自美国Sigma公司; Transwell小室和基质胶均购自美国BD公司; 蛋白裂解液、蛋白酶抑制剂、上样缓冲液、BCA定量及ECL发光试剂盒均购自上海碧云天生物公司; RNA分离试剂盒TRIzol、逆转录试剂盒(DRR037S)、PCR反应试剂盒等购自日本Takara公司.
1.2.1 Western blot印迹: 提取胰腺癌细胞系蛋白, 经BCA定量试剂盒测定蛋白浓度, 样品均定量为5 μg/μL, 每泳道上样50 μg, 经12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳, 电转移至PVDF膜. 5%脱脂奶粉封闭2 h, 加入KGF(1:100)4 ℃孵育过夜, 羊二抗(1:4000)室温孵育1.5 h. ECL发光并以凝胶显像仪(MF-chemibis 3.2 DNR, 以色列)显像.
1.2.2 PCR: 采用RNA分离试剂盒TRIzol提取并纯化组织总RNA. 所有RNA样本浓度均稀释至1 μg/μL, 根据Takara逆转录和扩增试剂盒说明书进行逆转录和扩增. 角质细胞生长因子受体(keratinocyte growth factor receptor, KGFR)的PCR参数为: 95 ℃预变性5 min, 进入PCR循环: 95 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 1 min, 30个循环, 最后72 ℃延伸5 min. 2%琼脂糖凝胶电泳, 通过凝胶显像仪(SYNGENE G: BOX, 英国)成像. 以GAPDH作为内参照, 与目的产物进行比较, 对PCR产物相对定量. KGFR和GAPDH引物均由Takara公司设计, 上海生工合成. KGFR上游引物5'-CTCAAGCACTCGGGGATAAA-3'; 下游引物5'-CTGTTTTGGCAGGACAGTGA-3'; GAPDH上游引物5'-CCACCCATGGCAAATTCCCATGGCA-3'; 下游引物5'-TCTAGACGGCAGGTCAGGTCCACC-3'.
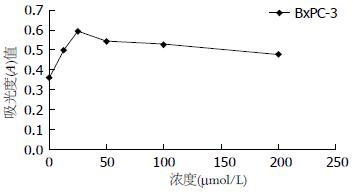
1.2.3 MTT实验: 胰腺癌细胞株(BxPC-3)以6-8×104/mL细胞数, 100 µL体系均匀加入96孔板中培养6-8 h. 待贴壁后加入不同浓度的KGF(浓度梯度见结果部分). 48 h后每孔加入10%MTT液(5 mg/mL)置37 ℃孵箱4 h. 弃去上清后加入100 µL DMSO, 摇床震荡20 min. 用酶标定量仪在试验波长570 nm, 参考波长为450 nm下测定吸光度(A)值. 细胞存活率 = (实验组A值-调零孔A值)/(对照组A值-调零孔A值)×100%.
1.2.4 细胞迁移及侵袭实验: 取对数生长期的胰腺癌细胞株加入24孔板中, 6-8 h贴壁后换液加入终浓度为100 µmol/L KGF培养基, 48 h后收集细胞, 调整适宜细胞密度接种于铺有基质胶(未铺入基质胶即为迁移实验)的Transwell小室的上室(24孔板), 其下室中加入含10%胎牛血清1640培养液置37 ℃、5%CO2湿化孵箱中培养24 h. 棉签擦净Transwell膜上室面细胞, 4%多聚甲醛固定30 min, 结晶紫染色25 min, 200倍光镜下计数膜上下左右中5个不同视野的穿过膜的细胞数, 取均值, 以迁移过的细胞数目来表示肿瘤细胞的侵袭及迁移能力, 实验重复3次.
统计学处理 采用SPSS19.0统计软件, 细胞增殖、凋亡、侵袭力差异比较均采用单因素方差分析. P<0.05为差异有统计学意义.
mRNA在6株胰腺癌细胞系中的表达水平 在6株胰腺癌细胞系中, KGF与KGFR mRNA的表达水平存在差异, 并且KGF蛋白在BxPC-3细胞株中的表达水平明显低于CaPan-2、BxPc-3、MIAPaca-2、ASPc-1、SW-1990和PANC-2细胞株, 而其受体mRNA的表达水平明显高于其他5组细胞株(图1).
筛选BxPc-3细胞研究KGF的促增殖作用. 与对照组相比(无血清培养基替代KGF), 实验组加入不同浓度梯度的KGF. 结果发现KGF能够显著增加BxPC-3细胞的增殖(P<0.01), 并且我们发现这种促增殖效果在KGF浓度为25 µmol/L时最为明显(图2).
选用BxPc-3细胞进行实验, 观察发现于对照组相比, 100 µmol/L KGF处理细胞后能够显著增加BxPC-3胰腺癌细胞株的迁移能力, 同样100 μmol/L KGF处理细胞也能增加肿瘤细胞的侵袭能力. 两项实验分别进行细胞计数并行统计学分析后发现, 迁移实验和侵袭实验中的实验组与对照组的细胞计数差异均具有统计学意义(P<0.01)(图3).
KGF首次由Rubin等[10]在1989年从人胚胎肺成纤维细胞的培养液中提纯得到, 是一种单链多肽, 分子量在26-28 kDa. 他是成纤维细胞生长因子(fibroblast growth factor, FGF)家族中的一员, 又被称作FGF-7, 并且与其他FGF家族成员具有30%-70%氨基酸序列同源性[11]. KGF表达于多种组织来源的间质细胞中, 如肺、乳腺、前列腺、胰腺和胃肠道等[12-15]. 在与其受体特异性结合后可促进上皮细胞DNA的合成、增殖和迁移, 并且与创伤修复及胚胎发育有关[16-20]. 不仅作为一个促有丝分裂原, 在不同的细胞中还能诱导其分化, 这个作用依据不同肿瘤的组织学类型. 如在动物试验中发现, KGF可诱导转基因小鼠乳腺上皮细胞的增生并最终发展成乳腺癌. 在进行体外培养时, 发现KGF可促进雌激素受体阳性乳腺癌细胞及前列腺癌细胞的增殖、运动和侵袭能力[17,21]. 此外还有研究表明KGF或KGF与其受体的协同表达与胰腺癌的不良预后以及转移有关[22].
本研究中, 首先通过Western印迹及PCR发现, KGF蛋白和KGFR mRNA的表达在6株胰腺癌细胞株存在差异. 为了排除肿瘤细胞内源性KGF分泌对实验的影响, 我们借此实验在6株胰腺癌细胞系中筛选出KGF蛋白低表达且其受体KGFR相对高表达的BxPC-3细胞株. 通过MTT实验发现, 不同浓度的KGF均可增加胰腺癌细胞BxPC-3)的增殖能力, 而这种促增殖效果并不随着浓度增加一直升高, 而是达到一定浓度后, 增殖效果达到峰值, 随后反而下降. 但是, 方差分析发现KGF处理组与对照组相比, 细胞数的差异具有统计学意义. 通过Transwell实验发现, KGF可以显著促进BxPC-3细胞的迁移及侵袭能力. 有趣的是, 在MTT实验中KGF促增殖效果在25 μmol/L时最为明显, 随着浓度的增高其促增殖效果反而下降, 而在进行Transwell实验中我们进一步发现, 其促进迁移及侵袭能力的效果在100 μmol/L时最为明显(迁移及侵袭能力与浓度的关系本研究中未予以体现). 国内外研究尚未见类似相关报道.
总之, KGF蛋白和KGFR mRNA的表达在胰腺癌细胞系中存在差异, 而对于KGF相对低表达, KGFR相对高表达的BxPC-3细胞株, KGF能够促进细胞增殖、迁移及侵袭. 本实验没有在6株胰腺癌细胞系之间进行比较, 处理因素的浓度与肿瘤细胞生物学行为的关系曲线也以待进一步完善. 目前研究发现, KGFR酪氨酸激酶抑制剂(一种高选择高效的KGFR抑制剂)可以抑制KGF介导的细胞运动并减少乳腺癌细胞中KGFR的表达[23]. 此外KGFR磷酸化抑制剂Ki23057已在胆道癌细胞中被证实可抑制其活性[24]. 因此我们认为, 针对KGF及其受体的靶向抑制剂可能对胰腺癌的发生发展有重要抑制作用, 但其具体机制以及是否能真正应用于抗肿瘤靶向治疗仍有待于更完善的体内及体外实验研究.
胰腺导管腺癌是一种常见的消化系恶性肿瘤, 近年来其发病率有增高的趋势. 而其手术切除率低, 术后复发率高, 对放化疗不敏感, 预后差. 至今没有有效的治疗手段及预后评价标准. 近年来, 随着肿瘤微环境与肿瘤发生发展关系的相关研究不断深入. 角质细胞生长因子(keratinocyte growth factor, KGF)在肿瘤中的作用也逐步受到重视.
郭俊明, 教授, 宁波大学医学院生物化学与分子生物学研究所; 汪思应, 教授, 安徽医科大学
KGF可以刺激不同类型肿瘤细胞的迁移和侵袭, 肿瘤间质分泌的KGF可能与肿瘤的恶性程度有关, 是肿瘤转移进展的重要分子. KGF mRNA及其受体在人乳腺癌细胞, 胰腺癌, 胃腺癌细胞以及前列腺癌细胞系中均有发现, 而在良性前列腺增生, 食管、胰腺和大肠癌组织中也有表达. KGF产生作用的确切机制仍然尚不十分明确.
胰腺导管腺癌(pancreatic ductal adenocarcinoma)是一种常见的恶性肿瘤, 其5年生存率低于5%. 不良预后与该病自身生物学行为特点有关, 以及早期诊断困难, 手术切除率低, 术后复发率高有关, 并且对化疗和放疗都不敏感. KGF是肿瘤转移进展的重要分子. 而且KGF及其受体在多种上皮组织来源的肿瘤细胞系中均有发现.
本文运用Western blot和PCR法检测6株胰腺癌细胞系中KGF蛋白的表达和其受体mRNA的表达水平. 并运用MTT、细胞迁移及侵袭实验检测KGF对胰腺癌细胞株(BxPC-3)增殖、迁移及侵袭的影响. 重点从细胞学水平探讨了KGF对胰腺癌细胞生物学功能的影响.
KGF能够促进肿瘤细胞的增殖, 并能够增加其迁移及侵袭能力. 因此针对KGF及其受体的靶向抑制剂可能对胰腺癌的发生发展有重要抑制作用. 提示其在作为抗肿瘤治疗的靶向位点上具有应用前景. 但尚需更完善的体内及体外实验研究进一步明确KGF的作用原理及调控方式.
本文探讨了KGF对胰腺癌细胞生物学功能的影响, 具有一定的意义.
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 2. | Nguyen TN, Zang XP, Pento JT. Keratinocyte growth factor stimulates the migration and proliferation of breast cancer cells in a culture wounding model. Pharmacol Res. 2002;46:179-183. [PubMed] [DOI] |
| 3. | Grose R, Dickson C. Fibroblast growth factor signaling in tumorigenesis. Cytokine Growth Factor Rev. 2005;16:179-186. [PubMed] [DOI] |
| 4. | Yamayoshi T, Nagayasu T, Matsumoto K, Abo T, Hishikawa Y, Koji T. Expression of keratinocyte growth factor/fibroblast growth factor-7 and its receptor in human lung cancer: correlation with tumour proliferative activity and patient prognosis. J Pathol. 2004;204:110-118. [PubMed] [DOI] |
| 5. | Hishikawa Y, Tamaru N, Ejima K, Hayashi T, Koji T. Expression of keratinocyte growth factor and its receptor in human breast cancer: its inhibitory role in the induction of apoptosis possibly through the overexpression of Bcl-2. Arch Histol Cytol. 2004;67:455-464. [PubMed] [DOI] |
| 6. | Ropiquet F, Huguenin S, Villette JM, Ronflé V, Le Brun G, Maitland NJ, Cussenot O, Fiet J, Berthon P. FGF7/KGF triggers cell transformation and invasion on immortalised human prostatic epithelial PNT1A cells. Int J Cancer. 1999;82:237-243. [PubMed] [DOI] |
| 7. | Cho K, Matsuda Y, Ueda J, Uchida E, Naito Z, Ishiwata T. Keratinocyte growth factor induces matrix metalloproteinase-9 expression and correlates with venous invasion in pancreatic cancer. Int J Oncol. 2012;40:1040-1048. [PubMed] [DOI] |
| 8. | Ishikawa A, Kudo M, Nakazawa N, Onda M, Ishiwata T, Takeshita T, Naito Z. Expression of keratinocyte growth factor and its receptor in human endometrial cancer in cooperation with steroid hormones. Int J Oncol. 2008;32:565-574. [PubMed] |
| 9. | Narita K, Fujii T, Ishiwata T, Yamamoto T, Kawamoto Y, Kawahara K, Nakazawa N, Naito Z. Keratinocyte growth factor induces vascular endothelial growth factor-A expression in colorectal cancer cells. Int J Oncol. 2009;34:355-360. [PubMed] [DOI] |
| 10. | Rubin JS, Osada H, Finch PW, Taylor WG, Rudikoff S, Aaronson SA. Purification and characterization of a newly identified growth factor specific for epithelial cells. Proc Natl Acad Sci U S A. 1989;86:802-806. [PubMed] |
| 11. | The fibroblast growth factor family. Nomenclature meeting report and recommendations. January 17, 1991. Ann N Y Acad Sci. 1991;638:xiii-xxvi. [PubMed] [DOI] |
| 12. | Rubin JS, Bottaro DP, Chedid M, Miki T, Ron D, Cunha GR, Finch PW. Keratinocyte growth factor as a cytokine that mediates mesenchymal-epithelial interaction. EXS. 1995;74:191-214. [PubMed] [DOI] |
| 13. | Lendvay TS, Sweet R, Han CH, Soygur T, Cheng JF, Plaire JC, Charleston JS, Charleston LB, Bagai S, Cochrane K. Compensatory paracrine mechanisms that define the urothelial response to injury in partial bladder outlet obstruction. Am J Physiol Renal Physiol. 2007;293:F1147-F1156. [PubMed] [DOI] |
| 14. | Pedchenko VK, Imagawa W. Pattern of expression of the KGF receptor and its ligands KGF and FGF-10 during postnatal mouse mammary gland development. Mol Reprod Dev. 2000;56:441-447. [PubMed] |
| 15. | Bates CM. Role of fibroblast growth factor receptor signaling in kidney development. Am J Physiol Renal Physiol. 2011;301:F245-F251. [PubMed] [DOI] |
| 16. | Mondrinos MJ, Koutzaki S, Lelkes PI, Finck CM. A tissue-engineered model of fetal distal lung tissue. Am J Physiol Lung Cell Mol Physiol. 2007;293:L639-L650. [PubMed] [DOI] |
| 17. | Gomperts BN, Belperio JA, Fishbein MC, Keane MP, Burdick MD, Strieter RM. Keratinocyte growth factor improves repair in the injured tracheal epithelium. Am J Respir Cell Mol Biol. 2007;37:48-56. [PubMed] [DOI] |
| 18. | Jenq RR, King CG, Volk C, Suh D, Smith OM, Rao UK, Yim NL, Holland AM, Lu SX, Zakrzewski JL. Keratinocyte growth factor enhances DNA plasmid tumor vaccine responses after murine allogeneic bone marrow transplantation. Blood. 2009;113:1574-1580. [PubMed] [DOI] |
| 19. | Werner S, Peters KG, Longaker MT, Fuller-Pace F, Banda MJ, Williams LT. Large induction of keratinocyte growth factor expression in the dermis during wound healing. Proc Natl Acad Sci U S A. 1992;89:6896-6900. [PubMed] |
| 20. | Braun S, Krampert M, Bodó E, Kümin A, Born-Berclaz C, Paus R, Werner S. Keratinocyte growth factor protects epidermis and hair follicles from cell death induced by UV irradiation, chemotherapeutic or cytotoxic agents. J Cell Sci. 2006;119:4841-4849. [PubMed] [DOI] |
| 21. | Chang HL, Sugimoto Y, Liu S, Wang LS, Huang YW, Ye W, Lin YC. Keratinocyte growth factor (KGF) regulates estrogen receptor-alpha (ER-alpha) expression and cell apoptosis via phosphatidylinositol 3-kinase (PI3K)/Akt pathway in human breast cancer cells. Anticancer Res. 2009;29:3195-3205. [PubMed] |
| 22. | Cho K, Ishiwata T, Uchida E, Nakazawa N, Korc M, Naito Z, Tajiri T. Enhanced expression of keratinocyte growth factor and its receptor correlates with venous invasion in pancreatic cancer. Am J Pathol. 2007;170:1964-1974. [PubMed] [DOI] |
| 23. | Mehta M, Kesinger JW, Zang XP, Lerner ML, Brackett DJ, Brueggemeier RW, Li PK, Pento JT. Influence of novel KGFR tyrosine kinase inhibitors on KGF-mediated proliferation of breast cancer. Anticancer Res. 2010;30:4883-4889. [PubMed] |
| 24. | Amano R, Yamada N, Doi Y, Yashiro M, Ohira M, Miwa A, Hirakawa K. Significance of keratinocyte growth factor receptor in the proliferation of biliary tract cancer. Anticancer Res. 2010;30:4115-4121. [PubMed] |