修回日期: 2013-05-30
接受日期: 2013-06-05
在线出版日期: 2013-07-18
目的: 评价选择性肝动脉栓塞术(transcatheter arterial embolization, TAE)治疗巨大肝血管瘤的长期临床疗效.
方法: 回顾性分析了2003-02/2010-06在我院进行选择性TAE治疗的46例肝血管瘤患者. 对栓塞前后病灶大小及并发症出现情况进行分析.
结果: 共治疗46个病灶, 瘤体最大径平均9.2 cm, 栓塞治疗成功率为100%. 随访3-106 mo, 瘤体从9.2 cm缩小到4.0 cm(P<0.05). 随访中, 8例病灶消失, 18例术前有临床症状者, 12例症状消失, 6例症状明显缓解. 术后27例出现栓塞后综合征, 无严重并发症.
结论: 选择性肝动脉栓塞治疗肝血管瘤技术上安全可行, 长期疗效确切可靠.
核心提示: 肝动脉栓塞术(transcatheter arterial embolization, TAE)治疗后并发症少, 5年内, 随着时间的增加, 瘤体呈不同程度、进行性的缩小, 充分说明TAE治疗肝血管瘤的长期疗效稳定、可靠.
引文著录: 范沙丽, 佟小强, 王健, 宋莉. 选择性肝动脉栓塞治疗巨大肝血管瘤46例. 世界华人消化杂志 2013; 21(20): 1925-1930
Revised: May 30, 2013
Accepted: June 5, 2013
Published online: July 18, 2013
AIM: To evaluate the long-term outcome of transarterial embolization (TAE) in patients with giant hepatic hemangiomas.
METHODS: This retrospective study included 46 patients with giant hepatic hemangiomas who were treated by TAE at our hospital from February 2003 to October 2010. Changes in tumor size between pre- and post-treatment were evaluated, and complications such as changes in liver function were analyzed as well.
RESULTS: The mean diameter of hemangiomas before TAE was 9.2 cm. All the patients were followed by ultrasound (US)/computed tomography (CT)/magnetic resonance imaging (MRI) for 3 to 106 mo. Follow-up radiological examinations revealed that the mean diameter of hemangiomas was 4.0 cm after treatment, and the reduction of tumor size was statistically significant (P < 0.05). Symptoms related to hemangiomas were relieved in all the patients. Minor complications were found in 27 cases (58.7%) after embolization, and no severe complication occurred.
CONCLUSION: TAE is safe and reliable in the treatment of giant hepatic hemangiomas in terms of long-term efficacy.
- Citation: Fan SL, Tong XQ, Wang J, Song L. Transarterial embolization for treatment of giant hepatic hemangiomas: An analysis of 46 cases. Shijie Huaren Xiaohua Zazhi 2013; 21(20): 1925-1930
- URL: https://www.wjgnet.com/1009-3079/full/v21/i20/1925.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i20.1925
肝血管瘤是最常见的肝脏良性肿瘤, 好发于30-50岁, 女性多见. 人群中发病率为3%-20%[1], 尸检发生率为0.4%-7.3%. 小的血管瘤多无临床症状, 巨大血管瘤(直径>4 cm)[1]可以引起腹痛、饱腹感、慢性恶心、呕吐、食欲不振、消化不良等常见症状, 少见的还包括胆汁淤积(或黄疸)、腹水、胆道出血和Kasabach-Merritt综合征等严重表现. 肝血管瘤的进行性增大可以导致瘤体的破裂出血, 死亡率高达60%-78%[2,3]. 所以巨大肝血管瘤需要临床干预.
目前, 非手术方法在肝血管瘤治疗中的应用越来越多, 最常用的有肝动脉栓塞术(transcatheter arterial embolization, TAE)及射频消融术(radiofrequency ablation, RFA). TAE具有创伤小、并发症少、疗效可靠等优点, 截至目前, 文献中大多是关于TAE治疗肝血管瘤短期疗效的报道, 对于长期疗效的分析较少. 本研究主要基于这一点进行回顾性分析, 总结如下.
选择2003-02/2010-06在我院进行TAE治疗的46例巨大肝血管瘤患者, 均进行术前常规检查. 入选标准: (1)病灶须经过增强计算机断层成像CT(computed tomography, CT)、增强核磁共振成像(magnetic resonance imaging, MRI)或血管造影(digital subtraction angiography, DSA)等3种检查中的至少一种诊断为肝血管瘤; (2)单发者血管瘤最大径>4 cm, 多发者最大瘤体>4 cm; (3)患者同意进行TAE治疗; (4)无恶性肿瘤证据. 排除标准: 血管瘤最大径≤4 cm; 依从性差或随访资料不全; 不能排除恶性肿瘤者.
1.2.1 治疗: TAE患者仰卧于手术台上, 右(或左)腹股沟区常规消毒、铺巾、局麻后, 采用Seldings技术穿刺右(或左)股动脉成功后, 插入5F导管至肝总动脉造影, 明确肿瘤供血动脉, 病灶区可见大小不等血窦染色, 动脉期呈"树上挂果征". 然后插入微导管, 超选择插管至肿瘤供血动脉, 造影剂证实后注入博来霉素及碘化油乳剂(博来霉素5-25 mg, 碘化油4-20 mL). 造影显示肿瘤内碘油沉积良好, 肿瘤染色消失, 结束手术. 拔管后局部加压包扎, 返回病房. 嘱右(或左)下肢制动24 h, 监测生命指征, 对症处理.
1.2.2 术后随访: 术后要求患者1-6 mo复查腹部增强CT, 如碘油沉积良好、瘤体缩小者则间隔半年或1年复查CT、MRI或B超; 疗效不明显者根据情况再次栓塞或选择其他治疗方法. 随访主要通过门诊、电话相结合的方式进行. 随访时间以患者首次接受栓塞治疗日期为起点至术后末次影像学检查时间. 由于患者均熟知肝血管瘤的良性特点, 在随访的时间及影像检查方法上存在一定的不均一性.
1.2.3 观察内容: 包括平均随访时间、栓塞前后血管瘤大小、进行何种影像学检查、临床症状、肝功能, 随访时间<36 mo(3年)、36-60 mo(3-5年)以及>60 mo(5年)者瘤体栓塞前后缩小程度以及栓塞后综合征发生情况. 临床症状缓解率为临床症状消失和症状改善病例数之和与术前总的有症状病例数之比.
统计学处理 运用SPSS13.0软件进行数据处理, 计量资料用mean±SD或者中位数(最大值, 最小值)表示; 同一患者治疗前后肿瘤大小比较采用自身配对t检验, 任意两组采用组间对比方差分析, 所有数据均为双侧检验, P<0.05为差异有统计学意义.
46例患者, 男:女=17:29, 年龄30-68岁, 平均46.6岁±8.2岁. 所有患者共治疗46个病灶, 单发27例(58.7%), 多发19例(41.3%), 多发者栓塞最大病灶. 瘤体最大径4.5-24.0 cm, 平均9.2 cm±3.5 cm, 具体分布如图1中所示. 其中23例无症状; 9例术前定期体检过程中瘤体不断增大; 18例有腹痛、腹胀、腹部不适、嗳气、腹部肿物等症状; 2例患者肝功轻度异常, 包括1例谷丙转氨酶升高, 1例谷丙转氨酶、谷草转氨酶均升高(表1).
| 年龄(岁) | 46.6±8.2(30-68) |
| 性别 | |
| 男 | 17 |
| 女 | 29 |
| 病灶特点(n) | |
| 单发 | 27 |
| 多发 | 19 |
| 病灶大小(cm) | 9.2±3.5(4.5-24.0) |
| 确诊方法n(%) | |
| CT | 43(93.5) |
| MRI | 2(4.3) |
| DSA | 1(2.2) |
43例患者经B超检查发现病灶, 另3例为CT检查时偶然发现. 所有患者中, 43例(93.5%)经腹部增强CT确诊, 2例(4.3%)经MRI确诊, 1例(2.2%)由DSA确诊.
46例术前造影动脉期均呈典型的"树上挂果征", 其中43例(93.5%)由肝动脉供血, 2例(4.3%)由肠系膜上动脉供血, 1例(2.2%)由胃十二指肠动脉供血. 1例术前CT检查为单发病灶, DSA造影发现新的小病灶.
共治疗46例患者中的46个病灶, 手术成功率为100%. 其中进行1次治疗37例(80.5%), 2次7例(15.2%), 3次2例(4.3%).
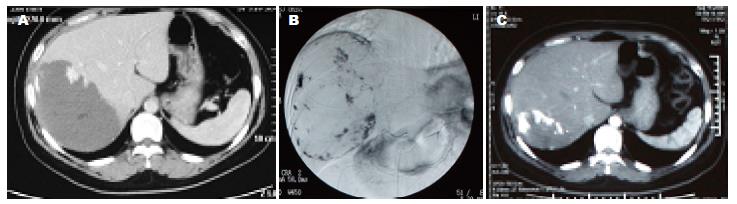
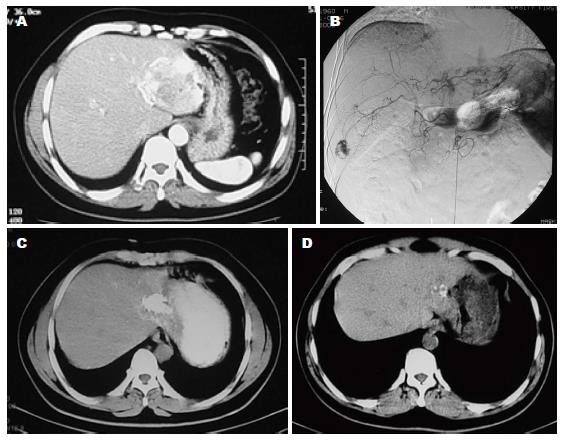
平均随访43.4 mo±24.8 mo(3-106 mo), 瘤体缩小了5.2 cm±2.8 cm(9.2 cm±3.5 cm vs 4.0 cm±3.4 cm), 采用配对t检验, 两者差异具有统计学意义(P<0.05). 其中19例随访时间<36 mo(3年), 瘤体缩小3.6 cm±2.6 cm(9.7 cm±4.5 cm vs 6.3 cm±3.8 cm, P<0.05); 14例随访36-60 mo(3-5年), 瘤体缩小6.1 cm±2.9 cm(8.7 cm±2.9 cm vs 2.6 cm±1.9 cm, P<0.05); 13例随访时间>60 mo(5年), 瘤体缩小6.3 cm±2.0 cm(8.9 cm±2.2 cm vs 2.6 cm±2.6 cm, P<0.05)(表2). 3组数据术前瘤体大小无明显差异, 术后随访时间<3年组与其他两组之间均P<0.05, 有统计学意义; 随访3-5年组与随访时间>5年组之间P>0.05, 无统计学意义. 随访过程中影像学检查包括14例采用CT, 1例MRI, 31例B超. 治疗的46个病灶中, 有8例(17.4%)随访过程中病灶消失(图1, 2), 1例患者术前术后瘤体大小无明显变化, 另1例患者经过2次栓塞治疗, 原病灶明显缩小(从10 cm缩小到2.3 cm), 术后第4年随访过程中出现一直径2.8 cm的新发血管瘤. 术前18例(18/46)有临床症状者, 随访过程中12例(66.7%)症状消失, 余6例(33.3%)症状明显改善, 故临床症状缓解率为100%. 随访中45例(97.8%)肝功正常, 1例(2.2%)胆红素轻度升高; 术前2例轻度肝功能异常者, 术后1 wk内复查均恢复正常.
| 随访时间(mo) | n | 血管瘤大小(cm) | P值 | ||
| 术前 | 术后 | 缩小 | |||
| <36(3年) | 19 | 9.7±4.5 | 6.3±3.8 | 3.6±2.6 | <0.05 |
| 36-60(3-5年) | 14 | 8.7±2.9 | 2.6±1.9 | 6.1±2.9 | <0.05 |
| >60(5年) | 13 | 8.9±2.2 | 2.6±2.6 | 6.3±2.0 | <0.05 |
46例患者中, 27例(58.7%)出现栓塞后综合征(post-embolization syndrome, PES). 20例(43.5%)术后3 d内肝功轻度异常, 其中谷丙转氨酶增高19例(41.3%), 谷草转氨酶增高13例(28.3%), 治疗后1 wk内多数恢复正常. 17例有临床症状, 包括腹痛、腹胀、腹部不适13例(28.3%), 恶心6例(13.0%), 呕吐3例(6.5%), 纳差2例(4.3%), 发热1例(2.2%), 皮肤红斑1例(2.2%), 以上症状均经保守或对症治疗后恢复正常. 所有病例均未出现肝功能严重损害、胆道损伤及异位栓塞等严重并发症(表3).
| 类型 | n | 所占百分比(%) |
| 腹痛、腹胀、腹部不适 | 13 | 28.3 |
| 恶心 | 6 | 13.0 |
| 呕吐 | 3 | 6.5 |
| 纳差 | 2 | 4.3 |
| 发热 | 1 | 2.2 |
| 皮肤红斑 | 1 | 2.2 |
| 一过性肝功异常 | 20 | 43.5 |
肝血管瘤分为海绵状血管瘤、毛细血管性血管瘤和混合性血管瘤, 成人最常见的是海绵状血管瘤. 迄今为止, 有文献报道[4]的成人肝毛细血管性血管瘤仅有7例, 所以通常所说的肝血管瘤是指成人的海绵状血管瘤, 系肝脏血窦于胚胎阶段的发育障碍所致. 文献报道中血管瘤最大径可达46 cm[5]. 肝血管瘤的血供均来自肝动脉[6], 这为TAE治疗肝血管瘤提供了理论依据.
目前, 关于巨大肝血管瘤的治疗标准仍存在争议. Erdogan等[7]认为肝血管瘤的治疗主要依据瘤体的大小和其引起的临床症状; Terkivatan等[8]则认为巨大肝血管瘤进行保守治疗是安全的, 只有当出现持续且严重的临床症状时才进行手术治疗, 因此, 瘤体的大小不能作为治疗的指征. 但是肝血管瘤越大, 其破裂出血的危险性就越高, 而肝血管瘤破裂出血患者的死亡率又极高, 所以, 通常把肝血管瘤的大小依然作为治疗的标准之一. 文献中对于自发破裂的巨大肝血管瘤[9-11]及>30 cm的巨大血管瘤[12-14]多采用肝动脉栓塞术联合手术切除进行治疗, 首先行栓塞术控制出血或减少血流然后进行手术切除.
迄今为止, 外科手术切除仍然是最常用、最有效的治疗手段[15,16], 包括局部肝切除、肿瘤核除及腔镜下肝切除术治疗3种. 研究表明血管瘤的大小与术中出血量、输血量及手术时间成正相关[17]. 近年来, 腹腔镜下肝切除术治疗肝血管瘤的数量不断增多, 具有创伤小、并发症少及恢复快等微创特点[18,19], 但腹腔镜肝切除术仍是一种高风险的手术, 必须严格控制手术适应证[18].
RFA治疗肝血管瘤具有创伤小、安全、有效等优点[20,21], 但是受到血管瘤位置和大小的制约, 而且RFA术后部分患者可以出现皮肤烧灼伤等并发症. 近年来, 随着超声技术的发展, 在超声引导下穿刺肝血管瘤注入硬化剂在临床取得较好的效果, 但是目前多是国内文献的报道[22], 有待进一步的研究.
TAE治疗肝血管瘤的疗效及安全性已得到肯定[23], 但是关于其长期疗效国内外文献中报道的却很少, 病例数也较少. 本研究中46例患者平均随访43.4 mo, 瘤体从9.2 cm缩小到4.0 cm(P<0.05), 临床症状缓解率达到100%; 其中8例患者病灶完全消失(1例瘤体13 cm经2次栓塞, 2例瘤体分别为9.5和10 cm各经1次栓塞), 说明TAE治疗肝血管瘤疗效显著, 与文献报道中[24-28]结果相一致. 根据随访时间的不同, 本数据分为3组, 即随访时间<36 mo(3年)、36-60 mo(3-5年)以及>60 mo(5年), 3组数据术前瘤体大小无明显差异, 术后随访时间<3年组与其他两组之间均P<0.05, 有统计学意义; 随访3-5年组与随访时间>5年组之间P>0.05, 无统计学意义, 说明栓塞治疗前后瘤体的缩小程度与栓塞后时间的增加不是线性相关, 且栓塞治疗后5年内, 随着时间的增加, 瘤体呈不同程度、进行性的缩小, 但是5年以后, 瘤体缩小程度明显减慢, 且瘤体大小与治疗后3-5年内大小基本无明显变化. 近期国内的一项研究[26]表明, 栓塞治疗后, 随着时间的增加, 瘤体呈不同程度、进行性的缩小, 本研究结果与此结果不相一致, 但是两者的样本量都偏小, 有待大样本研究来进一步证实. 总的来说, TAE治疗肝血管瘤的长期疗效稳定、可靠. 本研究中在随访期间仅有1例患者出现了新发血管瘤, 因瘤体较小且无症状, 所以采取保守治疗, 定期复查.
TAE术后并发症主要表现为栓塞后综合征(发热、腹痛、恶心、呕吐)、一过性肝功能轻度异常, 本研究中27例患者出现了轻微并发症, 经保守或对症支持治疗后均恢复正常. 46例患者均未出现严重并发症, 现有文献中关于栓塞后严重并发症的报道较少, 仅有10例出现肝内外胆管的损伤[29,30], 说明TAE治疗肝血管瘤的安全性较高.
总之, 本研究结果表明经导管肝动脉栓塞治疗肝血管瘤创伤小, 并发症少, 长期疗效显著.
食管鳞癌(esophageal squamous cell carcinoma, ESCC)发病率高, 5年生存率低, 加强其发病机制的研究有助于指导诊断和治疗. miRNAs参与调控细胞各项生物学功能, 在多种肿瘤的发生发展中具有重要的意义.
唐世刚, 教授, 湖南省人民医院
微小RNA-130b(miR-130b)是新近发现的一种miRNA, 已有相关研究报道在子宫内膜癌、肝癌、胃癌等恶性肿瘤中表达上调, 目前尚未有miR-130b在ESCC中的表达及功能的相关研究报道.
Li等研究发现miR-130b在子宫内膜不典型增生组织中表达上调, 在子宫内膜癌组织中上调更明显; 体内外实验证实miR-130b可靶向作用于人类DICER基因(DICER1)促进子宫内膜癌的侵袭.
本研究采用miRNA芯片分析技术筛选出ESCC组织中异常表达的miRNAs, 选取miR-130b进一步研究, 通过上调和下调ESCC细胞中miR-130b的表达探讨其对细胞增殖和侵袭的影响及可能的作用机制.
本实验为ESCC发病机制研究提供了新靶点, 为miR-130b用于ESCC的靶向治疗提供了初步的理论依据.
本研究总体设计合理, 方法可靠, 结论可信, 有一定的实际指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Schnelldorfer T, Ware AL, Smoot R, Schleck CD, Harmsen WS, Nagorney DM. Management of giant hemangioma of the liver: resection versus observation. J Am Coll Surg. 2010;211:724-730. [PubMed] [DOI] |
| 2. | Gilon D, Slater PE, Benbassat J. Can decision analysis help in the management of giant hemangioma of the liver? J Clin Gastroenterol. 1991;13:255-258. [PubMed] [DOI] |
| 3. | Griffa B, Basilico V, Bellotti R, Griffa A, Senatore S, Capriata G. [Spontaneous rupture of giant subcapsular hemangioma of the liver with hemoperitoneum and hemorrhagic shock: a case report]. Chir Ital. 2005;57:389-392. [PubMed] |
| 4. | Jhuang JY, Lin LW, Hsieh MS. Adult capillary hemangioma of the liver: case report and literature review. Kaohsiung J Med Sci. 2011;27:344-347. [PubMed] [DOI] |
| 5. | Giuliante F, Ardito F, Vellone M, Giordano M, Ranucci G, Piccoli M, Giovannini I, Chiarla C, Nuzzo G. Reappraisal of surgical indications and approach for liver hemangioma: single-center experience on 74 patients. Am J Surg. 2011;201:741-748. [PubMed] [DOI] |
| 6. | Herman P, Costa ML, Machado MA, Pugliese V, D'Albuquerque LA, Machado MC, Gama-Rodrigues JJ, Saad WA. Management of hepatic hemangiomas: a 14-year experience. J Gastrointest Surg. 2005;9:853-859. [PubMed] [DOI] |
| 7. | Erdogan D, Busch OR, van Delden OM, Bennink RJ, ten Kate FJ, Gouma DJ, van Gulik TM. Management of liver hemangiomas according to size and symptoms. J Gastroenterol Hepatol. 2007;22:1953-1958. [PubMed] [DOI] |
| 8. | Terkivatan T, Vrijland WW, Den Hoed PT, De Man RA, Hussain SM, Tilanus HW, IJzermans JN. Size of lesion is not a criterion for resection during management of giant liver haemangioma. Br J Surg. 2002;89:1240-1244. [PubMed] [DOI] |
| 9. | Jain V, Ramachandran V, Garg R, Pal S, Gamanagatti SR, Srivastava DN. Spontaneous rupture of a giant hepatic hemangioma - sequential management with transcatheter arterial embolization and resection. Saudi J Gastroenterol. 2010;16:116-119. [PubMed] [DOI] |
| 10. | Lupinacci RM, Szejnfeld D, Farah JF. Spontaneous rupture of a giant hepatic hemangioma. Sequential treatment with preoperative transcatheter arterial embolization and conservative hepatectomy. G Chir. 2011;32:469-472. [PubMed] |
| 11. | Vassiou K, Rountas H, Liakou P, Arvanitis D, Fezoulidis I, Tepetes K. Embolization of a giant hepatic hemangioma prior to urgent liver resection. Case report and review of the literature. Cardiovasc Intervent Radiol. 2007;30:800-802. [PubMed] [DOI] |
| 12. | Akamatsu N, Sugawara Y, Komagome M, Ishida T, Shin N, Cho N, Ozawa F, Hashimoto D. Giant liver hemangioma resected by trisectorectomy after efficient volume reduction by transcatheter arterial embolization: a case report. J Med Case Rep. 2010;4:283. [PubMed] [DOI] |
| 13. | Seo HI, Jo HJ, Sim MS, Kim S. Right trisegmentectomy with thoracoabdominal approach after transarterial embolization for giant hepatic hemangioma. World J Gastroenterol. 2009;15:3437-3439. [PubMed] [DOI] |
| 14. | Zhou JX, Huang JW, Wu H, Zeng Y. Successful liver resection in a giant hemangioma with intestinal obstruction after embolization. World J Gastroenterol. 2013;19:2974-2978. [PubMed] |
| 15. | Hoekstra LT, Bieze M, Erdogan D, Roelofs JJ, Beuers UH, van Gulik TM. Management of giant liver hemangiomas: an update. Expert Rev Gastroenterol Hepatol. 2013;7:263-268. [PubMed] [DOI] |
| 16. | Gedaly R, Pomposelli JJ, Pomfret EA, Lewis WD, Jenkins RL. Cavernous hemangioma of the liver: anatomic resection vs. enucleation. Arch Surg. 1999;134:407-411. [PubMed] [DOI] |
| 17. | Hanazaki K, Kajikawa S, Matsushita A, Monma T, Hiraguri M, Koide N, Nimura Y, Adachi W, Amano J. Giant cavernous hemangioma of the liver: is tumor size a risk factor for hepatectomy? J Hepatobiliary Pancreat Surg. 1999;6:410-413. [PubMed] [DOI] |
| 18. | 原 春辉, 修 典荣, 蒋 斌, 马 朝来, 李 磊, 李 智飞, 贾 易木, 熊 京伟, 张 同琳. 腹腔镜肝切除术在治疗肝血管瘤中的价值. 中国微创外科杂志. 2012;12:1072-1074. |
| 19. | 李 明浩, 王 克华, 刘 东涛, 张 涛, 刘 晶, 牛 占学. 腹腔镜肝切除术临床分析13例. 中国腔镜外科杂志(电子版). 2012;5:200-204. |
| 20. | Park SY, Tak WY, Jung MK, Jeon SW, Cho CM, Kweon YO, Kim KC. Symptomatic-enlarging hepatic hemangiomas are effectively treated by percutaneous ultrasonography-guided radiofrequency ablation. J Hepatol. 2011;54:559-565. [PubMed] [DOI] |
| 21. | Hinshaw JL, Laeseke PJ, Weber SM, Lee FT. Multiple-electrode radiofrequency ablation of symptomatic hepatic cavernous hemangioma. AJR Am J Roentgenol. 2007;189:W146-W149. [PubMed] [DOI] |
| 22. | 梁 荷英, 付 伟娟, 郭 孝伟, 王 艺海, 寇 育红, 褚 雯, 马 丽. 超声介入硬化治疗大块型、巨块型肝血管瘤的远期疗效. 中国介入影像与治疗学. 2006;3:52-54. |
| 23. | Giavroglou C, Economou H, Ioannidis I. Arterial embolization of giant hepatic hemangiomas. Cardiovasc Intervent Radiol. 2003;26:92-96. [PubMed] [DOI] |
| 24. | Zeng Q, Li Y, Chen Y, Ouyang Y, He X, Zhang H. Gigantic cavernous hemangioma of the liver treated by intra-arterial embolization with pingyangmycin-lipiodol emulsion: a multi-center study. Cardiovasc Intervent Radiol. 2004;27:481-485. [PubMed] [DOI] |
| 25. | 孔 鹏, 鹿 化伟, 王 家平, 闫 东, 李 迎春, 孙 敏, 谭 晶, 童 玉云, 滕 云山. 平阳霉素碘油乳剂超选择硬化性栓塞治疗肝血管瘤. 介入放射学杂志. 2011;20:123-126. |
| 27. | 田 锦林, 杜 亚辉, 罗 军, 李 春雷, 张 林医. 肝血管瘤栓塞治疗后肝功能及瘤体大小变化. 中国介入影像与治疗学. 2010;7:273-277. |
| 29. | Huang XQ, Huang ZQ, Duan WD, Zhou NX, Feng YQ. Severe biliary complications after hepatic artery embolization. World J Gastroenterol. 2002;8:119-123. [PubMed] |
| 30. | Huang X, Huang Z, Duan W, Zhou N, Feng Y. [Damage to intra- and extrahepatic bile duct after hepatic artery embolization]. Zhonghua Waike Zazhi. 2000;38:169-172, 179. [PubMed] |