修回日期: 2012-12-26
接受日期: 2013-01-05
在线出版日期: 2013-01-18
目的: 观察融合蛋白胞质转导肽(cytoplasmic transduction peptide, CTP)-HBcAg18-27-Tapasin体外诱导HBV转基因小鼠髓源性树突状细胞(dendritic cell, DC)成熟和对T淋巴细胞增殖的作用.
方法: 体外分离、培养HBV转基因小鼠及近交系C57BL/6小鼠髓源性DC, 加入重组粒细胞-巨噬细胞集落刺激因子和白介素(interleukin, IL)-4培养5 d, 再加入实验组10 μg/mL CTP-HBcAg18-27-Tapasin、对照组10 μg/mL CTP-HBcAg18-27、10 μg/mL HBcAg18-27-Tapasin及空白组RPMI 1640完全培养液. 流式细胞术测定DC表面分子CD80、CD83、MHC-1的表达, ELISA法测定DC培养上清液中的IL-12p70的水平, 细胞计数试剂盒(CCK-8)检测T淋巴细胞增殖反应, 流式细胞仪检测增殖的T淋巴细胞内的细胞因子.
结果: 体外成功诱导小鼠髓源性DC; CTP-HBcAg18-27-Tapasin能明显上调DC表面分子CD80、CD83、MHC-1的表达; 并且CTP-HBcAg18-27-Tapasin组诱导DC分泌的IL-12p70水平及诱导DC增殖T淋巴细胞增殖能力明显高于对照组及空白组[IL-12p70转基因小鼠(F = 205.85, P = 0.000); C57BL/6小鼠(F = 406.20, P = 0.000)]; 流式细胞仪检测实验组融合蛋白诱导的CTL水平也高于对照组[转基因小鼠(F = 155.45, P = 0.000); C57BL/6小鼠(F = 392.90, P = 0.000)], 同时HBV转基因小鼠DC表面分子及在T淋巴细胞增殖中的作用要比C57BL/6小鼠低.
结论: 分子伴侣Tapasin修饰胞内化抗原肽能促进HBV转基因小鼠髓源性DC的分化、成熟, 并能增强DC刺激T淋巴细胞增殖能力及诱导CTL的产生.
引文著录: 唐余燕, 余永胜, 卓萌, 臧国庆, 汤正好, 陈小华. 胞质转导肽-HBcAg18-27-Tapasin体外诱导HBV转基因小鼠髓源性树突状细胞成熟及在T淋巴细胞增殖中的作用. 世界华人消化杂志 2013; 21(2): 122-129
Revised: December 26, 2012
Accepted: January 5, 2013
Published online: January 18, 2013
AIM: To investigate the effects of cytoplasmic transduction peptide (CTP)-HBcAg18-27-Tapasin on the maturation of HBV transgenic mouse bone marrow-derived dendritic cells (DCs) and proliferation of T lymphocytes in vitro.
METHODS: DCs derived from bone marrow of HBV transgenic mice or C57BL/6 mice were cultured with recombinant granulocyte-macrophage colony-stimulating factor and recombinant interleukin-4 for 5 d. The fusion proteins CTP-HBcAg18-27-Tapasin (10 μg/mL), CTP-HBcAg18-27 (10 μg/mL), HBcAg18-27-Tapasin (10 μg/mL) or PRMI 1640 were then added into culture medium to induce DC maturation. DC phenotypes were analyzed by flow cytometry. The level of IL-12p70 in supernatants was detected by enzyme-linked immunosorbent assay. The proliferation of T lymphocytes was assessed using cell counting kit-8, and intracellular cytokines in proliferative T cells were analyzed by flow cytometry.
RESULTS: DCs were cultured and identified successfully. DC surface molecules, such as CD80, CD83 and major histocompatibility antigen-I, were up-regulated by treatment with CTP-HBcAg18-27-Tapasin. IL-12p70 level in cells treated with CTP-HBcAg18-27-Tapasin was higher than those in cells treated with CTP-HBcAg18-27, HBcAg18-27-Tapasin or medium. Treatment with CTP-HBcAg18-27-Tapasin not only significantly induced T lymphocyte proliferation, but also significantly increased the percentages of IFN-γ+CD8+ T cells compared to treatment with CTP-HBcAg18-27, HBcAg18-27-Tapasin or medium. However, the effects of CTP-HBcAg18-27-Tapasin on DC maturation and T lymphocyte proliferation were more significant when DCs and T lymphocyte were derived from C57BL/6 mice.
CONCLUSION: Molecular chaperone tapasin-modified intracellular antigen peptide could effectively promote the differentiation and maturation of dendritic cells derived from bone marrow cells of HBV transgenic mice and enhance the ability of DCs to stimulate T lymphocyte proliferation and induce cytotoxic T lymphocytes.
- Citation: Tang YY, Yu YS, Zhuo M, Zang GQ, Tang ZH, Chen XH. Cytoplasmic transduction peptide-HBcAg18-27-Tapasin induces HBV transgenic mouse bone marrow-derived dendritic cell maturation and T lymphocyte proliferation in vitro. Shijie Huaren Xiaohua Zazhi 2013; 21(2): 122-129
- URL: https://www.wjgnet.com/1009-3079/full/v21/i2/122.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i2.122
乙型肝炎病毒(hepatitis B virus)感染的控制、转归及病毒清除, 主要取决于宿主的免疫状态, HBcAg18-27是具有免疫优势的人类白细胞抗原(HLA)-A2限制性特异性CTL表位肽, 在HBV感染中能诱发较强的CTL反应[1-3]. 分子伴侣Tapasin是抗原提呈相关运载体蛋白(transporter associated with antigen processing, TAP)的基因产物, 与人类主要组织相容性复合体(major histocompatibility complex, MHC)-Ⅰ类分子同为免疫球蛋白超家族成员, Tapasin在形成抗原肽MHC/多肽复合物中有重要作用[4,5]. 胞质转导肽(cytoplasmic transduction peptide, CTP)能够有效穿透细胞膜, 高效携带外源性抗原进入细胞内部, 实现细胞亚定位[6-9]. 树突状细胞作为专职抗原递呈细胞是目前发现的激活初始T细胞功能最强的抗原提呈细胞(antigen presenting cell, APC). 研究表明机体对HBV的耐受状态并不是因为淋巴细胞功能缺陷, 而是由于抗原提呈细胞功能缺陷, 特别是DCs功能缺陷引起[10,11]. 本研究利用CTP-HBcAg18-27-Tapasin融合蛋白对体外培养HBV转基因小鼠及C57BL/6小鼠髓源性DCs及其在T淋巴细胞增值功能的影响进行观察, 探讨分子伴侣Tapasin在诱导免疫激活中的作用.
C57BL/6-HBV♀SPF级转基因小鼠, 周龄6-8 wk, 体质量22-26 g, 由中国人民解放军第458医院全军传染病中心提供, ♀SPF级C57BL/6健康小鼠, 6-8周龄, 22-26 g, 由上海生命科学研究院斯莱克实验动物有限公司提供, 在本院动物实验中心清洁级25 ℃-27 ℃条件下饲养. 融合蛋白CTP-HBcAg18-2-Tapasin、CTP-HBcAg18-27及HBcAg18-27-Tapasin由本课题组构建并保存[12]. 异硫氰酸荧光素(FITC)标志的小鼠单克隆抗体干扰素-γ(interferon-γ, IFN-γ)及藻红蛋白(PE)标志的小鼠单克隆抗体CD8α、CD11c、CD80、CD83及MHC-1均购自eBioscience公司; 重组粒细胞-巨噬细胞集落刺激因子与白介素(interleukin, IL)-4均购自PeproTech公司; IL-12p70 ELISA检测试剂盒为R&D公司产品; 佛波酯、莫能霉素、离子霉素及丝裂霉素C购自Sigma公司; 细胞固定剂和破膜剂购自Invitrogen公司; T细胞尼龙毛柱(Wako公司); 小鼠淋巴细胞分离液(北京康贝源科技有限公司); CCK-8试剂盒(日本同仁化学研究所).
1.2.1 髓源性DC的分离和培养: 小鼠拉颈处死后浸入750 mL/L乙醇中5 min左右, 无菌条件下取出股骨及胫骨, PBS反复冲洗骨髓直至发白, 收集细胞悬液低速离心, 弃上清液收集骨髓细胞; RPMI 1640培养液重悬, 细胞计数, 调整细胞密度为1×109/mL, 加至6孔板中, 4 h后去除未贴壁细胞, 加含10%胎牛血清的RPMI 1640培养液, 并加入rmGM-CSF和rmIL-4, 终浓度分别为20 ng /mL和10 ng /mL; 在37 ℃、50 mL/L CO2培养箱中培养. 隔天半量换液, 并补充细胞因子rmGM-CSF和rmIL-4至原浓度. 倒置显微镜下观察细胞形态和数量变化.
1.2.2 DC的诱导及分组: 本实验分4组: (1)实验组CTP-HBcAg18-27-Tapasin; (2)对照组CTP-HBcAg18-27; (3)对照组HBcAg18-27-Tapasin; (4)空白组为RPMI 1640培养基. 分别向培养至第5天的DC中加入10 μg/mL融合蛋白和RPMI 1640培养液, 同时加入20 ng/mL rmGM-CSF和10 ng/mL rmIL-4, 37 ℃、50 mL/L CO2培养箱中培养72 h后, 强力吹打收集DC及培养上清液, -80 ℃保存上清液以备检测.
1.2.3 DC表面分子检测: 收集培养到第8天的细胞, 每个标本细胞数约为1×106/mL, 用PBS洗涤两次, 弃上清; 分别加PE标志的CD80、CD83、CD86及MHC-Ⅰ, 并设置同型对照管, 4 ℃避光作用30 min; PBS洗涤后标本用1%多聚甲醛固定30 min, 流式细胞仪检测.
1.2.4 IL-12p70水平检测: 采用酶联免疫吸附法(ELISA)检测, 将标准品和样本各50 μL依次加入孔中, 每孔分别加入50 μL酶联亲和物, 37 ℃温育60 min后弃孔内液体, 用稀释的洗涤液反复冲洗5次后加入显色液, 室温下避光反应15 min, 每孔加入终止液50 μL酶标仪在450 nm测定吸光度(A)值. 通过标准曲线计算出IL-12p70水平.
1.2.5 脾淋巴细胞的制备: 处死C57BL/6小鼠, 无菌条件下取出小鼠脾脏, 在200目筛网中边用注射器活塞轻轻研磨, 边用PBS冲洗, 使脾细胞透过筛网到培养皿中得到脾细胞悬液, 将细胞悬液慢慢加到预先预热的淋巴细胞分裂液上层离心, 吸取淋巴细胞层, 再用PBS冲洗两遍, RPIM 1640培养液重悬得到混合淋巴细胞悬液.
1.2.6 T淋巴细胞的制备: 用20 mL培养液平衡T淋巴细胞尼龙毛柱, 再加入15 mL含血清的培养基, 随后关闭弹簧夹; 加入上述制备的混合淋巴细胞悬液, 打开弹簧夹, 再加入1 mL培养基, 关闭弹簧夹; 覆盖锡箔纸, 37 ℃、50 mL/L CO2培养箱孵育45-60 min; 用950 mL/L乙醇消毒并打开弹簧夹, 加入20 mL含血清的培养基, 收集细胞悬液约1个柱子的体积.
1.2.7 T淋巴细胞增殖反应: 培养至第8天的DC密度调整至1×106/mL, 加入丝裂霉素, 37 ℃水浴30 min作为刺激细胞, T淋巴细胞密度调整至1×106/mL作为效应细胞, 按效应细胞和刺激细胞分别为5:1、10:1、20:1, 每孔加入5×105效应细胞, 每组设3复孔, 37 ℃、50 mL/L CO2培养箱孵育72 h, 每孔加CCK-8试剂10 μL, 4 h后酶标仪450 nm波长条件下检测A值.
1.2.8 T细胞内细胞因子检测: 采用流式细胞仪检测, 将分离得到的T淋巴细胞以RPMI 1640调整至1×106/mL, 25 μg/mL佛波酯、1 μg/mL离子霉素和1.7 μg/mL莫能霉素加入培养液中37 ℃、50 mL/L CO2孵育6 h; PBS洗涤2次后收集细胞, 加入PE-CD8a抗体避光孵育15 min; PBS洗涤2次, 100 μL固定剂作用15 min, PBS洗涤后加入100 μL破膜剂作用5 min, 直接加FITC-IFN-γ抗体, 室温避光孵育30 min; PBS洗涤2次后用500 μLPBS重悬, 流式细胞仪对细胞荧光强度进行检测分析.
统计学处理 采用SPSS16.0软件进行分析, 数据以mean±SD表示, 多个样本均数间的比较采用单因素方差分析(one-way ANOVA), 组间两两比较采用LSD法, P<0.05为差异有统计学意义.
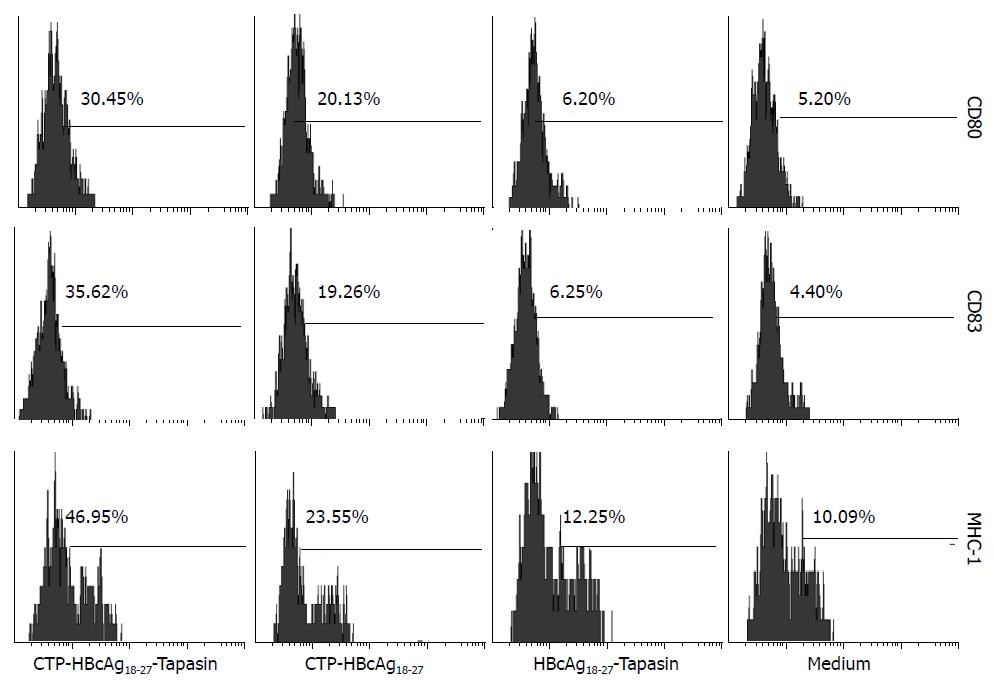
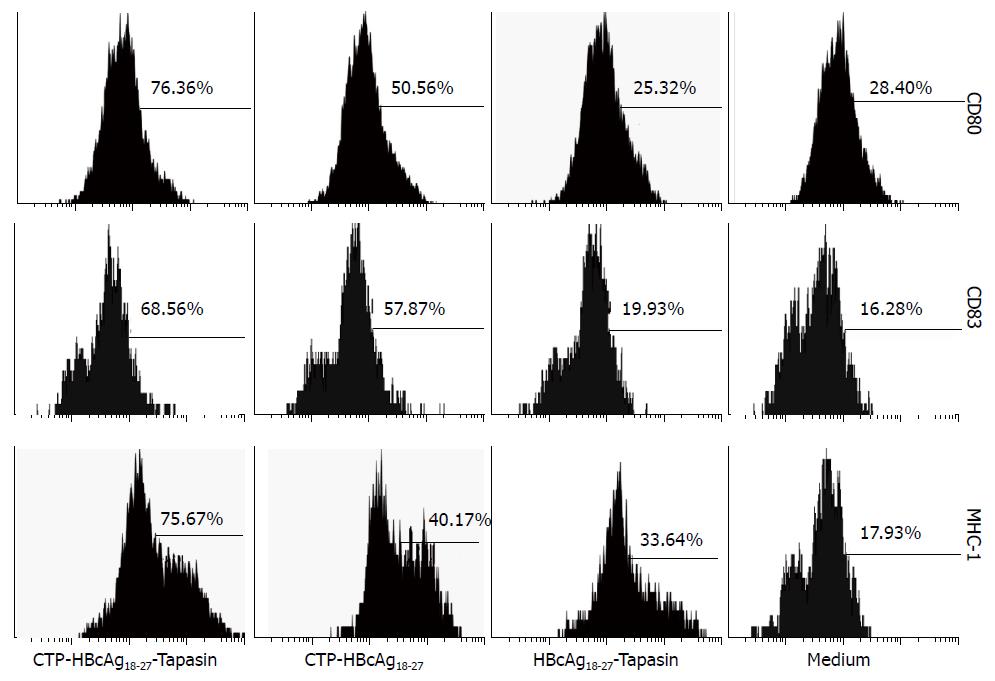
为了解融合蛋白诱导DC后对其表面分子的影响, 采用流式细胞仪分析, 流行细胞仪显示收集的DC表面分子CD11c为70%-80%, HBV转基因小鼠及C57BL/6小鼠, 融合蛋白CTP-HBcAg18-27-Tapasin诱导表面分子CD80、CD83及MHC-1明显高于对照组及空白组(转基因小鼠F = 1777.00、F = 657.50及F = 281.53, 均P<0.05; C57BL/6小鼠F = 70.07、F = 128.15及F= 1052.00, 均P<0.05) (图1, 2, 表1, 2).
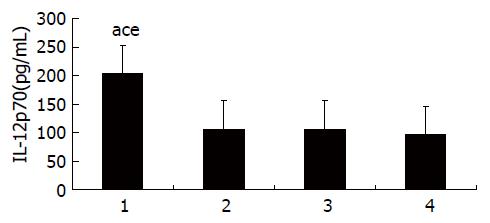
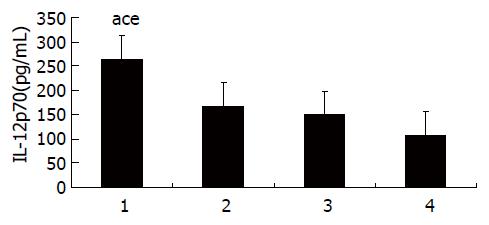
了解DC成熟程度还需了解其分泌IL-12p70水平, 采用ELISA法测定, HBV转基因小鼠及C57BL/6小鼠, 实验组CTP-HBcAg18-27-Tapasin培养上清液IL-12p70水平都明显高于对照组及空白组[转基因小鼠(F = 205.85, P = 0.000); C57BL/6小鼠(F = 406.20, P = 0.000)](图3, 4, 表3).
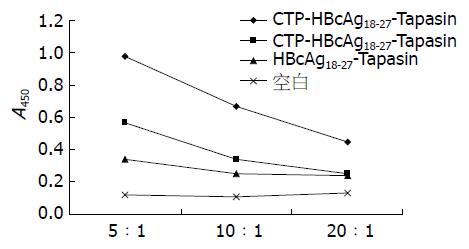
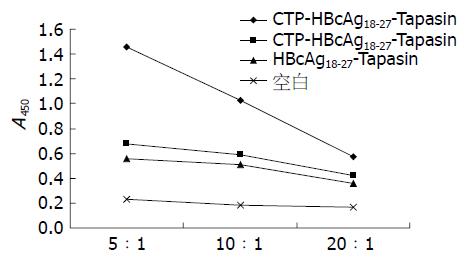
在不同效应细胞与刺激细胞比例下, C57BL/6小鼠和HBV转基因小鼠, 实验组CTP-HBcAg18-27-Tapasin对同种系小鼠T淋巴细胞增殖作用最强(转基因小鼠F = 29.96、F = 90.25及F = 103.07, 均P<0.05; C57BL/6小鼠F = 11.4、F = 10.87及F = 15.74, 均P<0.05), 且效应细胞与刺激细胞在5:1时增殖作用最强, 分别高于对照组CTP-HBcAg18-27、HBcAg18-27-Tapasin及空白组(均P<0.05)(图5, 6).
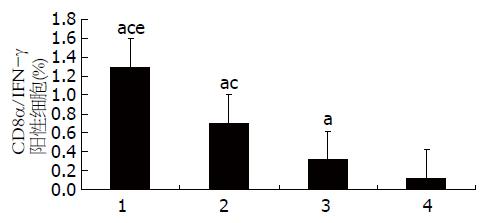
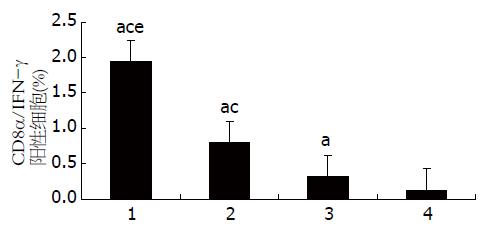
为了观察C57BL/6正常小鼠及HBV转基因小鼠的不同组蛋白致敏DC后对CD8α/IFN-γ双阳性细胞比例的影响, 采用流式细胞仪对细胞进行CD8α和IFN-γ双标检测, 结果刺激后的T淋巴细胞中产生IFN-γ的CTL数量在实验组CTP-HBcAg18-27-Tapasin最高分别高于对照组及空白组[转基因小鼠(F = 155.45, P = 0.000); C57BL/6小鼠(F = 392.90, P = 0.000)](图7, 8, 表4).
HBV慢性感染者中DC抗原提呈能力低下, 表达于DC表面的共刺激分子明显低于正常者, 刺激T淋巴细胞特异性增殖反应能力下降, 能够诱导T淋巴细胞向Thl分化的IL-12、IFN-γ分泌减少, 因而造成细胞免疫反应低下、病毒持续感染[13-16]. Kurose等[10]用HBV转基因小鼠模型研究HBV感染后机体免疫耐受状态和DC的关系, 发现机体对HBV的耐受状态并不是因为淋巴细胞功能缺陷, 而是由于抗原提呈细胞功能缺陷, 特别是DCs功能缺陷引起. CTP为蛋白转导域PTD(protein transduction domain)的衍生体, 诸多研究证实, PTD及其衍生体能够有效穿透细胞膜, 高效携带外源性抗原进入细胞内部, 实现细胞亚定位, 通过MHC-Ⅰ类分子途径提呈, 诱导特异性CTL, 从而发挥抗肿瘤、抗病不良反应[17-19]. HBcAg18-27为具有免疫优势的HLA-A2限制性CTL表位肽, 在90%HLA-A2阳性的急性自限性HBV感染者中能诱发强大的CTL反应[20-22]. 经典MHC-Ⅰ类分子在内质网内的装配要求有抗原肽配体和β2m的存在, 而这一过程需要伴侣分子(chaperones)如Tapasin、钙网蛋白(calreticulin, CRT)等的参与. Tapasin在形成抗原肽MHC复合物中有重要作用, 近年来一些研究发现某些肿瘤、病毒、及自身免疫性疾病的发生与Tapasin的表达下降有关[23-25].
前期研究中, 我们已经成功构建CTP-HBcAg18-27-Tapasin融合基因质粒, 融合蛋白表达纯化后证明其具有DC胞膜穿透能力并有效定位于胞质. 在此基础上, 为进一步探讨该融合蛋白对DC免疫功能的影响, 我们进行了体外培养HBV转基因小鼠及C57BL/6小鼠髓源性DC, 我们的实验显示, CTP-HBcAg18-27-Tapasin能明显上调细胞表面标志物的水平及提高细胞表面标志物及IL-12p70的水平, 证实其促进DC成熟的能力, 未成熟DC表面的MHC分子及其他分子(CD80、CD83)表达水平低下, DC成熟后细胞表面的MHC分子及其刺激分子的表达明显升高, CD83是DC成熟的标志, 成熟的DC分泌高水平的IL-12, IL-12是促进T细胞活化增殖的重要细胞因子之一, IL-12p70是IL-12的家族成员. 并采用尼龙毛柱分离法分离T淋巴细胞, 尼龙毛柱分离法利用了尼龙毛对B淋巴细胞的亲和力, 使T淋巴细胞达到足够的纯度. 增殖实验中先将成熟的DC用丝裂霉素C处理, 目的是为了排除DC本身的增殖带来的干扰, 使实验测得的结果为小鼠脾淋巴细胞的单向增殖. CCK-8法检测T淋巴细胞增殖能力也证实了CTP-HBcAg18-27-Tapasin组高于其他对照组. 流式细胞仪对T淋巴细胞进行CD8α和IFN-γ双标检测, CD8α和IFN-γ双阳性的为表达IFN-γ的CTL, 结果显示CTP-HBcAg18-27-Tapasin刺激后的淋巴细胞中产生IFN-γ的CTL数量明显高于对照组, 提示Tapasin有利于MHC-1提呈, 但CTP-HBcAg18-27-Tapasin诱导HBV转基因小鼠DC表面分子成熟及在T淋巴细胞增殖中的作用要比C57BL/6小鼠低, 提示HBV转基因小鼠DC功能可能存在缺陷. 本实验以正常小鼠为对照, 通过流式细胞仪检测HBV转基因小鼠树突状细胞表面分子表达明显低于正常小鼠, 这与HBV转基因小鼠DC刺激淋巴细胞增殖能力和诱导CTL低下相一致. Farag等[26]利用HBVsvp和LPS来刺激C57BL/6小鼠DC然后免疫转基因小鼠, 结果显示实验组转基因小鼠CD4+T淋巴细胞比空白组高, 并且HBsAg和HBV DNA水平比空白组低. 表明DC抗原提呈功能在清除HBV中起着至关重要的作用, Tapasin作为MHC-Ⅰ类分子与TAP之间的桥梁, 可增强抗原肽与MHC-Ⅰ类分子的结合能力, 并促进抗原提呈细胞(antigen presenting cells, APCs)表面MHC/多肽复合物的表达[27-29]. 近来有研究人员利用Tapasin结合表位肽来增强特异性CTL反应以抑制病毒复制及肿瘤细胞生长. Thirdborough等[30]利用CTL表位肽来免疫Tapasin-/-转基因小鼠和野生型小鼠, 结果发现经抗原肽刺激后Tapasin-/-生成特异性CD8+细胞的能力明显低于野生型小鼠, 提示Tapasin在诱导CTL反应中起重要作用. Boulanger等[31]利用Tapasin-/-转基因小鼠来研究由痘病毒所致的淋巴细胞性脉络丛脑膜炎, 发现Tapasin能促进CTL反应, 在病毒免疫作用中是一个有利因素, Tapasin缺乏会造成免疫反应的改变. 我们的实验结果与上述实验一致, 分子伴侣Tapasin能明显增强抗原肽刺激DCs成熟并诱导特异性CTLs的能力.
本实验证实了分子伴侣Tapasin修饰胞内化抗原肽(HBcAg18-27)能明显促进HBV转基因小鼠及C57BL/6小鼠DC表面分子上调, 提高IL-12p70的水平, 并有效刺激T淋巴细胞增殖及增加特异性CTL的表达, 证实Tapasin在免疫激活中的重要作用. 基于以上结果, 为进一步研究该融合蛋白诱导特异性CTL抑制HBV复制的体内研究提供理论依据.
乙型肝炎病毒(HBV)感染是严重的公共卫生问题, 全球约20亿人曾感染HBV, 其中3.5-4.0亿人为慢性HBV感染, 全球每年约100万人死于与HBV感染相关的肝病. 我国属乙型肝炎高发区, 约1.1亿人为慢性HBV感染.
白浪, 副教授, 四川大学华西医院感染性疾病中心
经典MHC-Ⅰ类分子在内质网内的装配要求有抗原肽配体和β2m的存在, 而这一过程需要伴侣分子(chaperones)如Tapasin、钙网蛋白(calreticulin, CRT)等的参与. Tapasin在形成抗原肽MHC复合物中有重要作用.
Thirdborough等利用CTL表位肽来免疫Tapasin-/-转基因小鼠和野生型小鼠, 结果发现经抗原肽刺激后Tapasin-/-生成特异性CD8+细胞的能力明显低于野生型小鼠, 提示Tapasin在诱导CTL反应中起重要作用. Boulanger等利用Tapasin-/-转基因小鼠来研究由痘病毒所致的淋巴细胞性脉络丛脑膜炎, 发现Tapasin能促进CTL反应, 在病毒免疫作用中是一个有利因素, Tapasin缺乏会造成免疫反应的改变.
本研究利用CTP-HBcAg18-27-Tapasin融合蛋白对体外培养HBV转基因小鼠及C57BL/6小鼠髓源性DCs及其在T淋巴细胞增值功能的影响进行观察, 探讨分子伴侣Tapasin在诱导免疫激活中的作用. 为慢性乙型肝炎患者的免疫治疗提供新的思路.
本文证实了分子伴侣Tapasin修饰胞内化抗原肽(HBcAg18-27)能明显促进HBV转基因小鼠及C57BL/6小鼠DC表面分子上调, 提高IL-12p70的水平, 并有效刺激T淋巴细胞增殖及增加特异性CTL的表达的作用, 证实Tapasin在免疫激活中的重要作用, 为进一步研究该融合蛋白诱导特异性CTL抑制HBV复制的体内研究提供理论依据.
本研究实验设计合理, 试验方法正确, 结果令人鼓舞, 将会对将来应用于临床提高HBV清除率提供新的思路和途径.
编辑: 田滢 电编: 闫晋利
| 1. | Shi TD, Wu YZ, Jia ZC, Zou LY, Zhou W. Therapeutic polypeptides based on HBV core 18-27 epitope can induce CD8 CTL-mediated cytotoxicity in HLA-A2+ human PBMCs. World J Gastroenterol. 2004;10:1902-1906. [PubMed] |
| 2. | Williams R. Global challenges in liver disease. Hepatology. 2006;44:521-526. [PubMed] |
| 3. | Phillips S, Chokshi S, Riva A, Evans A, Williams R, Naoumov NV. CD8(+) T cell control of hepatitis B virus replication: direct comparison between cytolytic and noncytolytic functions. J Immunol. 2010;184:287-295. [PubMed] [DOI] |
| 4. | Howarth M, Williams A, Tolstrup AB, Elliott T. Tapasin enhances MHC class I peptide presentation according to peptide half-life. Proc Natl Acad Sci USA. 2004;101:11737-11742. [PubMed] |
| 5. | Sadegh-Nasseri S, Chen M, Narayan K, Bouvier M. The convergent roles of tapasin and HLA-DM in antigen presentation. Trends Immunol. 2008;29:141-147. [PubMed] [DOI] |
| 6. | Morón G, Dadaglio G, Leclerc C. New tools for antigen delivery to the MHC class I pathway. Trends Immunol. 2004;25:92-97. [PubMed] |
| 7. | Shibagaki N, Udey MC. Dendritic cells transduced with TAT protein transduction domain-containing tyrosinase-related protein 2 vaccinate against murine melanoma. Eur J Immunol. 2003;33:850-860. [PubMed] |
| 8. | Chen X, Lai J, Pan Q, Tang Z, Yu Y, Zang G. The delivery of HBcAg via Tat-PTD enhances specific immune response and inhibits Hepatitis B virus replication in transgenic mice. Vaccine. 2010;28:3913-3919. [PubMed] [DOI] |
| 9. | Kim D, Jeon C, Kim JH, Kim MS, Yoon CH, Choi IS, Kim SH, Bae YS. Cytoplasmic transduction peptide (CTP): new approach for the delivery of biomolecules into cytoplasm in vitro and in vivo. Exp Cell Res. 2006;312:1277-1288. [PubMed] |
| 10. | Kurose K, Akbar SM, Yamamoto K, Onji M. Production of antibody to hepatitis B surface antigen (anti-HBs) by murine hepatitis B virus carriers: neonatal tolerance versus antigen presentation by dendritic cells. Immunology. 1997;92:494-500. [PubMed] |
| 11. | Woltman AM, Op den Brouw ML, Biesta PJ, Shi CC, Janssen HL. Hepatitis B virus lacks immune activating capacity, but actively inhibits plasmacytoid dendritic cell function. PLoS One. 2011;6:e15324. [PubMed] [DOI] |
| 12. | 刘 红红, 陈 小华, 周 丽芹, 刘 雪妮, 余 永胜, 臧 国庆, 汤 正好. CTP-HBcAg18-27-Tapasin融合蛋白胞内转导功能的检测. 中国临床药理学与治疗学. 2012;17:25-29. |
| 13. | Hasebe A, Akbar SM, Furukawa S, Horiike N, Onji M. Impaired functional capacities of liver dendritic cells from murine hepatitis B virus (HBV) carriers: relevance to low HBV-specific immune responses. Clin Exp Immunol. 2005;139:35-42. [PubMed] |
| 14. | Chen W, Shi M, Shi F, Mao Y, Tang Z, Zhang B, Zhang H, Chen L, Chen L, Xin S. HBcAg-pulsed dendritic cell vaccine induces Th1 polarization and production of hepatitis B virus-specific cytotoxic T lymphocytes. Hepatol Res. 2009;39:355-365. [PubMed] [DOI] |
| 15. | Ganem D, Prince AM. Hepatitis B virus infection--natural history and clinical consequences. N Engl J Med. 2004;350:1118-1129. [PubMed] |
| 16. | Chen JH, Yu YS, Chen XH, Liu HH, Zang GQ, Tang ZH. Enhancement of CTLs induced by DCs loaded with ubiquitinated hepatitis B virus core antigen. World J Gastroenterol. 2012;18:1319-1327. [PubMed] [DOI] |
| 17. | Parcej D, Tampé R. ABC proteins in antigen translocation and viral inhibition. Nat Chem Biol. 2010;6:572-580. [PubMed] [DOI] |
| 18. | Tey SK, Khanna R. Host immune system strikes back: Autophagy-mediated antigen presentation bypasses viral blockade of the classic MHC class I processing pathway. Autophagy. 2012;8:1839-1841. [PubMed] [DOI] |
| 19. | Säälik P, Elmquist A, Hansen M, Padari K, Saar K, Viht K, Langel U, Pooga M. Protein cargo delivery properties of cell-penetrating peptides. A comparative study. Bioconjug Chem. 2004;15:1246-1253. [PubMed] |
| 20. | Liu J, Chen KY, Ren EC. Structural insights into the binding of hepatitis B virus core peptide to HLA-A2 alleles: towards designing better vaccines. Eur J Immunol. 2011;41:2097-2106. [PubMed] [DOI] |
| 21. | Akbar SM, Chen S, Al-Mahtab M, Abe M, Hiasa Y, Onji M. Strong and multi-antigen specific immunity by hepatitis B core antigen (HBcAg)-based vaccines in a murine model of chronic hepatitis B: HBcAg is a candidate for a therapeutic vaccine against hepatitis B virus. Antiviral Res. 2012;96:59-64. [PubMed] [DOI] |
| 22. | Li J, Han YP, Liu B, Liu Y, Chen N, Dong L, Yan YD, Jiang LF, Huang ZH. [Dynamic changes and clinical significance of HBcAg18-27 specific cytotoxic T lymphocytes in acute hepatitis B patients]. Zhonghua Ganzangbing Zazhi. 2011;19:38-43. [PubMed] [DOI] |
| 23. | Halenius A, Hauka S, Dölken L, Stindt J, Reinhard H, Wiek C, Hanenberg H, Koszinowski UH, Momburg F, Hengel H. Human cytomegalovirus disrupts the major histocompatibility complex class I peptide-loading complex and inhibits tapasin gene transcription. J Virol. 2011;85:3473-3485. [PubMed] [DOI] |
| 24. | Chen M, Bouvier M. Analysis of interactions in a tapasin/class I complex provides a mechanism for peptide selection. EMBO J. 2007;26:1681-1690. [PubMed] |
| 25. | Neefjes J, Jongsma ML, Paul P, Bakke O. Towards a systems understanding of MHC class I and MHC class II antigen presentation. Nat Rev Immunol. 2011;11:823-836. [PubMed] [DOI] |
| 26. | Farag MM, Tedjokusumo R, Flechtenmacher C, Asen T, Stremmel W, Müller M, Protzer U, Weigand K. Immune tolerance against HBV can be overcome in HBV transgenic mice by immunization with dendritic cells pulsed by HBVsvp. Vaccine. 2012;30:6034-6039. [PubMed] [DOI] |
| 27. | Praveen PV, Yaneva R, Kalbacher H, Springer S. Tapasin edits peptides on MHC class I molecules by accelerating peptide exchange. Eur J Immunol. 2010;40:214-224. [PubMed] [DOI] |
| 28. | Hulpke S, Baldauf C, Tampé R. Molecular architecture of the MHC I peptide-loading complex: one tapasin molecule is essential and sufficient for antigen processing. FASEB J. 2012;26:5071-5080. [PubMed] [DOI] |
| 29. | Sadasivan B, Lehner PJ, Ortmann B, Spies T, Cresswell P. Roles for calreticulin and a novel glycoprotein, tapasin, in the interaction of MHC class I molecules with TAP. Immunity. 1996;5:103-114. [PubMed] |
| 30. | Thirdborough SM, Roddick JS, Radcliffe JN, Howarth M, Stevenson FK, Elliott T. Tapasin shapes immunodominance hierarchies according to the kinetic stability of peptide-MHC class I complexes. Eur J Immunol. 2008;38:364-369. [PubMed] [DOI] |