修回日期: 2013-05-27
接受日期: 2013-06-04
在线出版日期: 2013-07-08
目的: 检测酒精刺激对肝癌细胞miRNA表达谱差异, 探讨异常表达的miRNA与酒精刺激诱导肝癌细胞生长转移的分子机制.
方法: 0.2%酒精刺激细胞培养, 提取总RNA, 在miRNA微阵列芯片中杂交检测, 通过芯片扫描和数据分析, 获得miRNAs表达谱, 筛选出表达差异明显者进行RT-PCR验证; Western blot检测TET蛋白的表达.
结果: 0.2%酒精处理肝癌细胞24 h后出现多个miRNAs的差异表达, 其中miRNA-29家族上升较为明显, RT-PCR验证得到与芯片相一致的结果, Western blot检测结果显示TET3蛋白表达下降.
结论: 酒精刺激可以导致肝癌细胞miRNAs表达谱出现多种差异性改变, 这些改变可能会导致相关蛋白表达的改变从而影响肝癌的发生发展.
核心提示: 酒精刺激可上调miR-29b/c表达, 而下调的TET3蛋白的表达.
引文著录: 桂照华, 汪心怡, 陈吉, 陈卓, 赵华, 汪思应. 利用miRNA芯片分析酒精刺激肝癌细胞株miRNA表达谱的差异. 世界华人消化杂志 2013; 21(19): 1847-1852
Revised: May 27, 2013
Accepted: June 4, 2013
Published online: July 8, 2013
AIM: To detect the miRNA expression profile in liver cancer cells induced with ethanol, and explore the molecular mechanisms behind abnormal expression of miRNAs and the growth and metastasis of ethanol-induced liver cancer cells.
METHODS: After cells were stimulated with 0.2% ethanol, total RNA was extracted from cancer cells, and the miRNA expression profiles were obtained using miRNA microarray chip hybridization. MiRNAs whose expression had significant difference was determined by RT-PCR. TET protein expression was detected by Western blot.
RESULTS: There were multiple differentially expressed miRNAs in liver cancer cells induced with ethanol for 24 h. The expression of miRNA-29 family was up-regulated evidently. The results of RT-PCR were consistent with chip results. Western blot analysis showed that TET protein expression was decreased.
CONCLUSION: Stimulation with ethanol can lead to multiple changes of miRNA expression profiles in liver cancer cells, and these changes may influence the development and progression of liver cancer by causing changes in associated protein expression.
- Citation: Gui ZH, Wang XY, Chen J, Chen Z, Zhao H, Wang SY. MiRNA expression profiling of alcohol-stimulated liver cancer cell lines using miRNA chips. Shijie Huaren Xiaohua Zazhi 2013; 21(19): 1847-1852
- URL: https://www.wjgnet.com/1009-3079/full/v21/i19/1847.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i19.1847
肝细胞癌是常见的恶性肿瘤, 其发病率位居人类肿瘤发病率的第2位, 仅次于肺癌[1]. 研究发现, 其发病原因与肝炎病毒感染, 机体内在因素、环境因素、生活习惯等密切相关[2]. 其中长期饮酒与肝癌的发生发展的相关性已得到证实[3]. 在研究酒精与肝癌关系进程中, 虽然已取得很多成果但还有很多问题需要解决.
由19-25个核苷酸组成的, 非编码的单链RNA被称为微小核糖核酸(microRNA). 这类小RNA在表达上具有组织和时间的特异性, 是调节其他功能基因表达的重要调控分子, 在生物的生长发育过程中发挥着重要作用[4]. 研究表明, 多种microRNA参与肿瘤的恶性转变过程, 如恶性增殖、复发转移、凋亡抑制等[5,6]. 在本实验室前期的研究中发现, 酒精刺激HepG2细胞后影响细胞的生长和转移, 因此本实验利用miRNA微阵列分子技术重点探讨了酒精刺激HepG2细胞后是否是通过影响miRNA的表达影响了细胞的生长和转移.
人肝癌细胞HepG2由本实验室保存. 胎牛血清(FBS)由灏洋公司生产, DMEM培养基由Gibco公司生产. 无水乙醇购自Sigma公司. 总RNA提取试剂、TRIzol购自Invitrogen公司. RT-PCR试剂盒购自上海吉玛公司, 引物由上海吉玛公司合成.
1.2.1 酒精刺激细胞培养: 人类肝癌细胞HepG2用含10%胎牛血清、0.5 ng/mL白介素-3(interleukin-3, IL-3) DMEM培养液, 100 U/mL链霉素/100 U/mL青霉素, 37 ℃、5%CO2条件下一定湿度孵箱中培养. 待细胞贴壁后, 加入无水乙醇, 占培养液体积比0.2%. 然后将培养皿置入体积为2200 mL容器中, 容器内加入200 m灭菌后超纯水和400 µL无水乙醇(0.2%), 注入100 mL CO2, 密封容器, 置入孵箱, 使细胞保持在0.2%乙醇及一定湿度的稳定环境中培养.
1.2.2 细胞总RNA提取: 采用Invegetion公司的RNAVzol试剂. 细胞经胰酶消化, PBS洗涤一次, 调整细胞数量为1×106/mL转移至EP管中, 加入1 mL TRIzol试剂, 具体步骤按照说明书操作, 所得总RNA用紫外分光光度仪测纯度及浓度, 分装后-80 ℃冰箱保存.
1.2.3 miRNA基因芯片分析: 将提取的酒精刺激组总RNA及对照组总RNA送至上海吉玛公司检测miRNA表达谱差异.
1.2.4 反转录: PC(RT-PCR)验证芯片结果: 按照上海吉玛公司的试剂盒说明书进行操作. MiR-RT primers引物、2 µL总RNA、4 µL RT Buffer、0.75 µL dNTP、0.2 µL AMV、DEPC水配成20 µL反应体系, 反应条件: 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 10 min. 将反转录产物稀释3-4倍作为模板作PCR反应, 以U6为内参对照, 反应条件为: 99 ℃预变性1 min, 95 ℃ 3 min, 95 ℃ 12 s, 62 ℃ 50 s, 40个循环. 5%TAE琼脂糖凝胶电泳检测PCR产物.
1.2.5 蛋白质免疫印迹法检测TET蛋白的表达: 酒精处理细胞24 h后收集细胞, PBS洗3遍, 加入RIPA(含蛋白酶抑制剂)裂解, 冰上裂解30 min, 4 ℃ 12000 g离心20 min, 吸取上清液, 加入5×loading buffer, 99 ℃加热10 min, 分光光度计定量后10%SDS-PAGE分离样本, 200 mA转到PVDF膜上, 5%脱脂奶粉(TBST配制)室温封闭2 h, TET3蛋白一抗按照1:1000稀释, 4 ℃过夜, HRP标记的二抗按照1:5000稀释, ECL显色系统检测目的蛋白.
统计学处理 实验结果采用SPSS20.0软件分析, 上述实验均重复3次, 实验数据以mean±SD表示, 组间差异比较采用t检验, P<0.05表示有统计学意义.
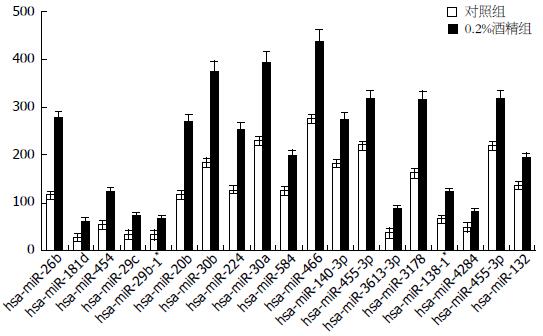
miRNA微阵列芯片杂交结果显示: 与正常对照组相比, 0.2%酒精刺激组miRNAs表达谱发生明显变化, 其中microRNA表达量显著升高的有21个, 其中miRNA-29家族上升较为明显(图1).
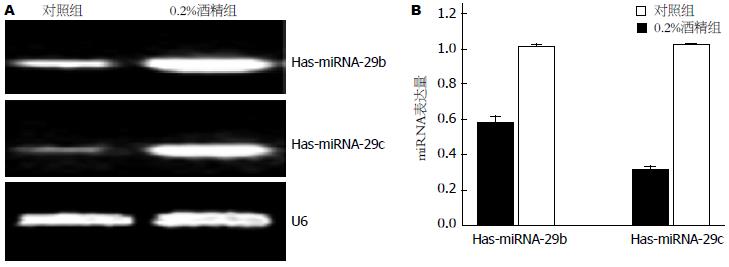
在对miRNAs表达谱进行分析的过程中发现miRNA-29家族成员中的miRNA-29c及miRNA-29b同时上升达1.5倍以上, 随后我们利用RT-PCR技术验证得到与芯片结果相一致(图2).
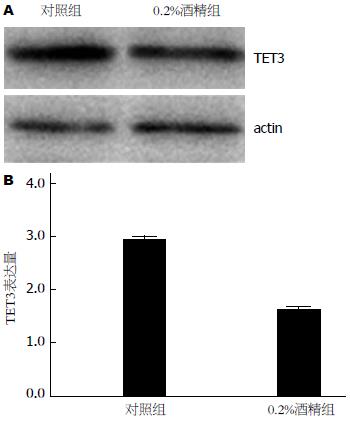
利用生物学信息预测结果发现, TET3 3' UTR区存在多个与miR-29b/c互补结合的核苷酸位点(表1), 提示TET3有可能是miR-29b/c的潜在靶基因. 为了进一步明确TET3与miR-29b/c的关系, 我们利用Western blot检测TET3蛋白的表达情况, 发现酒精处理组TET3蛋白的表达显著下降(图3).
| 预测的相应配对区域: 靶基因(上)和miRNA (下) | 种子序列 | ||||||||||||||||||||||||||
| TET3 3' UTR 53-59 | 5' | ... | C | C | C | G | A | G | C | U | G | U | C | U | C | U | G | U | G | G | U | G | C | U | U | ... | 3' |
| | | | | | | | | | | | | | | |||||||||||||||||||||
| Has-miR-29b | 3' | ... | U | U | G | U | G | A | C | U | A | A | A | G | U | U | U | A | C | C | A | C | G | A | U | ... | 5' |
| TET3 3' UTR 53-59 | 5' | ... | C | C | C | G | A | G | C | U | G | U | C | U | C | U | G | U | G | G | U | G | C | U | U | ... | 3' |
| | | | | | | | | | | | | | | |||||||||||||||||||||
| Has-miR-29c | 3' | ... | A | U | U | G | G | C | U | A | A | A | G | U | U | U | A | C | C | A | C | G | A | U | ... | 5' | |
| TET3 3' UTR 4472-4479 | 5' | ... | A | G | G | C | U | G | C | U | U | U | U | U | A | G | U | U | G | G | U | G | C | U | A | ... | 3' |
| | | | | | | | | | | | | | | | | | | | | ||||||||||||||||||
| Has-miR-29b | 3' | ... | U | U | G | U | G | A | C | U | A | A | A | G | U | U | U | A | C | C | A | C | G | A | U | ... | 5' |
| TET3 3' UTR 4472-4479 | 5' | ... | A | G | G | C | U | G | C | U | U | U | U | U | A | G | U | U | G | G | U | G | C | U | A | ... | 3' |
| | | | | | | | | | | | | | | | | | | | | ||||||||||||||||||
| Has-miR-29c | 3' | ... | A | U | U | G | G | C | U | A | A | A | G | U | U | U | A | C | C | A | C | G | A | U | ... | 5' | |
| TET3 3' UTR 1471-1477 | 5' | ... | U | U | U | G | A | A | A | U | G | A | G | A | A | U | G | U | G | G | U | G | C | U | U | ... | 3' |
| | | | | | | | | | | | | | | |||||||||||||||||||||
| Has-miR-29b | 3' | ... | U | U | G | U | G | A | C | U | A | A | A | G | U | U | U | A | C | C | A | C | G | A | U | ... | 5' |
| TET3 3' UTR 1471-1477 | 5' | ... | U | U | U | G | A | A | A | U | G | A | G | A | A | U | G | U | G | G | U | G | C | U | U | ... | 3' |
| | | | | | | | | | | | | | | |||||||||||||||||||||
| Has-miR-29c | 3' | ... | A | U | U | G | G | C | U | A | A | A | G | U | U | U | A | C | C | A | C | G | A | U | ... | 5' | |
| TET3 3' UTR 3808-3815 | 5' | ... | A | U | A | G | U | C | U | A | A | A | U | A | A | A | A | U | G | G | U | G | C | U | A | ... | 3' |
| | | | | | | | | | | | | | | |||||||||||||||||||||
| Has-miR-29b | 3' | ... | U | U | G | U | G | A | C | U | A | A | A | G | U | U | U | A | C | C | A | C | G | A | U | ... | 5' |
| TET3 3' UTR 3808-3815 | 5' | ... | A | U | A | G | U | C | U | A | A | A | U | A | A | A | A | U | G | G | U | G | C | U | A | ... | 3' |
| | | | | | | | | | | | | | | |||||||||||||||||||||
| Has-miR-29c | 3' | ... | U | U | G | U | G | A | C | U | A | A | A | G | U | U | U | A | C | C | A | C | G | A | U | ... | 5' |
长期饮酒是多种疾病的致病因素, 如糖尿病、精神疾病、心血管疾病、肝肠胰腺疾病等, 其中对肝脏的损伤尤为明显, 因而逐渐成为人们研究的热点[7]. 酒精对肝脏的损害是多方面的, 一方面肝脏作为酒精的代谢场所可造成对肝细胞的直接损伤, 另一方面酒精的多种代谢产物可造成对肝脏的间接损伤, 其中乙醛及其代谢产物4-羟壬烯醛(4-hydroxy-2-nonenal)、丙二醛(malonaldehyde)可以导致DNA的突变或缺失[8]. 长期饮酒不仅增加肝癌发生的危险性, 而且可以促进肝癌的转移和侵袭[9]. 因此, 研究酒精导致肝癌的分子机制具有重要的现实意义.
MicroRNA是一类保守的, 长度约为19-25 nt的非编码单链小RNA, 通过与靶基因3'非编码区特异性的结合, 导致miRNA的降解或翻译抑制, 从而在转录后水平调控基因的表达[10]. 目前已发现上千种miRNA, 这些miRNA调控着大约30%蛋白质的合成, 他们与人类的生长发育、干细胞分化与自我更新以及肿瘤、心血管疾病等多种疾病密切相关, 而在肿瘤演变过程中, 这些miRNA扮演着尤其重要的角色[11]. 近些年来随着对microRNA研究的深入, 越来越多的研究显示microRNA在肝癌组织中的异常表达, 可能参与了肝细胞恶性生长和肝癌转移的病理过程. Meng等[12]通过研究发现肝癌细胞中miR-21呈现高表达, 通过下调PTEN的表达进而影响PI3K信号通路促进肝癌细胞的增殖和转移. Gramantieri等[13]发现miR-122a通过调节靶基因cyclinG1的表达影响肝癌的发生. 由此, 我们想知道酒精导致肝脏损伤的过程是够也有microRNA的参与.
TET癌基因家族包括3个成员, 分别为TET1、TET2和TET3, 均属于α-酮戊二酸和Fe2+依赖的双加氧酶. 3种TET蛋白表现出显著的显著的组织特异性, 其中TET2在血液系统中含量较高, 因此对其功能的研究多集中在血液系统. 研究发现, TET蛋白基因突变或结构异常与造血系统恶性肿瘤密切相关[14]. Lorsbach等[15]发现, 在急性髓系白血病(acutemyeloid leukemia, AML)患者中存在TET1与组蛋白甲基转移酶MLL基因融合的现象. Abdel-Wahab等[16]通过对多种血液肿瘤的3种TET蛋白测序发现, TET2在MPN中突变率为7.6%, 慢性粒单核细胞白血病为42%, AML为12%, 而TET1和TET3基本未见突变. 在骨髓增生性疾病(myeloproliferative disease)或骨髓增生性肿瘤(myeloproliferative, MPN)中存在包含TET2位点的染色体缺失或TET2缺失性纯合子突变[17,18], 在MPN中TET2突变率可达到15%[19]. 然而对于TET蛋白, 尤其是TET3在实体肿瘤中发挥的作用还不清楚.
本实验中, 我们首先利用0.2%乙醇刺激培养肝癌HepG2细胞, 利用microRNA芯片技术分析发现两组之间microRNA表达谱的差异显著, 酒精组microRNA表达量上调1.5倍以上的有21个, 其中miRNA-29家族中的miRNA-29c及miRNA-29b同时上升达1.5倍以上. 进一步利用RT-PCR验证发现miR-29b/c的表达与芯片结果相一致. 通过生物学信息的预测我们发现TET3蛋白有可能是miR-29b的靶基因, 我们利用Western blot方法检测TET蛋白的表达情况, 结果显示酒精刺激组TET3蛋白的表达明显下降. 以上实验结果提示我们, 酒精刺激可上调miR-29b/c表达, 而下调的TET3蛋白的表达, 二者之间呈现负相关的关系. 但是, miR-29b/c是否调控TET3蛋白的表达仍需要荧光素酶报告基因实验的来进一步证实.
消化性溃疡是消化系统的常见疾病, 其同样是飞行员经常患有的疾病, 在最近的关于飞行员住院疾病统计中, 消化系统疾病位居前3位, 以胃炎及胃溃疡为主. 飞行员的工作环境特殊, 会经受各种刺激, 加速度是其中之一. 在正加速度(+Gz)下, 重力惯性力方向由头至足, 与主要大血管平行, 由于血液重量增加, 各系统将受到影响, 主要表现在一些组织器官的缺血、缺氧; 除此之外, +Gz对机体是一种刺激, 其可通过迷走神经调节内分泌功能. 这两者对消化性溃疡的愈合影响重大.
张小晋, 主任医师, 北京积水潭医院; 郑鹏远, 教授, 主任医师, 博士生导师, 副院长, 郑州大学第二附属医院消化科
研究在持续+Gz条件下, 消化性溃疡大鼠胃黏膜前列腺素E2(prostaglanding E2, PGE2)、血清降钙素基因相关肽(calcitonin gene-related peptide, CGRP)、NO变化及其在溃疡愈合方面发挥的作用.
持续+Gz下慢性胃溃疡的研究较少, 并且国内尚未报道.
在研究+Gz条件对飞行员消化性溃疡胃黏膜及血清指标的改变起到参考作用, 为临床治疗提供理论依据.
本文设计合理, 方法得当, 结论可信, 有一定的临床和预防实用意义. 特别是对飞行员减少停飞以及疾病有一定价值.
编辑: 田滢 电编:鲁亚静
| 1. | Jemal A, Center MM, DeSantis C, Ward EM. Global patterns of cancer incidence and mortality rates and trends. Cancer Epidemiol Biomarkers Prev. 2010;19:1893-1907. [PubMed] [DOI] |
| 2. | Perz JF, Armstrong GL, Farrington LA, Hutin YJ, Bell BP. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol. 2006;45:529-538. [PubMed] [DOI] |
| 3. | Lu Y, Cederbaum AI. CYP2E1 and oxidative liver injury by alcohol. Free Radic Biol Med. 2008;44:723-738. [PubMed] [DOI] |
| 4. | Swinkels-Meewisse IE, Roelofs J, Schouten EG, Verbeek AL, Oostendorp RA, Vlaeyen JW. Fear of movement/(re)injury predicting chronic disabling low back pain: a prospective inception cohort study. Spine (Phila Pa 1976). 2006;31:658-664. [PubMed] |
| 5. | Subramanian S, Steer CJ. MicroRNAs as gatekeepers of apoptosis. J Cell Physiol. 2010;223:289-298. [PubMed] [DOI] |
| 6. | Asaga S, Kuo C, Nguyen T, Terpenning M, Giuliano AE, Hoon DS. Direct serum assay for microRNA-21 concentrations in early and advanced breast cancer. Clin Chem. 2011;57:84-91. [PubMed] [DOI] |
| 7. | Altekruse SF, McGlynn KA, Reichman ME. Hepatocellular carcinoma incidence, mortality, and survival trends in the United States from 1975 to 2005. J Clin Oncol. 2009;27:1485-1491. [PubMed] [DOI] |
| 8. | Friedberg EC, Wagner R, Radman M. Specialized DNA polymerases, cellular survival, and the genesis of mutations. Science. 2002;296:1627-1630. [PubMed] |
| 9. | Mueller S, Millonig G, Seitz HK. Alcoholic liver disease and hepatitis C: a frequently underestimated combination. World J Gastroenterol. 2009;15:3462-3471. [PubMed] |
| 10. | Nicoloso MS, Sun H, Spizzo R, Kim H, Wickramasinghe P, Shimizu M, Wojcik SE, Ferdin J, Kunej T, Xiao L. Single-nucleotide polymorphisms inside microRNA target sites influence tumor susceptibility. Cancer Res. 2010;70:2789-2798. [PubMed] [DOI] |
| 11. | Lu LF, Boldin MP, Chaudhry A, Lin LL, Taganov KD, Hanada T, Yoshimura A, Baltimore D, Rudensky AY. Function of miR-146a in controlling Treg cell-mediated regulation of Th1 responses. Cell. 2010;142:914-929. [PubMed] [DOI] |
| 12. | Meng F, Henson R, Wehbe-Janek H, Ghoshal K, Jacob ST, Patel T. MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer. Gastroenterology. 2007;133:647-658. [PubMed] |
| 13. | Gramantieri L, Ferracin M, Fornari F, Veronese A, Sabbioni S, Liu CG, Calin GA, Giovannini C, Ferrazzi E, Grazi GL. Cyclin G1 is a target of miR-122a, a microRNA frequently down-regulated in human hepatocellular carcinoma. Cancer Res. 2007;67:6092-6099. [PubMed] |
| 14. | Langemeijer SM, Aslanyan MG, Jansen JH. TET proteins in malignant hematopoiesis. Cell Cycle. 2009;8:4044-4048. [PubMed] |
| 15. | Lorsbach RB, Moore J, Mathew S, Raimondi SC, Mukatira ST, Downing JR. TET1, a member of a novel protein family, is fused to MLL in acute myeloid leukemia containing the t(10; 11)(q22; q23). Leukemia. 2003;17:637-641. [PubMed] |
| 16. | Abdel-Wahab O, Mullally A, Hedvat C, Garcia-Manero G, Patel J, Wadleigh M, Malinge S, Yao J, Kilpivaara O, Bhat R. Genetic characterization of TET1, TET2, and TET3 alterations in myeloid malignancies. Blood. 2009;114:144-147. [PubMed] [DOI] |
| 17. | Viguié F, Aboura A, Bouscary D, Ramond S, Delmer A, Tachdjian G, Marie JP, Casadevall N. Common 4q24 deletion in four cases of hematopoietic malignancy: early stem cell involvement? Leukemia. 2005;19:1411-1415. [PubMed] |
| 18. | Jankowska AM, Szpurka H, Tiu RV, Makishima H, Afable M, Huh J, O'Keefe CL, Ganetzky R, McDevitt MA, Maciejewski JP. Loss of heterozygosity 4q24 and TET2 mutations associated with myelodysplastic/myeloproliferative neoplasms. Blood. 2009;113:6403-6410. [PubMed] [DOI] |
| 19. | Delhommeau F, Dupont S, Della Valle V, James C, Trannoy S, Massé A, Kosmider O, Le Couedic JP, Robert F, Alberdi A. Mutation in TET2 in myeloid cancers. N Engl J Med. 2009;360:2289-2301. [PubMed] [DOI] |