修回日期: 2013-04-23
接受日期: 2013-05-12
在线出版日期: 2013-06-28
目的: 检检测胃癌(gastric cancer, GC)患者外周血和肿瘤组织中胸苷酸合成酶基因(thymidylatesynthase, TYMS)和切除修复交叉互补基因1(excision repair cross-complementing 1, ERCC1)的多态性, 比较各基因型在外周血和肿瘤组织中是否一致.
方法: 收集43例GC患者术前抗凝外周血及肿瘤组织, 将其分为外周血组与肿瘤组织组. 应用PCR法和限制性片段长度多态性聚合酶链式反应(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)法分别检测外周血与肿瘤组织中TYMS和ERCC1基因的基因型.
结果: TYMS和ERCC1基因各基因型与GC患者临床病理因素无显著相关(P>0.05). 外周血与肿瘤组织中TYMS基因3R/3R、(2R/2R、2R/3R)基因型检出率76.7%、23.3%, ERCC1基因C/C、(T/T、C/T)基因型检出率为81.3%、18.7%, 差别有统计学意义(P<0.01).
结论: GC患者外周血和肿瘤组织中TYMS与ERCC1基因各基因型检出率一致, 提示外周血标本可代替肿瘤组织标本对TYMS与ERCC1基因多态性进行检测.
核心提示: 胃癌(gastric cancer)患者外周血和肿瘤组织中TYMS与ERCC1基因各基因型检出率一致, 提示外周血标本可代替肿瘤组织标本对TYMS与ERCC1基因多态性进行检测.
引文著录: 王珊珊, 沈燕, 李慧莲, 卫肖. 胃癌患者TYMS、ERCC1基因型在外周血和肿瘤组织中的多态性. 世界华人消化杂志 2013; 21(18): 1760-1765
Revised: April 23, 2013
Accepted: May 12, 2013
Published online: June 28, 2013
AIM: To compare the genotypes of thymidylatesynthase (TYMS) and excision repair cross-complementing 1 (ERCC1) between peripheral venous blood and tumor tissues of patients with gastric cancer (GC).
METHODS: Peripheral venous blood and tumor tissue samples of 43 GC patients were collected. The genotypes of TYMS and ERCC1 in these samples were detected by PCR and polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP).
RESULTS: There was no significant correlation between TYMS and ERCC1 genotypes and clinicopathologic parameters in GC patients (all P > 0.05). In both peripheral blood and tumor tissue samples, the detection rate of 3R/3R genotype and that of 2R/2R or 2R/3R genotype of TYMS were 76.7% and 23.3%, respectively; and the detection rate of C/C genotype and that of T/T or C/T genotype of ERCC1 were 81.3% and 18.7%, respectively. The detection rates of TYMS and ERCC1 genotypes in peripheral blood were consistent with those in tumor tissue samples (P < 0.01).
CONCLUSION: Peripheral venous blood samples can be used as an alternative to tumor tissue samples to detect gene polymorphisms.
- Citation: Wang SS, Shen Y, Li HL, Wei X. Comparison of TYMS and ERCC1 genotypes between peripheral venous blood and tumor tissues of patients with gastric cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(18): 1760-1765
- URL: https://www.wjgnet.com/1009-3079/full/v21/i18/1760.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i18.1760
胃癌(gastric cancer, GC)是全世界最常见的恶性消化系肿瘤之一, 我国发病率约占全球新发患者的42%. 早期GC以手术为主, 辅以化疗, 晚期则以化疗为主要手段, 因此化疗在GC治疗中占有重要地位. 但随着肿瘤对化疗药物耐药性的出现, 寻找能够衡量肿瘤对化疗药物敏感度的标志物和如何逆转肿瘤耐药逐渐成为研究的热点. 其中胸苷酸合成酶基因(thymidylatesynthase, TYMS)和切除修复交叉互补基因1(excision repair cross-complementing 1, ERCC1)最早引起人们关注[1-3], 且多项研究表明TYMS和ERCC1与5-氟尿嘧啶(5-fluorouracil, 5-Fu)和铂类药物敏感性密切相关[4-8]. 目前, 临床上对于化疗药物敏感基因的检测多采用肿瘤组织标本, 但由于患者病程存在个体差异, 可能有不适合进行手术切除等原因, 导致肿瘤组织难以获得. 因此, 寻求一种快速简便的检测方法迫在眉睫. 本研究通过检测并比较GC患者外周血及肿瘤组织中TYMS及ERCC1多态性是否一致, 来探讨外周血检测替代肿瘤组织检测的可行性.
选取2012-02/2012-08在河南郑州大学第一附属医院胃肠外科行GC切除术的患者43例, 收集患者术前抗凝全血2 mL和相应肿瘤组织标本. 肿瘤组织经病理学检查证实均为胃腺癌. 所有患者手术前均未行放疗和化疗.
1.2.1 外周血和肿瘤组织DNA的提取: GC患者外周血使用血液基因组柱式小量提取试剂盒(北京康为世纪生物科技有限公司)抽提基因组DNA, 肿瘤组织使用UNQ-10柱式动物组织DNA抽提试剂盒(上海生工生物工程股份有限公司)抽提基因组DNA, 并均严格按照说明书进行操作, 测定DNA纯度合格.
1.2.2 检测TYMS和ERCC1基因多态性: (1)TYMS多态性检测: 以提取的外周血和癌组织DNA为模板, 引物序列根据GenBank中人TYMS(gi:3842290047)基因序列选定. 上游引物序列为5'-GCGGAAGGGGTCCTGCCA-3', 下游引物序列为5'-CGTGCGGTCGTCCTTCCTG -3', 反应条件为: 第1步, 95 ℃预变性5 min; 第2步, 95 ℃ 30s、63 ℃ 30 s、72 ℃ 30 s, 共40个循环; 最后72 ℃延伸5 min. 取PCR扩增产物行3%琼脂糖凝胶电泳, 用凝胶成像仪观察结果并照相; (2)ERCC1多态性检测: 以提取的总DNA为模板, 引物序列根据GenBank中人ERCC1(gi:42544170)基因序列选定, 上游引物为5'-TGTGGTTATCAAGGGTCATCC-3', 下游引物为5'-CAGTCCAGAACACTGGGACAT-3',反应条件为: 第1步95 ℃预变性5 min; 第2步, 95 ℃ 30 s、58 ℃ 30 s、72 ℃ 30 s, 共40个循环; 最后72 ℃延伸5 min. 取扩增产物行1.2%琼脂糖凝胶电泳, 用凝胶成像仪观察结果并照相. 另取10 μL PCR扩增产物用HindⅢ酶进行消化, 取消化后的产物行2%琼脂糖凝胶电泳, 用凝胶成像仪观察结果并照相.
统计学处理 应用SPSS17.0软件进行统计分析, 所得资料均用样本例数表示, Spearman法进行样本组间相关性分析, 两组间的比较用χ2连续校正法检验, 双侧检验. 以P<0.05为差异有统计学意义.
43例GC术后患者中, TYMS和ERCC1基因多态性位点基因型与其性别、肿瘤部位、肿瘤分化程度、转移部位个数以及术前癌胚抗原水平方面均无显著相关性(P>0.05, 表1).
| 临床病理因素 | 患者人数 | |||||
| TYMS | P值 | ERCC1 | P值 | |||
| 3R/3R | 2R/2R、2R/3R | C/C | T/T、C/T | |||
| 性别 | 0.293 | |||||
| 男 | 22 | 9 | 0.651 | 25 | 6 | |
| 女 | 9 | 3 | 11 | 1 | ||
| 肿瘤部位 | 0.885 | |||||
| 胃底 | 3 | 1 | 4 | 0 | ||
| 胃体 | 16 | 7 | 0.778 | 18 | 5 | |
| 胃窦 | 11 | 4 | 13 | 2 | ||
| 其他 | 1 | 0 | 1 | 0 | ||
| 肿瘤分化程度 | 0.466 | |||||
| 高、中分化 | 9 | 2 | 0.417 | 10 | 1 | |
| 低分化 | 22 | 10 | 26 | 6 | ||
| 转移部位数目 | 0.717 | |||||
| 0 | 7 | 2 | 8 | 1 | ||
| 1 | 16 | 9 | 0.489 | 20 | 5 | |
| 2 | 6 | 1 | 7 | 0 | ||
| ≥3 | 2 | 0 | 1 | 1 | ||
| CEA水平 | 0.127 | |||||
| ≥10 | 19 | 9 | 0.41 | 25 | 4 | |
| <10 | 12 | 3 | 12 | 3 | ||
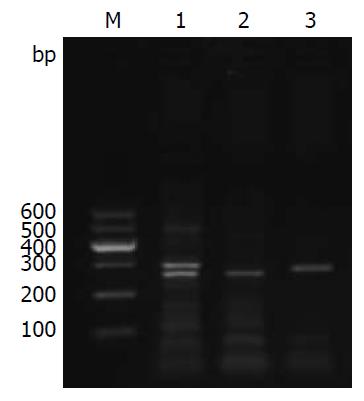
由电泳结果可知(图1), TYMS基因3R/3R基因型扩增片段为296 bp、2R/2R基因型扩增片段为268 bp, 2R/3R基因型同时存在268 bp与296 bp两种长度片段, 其扩增结果与预期结果相一致. TYMS基因各基因型在外周血和肿瘤组织中的分布见表2. 结果显示, 外周血与肿瘤组织中TYMS基因3R/3R基因型检出率为76.7%, (2R/2R、2R/3R)基因型检出率为23.3%. 经统计分析发现, 外周血和肿瘤组织中TYMS基因各基因型检出率一致, 且差别有计学意义(P<0.01).
| 肿瘤组织TYMS基因 | 外周血TYMS基因 | 合计 | χ2值 | P值 | |
| 3R/3R | 2R/2R、2R/3R | ||||
| 3R/3R | 31 | 0 | 31 | ||
| 2R/2R、2R/3R | 0 | 12 | 12 | ||
| 合计 | 31 | 12 | 43 | 38.175 | <0.01 |
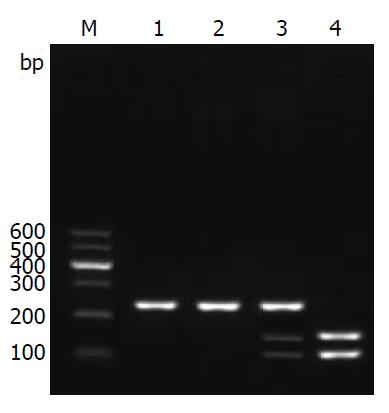
由电泳结果可知(图2), ERCC1基因扩增片段为240 bp, 经酶切之后, C/C基因型不被酶所切, 片段长度仍为240 bp, T/T基因型可被酶切为87 bp和153 bp, C/T基因型, 一部分不被酶切, 一部分被酶切为87 bp和153 bp两个片段, 其结果显示与预期结果相一致. ERCC1基因各基因型在外周血和肿瘤组织中的分布(表3). 结果显示, 外周血与肿瘤组织中ERCC1基因C/C基因型检出率为81.3%(T/T、C/T)基因型检出率为18.7%. 统计分析发现, 外周血和肿瘤组织中ERCC1基因各基因型检出率一致, 且差别有统计学意义(P<0.01).
| 肿瘤组织ERCC1基因 | 外周血ERCC1基因 | 合计 | χ2值 | P值 | |
| C/C | T/T、C/T | ||||
| C/C | 35 | 0 | 35 | ||
| T/T、C/T | 0 | 8 | 8 | ||
| 合计 | 35 | 8 | 43 | 38.750 | <0.01 |
5-Fu和铂类药物是目前用于GC化疗的基本药物. 5-Fu在体内的代谢产物可与DNA合成所需的酶类形成稳定共价络合物, 从而干扰DNA的合成; 铂类药物主要通过形成链内/链间DNA加合物而引起DNA复制障碍, 抑制细胞复制, 在临床上奥沙利铂联合5-Fu和醛氢叶酸(FOLFOX)作为一线化疗方案已广泛用于进展期GC的治疗, 总有效率在50%左右[6].
目前报道与5-Fu敏感性密切相关的基因包括TYMS和MTHFR, 与铂类药物敏感性密切相关的基因有ERCC1、XRCC1和GSTP1[9-13]. 其中TYMS表达产物是叶酸循环中起中心作用的酶类之一, 可将脱氧尿苷酸转变成脱氧胸苷酸, 后者是DNA合成和修复所需胸苷酸唯一来源, 但TYMS在5'非翻译区存在的28 bp核苷酸片段重复多态可影响mRNA稳定性, 进而影响表达, 从而改变个体对化疗药物的敏感性. 早在2005年时, Yawata等[14]就提出TYMS拷贝数可作为氟尿嘧啶药物敏感性的预测指标. 而后Brody等[15]Watson等[16]证实TYMS基因的5'端28 bp核苷酸片段重复多态可影响5-Fu在肿瘤患者体内的反应, Huang等[17]通过对116例以5-Fu为基础化疗的GC患者的研究, 也得出了相似的结论, 而ERCC1是核苷酸切除修复系统中的关键基因, 与铂类药物抵抗明显相关. 众多研究认为, ERCC1最常见且有意义的C118T多态可降低细胞中ERCC1的转录效率及蛋白表达水平, 从而减弱ERCC1的DNA修复能力, 并进一步影响个体对铂类化疗药物的反应[10,18,19]. 2011年时, Yin等[20]在对以奥沙利铂化疗为主的GC和大肠癌的研究中指出, ERCC1 C118T可作为以奥沙利铂为主的治疗的预测因子.
本研究结果显示, 胃腺癌患者外周血中TYMS和ERCC1的基因型与相应的肿瘤组织中的基因型相一致, 说明外周血中TYMS和ERCC1的基因型可在一定程度上反映其在肿瘤组织中的基因型, 这可能是由于外周血中所含的有核细胞和肿瘤组织细胞均来自同一个体, 其遗传特征相同, 但也不能排除外周血中混有肿瘤细胞的可能. 本次研究发现, 外周血TYMS基因中3R/3R基因型频率为76.7%, 稍高于2002年Luo等[21]对中国人群TYMS基因多态性研究的结果(3R/3R, 66.06%). 同时ERCC1基因C/C基因型频率为81.3%, 也高于刘永萍等[22]对126例GC患者ERCC1基因型的研究结果(64.29%), 这可能是由于本次研究样本例数较少, 导致取得的样本有所偏倚, 或者是由地域的差别所致.
由于进行GC筛查时, 部分患者取得肿瘤组织标本比较困难. 对于已行放、化疗治疗的患者, 肿瘤组织缩小、变性, 甚至消失, 而对于已行手术治疗的患者, 肿瘤组织早已被切除, 更难再次取得肿瘤组织标本进行检测. 另外外科医生在手术过程中对于标本的留取有一定的偏差, 有取不到含有肿瘤细胞的可能性, 其次肿瘤组织在提取核酸过程中有诸多不利影响因素, 如组织块的大小不易掌握, 以及组织粉碎、细胞的裂解过程, 若粉碎或裂解不充分, 则会残留组织块, 提取的核酸纯度会受到影响, 而且所需时间比较长. 但抽取患者外周血进行检测则方便、快捷, 能够对大量被检测者多次取得标本进行检测, 创伤及危险性均较小, 患者比较容易接受, 且外周血提取核酸很方便, 所需时间较少, 能快速得到结果, 为患者的治疗争取时间. 因此用外周血标本代替肿瘤组织标本检测TYMS与ERCC1基因多态性可为患者早期制定个性化的联合化疗方案, 提高患者生存率和生活质量.
胃癌(gastric cancer, GC)是全世界最常见的恶性消化系肿瘤之一, 化疗在GC治疗中占有重要地位. 多项研究表明胸苷酸合成酶基因(thymidylatesynthase, TYMS)和切除修复交叉互补基因1(excision repair cross-complementing 1, ERCC1)与5-氟尿嘧啶(5-fluorouracil)和铂类药物敏感性密切相关. 目前, 临床上对于化疗药物敏感基因的检测多采用肿瘤组织标本, 但由于患者病程存在个体差异, 可能有不适合进行手术切除等原因, 导致肿瘤组织难以获得. 因此, 需寻求一种快速简便的检测方法.
王刚, 副研究员, 哈尔滨医科大学附属第一医院胰胆外科(普外二科)
寻找能够衡量肿瘤对化疗药物敏感度的标志物和如何逆转肿瘤耐药逐渐成为目前研究的热点. 因此, 寻求一种快速简便的检测方法迫在眉睫.
Ayako等提出TYMS拷贝数可作为氟尿嘧啶药物敏感性的预测指标; Yin等在对以奥沙利铂化疗为主的GC和大肠癌的研究中指出, ERCC1 C118T可作为以奥沙利铂为主的治疗的预测因子.
通过检测并比较GC患者外周血及肿瘤组织中TYMS及ERCC1多态性是否一致, 来探讨外周血检测替代肿瘤组织检测的可行性.
外周血标本代替肿瘤组织标本检测TYMS与ERCC1基因多态性可为患者早期制定个性化的联合化疗方案, 提高患者生存率和生活质量.
本文探讨并检测了GC患者外周血和肿瘤组织中TYMS和ERCC1的多态性, 比较各基因型在外周血和肿瘤组织中是否一致, 从而为GC患者化疗及时、准确地实施提供了有效的辅助手段, 具有一定的临床意义.
编辑: 田滢 电编:闫晋利
| 1. | Ishida Y, Kawakami K, Tanaka Y, Kanehira E, Omura K, Watanabe G. Association of thymidylate synthase gene polymorphism with its mRNA and protein expression and with prognosis in gastric cancer. Anticancer Res. 2002;22:2805-2809. [PubMed] |
| 2. | Ryu JS, Hong YC, Han HS, Lee JE, Kim S, Park YM, Kim YC, Hwang TS. Association between polymorphisms of ERCC1 and XPD and survival in non-small-cell lung cancer patients treated with cisplatin combination chemotherapy. Lung Cancer. 2004;44:311-316. [PubMed] |
| 3. | Cho HJ, Park YS, Kang WK, Kim JW, Lee SY. Thymidylate synthase (TYMS) and dihydropyrimidine dehydrogenase (DPYD) polymorphisms in the Korean population for prediction of 5-fluorouracil-associated toxicity. Ther Drug Monit. 2007;29:190-196. [PubMed] |
| 4. | Sugata Y, Harada Y. Electrophysiological study on a cochlear outer hair cell. Auris Nasus Larynx. 1991;18:107-114. [PubMed] |
| 5. | Viguier J, Boige V, Miquel C, Pocard M, Giraudeau B, Sabourin JC, Ducreux M, Sarasin A, Praz F. ERCC1 codon 118 polymorphism is a predictive factor for the tumor response to oxaliplatin/5-fluorouracil combination chemotherapy in patients with advanced colorectal cancer. Clin Cancer Res. 2005;11:6212-6217. [PubMed] |
| 7. | Lee S, Park YH, Kim KH, Cho EY, Ahn YC, Kim K, Shim YM, Ahn JS, Park K, Im YH. Thymidine synthase, thymidine phosphorylase, and excision repair cross-complementation group 1 expression as predictive markers of capecitabine plus cisplatin chemotherapy as first-line treatment for patients with advanced oesophageal squamous cell carcinoma. Br J Cancer. 2010;103:845-851. [PubMed] [DOI] |
| 8. | Chai H, Pan J, Zhang X, Zhang X, Shen X, Li H, Zhang K, Yang C, Sheng H, Gao H. ERCC1 C118T associates with response to FOLFOX4 chemotherapy in colorectal cancer patients in Han Chinese. Int J Clin Exp Med. 2012;5:186-194. [PubMed] |
| 9. | Su D, Ma S, Liu P, Jiang Z, Lv W, Zhang Y, Deng Q, Smith S, Yu H. Genetic polymorphisms and treatment response in advanced non-small cell lung cancer. Lung Cancer. 2007;56:281-288. [PubMed] |
| 10. | Liang J, Jiang T, Yao RY, Liu ZM, Lv HY, Qi WW. The combination of ERCC1 and XRCC1 gene polymorphisms better predicts clinical outcome to oxaliplatin-based chemotherapy in metastatic colorectal cancer. Cancer Chemother Pharmacol. 2010;66:493-500. [PubMed] [DOI] |
| 11. | Chen YC, Tzeng CH, Chen PM, Lin JK, Lin TC, Chen WS, Jiang JK, Wang HS, Wang WS. Influence of GSTP1 I105V polymorphism on cumulative neuropathy and outcome of FOLFOX-4 treatment in Asian patients with colorectal carcinoma. Cancer Sci. 2010;101:530-535. [PubMed] [DOI] |
| 12. | Ghosh S, Hossain MZ, Borges M, Goggins MG, Ingersoll RG, Eshleman JR, Klein AP, Kern SE. Analysis of polymorphisms and haplotype structure of the human thymidylate synthase genetic region: a tool for pharmacogenetic studies. PLoS One. 2012;7:e34426. [PubMed] [DOI] |
| 13. | Jakobsen A, Nielsen JN, Gyldenkerne N, Lindeberg J. Thymidylate synthase and methylenetetrahydrofolate reductase gene polymorphism in normal tissue as predictors of fluorouracil sensitivity. J Clin Oncol. 2005;23:1365-1369. [PubMed] |
| 14. | Yawata A, Kim SR, Miyajima A, Kubo T, Ishida S, Saito Y, Nakajima Y, Katori N, Matsumoto Y, Fukuoka M. Polymorphic tandem repeat sequences of the thymidylate synthase gene correlates with cellular-based sensitivity to fluoropyrimidine antitumor agents. Cancer Chemother Pharmacol. 2005;56:465-472. [PubMed] |
| 15. | Brody JR, Hucl T, Gallmeier E, Winter JM, Kern SE, Murphy KM. Genomic copy number changes affecting the thymidylate synthase (TYMS) gene in cancer: a model for patient classification to aid fluoropyrimidine therapy. Cancer Res. 2006;66:9369-9373. [PubMed] |
| 16. | Watson RG, Muhale F, Thorne LB, Yu J, O'Neil BH, Hoskins JM, Meyers MO, Deal AM, Ibrahim JG, Hudson ML. Amplification of thymidylate synthetase in metastatic colorectal cancer patients pretreated with 5-fluorouracil-based chemotherapy. Eur J Cancer. 2010;46:3358-3364. [PubMed] [DOI] |
| 17. | Huang ZH, Hua D, Li LH. The polymorphisms of TS and MTHFR predict survival of gastric cancer patients treated with fluorouracil-based adjuvant chemotherapy in Chinese population. Cancer Chemother Pharmacol. 2009;63:911-918. [PubMed] [DOI] |
| 18. | Smith S, Su D, Rigault de la Longrais IA, Schwartz P, Puopolo M, Rutherford TJ, Mor G, Yu H, Katsaros D. ERCC1 genotype and phenotype in epithelial ovarian cancer identify patients likely to benefit from paclitaxel treatment in addition to platinum-based therapy. J Clin Oncol. 2007;25:5172-5179. [PubMed] |
| 19. | Liang J, Li QF, Yao RY, Lü HY, Jiang J, Sun YY, Song SA, Jiang T. [Association between genetic polymorphisms of ERCC1, XRCC1, GSTP1 and survival of advanced gastric cancer patients treated with oxaliplatin/5-Fu-based chemotherapy]. Zhonghua Zhongliu Zazhi. 2010;32:515-519. [PubMed] |
| 20. | Yin M, Yan J, Martinez-Balibrea E, Graziano F, Lenz HJ, Kim HJ, Robert J, Im SA, Wang WS, Etienne-Grimaldi MC. ERCC1 and ERCC2 polymorphisms predict clinical outcomes of oxaliplatin-based chemotherapies in gastric and colorectal cancer: a systemic review and meta-analysis. Clin Cancer Res. 2011;17:1632-1640. [PubMed] [DOI] |
| 21. | Luo HR, Lü XM, Yao YG, Horie N, Takeishi K, Jorde LB, Zhang YP. Length polymorphism of thymidylate synthase regulatory region in Chinese populations and evolution of the novel alleles. Biochem Genet. 2002;40:41-51. [PubMed] |