修回日期: 2013-05-21
接受日期: 2013-05-25
在线出版日期: 2013-06-28
目的: 对比研究人肝癌细胞与人正常肝细胞的钙池操纵的Ca2+通道(store-operated Ca2+ channel, SOC)功能改变, 探讨SOC对肝癌细胞增殖能力的影响.
方法: 培养人肝癌细胞(SMMC7721)与人正常肝细胞(HL-7702), 应用膜片钳技术检测两组细胞的细胞膜SOC电流, 应用激光共聚焦显微镜检测两组细胞的细胞内游离Ca2+离子浓度, 应用MTT法检测两组细胞的增殖能力, 应用流式细胞仪检测两组细胞的增殖周期.
结果: 人肝癌细胞的SOC电流密度为19.36 pA/pF±4.9 pA/pF, 明显高于人正常肝细胞的电流密度8.90 pA/pF±2.78 pA/pF; 人肝癌细胞的细胞内钙荧光强度增加31.81%±8.89%, 明显高于人正常肝细胞的21.58%±6.01%; MTT生长曲线显示从第3天开始, 人肝癌细胞的增殖能力明显高于人正常肝细胞, 且时间越长, 增殖能力差别越大; 流式细胞仪研究提示人肝癌细胞的S期细胞比例(S-phase cells ratio, SPF)、增殖指数(proliferation index, PI)明显大于人正常肝细胞, 从而提示人肝癌细胞的增殖能力明显高于人肝细胞.
结论: 与人正常肝细胞相比, 人肝癌细胞的SOC电流密度增大、细胞内游离Ca2+浓度升高、增殖能力增强, 提示人肝癌细胞增殖能力提高与其SOC功能增强有关.
核心提示: 与人正常肝细胞相比, 人肝癌细胞Ca2+池操纵的钙通道功能增强, 同时可能与人肝癌细胞增殖能力提高有一定关系. 这一研究结果为肝癌发生机制的探讨和治疗靶点提供了新的思路.
引文著录: 陈金, 于宏伟, 张宗明. 钙池操纵的Ca2+通道对人肝癌细胞增殖的影响. 世界华人消化杂志 2013; 21(18): 1745-1749
Revised: May 21, 2013
Accepted: May 25, 2013
Published online: June 28, 2013
AIM: To investigate the changes in the function of store-operated Ca2+ channels (SOCs) between human hepatoma cells and human liver cells and to dicuss the effect of SOCs on the proliferative ability of hepatoma cells.
METHODS: Cultured human hepatoma cells (SMMC7721) and human liver cells (HL7702) were used in this study. Membrant current of SOCs was detected using the patch-clamp technique. Intracellular free Ca2+ concentration was determined using laser scanning confocal microscopy. Cell proliferation was assessed by MTT assay, and cell cycle progression was detected by flow cytometry.
RESULTS: The SOC current density was significantly higher in human hepatoma cells than in human liver cells (19.36 pA/pF ± 4.99 pA/pF vs 8.90 pA/pF ± 2.78 pA/pF, P < 0.05). The increase in intracellular calcium fluorescence intensity was also significantly higher in human hepatoma cells than in human liver cells (31.81% ± 8.89% vs 21.58% ± 6.01%, P < 0.05). MTT growth curve showed that the proliferative ability of human hepatoma cells was significantly higher than that of human liver cells from the third day, and the difference was increasing with the prolongation of time. Flow cytometry analysis indicated that S-phase fraction (SPF) and proliferation index (PI) were significantly greater in human hepatoma cells than in human liver cells, suggesting that the proliferative ability of hepatoma cells is much high than that of human liver cells.
CONCLUSION: Compared to human liver cells, human hepatoma cells have significantly increased SOC current density, intracellular free Ca2+ concentration, and proliferative ability, indicating that the enhancement of proliferative ability of human hepatoma cells may be related to the enhancement of SOC function.
- Citation: Chen J, Yu HW, Zhang ZM. Effect of store-operated Ca2+ channels on proliferative activity of hepatoma cells. Shijie Huaren Xiaohua Zazhi 2013; 21(18): 1745-1749
- URL: https://www.wjgnet.com/1009-3079/full/v21/i18/1745.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i18.1745
肝癌是位居全球第5位、我国第2位的常见癌症. 目前, 全球每年有75万新增的肝癌患者. 我国发病人数约占全球的半数以上, 占全球肝癌病人的55%. 据最新统计, 肝癌是世界上死亡率第2的肿瘤, 同时其死亡率在全球在不断地上升[1,2]. 因此, 深入探讨肝癌的发生、发展机制十分必要. 诸多研究发现, 细胞Ca2+稳态的破坏和肿瘤的发生、发展有密切关系, 肿瘤细胞的钙离子通道功能常发生改变[3,4]. 本实验拟对比研究人肝癌细胞与人正常肝细胞钙池操纵的Ca2+通道(store-operated Ca2+ channel, SOC)功能改变, 探讨SOC对肝癌细胞增殖能力的影响.
1.1 材料
1.1.1 细胞株及培养: 人肝癌细胞系SMMC7721、人肝细胞系HL7702购自武汉大学细胞保藏中心, 用含200 mL/L胎牛血清、100 kU/L青霉素、100 mg/L链霉素的RPMI 1640培养基在37 ℃、5%CO2, 饱和湿度的培养箱中培养. 胎牛血清, 杭州四季青生物有限公司. Fluo4/AM、RPMI medium1640、DMSO、MTT、PI, 美国Invitrogen公司. Thapsigargin(Tg), 美国Merk公司. 电极内液: CsCl 150 mmol/L, CaCl2 0.5 mmol/L, D-glucose 135 mmol/L, HEPES 10 mmol/L, EGTA 1 mmol/L, pH7.2. 钙成像液: NaHCO3 2.3 mmol/L, Na2SO4 27 mmol/L, KCl 9.7 mmol/L, MgCl2 61.1 mmol/L, NaCl 366.7 mmol/L. 电极外液: NaCl 140 mmol/L, CsCl 4 mmol/L, MgCl2 2 mmol/L, CaCl2 10 mmol/L, D-glucose 10 mmol/L, HEPES 10 mmol/L, pH 7.4. 膜片钳放大系统及分析软件, 德国HEKA公司; Zeiss激光扫描共聚焦显微镜LSM710、流式细胞分析仪BD Calibur, 清华大学生物医学测试中心.
1.2.1 细胞膜SOC电流测定: 应用全细胞膜片钳记录技术, 钳制电位0 mV, RAMP电位-100 mV-+100 mV, 电位时程100 ms, 每次间隔2 s, 持续600-1000 s.
1.2.2 细胞内游离Ca2+浓度测定: 应用激光共聚焦显微镜, 激发波长488 nm, 发射波长525 nm, 每5 s测量细胞内钙浓度的变化: 首先在不含钙的记录液记录1 min, 加入2 μmol/L Tg记录3 min, 最后加入2 mmol/L CaCl2记录2 min.
1.2.3 检测肝癌细胞与正常肝细胞的增殖能力改变: (1)MTT法检测细胞增殖能力: 将细胞以2×104/孔的密度接种到96孔细胞培养板中, 各组均设立12个复孔, 共有6个时间点, 细胞在37 ℃、5%CO2培养箱中培养1-6 d, 每间隔24 h进行1次检测, 分别用四乙基偶氮唑盐(MTT, 5 mg/mL, 20 μL/孔)处理各组细胞3 h, 然后加入二甲基亚砜(DMSO, 150 μL/孔), 震荡10 min, 待形成的紫色结晶物充分溶解后, 用酶标仪于490 nm波长处测量每孔的吸光度(A)值. 细胞增殖能力以平均A值分析, 以A值为纵坐标, 时间(d)为横坐标, 绘制生长曲线; (2)流式细胞仪检测细胞增殖周期: 用0.25%的胰酶消化并收集细胞, 每检测管中(0.5-1.0)×106细胞, PBS清洗2次, 离心(1000 r/min, 5 min)弃上清, 缓慢加入70%的乙醇, 混匀, -20 ℃固定过夜, 离心(1000 r/min, 5 min)弃上清, PBS清洗2次, 加入10 mg/mL的Rnase A 50 μL, 室温放置30 min, 再加入50 μg/mL的PI 800 μL, 4 ℃避光染色30 min, 用流式细胞仪进行细胞增殖周期检测.
统计学处理 实验数据采用SPSS18.0统计软件处理, 膜片钳数据以patchmaster软件采集, Ignor 6.2软件分析, 流式细胞仪数据以modfit 3.1软件分析, 各组间均数比较应用独立样本t检验, P<0.05被认为差异具有统计学意义.
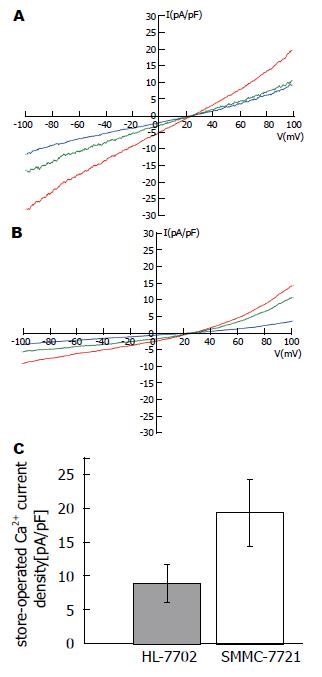
SMMC7721与HL7702细胞的SOC电流记录(图1A, B). SMMC7721细胞的SOC电流密度为19.36 pA/pF±4.99 pA/pF( n = 18), 明显高于HL7702细胞的电流密度(8.90 pA/pF±2.78 pA/pF)( n = 17), 两组差异显著(P<0.05)(图1C). 电流密度 = 电流峰值/细胞膜电容.
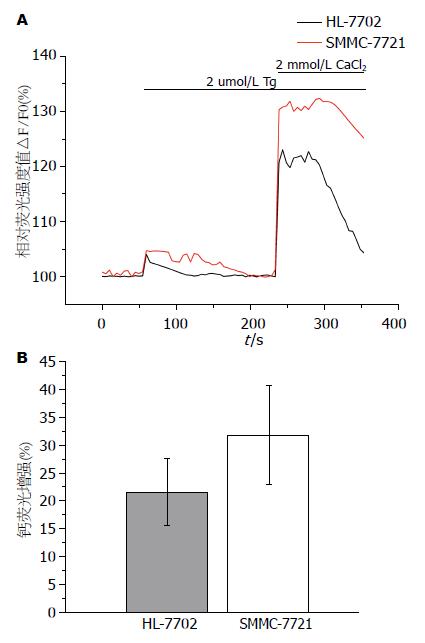
细胞内游离钙离子浓度用相对荧光强度值△F/F0表示, F0为在1 min内不含钙记录液中得到的基线强度, △F为实际测到的荧光值, 首先在不含钙的记录液中记录, 加入2 μmol/L Tg后, 出现一个由Tg抑制内质网钙泵出现的钙浓度升高峰, 加入2 mmol/L CaCl2后, 出现SOC开放导致的细胞内钙浓度高峰. 细胞内钙离子浓度的变化见图2A. 细胞内钙荧光增强(%) = 加入CaCl2 后单位时间内钙荧光增加值/加入CaCl2前钙荧光值. 结果显示SMMC7721细胞的胞内钙荧光增强幅度为31.81%±8.89%( n = 18), HL7702细胞为21.58%±6.01%( n = 11), 两组差异有统计学意义(P<0.05)(图2B).
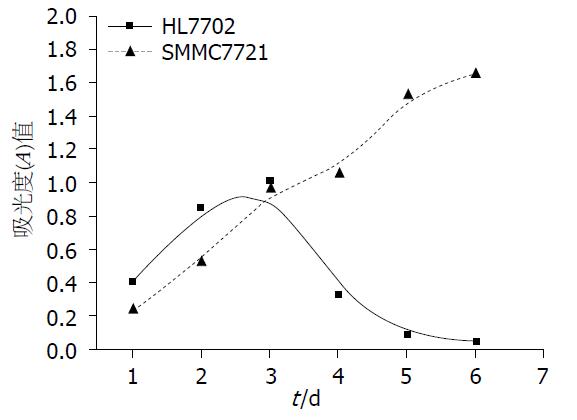
2.3.1 MTT法检测两组细胞的增殖能力: MTT法检测结果显示, 第1-3天, 人肝癌细胞SMMC7721的增殖速度略低于人肝细胞. 从第3天开始, 人肝癌细胞SMMC7721组的增殖速度明显高于人肝细胞HL-7702组, 随着时间的增加, 增殖能力的差异越来越大. 对两组细胞每天的A值进行t检验, 均P<0.05, 差异有统计学意义(图3).
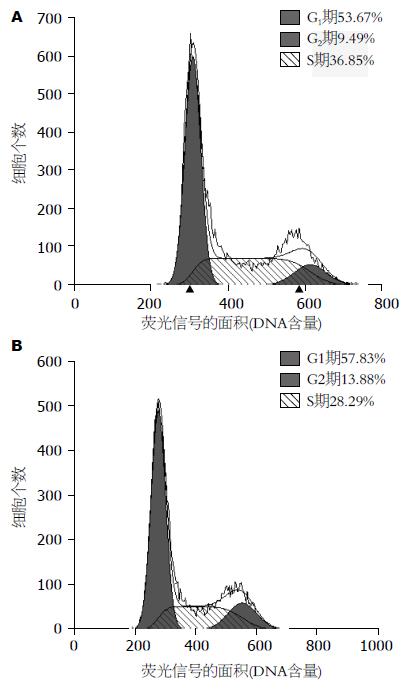
2.3.2 流式细胞仪检测两组细胞的增殖周期: 人肝癌细胞SMMC7721与人肝细胞HL7702相比, S期细胞比例S期细胞比例(S-phase cells ratio, SPF)、增殖指数(proliferation index, PI)明显增加, G1、G2明显减少, 均P<0.01, 有统计学意义(表1). 细胞的增殖能力主要由SPF、PI来决定, 因此, 可见人肝癌细胞SMMC7721增殖能力明显强于人肝细胞HL7702. 流式细胞仪检测结果见图4.
Ca2+作为细胞内最重要的第二信使之一, 参与着细胞的生存、增殖、死亡等关键的生理过程, 其稳态主要是由细胞内的钙池和细胞外的钙离子平衡调控[5]. 细胞内Ca2+稳态失衡, 对肿瘤细胞的增殖、转移、凋亡等一系列过程都有重要影响. SOC是非兴奋细胞Ca2+内流的主要通道之一. 近年越来越多的研究显示, 许多肿瘤的发生常伴有Ca2+通道功能的异常[6-8], McAndrew等[9]研究发现, 在乳腺癌患者中, SOC通道蛋白Orai1表达增加, 介导的钙离子内流增加. 作为人肝癌细胞Ca2+内流的主要通道[5], SOC在人肝癌细胞中的功能是否有明显变化, SOC与肝癌细胞的增殖有无关系, 目前尚未见有关报道.
本实验采用膜片钳方法检测人肝癌细胞SOC通道的电流, 并与人正常肝细胞进行比较, 结果显示人肝癌细胞的电流密度明显高于人正常肝细胞, 提示人肝癌细胞SOC通道功能明显高于人正常肝细胞. 本实验以共聚焦显微镜动态观测细胞内游离Ca2+浓度, 结果发现人肝癌细胞内的游离Ca2+浓度明显高于人正常肝细胞. 为进一步证实人肝癌细胞SMMC7721组的增殖能力确实较人肝细胞HL7702组有较大的增强, 本实验采用MTT和流式细胞仪分别检测细胞增殖能力和增殖周期, 均提示人肝癌细胞SMMC7721组较人肝细胞HL7702组处于高增殖状态.
有研究报道, 胞内Ca2+增加能够影响细胞内活性氧簇(reactive oxygen species, ROS)水平, 促使细胞内ROS水平轻度增加, 激活PKB和ERK磷酸化信号通路, 促进转录因子AP-1和核因子κB(nuclear factor κB, NF-κB)的活化, 抑制p53的表达, 促进细胞的过度增殖[10]. 我们的研究结果显示, 人肝癌细胞的SOC通道功能较人肝细胞SOC功能增强, 细胞内Ca2+增加程度明显, 细胞增殖能力增强, 因此, 可以推论人肝癌细胞增殖能力增强与SOC功能增强有关. 细胞周期中, Ca2+对促使细胞脱离G0期[11]和G1期细胞周期素蛋白CyclinD1[12,13]的适当表达都发挥着重要作用. 有研究提出, Bid基因可以诱导大鼠细胞钙库耗竭从而导致细胞膜上的SOC开放, 使胞内Ca2+短暂性大量增加[14]. 随着细胞内Ca2+的迅速增多, 细胞周期素CyclinD1过度表达, CyclinD1-CDK复合物增多, 大量CDK4被磷酸化激活, 使其介导的Rb磷酸化途径激活, 从而促使肿瘤细胞迅速增殖[15,16].
总之, 与人正常肝细胞相比, 人肝癌细胞的SOC电流密度增大、细胞内游离Ca2+浓度升高、增殖能力增强, 提示人肝癌细胞增殖能力提高与其SOC功能增强有关. 这一研究结果为肝癌发生机制的探讨和治疗靶点提供了新的思路.
肝癌是最常见的恶性肿瘤之一, 其发生发展的分子机制尚不明确. Ca2+池操纵的钙通道是常见的钙离子通道, 其在许多肿瘤中的功能都发生变化, 而其在肝癌中的变化并未有人去探讨, 本文旨在讨论其在肝癌细胞中的变化, 研究肝癌发生发展的机制, 同时为肝癌的分子治疗学提供一个新的方向.
单云峰, 副主任医师, 温州医学院第一附属医院肝胆外科
Ca2+池操纵的钙通道是常见的钙离子通道, 也是在肿瘤学中目前很热门的一个研究方向, 而肝癌一直都是研究的重点肿瘤之一, 从离子通道的角度来研究肝癌的发生发展在是比较新的一个方向.
本文选择了肝癌细胞, 目前尚未有关对Ca2+池操纵的钙通道是常见的钙离子通道在此肿瘤中的变化进行分析研究, 而本文除采用MTT经典实验方法外, 所采用的膜片钳技术、共聚焦显微镜技术以及流式细胞仪技术是目前比较新的有效的实验方法.
本文提出Ca2+池操纵的钙通道在肝癌细胞中的功能有所增强, 并提出Ca2+池操纵的钙通道可能会促进肝癌细胞的增殖, 这不但对肝癌发生发展从分子水平上提出了一个新的方向, 而且对于以后研究肝癌治疗的药物提出了一个新的方向.
本文拟研究钙池操纵的Ca2+通道对人肝癌细胞增殖的影响, 选题比较新颖, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] |
| 3. | Capiod T, Shuba Y, Skryma R, Prevarskaya N. Calcium signalling and cancer cell growth. Subcell Biochem. 2007;45:405-427. [PubMed] |
| 4. | Monteith GR, McAndrew D, Faddy HM, Roberts-Thomson SJ. Calcium and cancer: targeting Ca2+ transport. Nat Rev Cancer. 2007;7:519-530. [PubMed] [DOI] |
| 5. | Munaron L, Antoniotti S, Fiorio Pla A, Lovisolo D. Blocking Ca2+entry: a way to control cell proliferation. Curr Med Chem. 2004;11:1533-1543. [PubMed] [DOI] |
| 6. | Enfissi A, Prigent S, Colosetti P, Capiod T. The blocking of capacitative calcium entry by 2-aminoethyl diphenylborate (2-APB) and carboxyamidotriazole (CAI) inhibits proliferation in Hep G2 and Huh-7 human hepatoma cells. Cell Calcium. 2004;36:459-467. [PubMed] |
| 7. | Monteith GR, Davis FM, Roberts-Thomson SJ. Calcium channels and pumps in cancer: changes and consequences. J Biol Chem. 2012;287:31666-31673. [PubMed] [DOI] |
| 8. | Lee JM, Davis FM, Roberts-Thomson SJ, Monteith GR. Ion channels and transporters in cancer. 4. Remodeling of Ca(2+) signaling in tumorigenesis: role of Ca(2+) transport. Am J Physiol Cell Physiol. 2011;301:C969-C976. [PubMed] [DOI] |
| 9. | McAndrew D, Grice DM, Peters AA, Davis FM, Stewart T, Rice M, Smart CE, Brown MA, Kenny PA, Roberts-Thomson SJ. ORAI1-mediated calcium influx in lactation and in breast cancer. Mol Cancer Ther. 2011;10:448-460. [PubMed] [DOI] |
| 10. | Jones RG, Bui T, White C, Madesh M, Krawczyk CM, Lindsten T, Hawkins BJ, Kubek S, Frauwirth KA, Wang YL. The proapoptotic factors Bax and Bak regulate T Cell proliferation through control of endoplasmic reticulum Ca(2+) homeostasis. Immunity. 2007;27:268-280. [PubMed] [DOI] |
| 11. | Cheng G, Liu BF, Yu Y, Diglio C, Kuo TH. The exit from G(0) into the cell cycle requires and is controlled by sarco(endo)plasmic reticulum Ca2+ pump. Arch Biochem Biophys. 1996;329:65-72. [PubMed] |
| 12. | Simon VR, Moran MF. SERCA activity is required for timely progression through G1/S. Cell Prolif. 2001;34:15-30. [PubMed] |
| 13. | Lee MY, Lee SH, Kim YH, Heo JS, Park SH, Lee JH, Han HJ. Effect of EGF on [3H]-thymidine incorporation and cell cycle regulatory proteins in primary cultured chicken hepatocytes: Involvement of Ca2+/PKC and MAPKs. J Cell Biochem. 2006;99:1677-1687. [PubMed] [DOI] |
| 14. | Ni HM, Baty CJ, Li N, Ding WX, Gao W, Li M, Chen X, Ma J, Michalopoulos GK, Yin XM. Bid agonist regulates murine hepatocyte proliferation by controlling endoplasmic reticulum calcium homeostasis. Hepatology. 2010;52:338-348. [PubMed] [DOI] |
| 15. | Kahl CR, Means AR. Regulation of cell cycle progression by calcium/calmodulin-dependent pathways. Endocr Rev. 2003;24:719-736. [PubMed] [DOI] |
| 16. | Kahl CR, Means AR. Calcineurin regulates cyclin D1 accumulation in growth-stimulated fibroblasts. Mol Biol Cell. 2004;15:1833-1842. [PubMed] [DOI] |