修回日期: 2013-04-18
接受日期: 2013-05-19
在线出版日期: 2013-06-28
目的: 探讨SLP-2 siRNA对裸鼠胃癌移植瘤细胞增殖及凋亡的影响.
方法: 设计合成化学修饰的SLP-2 siRNA, 将胃癌细胞SGC-7901接种于裸鼠皮下建立裸鼠胃癌移植瘤模型, 随机分为转染SLP-2 siRNA组、阴性对照组和空白对照组, 于肿瘤局部分别多点多次注射化学修饰SLP-2 siRNA、阴性对照siRNA及生理盐水. 检测3组移植瘤细胞增殖及凋亡状况, RT-PCR及免疫组织化学技术检测移植瘤细胞内SLP-2 mRNA及蛋白的表达.
结果: 与两对照组相比, 注射化学修饰的SLP-2 siRNA后, 裸鼠胃癌移植瘤细胞生长速度减慢、移植瘤体积减小(P = 0.009, P = 0.003). 抑制瘤率分别为26.74%和30.15%, 细胞凋亡无明显变化(P>0.05), 肿瘤细胞内SLP-2 mRNA及蛋白的表达量降低.
结论: SLP-2 siRNA可抑制人胃癌裸鼠移植瘤的生长, 但对细胞凋亡无影响, 提示SLP-2基因参与促进胃癌细胞增殖.
核心提示: 本实验构建了胃癌细胞SGC-7901的裸鼠移植瘤模型, 观察SLP-2 siRNA对体内胃癌细胞的作用, 结果发现, SLP-2 siRNA能抑制裸鼠体内胃癌的生长, 但对细胞凋亡无明显影响.
引文著录: 张剑, 吴敏, 王丽娟, 张红巧, 师广勇, 巴楠, 张自森, 闫琳, 郑晓珂. SLP-2 siRNA对裸鼠胃癌移植瘤细胞增殖及凋亡的影响. 世界华人消化杂志 2013; 21(18): 1740-1744
Revised: April 18, 2013
Accepted: May 19, 2013
Published online: June 28, 2013
AIM: To investigate the effect of siRNA-mediated SLP-2 silencing on tumor cell proliferation and apoptosis in nude mice bearing gastric tumor xenografts.
METHODS: Chemically modified SLP-2 siRNA was designed and constructed. A tumor-bearing model was developed by inoculation of gastric cancer SGC-7901 cells into BALB/c nude mice subcutaneously. All mice were randomized into three groups: a SLP-2 siRNA-transfected group, a negative control group and a blank control group. Chemically modified SLP-2 siRNA and a negative control siRNA were injected into tumor xenografts of the SLP-2 siRNA transfected group and negative control group, respectively, while the blank control group only received an injection of equal volume of saline. Tumor volume was recorded and the apoptosis index was observed. The expression of SLP-2 mRNA and protein in tumor tissue was measured by RT-PCR and immunohistochemistry.
RESULTS: Compared to the two control groups, tumor volume was significantly decreased in the SLP-2 siRNA transfected group (P = 0.009, 0.003), and the reduced rate of tumor growth was 26.74% and 30.15%. The number of apoptotic cells and apoptosis index showed no significant differences between the SLP-2 siRNA transfected group and the two control groups (both P > 0.05).
CONCLUSION: SiRNA-mediated SLP-2 silencing inhibits tumor cell growth but has no significant effect on tumor cell apoptosis in tumor xenografts.
- Citation: Zhang J, Wu M, Wang LJ, Zhang HQ, Shi GY, Ba N, Zhang ZS, Yan L, Zheng XK. Effect of siRNA-mediated SLP-2 silencing on tumor cell proliferation and apoptosis in nude mice bearing gastric tumor xenografts. Shijie Huaren Xiaohua Zazhi 2013; 21(18): 1740-1744
- URL: https://www.wjgnet.com/1009-3079/full/v21/i18/1740.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i18.1740
胃癌是世界上最为常见的恶性肿瘤之一, 居男性恶性肿瘤发病率的第3位, 女性恶性肿瘤发病率的第4位. 包括中国在内的东亚地区是世界上胃癌发病率和死亡率最高的地区[1]. 腺癌是胃癌最主要的病理类型. 恶性肿瘤的发生是涉及到多基因、多分子水平变化、多阶段的一个复杂过程, 而癌基因的激活和抑癌基因的失活是该过程的重要事件之一. SLP-2基因是2000年由美国耶鲁大学病理科首次发现并命名的, 属于stomatin基因超家族的一个新成员[2], 其具体特性和功能尚未查明. 中国医学科学院张立勇等[3]首次发现SLP-2基因在食管鳞状细胞癌中过表达, 其在食管鳞癌中的表达水平是正常食管黏膜中的6倍以上, 并发现其与肿瘤的发生发展关系密切. 在前期工作中, 我们采用RT-PCR法及免疫组织化学法发现SLP-2基因在胃癌组织中的表达明显高于癌旁正常胃组织[4], 在本研究中, 我们构建胃癌细胞SGC-7901裸鼠移植瘤模型, 通过多点多次注射将化学修饰的SLP-2 siRNA转染入移植瘤细胞, 观察SLP-2 siRNA对裸鼠移植瘤细胞增殖、凋亡的影响, 并通过RT-PCR和免疫组织化学法检测转染SLP-2 siRNA后移植瘤中SLP-2基因的表达, 以期为肿瘤的基因治疗提供参考依据.
人中分化胃腺癌细胞系SGC-7901购自上海中国科学院典型培养物保藏委员会细胞库. 用含10%胎牛血清、100 U/mL青霉素、0.1 mg/mL链霉素的RPMI 1640培养液于37 ℃、5%CO2培养箱中培养, 4-6 d传代1次, 选用对数生长期细胞进行实验. Balb/c♀裸小鼠, 4-6 wk, 体质量14-16 g, 购自中国科学院上海实验动物中心, 在郑州大学一附院实验动物中心SPF条件下饲养. 化学修饰的SLP-2 siRNA序列(Sense 5'-UGC UGC CUG AUU UAU CUG UUC AGC C-3', Antisense 5'-GGC UGA ACA GAU AAA UCA GGC AGC A-3')及1对与SLP-2基因序列无同源性的阴性对照siRNA序列由上海吉玛公司设计合成.
1.2.1 人胃癌裸鼠模型的建立和处理: 消化细胞, 制成细胞悬液, 调整细胞浓度为5×107个/mL, 将200 µL细胞悬液(约含l×107个细胞)注射于15只裸鼠近左侧腋窝处皮下. 将裸鼠分为3组: 转染SLP-2 siRNA组、阴性对照组和空白对照组, 每组5只. 转染SLP-2 siRNA组每只裸鼠移植瘤内多点注射20 µL(10 µg/µL)SLP-2 siRNA-lipofectamine复合物, 阴性对照组给予等量阴性对照siRNA-lipofectamine复合物, 空白对照组仅给予等量生理盐水注射, 1次/3 d, 共15 d, 第16天处死裸鼠.
1.2.2 观察移植瘤体积并计算生长抑制率: 测量肿瘤长径(a)和短径(b), 并计算其体积(V = 1/6πab2), 每3 d测量一次, 计算移植瘤生长抑制率, 同时用电子天平测量裸鼠体质量. 第16天处死裸鼠后, 一部分肿瘤组织迅速置于液氮中保存, 随后转移至-80 ℃冰箱中长期保存. 另一部分肿瘤组织用10%甲醛固定, 石蜡包埋制成切片. 移植瘤生长抑瘤率(%) = (△V对照组-△V 转染SLP-2 siRNA组/△V对照组)×100%.
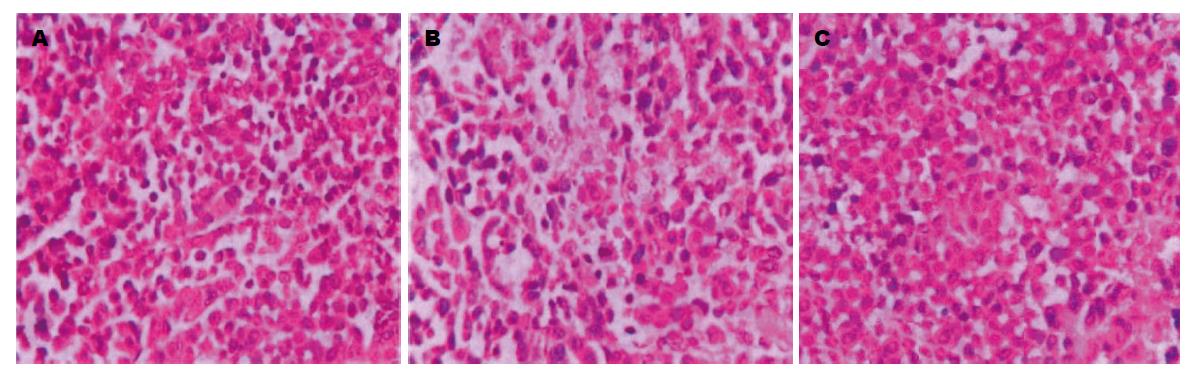
1.2.3 计算移植瘤细胞凋亡指数: 每个裸鼠移植瘤切片随机选取5个高倍视野计数100个瘤细胞中的凋亡细胞数, 百分比即为凋亡指数(apoptosis index, AI).
1.2.4 IHC法检测SLP-2蛋白在裸鼠移植瘤中的表达: 所有组织均用10%甲醛溶液固定, 经脱水、包埋、3 µm厚连续切片. 鼠抗人SLP-2单克隆抗体购自美国proteintech公司, 稀释度为1:200. 即用型一步法(非生物素)检测试剂盒购自迈新公司. 操作步骤按试剂盒说明书进行. 用PBS代替一抗作阴性对照, 用已知阳性片作阳性对照.
免疫组织化学染色由两位高年资病理科医师在双盲条件下进行评定, 判定标准参照文献[5], 每张切片根据阳性细胞染色程度及细胞阳性百分数的多少进行分级. 计数阳性细胞百分数: 没有阳性细胞赋值为0, 1%-25%为1, 26%-50%为2, 51-75%为3, >75%为4. 染色程度根据据每张切片的大多数细胞染色特征决定: 细胞膜及细胞浆无着色赋值为0, 浅黄色为1, 黄色为2, 棕黄色为3. 最终评分由两者分数相乘得到, 总值≥8分为高表达, <8分为阴性或低表达.
1.2.5 RT-PCR法检测SLP-2 mRNA在裸鼠移植瘤中的表达: 用于扩增SLP-2基因的上游引物5'-CTGGAGCCTGGTTTGAACAT-3'; 下游引物为5'-AGGATCTGGGCCTGTTTCTT-3', 扩增片断长度为500 bp. 以β-actin为内对照, 上游引物为5'-ACACTGTGCCCATCTACGACC-3'; 下游引物为5'-AGGGGCCGGACTCGTCATAGA-3', 扩增片断长度为242 bp. PCR反应体系: 2×Taq PCR MasterMix 12.5 µL, β-actin上、下游引物各1 µL, SLP-2上、下游引物各1 µL, cDNA 2 µL, ddH2O补至25 µL. PCR反应在2400型PCR仪(美国PE公司产品)上进行, 预变性: 94 ℃, 5 min, 进入循环: 94 ℃, 30 s, 55 ℃, 30 s, 72 ℃, 50 s, 共30个循环, 最后延伸72 ℃, 7 min, 获取扩增片断.
扩增产物进行1.5%琼脂糖凝胶电泳后, 电泳条带图像用Fluor-S MutiImager凝胶成像仪(美国Bio-Rad公司产品)扫描, 用Multi-Analyst软件包(美国Bio-Rad公司产品)定量分析电泳分离的各特异扩增条带的原始A值, 以SLP-2与β-actin的A值的比值表示SLP-2 mRNA的相对表达水平.
统计学处理 采用SPSS16.0软件进行统计分析. 采用χ2检验及方差分析, 组间比较用LSD-t检验. P<0.05为差异有统计学意义.
与两对照组相比, 转染SLP-2 siRNA组瘤体体积明显减小, 3组比较差异有统计学意义(P = 0.007)(表1, 图1). 组间比较, 转染SLP-2 siRNA组与两对照组相比差异均有统计学意义(P = 0.009, P = 0.003), 而两对照组之间差异无统计学意义(P = 0.580), 移植瘤生长抑制率分别为: 26.74%和30.15%.
| 分组 | 移植瘤体积(mm3) | F值 | P值 |
| 转染SLP-2 siRNA组 | 662.60±115.65 | ||
| 阴性对照组 | 904.40±146.59 | 7.839 | 0.007 |
| 空白对照组 | 948.60±102.42 |
转染SLP-2 siRNA组的移植瘤细胞AI与两对照组相比较, 差异无统计学意义(P = 0.513)(表2, 图2).
| 分组 | 凋亡指数(%) | F值 | P值 |
| 转染SLP-2 siRNA组 | 8.18±1.21 | ||
| 阴性对照组 | 7.08±2.07 | 0.706 | 0.513 |
| 空白对照组 | 7.28±1.25 |
siRNA对裸鼠移植瘤SLP-2蛋白表达的影响: 转染SLP-2 siRNA组染色积分与两对照组相比, 差异有统计学意义(P = 0.000), 组间比较, 转染SLP-2 siRNA组与两对照组相比差异均有统计学意义(P = 0.000, P = 0.000), 阴性对照组和空白对照组相比无显著差异(P = 0.781)(表3).
| 分组 | SLP-2染色积分 | F值 | P值 |
| 注射SLP-2 siRNA组 | 4.20±1.31 | ||
| 阴性对照组 | 8.20±0.84 | 22.757 | 0 |
| 空白对照组 | 8.40±1.14 |
siRNA对裸鼠移植瘤SLP-2 mRNA表达的影响 转染SLP-2 siRNA组与两对照组相比, 差异有统计学意义(P = 0.000, 表4). 组间比较, 转染SLP-2 siRNA组与两对照组相比差异均有统计学意义(P = 0.000, P = 0.000), 阴性对照组和空白对照组相比无显著差异(P = 0.337)(表4).
| 分组 | SLP-2/β-catin | F值 | P值 |
| 注射SLP-2 siRNA组 | 0.74±0.10 | ||
| 阴性对照组 | 1.16±0.10 | 33.572 | 0 |
| 空白对照组 | 1.11±0.06 |
SLP-2基因是2000年首次发现并命名的一个新基因, 并在当时被鉴定为细胞膜相关蛋白[2]. SLP-2基因其含有Stomatin家族的保守序列而被认为是stomatin家族的一个新成员. Stomatin蛋白广泛存在于不同种属的多种组织中, 是一种整合膜蛋白, Stomatin及其同源物可能作为离子通道和细胞骨架之间的连接分子, 从而影响细胞信号传导通路和细胞骨架[6,7]. SLP-2基因定位于染色体9P13.1, 长约3250 bp, SLP-2蛋白具有Stomatin基因家族所共有的SPFH(stomatin/prohibitin/flotillin/hflk)结构域, 但不具有其他Stomatin家族成员所共有的N-端疏水结构域[2], 因此推测, SLP-2蛋白可能是一种细胞质膜相关蛋白, 但不直接整合到细胞膜脂质双层结构中, 可能作为外周膜蛋白起作用, 调控离子通道和脂筏结构[2,8]. 近年来关于线粒体的蛋白组学研究发现, SLP-2存在于细胞的线粒体中[9], 并与一些线粒体内膜相关蛋白有直接结合, 可能参与调节与其结合的线粒体膜相关蛋白的稳定性[10,11].
张立勇等[3]首次发现SLP-2基因在食管鳞状细胞癌中过表达, 并与肿瘤的发生﹑发展关系密切. 此后的一些研究表明, SLP-2基因在肺癌、子宫内膜癌、结直肠癌[12-17]等恶性肿瘤中也存在高表达. 推测其可能是一个新的癌基因. 在前期工作中, 我们发现SLP-2基因在胃癌组织中高表达. 基于以上研究结果, 本实验构建了胃癌细胞SGC-7901的裸鼠移植瘤模型, 观察SLP-2 siRNA对体内胃癌细胞的作用, 研究发现, SLP-2 siRNA能抑制裸鼠体内胃癌的生长, 但对细胞凋亡无明显影响.
因此我们认为SLP-2 siRNA能够抑制体内胃癌的生长, 对胃癌细胞的凋亡无明显影响, 且对裸鼠的生长并无影响. SLP-2在恶性肿瘤发生发展中的作用机制尚未明确, 推测可能与调节细胞信号传导通路及线粒体能量代谢有关. 近年来的研究表明, 细胞信号传导通路在细胞的分裂增殖及凋亡过程中发挥着重要作用, 传导通路的异常(异常活跃/传导受阻)会导致细胞生长、分裂和增殖等的异常, 可使细胞增殖失控, 凋亡受阻, 细胞的侵袭和转移能力增强. SLP-2蛋白作为一种膜相关蛋白, 与细胞信号通路密切相关, 可能通过对信号通路的调节参与恶性肿瘤的发生、发展. 有文献报道, SLP-2蛋白可能通过与Rho家族蛋白的相互作用, 参与细胞信号传导通路来调节肿瘤细胞的侵袭转移能力[18]; 祁代华等[15]的研究也显示, 结直肠癌组织中SLP-2和Rho家族CDC42蛋白表达呈正相关, 且与结直肠癌的Dukes分期、淋巴结转移相关. 此外, Hájek等[10]发现使用siRNA降低Hela细胞中SLP-2的表达量, 可以引起线粒体膜电势的降低. Wang等[5]的研究发现, 转染siRNA降低食管癌KYSE150细胞中SLP-2表达后, KYSE150细胞发生线粒体膜电势和ATP水平降低, 同时伴有细胞运动能力下降及细胞增殖能力减弱, 推测SLP-2可能通过影响细胞的能量代谢参与肿瘤细胞的增殖和转移. 目前对SLP-2的研究不多, 对SLP-2在恶性肿瘤中作用机制的研究仍处于起步阶段, 有待进一步探索.
SLP-2基因是2000年发现并命名的一个新基因. 研究表明, SLP-2基因在食管癌、肺癌、子宫内膜癌、结直肠癌等恶性肿瘤中高表达. 推测其可能是一个新的癌基因. 在前期工作中, 我们采用RT-PCR法及免疫组织化学法发现SLP-2基因在胃癌组织中的表达明显高于癌旁正常胃组织.
肖秀英, 副主任医师, 上海市徐汇区中心医院肿瘤科; 于颖彦, 教授, 瑞金医院消化外科研究所与器官移植中心
目前SLP-2与恶性肿瘤的关系及其作用机制是研究热点.
研究显示, SLP-2基因在食管癌、肺癌、子宫内膜癌、乳腺癌、前列腺癌、结直肠癌、肝癌等恶性肿瘤中存在高表达, 将SLP-2正义核酸和反义核酸导入食管癌、肺癌和子宫内膜癌细胞系, 发现SLP-2正义核酸可促进癌细胞增殖、抑制细胞凋亡, 并能提高癌细胞的转移能力, 而反义核酸的作用相反.
本实验首次通过建立裸鼠移植瘤模型, 研究SLP-2基因沉默对在体胃癌细胞生长及凋亡的影响. 结果表明, SLP-2 siRNA可抑制人胃癌裸鼠移植瘤的生长, 但对细胞凋亡无影响, 提示SLP-2基因参与促进胃癌细胞增殖.
本实验发现SLP-2 siRNA对体内胃癌细胞的增殖有抑制作用, 为寻找胃癌治疗的基因靶点提供了参考依据.
本文立题新颖, 相关报道不多, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Wang Y, Morrow JS. Identification and characterization of human SLP-2, a novel homologue of stomatin (band 7.2b) present in erythrocytes and other tissues. J Biol Chem. 2000;275:8062-8071. [PubMed] [DOI] |
| 3. | 张 立勇, 王 涛, 丁 芳, 刘 仲敏, 刘 芝华, 李 衍达. SLP-2基因在食管鳞癌中的差异表达及其生物信息学分析. 世界华人消化杂志. 2004;12:1517-1521. [DOI] |
| 5. | Wang Y, Cao W, Yu Z, Liu Z. Downregulation of a mitochondria associated protein SLP-2 inhibits tumor cell motility, proliferation and enhances cell sensitivity to chemotherapeutic reagents. Cancer Biol Ther. 2009;8:1651-1658. [PubMed] |
| 6. | Stewart GW, Hepworth-Jones BE, Keen JN, Dash BC, Argent AC, Casimir CM. Isolation of cDNA coding for an ubiquitous membrane protein deficient in high Na+, low K+ stomatocytic erythrocytes. Blood. 1992;79:1593-1601. [PubMed] |
| 7. | Hiebl-Dirschmied CM, Entler B, Glotzmann C, Maurer-Fogy I, Stratowa C, Prohaska R. Cloning and nucleotide sequence of cDNA encoding human erythrocyte band 7 integral membrane protein. Biochim Biophys Acta. 1991;1090:123-124. [PubMed] [DOI] |
| 8. | Sprenger RR, Speijer D, Back JW, De Koster CG, Pannekoek H, Horrevoets AJ. Comparative proteomics of human endothelial cell caveolae and rafts using two-dimensional gel electrophoresis and mass spectrometry. Electrophoresis. 2004;25:156-172. [PubMed] [DOI] |
| 9. | Chevallet M, Lescuyer P, Diemer H, van Dorsselaer A, Leize-Wagner E, Rabilloud T. Alterations of the mitochondrial proteome caused by the absence of mitochondrial DNA: A proteomic view. Electrophoresis. 2006;27:1574-1583. [PubMed] |
| 10. | Hájek P, Chomyn A, Attardi G. Identification of a novel mitochondrial complex containing mitofusin 2 and stomatin-like protein 2. J Biol Chem. 2007;282:5670-5681. [PubMed] [DOI] |
| 11. | Da Cruz S, Parone PA, Gonzalo P, Bienvenut WV, Tondera D, Jourdain A, Quadroni M, Martinou JC. SLP-2 interacts with prohibitins in the mitochondrial inner membrane and contributes to their stability. Biochim Biophys Acta. 2008;1783:904-911. [PubMed] |
| 13. | Chang D, Ma K, Gong M, Cui Y, Liu ZH, Zhou XG, Zhou CN, Wang TY. SLP-2 overexpression is associated with tumour distant metastasis and poor prognosis in pulmonary squamous cell carcinoma. Biomarkers. 2010;15:104-110. [PubMed] [DOI] |
| 17. | Cao W, Zhang B, Liu Y, Li H, Zhang S, Fu L, Niu Y, Ning L, Cao X, Liu Z. High-level SLP-2 expression and HER-2/neu protein expression are associated with decreased breast cancer patient survival. Am J Clin Pathol. 2007;128:430-436. [PubMed] [DOI] |
| 18. | Horiuchi A, Imai T, Wang C, Ohira S, Feng Y, Nikaido T, Konishi I. Up-regulation of small GTPases, RhoA and RhoC, is associated with tumor progression in ovarian carcinoma. Lab Invest. 2003;83:861-870. [PubMed] |