修回日期: 2013-05-19
接受日期: 2013-05-25
在线出版日期: 2013-06-28
目的: 研究抑癌基因WWOX与p53在胃癌(gastric cancer, GC)中的表达及相互关系, 探讨其在GC发生、发展中可能的机制.
方法: 随机选择手术切除的GC石蜡标本70例及相应癌旁正常组织的石蜡标本20例, 采用免疫组织化学的方法检测WWOX、p53蛋白表达. 对所得数据进行统计学分析.
结果: p53蛋白在GC中的表达率为51.42%(36/70), 癌旁正常组织的表达率为0.00%(0/20); 淋巴结转移组表达显著高于无转移组(χ2 = 4.79, P<0.05); 晚期GC组表达高于早期GC(χ2 = 6.62, P<0.05). WWOX蛋白在GC中的表达率为41.43%(29/70), 癌旁正常组织的表达率为90.00%(18/20); 淋巴结转移组与无转移组相比, 无统计学意义(χ2 = 0.29, P>0.05); 晚期GC显著低于早期GC(χ2 = 9.36, P<0.05). WWOX与p53表达呈负相关(r = -0.61, P<0.05).
结论: p53、WWOX蛋白在GC中表达, 与浸润深度、淋巴结转移、临床分期相关, 二者在GC发生、发展中相互作用.
核心提示: p53蛋白在胃癌(gastric cancer, GC)组织中高表达; WWOX蛋白在GC组织中低表达或表达缺失; WWOX与p53可能在GC发生发展中相互作用, 使GC分化差, 预后欠佳.
引文著录: 李小华, 何利平, 罗忠金. 抑癌基因WWOX与p53在胃癌组织中的表达及相互关系. 世界华人消化杂志 2013; 21(18): 1701-1707
Revised: May 19, 2013
Accepted: May 25, 2013
Published online: June 28, 2013
AIM: To examine the expression of WWOX and p53 proteins in gastric cancer, and to analyze the possible mechanisms behind the malignant growth of gastric cancer.
METHODS: The expression of WWOX and p53 proteins was detected by immunohistochemistry in 70 paraffin-embedded samples of gastric cancer and 20 tumor-adjacent normal tissue samples. Statistical analyses were then performed to analyze the relationship between WWOX and p53 expression and clinicopathologic parameters of gastric cancer.
RESULTS: The positive rate of expression of p53 protein in gastric cancer was significantly higher than that in normal gastric tissue (51.42% vs 0.00%, P < 0.05). Expression of p53 protein in gastric cancer was related with depth of invasion, lymph node metastasis, and tumor clinical stage (all P < 0.05). The positive rate of expression of WWOX protein was significantly lower in gastric cancer than in normal gastric tissue (41.43% vs 90.00%, P < 0.05). Expression of WWOX protein in gastric cancer was related with depth of invasion and clinical stage, but not with lymph node metastasis. There is a negative correlation between WWOX and p53 expression in gastric cancer.
CONCLUSION: Detection of expression of p53 protein and WWOX proteins might be useful for early diagnosis and evaluation of prognosis of gastric cancer.
- Citation: Li XH, He LP, Luo ZJ. Expression of WWOX and p53 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(18): 1701-1707
- URL: https://www.wjgnet.com/1009-3079/full/v21/i18/1701.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i18.1701
胃癌(gastric cancer, GC)为全球第4大恶性肿瘤, 在癌症中的致死率位居第2位, 因其高发病率、高病死率及诊断的滞后性, GC成为威胁人类健康的主要问题. 从分子遗传学的角度而言, GC是一种基因病. GC的发生不仅仅是单个基因突变的结果, 而且是一个长期的分阶段的多基因突变累积的过程. 环境的和遗传的致癌因素引起细胞遗传物质(DNA)改变的主要靶基因是原癌基因和抑癌基因, 原癌基因的激活和或抑癌基因的失活均可导致细胞的恶性转化. WWOX、p53同为抑癌基因, 且WWOX抑制肿瘤生长和诱导细胞凋亡的过程与p53相关, 故WWOX、p53基因中任何一者的表达降低、升高或p53基因的突变都可能成为影响GC发生、发展及转移的重要因素. 目前, 国内外将这两个基因放在一起, 研究他们在GC中的表达及相互关系的资料少见.
本研究致力于探讨抑癌基因WWOX、p53在各种类型GC组织中的表达情况及其相互关系, 以期寻求GC特异、敏感的生物学标志物甚或靶向治疗靶点, 为GC的早期诊断、早期治疗提供更多的思路.
随机选取2007-01/2010-06于厦门市第二医院普外科行根治手术切除的70例GC患者的石蜡标本, 包括GC组织70例, 其中, 男41例, 女29例, 平均年龄62.3岁, 及与GC组织相对应的癌旁正常组织20例, 所有病例术前均未行化疗及放疗, 术后均经病理证实. 纳入标准: (1)首次发病的患者; (2)原发GC患者; (3)术前未接受放疗及化疗的患者; (4)石蜡标本可取用的患者. 排除标准: (1)术前接受化疗或放疗的患者; (2)合并其他恶性疾病的患者. WWOX兔抗人多克隆抗体(ab33248), 购自美国Abcom公司; p53鼠抗人单克隆抗体(MAB-0142), 购自福州迈新生物科技有限公司.
运用免疫组织化学(Elivison二步法)检测WWOX、p53二种基因在GC组织及其癌旁组织的表达. 各步骤时间在每个批次实验中保持一致, 设置阴性阳性对照. 以已知阳性表达的切片作为阳性对照. 以PBS代替一抗作为阴性对照. 由两位主治以上的病理科医师双盲法观察切片判断蛋白的表达结果.
统计学处理 对所得数据进行四格表、行×列表χ2检验及Sperman秩相关分析, P<0.05为差异有统计学意义.
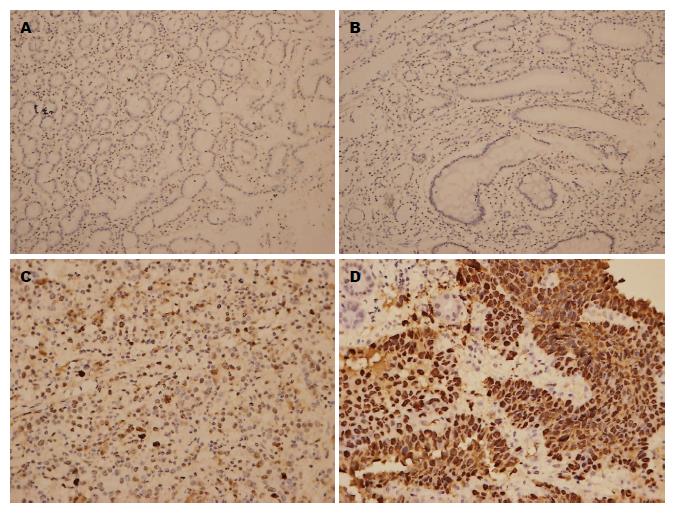
p53蛋白表达于癌细胞腺体细胞核, 呈黄至棕褐色颗粒分布.
癌旁正常组织中p53蛋白阳性表达0.00%(0/20); GC p53蛋白表达阳性率51.43%(36/70), 与癌旁正常组织相比, 差异有统计学意义(χ2 = 17.12, P<0.05)(表1, 图1).
| 分组 | n | p53表达情况 | 阳性率(%) | χ2值 | P值 | |||
| - | + | ++ | +++ | |||||
| 17.12 | <0.005 | |||||||
| 胃癌 | 70 | 34 | 4 | 12 | 20 | 51.43 | ||
| 胃癌旁正常组织 | 20 | 20 | 0 | 0 | 0 | 0 | ||
GC p53蛋白阳性表达率差异与年龄(χ2 = 0.18, P>0.05)、性别(χ2 = 0.01, P>0.05)、肿瘤大小(χ2 = 0.23, P>0.05)、肉眼形态(χ2 = 1.12, P>0.05)无关, 差异无统计学意义; 与GC浸润深度(χ2 = 11.97, P<0.05)、淋巴结转移(χ2 = 4.79, P<0.05)、临床分期(χ2 = 6.62, P<0.05)相关, 差异有统计学意义(表2).
| 临床病理学特征 | n | p53表达情况 | 阳性率(%) | χ2值 | P值 | |||
| - | + | ++ | +++ | |||||
| 年龄(岁) | 0.18 | 0.500< P<0.750 | ||||||
| <59 | 23 | 12 | 1 | 5 | 5 | 47.83 | ||
| ≥59 | 47 | 22 | 3 | 7 | 15 | 53.19 | ||
| 性别 | 0.01 | > 0.900 | ||||||
| 男 | 41 | 19 | 3 | 6 | 13 | 53.66 | ||
| 女 | 29 | 15 | 1 | 6 | 7 | 48.28 | ||
| 肉眼形态 | 1.12 | 0.500< P<0.750 | ||||||
| 浸润型 | 25 | 18 | 2 | 1 | 4 | 28 | ||
| 隆起型 | 13 | 5 | 1 | 6 | 1 | 61.54 | ||
| 溃疡型 | 32 | 11 | 1 | 5 | 15 | 65.63 | ||
| 肿瘤大小(cm) | 0.23 | 0.500< P<0.750 | ||||||
| <4 | 43 | 29 | 1 | 4 | 9 | 32.56 | ||
| ≥4 | 27 | 5 | 3 | 8 | 11 | 81.48 | ||
| 浸润深度 | 11.97 | <0.005 | ||||||
| T1-2 | 4 | 4 | 0 | 0 | 0 | 0 | ||
| T3 | 16 | 12 | 2 | 1 | 1 | 25 | ||
| T4 | 50 | 18 | 2 | 11 | 19 | 64 | ||
| 淋巴结转移 | 4.79 | 0.025< P<0.050 | ||||||
| 无 | 24 | 16 | 4 | 2 | 2 | 33.33 | ||
| 有 | 46 | 18 | 0 | 10 | 18 | 60.87 | ||
| TNM分期 | 6.62 | 0.025< P<0.050 | ||||||
| Ⅰ-Ⅱ期 | 17 | 12 | 2 | 2 | 1 | 29.41 | ||
| Ⅲ期 | 32 | 16 | 1 | 7 | 8 | 50 | ||
| Ⅳ期 | 21 | 6 | 1 | 3 | 11 | 71.43 | ||
WWOX蛋白表达于腺体细胞浆, 呈黄色颗粒分布.
无论GC组织还是对照组织, WWOX蛋白的阳性颗粒均主要分布于腺体的细胞浆. GC组织中WWOX蛋白阳性表达率41.43%(29/70), 癌旁正常组织中WWOX蛋白阳性表达率90.00%(18/20), 两者相比, 差异有统计学意义(χ2 = 14.71, P<0.05)(表3, 图2).
| 分组 | n | WWOX表达情况 | 阳性率(%) | χ2值 | P值 | |||
| - | + | ++ | +++ | |||||
| 14.71 | <0.005 | |||||||
| 胃癌 | 70 | 41 | 13 | 8 | 8 | 41.43 | ||
| 胃癌旁正常组织 | 20 | 2 | 1 | 4 | 13 | 90.00 | ||
GC WWOX蛋白阳性表达率差异与年龄(χ2 = 0.62, P>0.05)、性别(χ2 = 0.24, P>0.05)、肉眼形态 (χ2 = 2.38, P>0.05)、肿瘤大小(χ2 = 0.17, P>0.05)、淋巴结转移(χ2 = 0.29, P>0.05)无关, 差异无统计学意义; 与浸润深度(χ2 = 6.69, P<0.05)、临床分期(χ2 = 9.36, P<0.05)相关, 差异有统计学意义(表4).
| 临床病理学特征 | n | WWOX表达情况 | 阳性率(%) | χ2值 | P值 | |||
| - | + | ++ | +++ | |||||
| 年龄(岁) | 0.62 | 0.250< P<0.500 | ||||||
| <59 | 23 | 15 | 5 | 2 | 1 | 34.78 | ||
| ≥59 | 47 | 26 | 8 | 8 | 5 | 44.68 | ||
| 性别 | 0.24 | 0.500< P<0.750 | ||||||
| 男 | 41 | 25 | 6 | 7 | 3 | 39.02 | ||
| 女 | 29 | 16 | 7 | 3 | 3 | 44.83 | ||
| 肉眼形态 | 2.38 | 0.250< P<0.500 | ||||||
| 浸润型 | 25 | 13 | 6 | 2 | 4 | 48.00 | ||
| 隆起型 | 13 | 10 | 3 | 0 | 0 | 23.08 | ||
| 溃疡型 | 32 | 18 | 4 | 8 | 2 | 43.75 | ||
| 肿瘤大小(cm) | 0.17 | 0.500< P<0.750 | ||||||
| <4 | 43 | 26 | 11 | 5 | 1 | 39.53 | ||
| ≥4 | 27 | 15 | 2 | 5 | 5 | 44.44 | ||
| 浸润深度 | 6.69 | 0.025< P<0.050 | ||||||
| T1-2 | 1 | 1 | 0 | 2 | 1 | 75.00 | ||
| T3 | 16 | 6 | 3 | 2 | 5 | 62.50 | ||
| T4 | 50 | 34 | 10 | 6 | 0 | 32.00 | ||
| 淋巴结转移 | 0.29 | 0.500< P<0.750 | ||||||
| 无 | 24 | 13 | 2 | 4 | 5 | 45.83 | ||
| 有 | 46 | 28 | 11 | 6 | 1 | 39.13 | ||
| TNM分期 | 9.36 | 0.005< P<0.010 | ||||||
| Ⅰ-Ⅱ期 | 17 | 7 | 4 | 4 | 2 | 58.82 | ||
| Ⅲ期 | 32 | 16 | 7 | 5 | 1 | 50.00 | ||
| Ⅳ期 | 21 | 18 | 2 | 1 | 0 | 14.28 | ||
WWOX和p53共同阳性表达率为28.57%(20/70), WWOX和p53共同阴性表达率为35.71%(25/70), WWOX+/p53表达率为12.86%(9/70), WWOX-/p53+表达率为22.86%(16/70), 经Sperman秩相关分析, χ2 = 6.10, P<0.05, 有统计学意义, 认为两者在GC中的表达相关, 结合相关系数r = -0.61, 认为两者在GC中的表达呈负相关(表5).
| WWOX | p53 | 合计 | |
| - | + | ||
| - | 25 | 16 | 41 |
| + | 9 | 20 | 29 |
| 合计 | 34 | 36 | 70 |
1979年, Lane等[1,2]运用SV40抗T抗体的联合免疫沉淀法, 在SV40转化细胞提取物中发现了与T抗原同时存在的一种特殊的蛋白质, 因分子质量为53 ku, 故将其命名为p53. p53蛋白存在两种形态: 野生型(wtp53)和突变型(mtp53). 目前证实, wtp53蛋白的功能是诱导细胞凋亡. 相反, mtp53在细胞内累积则可抑制细胞凋亡, 促进细胞转化和增殖, 导致肿瘤细胞发生.
p53蛋白阳性反应物均聚集在癌变细胞核内, 相应正常黏膜上皮细胞核内未见阳性表达, 这与国内外文献报告相一致[3-8]. 实验组GC p53蛋白表达率高(51.42%), 对照组癌旁正常组织p53蛋白表达缺失(0.00%). 实验组p53蛋白表达阳性率与其对照组相比, 差异具有统计学意义(P<0.05), 说明抑癌基因p53参与了GC的发生、发展. GC组织p53蛋白表达的阳性率虽高, 并不是所有GC组织均有p53蛋白表达, 可能原因为: 部分突变型p53基因失去合成蛋白的能力; 肿瘤的发生具有基因多态性, GC也不例外. 本研究GC p53蛋白阳性表达率高于国内外文献报道的水平, 不排除与区域性致癌因素相关.
Barnes等[9]与Duman等[10]发现: 乳腺浸润性导管癌p53蛋白阳性表达率明显高于乳腺导管内癌. Giatromanolaki等、Yuan等及Bonnefoi等[11-13]发现大结节晚期肝癌表达率明显高于小结节早期肝癌. 本研究发现: p53蛋白的阳性表达率随着GC浸润程度的增加而增加, 即浸润达肌层(25.00%)及浆膜以外(64.00%)的晚期GC远高于浸润仅达黏膜层或黏膜下层(0.00%)的早期GC, 差异具有统计学意义(P<0.05), 提示GC p53蛋白的表达率高低可辅助判断肿瘤浸润性生长的情况. GC淋巴结转移组p53蛋白阳性表达率(60.9%)明显高于无转移组(33.3%), 差异具有统计学意义(P<0.05). 这与Martin等[14]及Choi等[15]报告的结果相一致, 提示p53蛋白阳性的GC细胞更容易发生淋巴结转移, 生存期短. GCTNM Ⅰ-Ⅱ、TNM Ⅲ、TNM Ⅳ期p53蛋白的阳性表达率分别为29.41%、50.00%、71.43%, 差异具有统计学意义(P<0.05), 提示p53蛋白的阳性表达率越高, 临床分期越晚. 本研究还发现p53蛋白的过表达与GC患者的年龄、性别、肿瘤大小无关.
总之, p53蛋白参与了GC的发生、分化、浸润、转移等过程. GC患者p53阳性者明显存在组织分化差、淋巴结转移率高、临床分期晚、预后差的现象, 可作为GC早期诊断、早期治疗及估计预后的指标之一.
2000年, Bednarek等与Chen等[16-18]应用鸟枪基因测序技术, 通过对感兴趣区域的转录子进行分离分析, 鉴别出一种新的抑癌基因, 即含有WW结构域的WWOX. WWOX蛋白含有414个氨基酸, 是一种促凋亡蛋白, 参与了多种信号转导途径[19-27]: 增强TNF介导的细胞毒性, 与TNF凋亡途径中的TRADD和TRAF2作用; 与IkBa、p53凋亡途径中的p53作用等.
Aqeilan等[28]在81例胃腺癌样本中发现: 31%的病例存在WWOX杂合子丢失, 65%的原发胃腺癌标本和33%的GC细胞株中WWOX蛋白表达缺失, 显示在GC发生中可能有WWOX基因突变事件. 同文献报道, 本研究检测出WWOX蛋白表达于部分癌病及正常腺体细胞浆, 实验组GC WWOX蛋白阳性表达率为41.43%, 对照组癌旁正常组织WWOX表达90.00%, 实验组WWOX蛋白表达阳性率与其对照组相比, 差异具有统计学意义(P<0.05), 提示抑癌基因WWOX参与了GC的发生、发展.
胡浩等与李帅等[29,30]运用RT-PCR法测WWOX mRNA在GC组织中的表达, 得出结论WWOX表达与GC淋巴结和远处转移无关(P>0.05). 本研究运用免疫组织化学的方法发现: GC淋巴结转移组WWOX蛋白阳性表达率为45.83%, GC无淋巴结转移组的WWOX蛋白阳性表达率为39.13%, 差异无统计学意义(P>0.05), 和胡浩等[29,30]的研究结果相同, 支持WWOX蛋白表达与GC淋巴结是否转移无关.
本研究发现, GC细胞浸润仅达黏膜层或黏膜下层者WWOX蛋白的阳性表达率为75.00%, 癌细胞浸润仅达肌层者WWOX蛋白的阳性表达率62.50%, 癌细胞浸润达浆膜以外者WWOX蛋白的阳性表达率为32.00%, 差异具有统计学意义(P<0.05), 提示WWOX参与了GC的浸润, 浸润程度越深, WWOX蛋白的阳性表达率越低. GC TNM Ⅰ-Ⅱ、TNM Ⅲ、TNM Ⅳ期WWOX蛋白的阳性表达率分别为58.82%、50.00%、14.28%, 差异具有统计学意义(P<0.05), 提示WWOX蛋白的表达与GC的临床分期明显相关.
总之, WWOX蛋白可能参与了GC的发生、分化、浸润等过程, 可作为GC早期诊断、及预后评估的指标之一.
目前, 国内外部分研究表明WWOX与p53同为抑癌基因, 且WWOX抑制肿瘤生长和诱导细胞凋亡的过程与p53基因相关. 本研究发现WWOX与p53基因的表达呈负相关, 说明p53与WWOX在GC发生发展过程中可能存在协同作用, 但二者的共同作用机制如何,在肿瘤发生发展的哪个阶段作用, 需要我们扩大标本量, 采用Western blot、免疫共沉淀等方法在基因突变等方面做进一步研究, 才能揭示其中的奥秘. 在治疗方面, 针对p53的基因治疗药物已在临床上得到应用, 但针对WWOX的基因治疗药物目前研究甚少, p53与WWOX状态的改变对化疗敏感性影响的报道也鲜见, 我们有必要进一步研究联合检测p53与WWOX相关基因在GC方面的靶向治疗及个体化治疗.
胃癌(gastric cancer, GC)为全球第4大恶性肿瘤, 从分子遗传学的角度而言, GC是一种基因病, GC的发生不仅仅是单个基因突变的结果, 而且是一个长期的分阶段的多基因突变累积的过程, 亦称为GC的基因多态性, 原癌基因的激活和/或抑癌基因的失活均可导致细胞的恶性转化. 国内外相关资料显示: 抑癌基因WWOX、p53可能在GC的发生、发展、侵袭中相互作用.
刘颖斌, 主任医师, 上海交通大学医学院附属新华医院
p53蛋白在GC组织中高表达;与GC的组织分化程度、淋巴结转移、浸润深度、临床分期相关; 检测p53蛋白表达对GC的早期诊断和预后评估有十分重要的临床意义. WWOX蛋白在GC组织中低表达或表达缺失, 在癌旁正常组织中高表达; WWOX蛋白的表达与GC的组织分化程度、GC浸润深度、临床分期相关, 但与淋巴结转移无相关; 检测WWOX蛋白表达对GC的早期诊断和预后评估有十分重要的临床意义. WWOX与p53蛋白表达呈负相关, 提示WWOX与p53可能在GC发生发展中相互作用, 使GC分化差, 预后不好.
本研究发现WWOX与p53基因的表达呈负相关, 说明p53与WWOX在GC发生发展过程中可能存在协同作用, 但二者的共同作用机制如何, 在肿瘤发生发展的哪个阶段作用, 需要我们扩大标本量, 采用Western blot、免疫共沉淀等方法在基因突变等方面做进一步研究, 才能揭示其中的奥秘. 在治疗方面, 针对p53的基因治疗药物已在临床上得到应用, 但针对WWOX的基因治疗药物目前研究甚少, p53与WWOX状态的改变对化疗敏感性影响的报道也鲜见, 我们有必要进一步研究联合检测p53与WWOX相关基因在GC方面的靶向治疗及个体化治疗.
本文设计合理科学, 结论可信, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Lane DP, Crawford LV. T antigen is bound to a host protein in SV40-transformed cells. Nature. 1979;278:261-263. [PubMed] [DOI] |
| 2. | Lane DP, Crawford LV. The complex between simian virus 40 T antigen and a specific host protein. Proc R Soc Lond B Biol Sci. 1980;210:451-463. [PubMed] [DOI] |
| 4. | Iggo R, Gatter K, Bartek J, Lane D, Harris AL. Increased expression of mutant forms of p53 oncogene in primary lung cancer. Lancet. 1990;335:675-679. [PubMed] [DOI] |
| 5. | Ishida S, Yamashita T, Nakaya U, Tokino T. Adenovirus-mediated transfer of p53-related genes induces apoptosis of human cancer cells. Jpn J Cancer Res. 2000;91:174-180. [PubMed] [DOI] |
| 6. | Escher A, Piotet E, Waridel F, Iggo R, Monnier P. p53 Mutation in histologically normal mucosa of the aero-digestive tract is not a marker of increased risk for second primary carcinoma in head and neck cancer patients. Eur Arch Otorhinolaryngol. 2009;266:547-551. [PubMed] [DOI] |
| 7. | Kaeser MD, Pebernard S, Iggo RD. Regulation of p53 stability and function in HCT116 colon cancer cells. J Biol Chem. 2004;279:7598-7605. [PubMed] [DOI] |
| 8. | Meinhold-Heerlein I, Ninci E, Ikenberg H, Brandstetter T, Ihling C, Schwenk I, Straub A, Schmitt B, Bettendorf H, Iggo R. Evaluation of methods to detect p53 mutations in ovarian cancer. Oncology. 2001;60:176-188. [PubMed] [DOI] |
| 9. | Barnes DM, Dublin EA, Fisher CJ, Levison DA, Millis RR. Immunohistochemical detection of p53 protein in mammary carcinoma: an important new independent indicator of prognosis? Hum Pathol. 1993;24:469-476. [PubMed] [DOI] |
| 10. | Duman BB, Sahin B, Acikalin A, Ergin M, Zorludemir S. PTEN, Akt, MAPK, p53 and p95 expression to predict trastuzumab resistance in HER2 positive breast cancer. J BUON. 2013;18:44-50. [PubMed] |
| 11. | Giatromanolaki A, Koukourakis MI, Stathopoulos GP, Kapsoritakis A, Paspatis G, Kakolyris S, Sivridis E, Georgoulias V, Harris AL, Gatter KC. Angiogenic interactions of vascular endothelial growth factor, of thymidine phosphorylase, and of p53 protein expression in locally advanced gastric cancer. Oncol Res. 2000;12:33-41. [PubMed] |
| 12. | Yuan RH, Jeng YM, Hu RH, Lai PL, Lee PH, Cheng CC, Hsu HC. Role of p53 and β-catenin mutations in conjunction with CK19 expression on early tumor recurrence and prognosis of hepatocellular carcinoma. J Gastrointest Surg. 2011;15:321-329. [PubMed] [DOI] |
| 13. | Bonnefoi H, Ducraux A, Movarekhi S, Pelte MF, Bongard S, Lurati E, Iggo R. p53 as a potential predictive factor of response to chemotherapy: feasibility of p53 assessment using a functional test in yeast from trucut biopsies in breast cancer patients. Br J Cancer. 2002;86:750-755. [PubMed] [DOI] |
| 14. | Martin HM, Filipe MI, Morris RW, Lane DP, Silvestre F. p53 expression and prognosis in gastric carcinoma. Int J Cancer. 1992;50:859-862. [PubMed] [DOI] |
| 15. | Choi SW, Park WS, Yang JM, Kang CS, Sun HS, Kim BS, Seo EJ, Lee MJ, Park CS. p53 protein overexpression and allele loss of p53 gene in gastric adenocarcinoma. J Korean Med Sci. 1994;9:299-303. [PubMed] |
| 16. | Bednarek AK, Laflin KJ, Daniel RL, Liao Q, Hawkins KA, Aldaz CM. WWOX, a novel WW domain-containing protein mapping to human chromosome 16q23.3-24.1, a region frequently affected in breast cancer. Cancer Res. 2000;60:2140-2145. [PubMed] |
| 17. | Bednarek AK, Keck-Waggoner CL, Daniel RL, Laflin KJ, Bergsagel PL, Kiguchi K, Brenner AJ, Aldaz CM. WWOX, the FRA16D gene, behaves as a suppressor of tumor growth. Cancer Res. 2001;61:8068-8073. [PubMed] |
| 18. | Chen X, Li P, Yang Z, Mo WN. Expression of fragile histidine triad (FHIT) and WW-domain oxidoreductase gene (WWOX) in nasopharyngeal carcinoma. Asian Pac J Cancer Prev. 2013;14:165-171. [PubMed] |
| 19. | Chang NS, Doherty J, Ensign A, Lewis J, Heath J, Schultz L, Chen ST, Oppermann U. Molecular mechanisms underlying WOX1 activation during apoptotic and stress responses. Biochem Pharmacol. 2003;66:1347-1354. [PubMed] [DOI] |
| 20. | Chang NS, Pratt N, Heath J, Schultz L, Sleve D, Carey GB, Zevotek N. Hyaluronidase induction of a WW domain-containing oxidoreductase that enhances tumor necrosis factor cytotoxicity. J Biol Chem. 2001;276:3361-3370. [PubMed] [DOI] |
| 21. | Chang NS. The non-ankyrin C terminus of Ikappa Balpha physically interacts with p53 in vivo and dissociates in response to apoptotic stress, hypoxia, DNA damage, and transforming growth factor-beta 1-mediated growth suppression. J Biol Chem. 2002;277:10323-10331. [PubMed] [DOI] |
| 22. | Chang NS, Doherty J, Ensign A. JNK1 physically interacts with WW domain-containing oxidoreductase (WOX1) and inhibits WOX1-mediated apoptosis. J Biol Chem. 2003;278:9195-9202. [PubMed] [DOI] |
| 23. | Wu D, Wu S. A conserved serine residue regulates the stability of Drosophila Salvador and human WW domain-containing adaptor 45 through proteasomal degradation. Biochem Biophys Res Commun. 2013;433:538-541. [PubMed] [DOI] |
| 24. | Abdeen SK, Salah Z, Khawaled S, Aqeilan RI. Characterization of WWOX inactivation in murine mammary gland development. J Cell Physiol. 2012; Dec 18. [Epub ahead of print]. [PubMed] [DOI] |
| 25. | Li YP, Wu CC, Chen WT, Huang YC, Chai CY. The expression and significance of WWOX and β-catenin in hepatocellular carcinoma. APMIS. 2013;121:120-126. [PubMed] [DOI] |
| 26. | Sudol M, McDonald CB, Farooq A. Molecular insights into the WW domain of the Golabi-Ito-Hall syndrome protein PQBP1. FEBS Lett. 2012;586:2795-2799. [PubMed] [DOI] |
| 27. | Qin J, Barajas D, Nagy PD. An inhibitory function of WW domain-containing host proteins in RNA virus replication. Virology. 2012;426:106-119. [PubMed] [DOI] |
| 28. | Aqeilan RI, Pekarsky Y, Herrero JJ, Palamarchuk A, Letofsky J, Druck T, Trapasso F, Han SY, Melino G, Huebner K. Functional association between Wwox tumor suppressor protein and p73, a p53 homolog. Proc Natl Acad Sci U S A. 2004;101:4401-4406. [PubMed] [DOI] |