修回日期: 2013-03-15
接受日期: 2013-05-19
在线出版日期: 2013-06-18
目的: 探索亚砷酸钠(sodiumarsenite, NaAsO2)对原代培养的大鼠骨髓间充质干细胞(mesenchymal stem cells, MSCs)的氧化应激作用.
方法: 采集4周龄SD大鼠骨髓, 体外培养获得大鼠骨髓MSCs, 取第3代大鼠骨髓MSCs, 将不同浓度NaAsO2(10、20、30、40和50 μmol/L)作用于大鼠骨髓MSCs, 进行染毒, 染毒时间为24 h, 采用细胞毒性试验法观察NaAsO2对大鼠MSCs的细胞毒性作用, 利用2',7'-二乙酰二氯荧光素(2',7'-dichlorofluorescin diacetate, DCFH-DA)检测细胞内活性氧(reactive oxygen species, ROS)水平, 并测定细胞中丙二醛(malondialdehyde, MDA)含量及超氧化物歧化酶(superoxide dismutase, SOD)活力, 同时测定细胞内还原型谷胱甘肽(reduced glutathione, GSH)的含量, Caspase 3试剂盒检测Caspase 3酶活性.
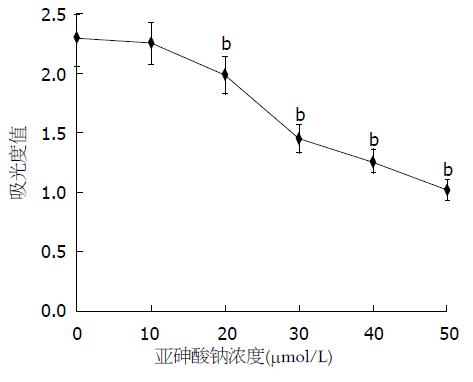
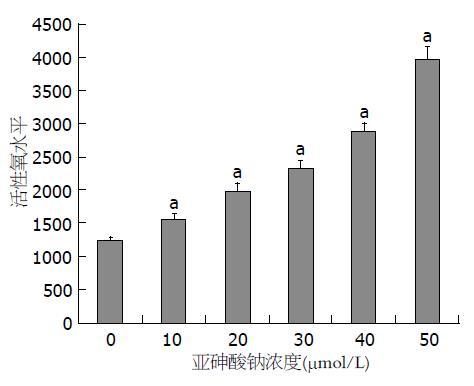
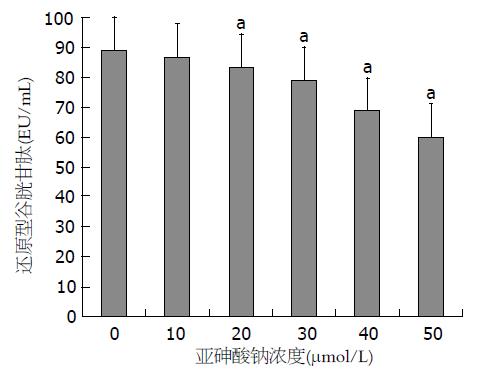
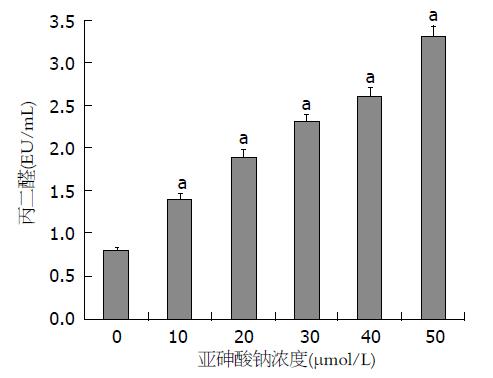
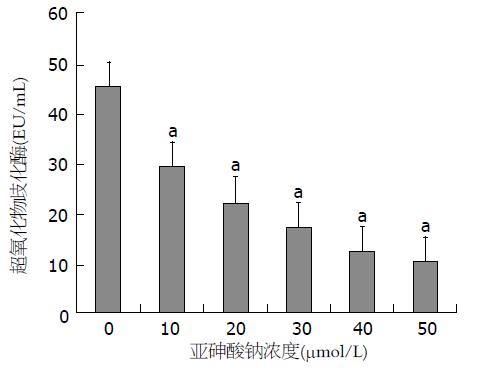
结果: 不同浓度的NaAsO2作用于大鼠骨髓MSCs, 用MTS法进行细胞毒性检测显示, 当NaAsO2浓度≥20 μmol/L时, 大鼠骨髓MSCs吸光度值分别为1.98±0.09、1.45±0.12、1.26±0.11和1.02±0.15, 与对照组比较明显降低(P<0.01); 不同浓度NaAsO2作用于大鼠骨髓MSCs, DCF荧光强度分别为1572±124, 1998±97、2337±210、2878±154和3960±135, 与对照组相比均明显增高(P<0.05); 不同浓度NaAsO2作用于大鼠骨髓MSCs, MDA分别为1.4 EU/mL±0.06 EU/mL、1.9 EU/mL±0.12 EU/mL、2.3 EU/mL±0.08 EU/mL、2.6 EU/mL±0.11 EU/mL和3.3 EU/mL±0.09 EU/mL, 与对照组相比均明显增高(P<0.05); 不同浓度NaAsO2作用于大鼠骨髓MSCs, SOD分别为29 EU/mL±0.19 EU/mL、22 EU/mL±0.12 EU/mL、17 EU/mL±0.06 EU/mL、12 EU/mL±0.11 EU/mL和10 EU/mL±0.06 EU/mL, 与对照组相比均明显降低(P<0.05); 当NaAsO2浓度≥20 μmol/L时, 大鼠骨髓MSCs的GSH分别为75 EU/mL±0.11 EU/mL、71 EU/mL±0.8 EU/mL、62 EU/mL±0.12 EU/mL和54 EU/mL±0.9 EU/mL, 与对照组相比均明显降低(P<0.05).
结论: NaAsO2可以诱导大鼠骨髓MSCs氧化损伤增加, 提示氧化应激可能是NaAsO2致大鼠骨髓MSCs细胞毒作用机制之一.
核心提示: 亚砷酸钠(sodiumarsenite)降低细胞活力, 还原型谷胱甘肽(reduced glutathione, GSH)和超氧化物歧化酶(superoxide dismutase)水平, 增加细胞内活性氧(reactive oxygen species), GSH和丙二醛(malondialdehyde)含量.
引文著录: 吕海龙, 李思源, 慕晓玲, 姜玉峰. 亚砷酸钠对大鼠骨髓间充质干细胞的过氧化损伤. 世界华人消化杂志 2013; 21(17): 1649-1653
Revised: March 15, 2013
Accepted: May 19, 2013
Published online: June 18, 2013
AIM: To investigate the toxic effect of NaAsO2 on rat bone marrow mesenchymal stem cells (MSCs) and to explore the possible mechanism involved.
METHODS: Cultured rat bone MSCs were exposed to different concentrations of NaAsO2 (10, 20, 30, 40 and 50 μmol/L) for 24 h. MTT assay was used to evaluate cell viability. The level of reactive oxygen species (ROS) was detected by staining cells with DCFH-DA. The content of malondialdehyde (MDA) and activity of superoxide dismutase (SOD) in rat bone MSCs were also measured.
RESULTS: Treatment with NaAsO2 significantly decreased cell viability, GSH content and SOD activity, increased ROS and MDA formation, and induced Caspase 3 activation in rat bone MSCs cells.
CONCLUSION: Our findings suggest that NaAsO2-induced oxidative stress may cause MSC apoptosis via mitochondria-dependent signaling pathways.
- Citation: Lv HL, Li SY, Mu XL, Jiang YF. NaAsO2 induces cytotoxicity to rat bone marrow mesenchymal stem cells. Shijie Huaren Xiaohua Zazhi 2013; 21(17): 1649-1653
- URL: https://www.wjgnet.com/1009-3079/full/v21/i17/1649.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i17.1649
砷是自然界存在的有毒类金属元素, 广泛分布于岩石、土壤和水环境中[1]. 砷主要经呼吸道和消化系途径进入机体, 长期摄入会在体内蓄积, 引起慢性砷中毒, 新疆是地方性砷中毒危害较严重的地区之一. 砷暴露所引起的健康损害不仅包括急、慢性砷中毒, 还包括致癌、致畸和致突变作用[2,3], 砷已被国际肿瘤研究中心(International Agency for Research on Cancer, IARC)归类为第一类致癌物[4].
骨髓间充质干细胞(mesenchymal stem cells, MSCs)是存在于体内的正常细胞, 他具有多向分化的潜能, 可以分化为成骨细胞、成软骨细胞、脂肪细胞、肌细胞和神经细胞等[5]. 有关砷的致癌作用机制, 已经开展了一定的研究, 但是砷暴露对干细胞损伤的确切机制目前并不明确, 有关砷暴露对骨髓MSCs的实验研究也不多见. 为了深入研究砷对体内正常干细胞毒性的作用, 本研究采用体外培养的原代骨髓MSCs, 探讨亚砷酸钠(sodiumarsenite, NaAsO2)对大鼠骨髓MSCs细胞的毒性和氧化应激作用, 为进一步阐明砷导致干细胞损伤作用机制提供依据.
CO2培养箱(日本三洋公司); 低温离心机(日本Sigma公司); 倒置相差显微镜(Olympus); 全自动酶标仪(Bio-Tek); 全波长分光光度计(Bio-Tek). NaAsO2(美国Sigma公司); 胰蛋白酶(美国Sigma公司); DMEM培养基和胎牛血清(美国Gibco公司); DCFH-DA(美国Sigma公司); Caspase 3酶活性试剂盒(碧云天公司); CellTiter 96 Aqueous Non-Radioactive cell proliferation Assay试剂盒(美国Promega公司); 超氧化物歧化酶(superoxide dismutase, SOD)试剂盒、丙二醛(malondialdehyde, MDA)试剂盒、还原型谷胱甘肽(reduced glutathione, GSH)(南京建成生物工程研究所).
1.2.1 大鼠骨髓MSCs的分离、扩增和纯化: 4周龄SD大鼠引颈处死后置于750 mL/L乙醇浸泡约1 min, 无菌条件下分离出大鼠的股骨和胫骨, 用注射器冲出骨髓细胞后经4号针头吹打, 制成单细胞悬液. 1000 r/min离心5 min, 弃去上清. 用加有10%胎牛血清的DMEM重悬细胞, 接种于25 cm2的培养瓶, 置37 ℃, 5%CO2培养箱中培养. 3 d后更换培养液, 以后每3-4 d换液1次, 7-10 d细胞生长融合. 经0.25%胰酶消化, 以1×105/mL密度传代培养[6,7]. 最终获得排列呈旋涡状、贴壁生长的长梭形大鼠骨髓MSCs. 取第3代细胞用于染毒实验, 实验组分别加入新鲜配制的不同浓度的NaAsO2, 对照组加入正常培养液.
1.2.2 细胞毒性试验法: 将大鼠骨髓MSCs以每孔1×105/mL接种于96孔板, 待长至85%融合后, 吸出原培养液, 以不同浓度浓度的NaAsO2(10、20、30、40和50 μmol/L)作用于大鼠骨髓MSCs, 37 ℃, 5%CO2培养24 h后, 每孔加20 mL MTS, 继续培养4 h, 于490 nm波长处测定光密度(A)值. A值的大小与活细胞数呈正比关系.
1.2.3 ROS的检测: 利用荧光探DCFH-DA检测细胞内ROS的形成. 大鼠骨髓MSCs用各浓度的NaAsO2作用24 h后, PBS洗2次, 加入含10 µmol/L DCFH-DA的DMEM培养液1 mL至各孔中, 37 ℃孵育30 min, 用DMEM培养液洗去细胞外DCFH-DA, 使用全波长分光光度计测定细胞内DCF荧光强度(激发光485 nm, 发射光528 nm), 用BCA方法进行蛋白定量.
1.2.4 MDA、GSH含量和SOD活力的测定: 将大鼠骨髓MSCs以1×105/mL密度接种于培养皿中, 加入不同浓度浓度的NaAsO2(10、20、30、40和50 µmol/L)处理24 h后收集细胞, 裂解, 12000 g离心10 min, 取上清液. 采用相关试剂盒测定MDA、GSH含量和SOD活力, 用BCA方法进行蛋白定量, 本实验重复3次.
1.2.5 Caspase 3酶活性检测: 以不同浓度的NaAsO2(10、20、30、40和50 µmol/L)处理大鼠骨髓MSCs之后, 离心收集细胞, 加入裂解液, 冰上孵育, 缓冲液Ac-DEVD-pNA孵育, 用BCA方法进行蛋白定量. 用酶标仪405 nm波长测量A值.
统计学处理 每组实验重复3次. 数据均以mean±SD表示, 使用SPSS11.5统计软件进行显著性t检验和单因素方差(ANOVA)统计分析.
由图1可见, 用MTS法进行细胞毒性检测显示, 不同浓度的亚砷酸钠处理大鼠骨髓MSCs后, 与对照组比较, 各组间细胞活性存在明显差异. 经t检验进行两两比较发现, 当浓度≥20 μmol/L时, NaAsO2处理组的A值与对照组比较明显降低(P<0.01), 说明接触染毒24 h后, 大鼠骨髓MSCs活性明显降低. 提示一定浓度的NaAsO2对大鼠骨髓MSCs具有明显的毒性作用.
以DCFH-DA的转化产物二氯荧光素(2',7'-dichlorodihydrofluorescin, DCF)的平均荧光强度代表ROS含量, 各浓度NaAsO2作用于大鼠骨髓MSCs后DCF荧光强度与对照组相比均明显增高, 且呈剂量-反应趋势(P<0.05, 图2).
与对照组比较, 各浓度亚砷酸钠染毒组, 大鼠骨髓MSCs细胞内MDA含量均显著升高, GSH和SOD活力均显著下降(图3-5), 差异有统计学意义(P<0.05), 且随着亚砷酸钠染毒浓度的升高, 大鼠骨髓MSCs细胞内MDA均呈明显的上升趋势, SOD活力和GSH含量呈明显的下降趋势, 差异均有统计学意义(P<0.05).
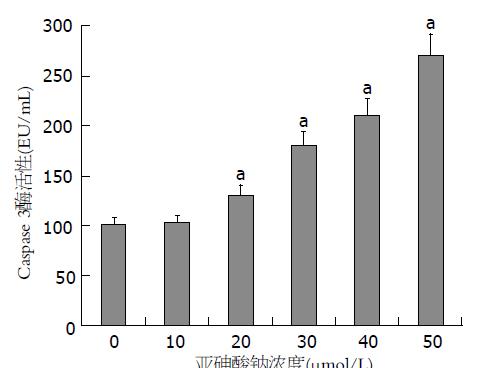
不同浓度NaAsO2作用于大鼠骨髓MSCs 24 h, 各浓度均激活Caspase 3酶活性, 50 μmol/L时细胞Caspase 3酶活性最高(P<0.05), 进一步表明凋亡可能是NaAsO2导致大鼠骨髓MSCs毒性作用的原因之一(图6). 结果如图所示, 与对照组相比, NaAsO2作用大鼠骨髓MSCs诱导其凋亡, 且有明显剂量效应关系, 这个结果说明NaAsO2可以诱导大鼠骨髓MSCs细胞凋亡.
砷是一种公认的毒物, 砷所引起的氧化应激已被不少研究所证实, 亚砷酸盐可以提高细胞超氧阴离子自由基和羟自由基的生成, 砷诱导人类上皮细胞ROS和活性氮族(reactive nitrogen species, RNS)的生成, 氧化应激被认为是砷毒理学作用特别是致癌作用的重要机制[8,9]. 本实验表明, NaAsO2能明显的抑制大鼠骨髓MSCs的增殖, 并且随着NaAsO2浓度的升高, 其抑制作用越显著, 说明这种效应存在浓度依赖性. 本实验也证实砷可以引起大鼠骨髓MSCs细胞内ROS和MDA含量均显著升高, GSH和SOD活力均显著下降. 各浓度的NaAsO2作用大鼠骨髓MSCs 24 h后, 均引起了细胞的凋亡, 并且诱导凋亡效应与NaAsO2浓度也呈一定的依赖性.
ROS是细胞氧代谢的产物, 他的产量增多可能引起机体氧化和抗氧化的失衡, 从而影响细胞凋亡. DCFH-DA是一种非极性荧光染料, 可以自由通过细胞膜, 进入细胞后被细胞非特异性内酯酶去酯形成DCFH, DCFH本身不发荧光, 但若被过氧化氢等氧化后即可形成发荧光的DCF, 通过DCF荧光强度的变化可检测细胞内的ROS[10]. 本实验发现NaAsO2可引起大鼠骨髓MSCs细胞ROS产生增多, 结果显示出NaAsO2染毒浓度越大, 细胞内ROS增加趋势越明显, 砷的细胞毒性也就越大. 究其原因, ROS可激活线粒体膜通透性孔道(permeability transition pore, PTP)开放, 导致线粒体膜损伤, 进而引起细胞色素c的释放, 激活Caspase 3, 诱导细胞凋亡. 因此, 本研究将不同浓度NaAsO2作用于大鼠骨髓MSCs, 研究证实, NaAsO2诱导大鼠骨髓MSCs细胞激活Caspase 3, 激活Caspase 3的激活与NaAsO2的染毒浓度呈现剂量效应关系.
砷可以在体内和体外诱导氧化应激的产生, 通过多种机制发生生理和病理反应. GSH是一种重要的抗氧化物, 可以清除过量产生的自由基, 砷进入体内后与含巯基的酶结合, SH在砷的甲基化过程中通过酶促和非酶促作用与砷形成砷-硫复合物, 减少砷在体内的蓄积, 从而减轻砷的毒性. 因此GSH可作为机体防止砷中毒的第一道防线[11,12]. 细胞MDA含量反映细胞脂质过氧化损伤程度, 而抗氧化酶SOD能清除细胞ROS, 避免细胞过度氧化应激. SOD是存在于线粒体内的抗氧化物酶, 与ROS结合, 并将其转换为过氧化氢和氧, 在保护细胞免受氧化损伤中起关键作用[13,14]. 在本研究中, 染毒组的SOD活力均下降, 这可能是由于在正常状态下, SOD是维持机体内ROS产生和清除动态平衡的重要抗氧化酶之一, 但当外源性化学物质(如砷化物)进入机体后, 其原形或中间活性产物均可破坏体内抗氧化系统的平衡, 使SOD活力降低. 可见, 过量的自由基一方面造成了过氧化物的增加, 另一方面又会造成SOD和GSH的耗竭[15,16], 因此, 在MDA、GSH、SOD的改变方面表现了剂量-效应关系的一致性, 这与本试验研究结果相似.
总之, 本研究中NaAsO2的暴露影响了大鼠骨髓MSCs细胞抗氧化系统的平衡, 使SOD活力下降, 进而导致由砷生成的ROS不能被及时清除, 使ROS水平持续升高, 可见氧化应激可能是NaAsO2致大鼠骨髓MSCs细胞毒性作用的机制之一. 本研究从氧化应激角度探讨了砷所致大鼠骨髓MSCs细胞损伤的可能机制, 为进一步深入研究砷对机体干细胞毒性的机制提供了理论依据.
砷是一种公认的毒物, 砷所引起的氧化应激在多种细胞中已被证实, 骨髓间充质干细胞是存在于体内的正常细胞, 他具有多向分化的潜能. 但是亚砷酸钠(sodiumarsenite, NaAsO2)对骨髓间充质干细胞损伤的确切机制目前尚未阐明.
吴江锋, 教授, 三峡大学医学院形态学部
探究NaAsO2对大鼠骨髓间充质干细胞的毒性和氧化应激作用, 可能会成为砷毒性作用研究的新热点.
NaAsO2对体外培养的神经元, 肝脏细胞, 肾脏细胞等细胞有细胞毒性作用, 其作用机制可能通过产生氧化应激反应, 但目前有关NaAsO2对原代培养的骨髓间充质干细胞的作用, 尚未阐明.
采用贴壁分离方法, 获得高纯度的大鼠骨髓间充质干细胞. 在此基础上, 进行了NaAsO2毒性作用实验, 检测了氧化应激相关酶和Caspase 3酶活性水平.
可应用于砷对机体干细胞损伤及毒性作用机制的研究等方面.
本文新颖性较好, 内容重要, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Bachate SP, Khapare RM, Kodam KM. Oxidation of arsenite by two β-proteobacteria isolated from soil. Appl Microbiol Biotechnol. 2012;93:2135-2145. [PubMed] [DOI] |
| 2. | Chen B, Arnold LL, Cohen SM, Thomas DJ, Le XC. Mouse arsenic (+3 oxidation state) methyltransferase genotype affects metabolism and tissue dosimetry of arsenicals after arsenite administration in drinking water. Toxicol Sci. 2011;124:320-326. [PubMed] [DOI] |
| 3. | Chowdhury R, Dutta A, Chaudhuri SR, Sharma N, Giri AK, Chaudhuri K. In vitro and in vivo reduction of sodium arsenite induced toxicity by aqueous garlic extract. Food Chem Toxicol. 2008;46:740-751. [PubMed] [DOI] |
| 4. | Jeon BG, Kumar BM, Kang EJ, Maeng GH, Lee YM, Hah YS, Ock SA, Kwack DO, Park BW, Rho GJ. Differential cytotoxic effects of sodium meta-arsenite on human cancer cells, dental papilla stem cells and somatic cells correlate with telomeric properties and gene expression. Anticancer Res. 2011;31:4315-4328. [PubMed] |
| 5. | Saeed H, Taipaleenmäki H, Aldahmash AM, Abdallah BM, Kassem M. Mouse embryonic fibroblasts (MEF) exhibit a similar but not identical phenotype to bone marrow stromal stem cells (BMSC). Stem Cell Rev. 2012;8:318-328. [PubMed] [DOI] |
| 6. | Azizi SA, Stokes D, Augelli BJ, DiGirolamo C, Prockop DJ. Engraftment and migration of human bone marrow stromal cells implanted in the brains of albino rats--similarities to astrocyte grafts. Proc Natl Acad Sci U S A. 1998;95:3908-3913. [PubMed] [DOI] |
| 8. | Li B, Li X, Zhu B, Zhang X, Wang Y, Xu Y, Wang H, Hou Y, Zheng Q, Sun G. Sodium arsenite induced reactive oxygen species generation, nuclear factor (erythroid-2 related) factor 2 activation, heme oxygenase-1 expression, and glutathione elevation in Chang human hepatocytes. Environ Toxicol. 2011; Aug 1. [Epub ahead of print]. [PubMed] [DOI] |
| 9. | Lafferty BJ, Ginder-Vogel M, Sparks DL. Arsenite oxidation by a poorly-crystalline manganese oxide. 3. Arsenic and manganese desorption. Environ Sci Technol. 2011;45:9218-9223. [PubMed] [DOI] |
| 10. | Eblin KE, Hau AM, Jensen TJ, Futscher BW, Gandolfi AJ. The role of reactive oxygen species in arsenite and monomethylarsonous acid-induced signal transduction in human bladder cells: acute studies. Toxicology. 2008;250:47-54. [PubMed] [DOI] |
| 11. | Kohsaka S, Takahashi K, Wang L, Tanino M, Kimura T, Nishihara H, Tanaka S. Inhibition of GSH synthesis potentiates temozolomide-induced bystander effect in glioblastoma. Cancer Lett. 2013;331:68-75. [PubMed] [DOI] |
| 12. | Kisić B, Mirić D, Žorić L, Ilić A, Dragojević I. [Reduced glutathione level and GSH-dependent enzyme activities in corticonuclear blocks of lenses in patients with senile cataract]. Srp Arh Celok Lek. 2012;140:563-570. [PubMed] [DOI] |
| 13. | Thomas R, Sharifi N. SOD mimetics: a novel class of androgen receptor inhibitors that suppresses castration-resistant growth of prostate cancer. Mol Cancer Ther. 2012;11:87-97. [PubMed] [DOI] |
| 14. | Assady M, Farahnak A, Golestani A, Esharghian M. Superoxide Dismutase (SOD) Enzyme Activity Assay in Fasciola spp. Parasites and Liver Tissue Extract. Iran J Parasitol. 2011;6:17-22. [PubMed] |
| 15. | Lii CK, Lin AH, Lee SL, Chen HW, Wang TS. Oxidative modifications of proteins by sodium arsenite in human umbilical vein endothelial cells. Environ Toxicol. 2011;26:459-471. [PubMed] [DOI] |
| 16. | Mittal M, Flora SJ. Effects of individual and combined exposure to sodium arsenite and sodium fluoride on tissue oxidative stress, arsenic and fluoride levels in male mice. Chem Biol Interact. 2006;162:128-139. [PubMed] [DOI] |