修回日期: 2013-04-24
接受日期: 2013-05-12
在线出版日期: 2013-06-18
目的: 肠上皮细胞(intestinal epithelial cells, IEC)来源的整合素αVβ6在肠道耐受性树突状细胞(tolerance dendritic cell, TolDC)生成中的机制研究.
方法: Balb/c ♂ 小鼠30只, 随机分为3组: 空白对照组、卵清蛋白(ovalbumin, OVA)组、OVA+抗αVβ6抗体组. 取空肠分离固有层单核细胞(lamia propria mononuclear cells, LPMC)流式细胞仪测定CD11c+与转化生长因子β1+(transforming growth factor-β1+, TGF-β1+)的比率变化. 免疫荧光双染(immunofluorescence double staining, IF)检测空肠CD11c+与TGF-β1+分布情况. Western bolt法测定TGF-β1蛋白水平变化.
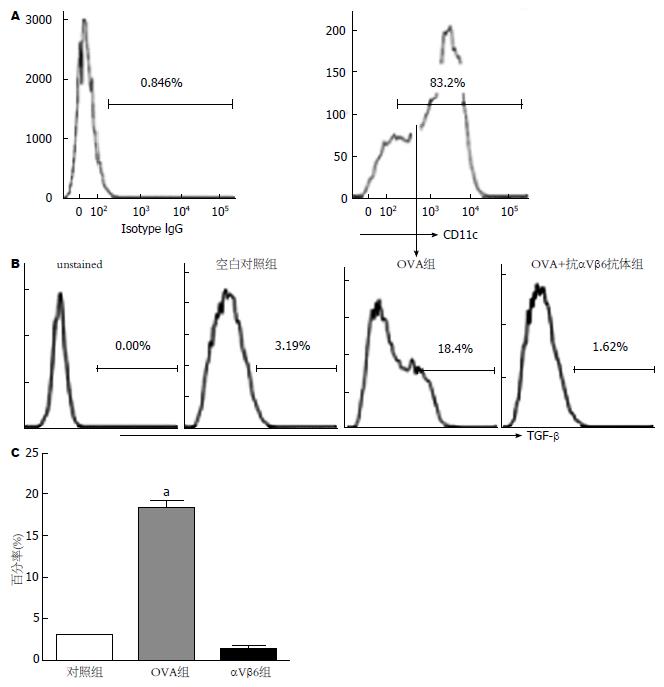
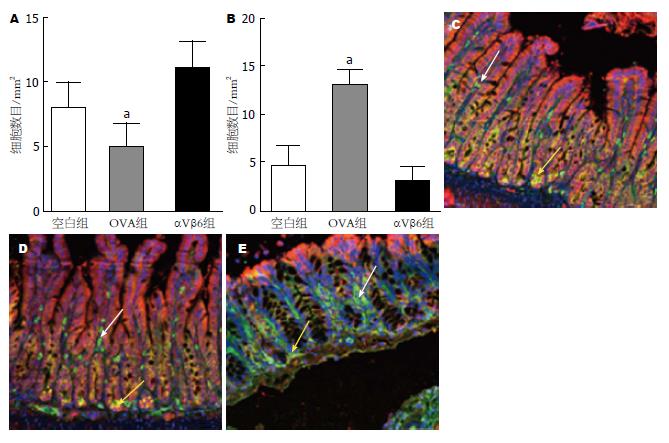
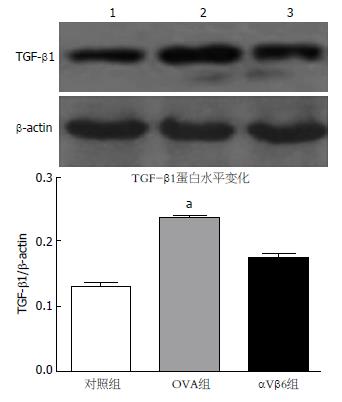
结果: 流式细胞仪测定结果显示: 与空白对照组相比, OVA组肠道LPMC中的TGF-β1+明显增加(P<0.05), 而OVA+抗αVβ6抗体组TGF-β1+明显降低(P<0.05). 与OVA组相比, OVA+抗αVβ6抗体组TGF-β1+明显降低(P<0.05). 免疫荧光双染法显示: OVA组中TolDC细胞计数为(13.0±1.76), 较空白对照组(4.9±1.66)显著增加(P<0.01), 该组中CD11c+ DC细胞计数(5.0±1.83), 较空白对照组(8.1±1.91)显著减少(P<0.01); OVA+抗αVβ6抗体组中TolDC细胞计数为(3.2±1.37), 较空白对照组(4.9±1.66)无明显变化(P>0.01), 该组中CD11c+ DC细胞计数(11.0±2.16), 较空白对照组(8.1±1.91)无明显变化(P>0.01). Western bolt结果显示: 与空白对照组相比(0.129±0.069), OVA组(0.236±0.049)TGF-β1表达显著增高, 差异有统计学意义(P<0.05); OVA+抗αVβ6抗体组(0.174±0.075)表达也降低, 差异有统计学意义(P<0.05). 与OVA组相比, OVA+抗αVβ6抗体组(0.174±0.075)TGF-β1表达显著降低, 差异有统计学意义(P<0.05).
结论: 肠上皮来源整合素αVβ6能够增加树突状细胞(dendritic cell, DC)中TGF-β1的表达, 并使其转变为TolDC, 从而在肠道免疫耐受中起重要作用.
核心提示: 肠上皮来源整合素αVβ6能够增加树突状细胞(dendritic cell)中转化生长因子-β1的表达, 并使其转变为耐受性树突状细胞(tolerance dendritic cell), 从而在肠道免疫耐受中起重要作用.
引文著录: 李凯, 郑鹏远, 刘志强, 陈东晖. 肠上皮细胞来源的整合素αVβ6对肠道树突状细胞TGF-β1表达的影响. 世界华人消化杂志 2013; 21(17): 1642-1648
Revised: April 24, 2013
Accepted: May 12, 2013
Published online: June 18, 2013
AIM: To determine the role of intestinal epithelial integrin αVβ6 in the generation of intestinal tolerogenic dendritic cell (TolDC).
METHODS: Thirty Balb/c male mice were randomly divided into three groups: a blank control group, an ovalbumin (OVA) group, and an OVA + αVβ6 antibody group. Lamina propria mononuclear cells (LPMCs) of the jejunum and CD11c+ and TGF-β1+ DCs were isolated by flow cytometry. Distribution of CD11c+ DCs and TolDC (CD11c+ TGF-β1+) in the jejunum was detected by double immunofluorescence. Transforming growth factor-β1 (TGF-β1) protein level was determined by Western bolt.
RESULTS: Compared to the blank control group, the number of TGF-β1+ DCs in LPMC in the intestine mucosa significantly increased in the OVA group (P < 0.05); however, the number of intestinal TGF-β1+ DCs significantly decreased in the OVA + αVβ6 antibody group compared to the OVA group (P < 0.05). TolDC cell count in the OVA group was significantly higher than that in the blank control group (13.0 ± 1.76 vs 4.9 ± 1.66, P < 0.05), while CD11c+ DC cell count was significantly lower in the OVA group than in the blank control group (5.0 ± 1.83 vs 8.1 ± 1.91, P < 0.05). TolDC and CD11c+ DC cell counts showed no significant differences between the OVA + anti αVβ6 antibody group and the blank control group (3.2 ± 1.37 vs 4.9 ± 1.66, P > 0.05; 11.0 ± 2.16 vs 8.1 ± 1.91, P > 0.05). Compared to the blank control group, TGF-β1 expression was significantly increased in the OVA group (0.129 ± 0.069 vs 0.236 ± 0.049, P < 0.05); however, TGF-β1 expression was significantly lower in the OVA + αVβ6 antibody group than in the OVA group (0.174 ± 0.075 vs 0.236 ± 0.049, P < 0.05).
CONCLUSION: Intestinal epithelial integrin αVβ6 is necessary to increase TGF-β1 expression in DCs and turn DCs into TolDC, thus playing an important role in intestinal immune tolerance.
- Citation: Li K, Zheng PY, Liu ZQ, Chen DH. Influence of intestinal epithelial integrin αVβ6 on TGF-β1 expression in intestinal dendritic cells. Shijie Huaren Xiaohua Zazhi 2013; 21(17): 1642-1648
- URL: https://www.wjgnet.com/1009-3079/full/v21/i17/1642.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i17.1642
近年来, 食物过敏(food allergy, FA)的发病率逐年增高, 已经成为了严重影响人类健康的全球性问题, 有研究显示, 儿童发病率约4%-8%, 成人为3%-4%[1]. 目前还没有有效的治疗措施能够避免FA的发生[2], 虽然有关FA领域的研究进展迅速, 然而其发病机制仍不清楚.
研究显示, FA是以肠道口服耐受受损和Th2极化为特征的免疫反应, 主要分为IgE介导的和非IgE介导的反应[3]. 口服耐受是通过口服抗原后诱导机体对该抗原的免疫低反应性, 其可能的机制涉及到克隆清除、克隆无能或诱导调节性T细胞(T regulatory cell, Treg)产生及其调节作用. 针对食物抗原的口服耐受机制失常在将导致肠道发生Th2型过敏反应. 研究显示, 耐受性树突状细胞(tolerance dendritic cell, TolDC)在Treg产生和口服耐受中起关键作用, 能够启动机体免疫反应及维持免疫耐受性[4-6], 其高表达白介素-10(interleukin-10, IL-10)、转化生长因子-β(transforming growth factor-β, TGF-β), 低表达MHCⅡ类和共刺激分子, 通过诱导Foxp3+ Treg来抑制免疫反应. 然而, 目前为止, 有关肠道TolDC的产生机制仍不清楚. 研究显示, 正常肠上皮细胞(intestinal epithelial cells, IEC)促进肠道TolDC和Treg细胞的分化[7-9], 并能够增加树突状细胞(dendritic cell, DC)细胞表达TGF-β. TGF-β有3个亚型TGF-β1、TGF-β2和TGF-β3, 3者之间具有较高的同源性, 且功能相近, 对细胞的生长、分化和免疫功能都有重要的调节作用. 研究显示, TGF-β在TolDC的分化产生中起重要作用[10], 然而TGF-β是如何使DC转变为TolDC的机制有待进一步研究. 整合素是由24个结构不同的二聚体构成, 含α和β亚基的细胞受体, 主要是介导细胞-细胞和细胞-细胞外基质间相互作用[11]. αVβ6可结合在非活化(latent form)TGF-β的羧基末端的氨基酸序列上[12,13], 从而使TGF-β与其受体结合, 并进一步形成活化TGF-β. 卵清蛋白(ovalbumin, OVA)因具有可靠抗原性而用于食物耐受模型的建立及FA小鼠模型的研究, 我们既往研究中, 通过给予小鼠OVA和佐剂建立了经典的小鼠肠道OVA过敏模型[14]. 另有研究显示, 通过灌胃只给予OVA则能够诱导建立小鼠肠道食物抗原耐受模型[15], 其机制有待进一步研究. 我们既往通过体外细胞培养实验研究显示, 肠道上皮细胞来源外泌体中含有整合素αVβ6及食物抗原, 能够增加骨髓来源DC中TGF-β的表达, 并使之转变为TolDC[16], 但整合素αVβ6在肠道TolDC产生中是否具有重要作用仍有待进一步研究.
本研究中, 我们将通过体内试验, 首先建立小鼠OVA耐受模型, 并进一步通过抗整合素αVβ6干预, 评价肠道黏膜TolDC的产生. 抗αVβ6抗体能够阻断OVA耐受小鼠肠道中TolDC的产生. 肠上皮来源整合素αVβ6能够增加DC中TGF-β1的表达, 并使其转变为TolDC, 从而在肠道免疫耐受中起重要作用, 本研究为FA性疾病发病机制的研究提供了新的理论依据.
卵清蛋白、抗小鼠αVβ6、DNaseⅠ酶(美国Sigma公司) , collagenase Ⅳ酶(Roche公司)和dispase Ⅱ酶(Roche公司), FITC-抗CD11c(BioLegend公司), PE-抗小鼠TGF-β1(美国ebioscience公司), 蛋白提取试剂(北京鼎国), TGF-β1(Santa cruz), Hrp标记二抗(北京中山生物技术有限公司). Balb/c小鼠购自北京维通利华实验动物技术有限公司[合格证号SCXK(京)2007-0001], 在清洁无抗原及微生物环境下饲养, 实验经郑州大学动物伦理委员会批准.
1.2.1 动物模型的建立: ♂ Balb/c小鼠30只, 6-8周龄, 随机分为3组, 每组10只: 空白对照组(A组)、OVA组(B组)、OVA+抗αVβ6抗体组(C组). B组每只小鼠给予1 mg OVA(溶于0.3 mL生理盐水), 于第0、1、2、3天灌胃, 第7、9、13天再次给予1 mg OVA灌胃进行激发. A组只给予等体积的生理盐水(NS)进行灌胃及激发, 作为空白对照. C组小鼠在第7、9、13天每次给予1 mg OVA灌胃进行激发前30 min腹腔注射抗αVβ6抗体(10 μg溶于0.3 mL NS).
1.2.2 肠道固有层单个核细胞的分离: 无菌取小鼠空肠组织, PBS冲洗3次, 剪成长约1 cm的组织片段, 经PBS再次冲洗, 置于含有5 mmol/L EDTA和1 mmol/L DTT的PBS中室温振荡孵育20 min. 100 μm滤网过滤, 然后将组织置消化溶液(0.05%Ⅳ胶原酶, 0.05%DNaseⅠ和0.03%中性胶原酶)消化20 min. 40 μm滤网过滤, 重复冲洗2次. 40/80 Percoll梯度离心, 分离的LPMC培养过夜[17].
1.2.3 免疫磁珠法进行细胞分选及流式细胞仪检测: 各组小鼠肠道固有层单个核细胞分离后, 经密度梯度离心去除死细胞, 过滤成单细胞悬液, 300 g×10 min离心收集细胞, 加入经抗CD11c抗体包被的免疫磁珠10 μL, 混匀, 冰上孵育15 min, 离心重悬细胞. 把MS型细胞分选柱放入MACS分选架, 加入500 μL缓冲液冲洗分选柱, 然后加入细胞悬液, 收集流出细胞悬液, 待液体流干后, 加入500 μL缓冲液冲洗共3次, 收集的细胞为免疫磁珠非结合细胞部分. 把分选柱转移出磁场, 加入500 μL缓冲液后, 迅速把与免疫磁珠结合的细胞推出, 收集后的细胞为CD11c阳性DC细胞. PBS液重悬细胞, 调整细胞浓度至1×106/mL. 将PE标记的抗小鼠CD11c 0.2 μL、FITC标记的抗小鼠TGF-β 0.2 μL加入细胞悬液, 冰上染色30 min, PBS洗涤2次, PBS重悬细胞后过滤网, 流式细胞仪检测.
1.2.4 免疫荧光步骤: 迅速取各组小鼠空肠组织放入福尔马林固定液固定4 h. 制备组织石蜡切片, 切片脱蜡至水, PBS洗3次, 柠檬酸抗原修复10 min, 自然冷却, PBS浸泡, 3%H2O2封闭内源性过氧化物酶, 室温20 min, PBS浸泡, 滴加山羊血清50 μL/片,室温封闭内源性生物20 min, 甩除勿洗, 滴加一抗(CD11c, TGF-β1)100 μL/片, 4 ℃过夜, PBS浸泡, 滴加TRITC标记二抗(羊抗兔), 37 ℃孵育2 h, PBS浸泡, DAPI复染胞核, PBS浸泡, 荧光显微镜下采集图像.
1.2.5 Western blot检测细胞中TGF-β1蛋白表达: 按蛋白提取试剂盒提取各组分离的肠道LPMC中CD11c阳性细胞的总蛋白, Bradford法对蛋白样品进行定量. 取出30 μg蛋白经过煮沸变性后进行SDS-PAGE凝胶电泳并转至硝酸纤维膜上, 脱脂牛奶于4 ℃封闭过夜后, 分别用TGF-β1抗体4 ℃孵育过夜, 然后加入辣根过氧化物酶标记的山羊抗小鼠IgG抗体(1:10000)室温2 h, 最后加ECL发光剂于暗室充分反应后用胶片曝光, 蛋白含量用每组样本所测得的TGF-β1蛋白灰度值与对应的β-actin蛋白的灰度值的比值表示.
统计学处理 实验数据均以mean±SD表示, 采用SPSS17.0统计软件包进行分析, 单因素方差分析比较各组间有无统计学差异, 采用α = 0.05为假设检验标准.
分离各组小鼠肠道LPMC, 免疫磁珠分选肠道DC细胞, 流式细胞仪分析, 结果显示, OVA组肠道中CD11c+TGF-β1+表达量为(18.400±0.835), 较空白对照组(3.190±0.069)明显增加(P<0.05), 而OVA+抗αVβ6抗体组CD11c+ TGF-β1+表达量为(1.620±0.109), 较空白照组(3.190±0.069)明显降低(P<0.05). OVA+抗αVβ6抗体组中CD11c+ TGF-β1+表达量为(1.620±0.109), 较OVA组(18.400±0.835)明显降低(P<0.05). 提示αVβ6抗体阻断能够减少肠道DC中TGF-β1的表达(图1).
颈椎脱臼法处死小鼠, 立即取小鼠空肠组织, 福尔马林固定制作组织切片, 经抗经CD11c和抗TGF-β1抗体染色, 荧光纤维镜观察染色阳性细胞. 观察到CD11c+ DC细胞被染成绿色, TolDC细胞被染成棕黄色, 每只小鼠肠道黏膜组织随机取20个视野在高倍镜下观察计数阳性细胞数目并求平均值(图2).
空白对照组(图2C)TolDC细胞数为(4.9±1.66), CD11c+ DC细胞数(8.1±1.91). 与空白对照组相比OVA组(图2D)TolDC细胞(13.0±1.76)数明显增多(P<0.01), 而CD11c+ DC细胞(5.0±1.83)明显减少(P<0.01); 与空白对照组相比, OVA+抗αVβ6抗体组(图2E)TolDC细胞(3.2±1.37)无明显变化(P>0.01), CD11c+ DC细胞(11.0±2.16)无明显变化(P>0.01). 提示OVA可促进CD11c+ DC细胞向TolDC细胞转化, 但是该转化可被抗αVβ6抗体阻断(表1).
取分离的各组小鼠肠道LPMC, 免疫磁珠分离CD11c阳性细胞并提取总蛋白, Western blot分析TGF-β1蛋白表达量. 经OVA激发后, 该组肠道DC细胞中TGF-β1蛋白表达量(0.236±0.049), 较空白对照组(0.129±0.069)明显增加(P<0.05), 而OVA+抗αVβ6抗体组中TGF-β1蛋白表达量(0.174±0.075), 较OVA组(0.236±0.049)明显减少(P<0.05)(图3).
在过去的几十年里, 过敏性疾病的发病率显著增加, 已经形成比较严重的健康问题. 人们普遍认为, 肠溶微生物参与胃肠道中的多种生理功能的调节, 包括竞争与减少病原体定植, 促进不易消化物质的降解, 促进短链脂肪酸、叶酸和维生素的产生, 刺激肠上皮细胞的代谢以及黏膜免疫的形成[18-20]. 许多免疫活性细胞参与过敏性疾病的发生发展: Th2细胞极化、DC激活、Treg、效应性CD4+和CD8细胞等. Treg活性丧失很可能在打破口服耐受和进而发生的FA中起重要作用, 而TolDC在Treg产生和口服耐受中起关键作用[21]. 与身体其他器官相比, 肠道固有层拥有更多的TolDC, IEC在该细胞产生过程中具有重要作用, 而TolDC能够使肠道针对食物抗原保持免疫耐受状态.
TGF-β作为二聚体多肽生长因子家族的成员, 参与细胞功能调节、增殖、分化和迁移. 在TGF-β已知的3个异构体(TGF-β1、TGF-β2和TGF-β3)中, TGF-β1主要在免疫系统中表达, TGF-β1主要与其受体结合来调节免疫功能, 以非活化的状态存在, 被激活后才能发挥其潜在的复杂的生物学作用. 正常IEC能够促使非活化TGF-β1高表达在DC的表面. 当小鼠摄入蛋白质抗原时, 整合素αVβ6在IEC中表达量上升. 在本实验中通过OVA灌胃, 诱导小鼠产生口服免疫耐受, 分离小肠空肠LPMC, 经免疫磁珠进一步纯化DC, 流式细胞仪分析DC中TGF-β1的表达显示: OVA组中TGF-β1的表达量显著上升, 而经过抗αVβ6抗体的拮抗后TGF-β1表达量显著下降.
体外培养IEC, 经食物抗原刺激后, IEC中αVβ6的表达量增加; 体外得到的外泌体经食物抗原刺激后, 能够携带αVβ6和抗原, 并可被DC捕获. 本研究发现小鼠经OVA刺激后, 空肠组织免疫荧光发现TolDC的表达数量增加, 而使用αVβ6抗体拮抗后, 其数量明显降低, 没有接受抗原刺激的空白组则没有变化, 说明食物抗原诱导免疫耐受的产生. 另外小鼠经OVA刺激后, TGF-β1蛋白表达增加; 经抗αVβ6抗体干预后, TGF-β1表达下降, 提示αVβ6能够促进TGF-β1活化. 最近研究表明DC的CD103的上调需要上皮衍生转化生长因子TGF-β和视黄酸, 上皮细胞来源的DC反过来可以诱导分化适应肠道环境Foxp3+ Treg细胞[22,23]. 另有研究表明肠上皮细胞来源外泌体中有整合素αVβ6的表达, 在肠道中食物抗原的协同作用下, 能够诱导肠道黏膜中分泌TGF-β1的TolDC产生, 进而促使Treg细胞产生TGF-β1[24].
肠道是表面积最大的免疫器官, 而IEC处于机体与外界抗原接触的第一线, 表面表达一系列表面分子, 通过限制肠腔细菌和食物过敏原的穿透, 在维护肠道内环境稳定中起着至关重要的作用. 我们实验结果提示IEC来源的αVβ6在肠道TolDC产生中可能具有关键作用. 整合素αVβ6的功能之一就是从TGF-β1分子上游离隐性相关肽, 使活化的TGF-β1增加, 活化的TGF-β1可以促使TolDC细胞的分化. 分化的TolDC可抑制过敏性免疫反应, 并改善其相应的过敏症状.
近年来, 食物过敏(food allergy, FA)的发病率逐年增高. 研究显示, FA是以肠道口服耐受受损和Th2极化为特征的免疫反应. 耐受性树突状细胞(tolerance dendritic cell, TolDC)在调节性T细胞的产生和口服耐受中起关键作用, 而转化生长因子β1(transforming growth factor-β1, TGF-β1)在维持树突状细胞(dendritic cell, DC)耐受表型中起重要作用. 整合素αVβ6可促使TGF-β活化.
马欣, 主任医师, 甘肃省人民医院消化科
整合素αVβ6是整合素αV亚家族的一种, 其可结合在羧基末端的精氨酸-甘氨酸-天冬氨酸序列上, 从而使TGF-β更易于与其受体结合并进一步形成活化TGF-β. 肠道上皮细胞来源外泌体中含有整合素αVβ6及食物抗原, 能够增加骨髓来源DC中TGF-β的表达, 并使之转变为TolDC, 但整合素αVβ6在肠道TolDC产生是否具有重要作用仍有待进一步研究.
卵巢癌中TGF-β1水平增加, 而整合素αVβ6在TGF-β1的活化中起着作用, 如果整合素αVβ6被抗体所阻断, 那么TGF-β1将不能激活癌细胞. 也有研究显示肠上皮细胞来源外泌体中有整合素αVβ6的表达, 在肠道中食物抗原的协同作用下, 能够诱导肠道黏膜中分泌TGF-β1的TolDC产生.
本研究通过动物实验, 探讨肠上皮细胞来源的整合素αVβ6在肠道中TolDC产生中的作用.
整合素αVβ6的功能之一就是从TGF-β1分子上游离隐性相关肽, 使活化的TGF-β1增加, 活化的TGF-β1可以促使TolDC细胞的分化, 分化的TolDC可抑制过敏性免疫反应, 诱导机体免疫耐受恢复, 并改善过敏症状. 因此, 通过增强αVβ6分子靶点而改善TolDC分化的治疗FA是一个很好方向.
本文条理分明, 有系统的理论分析和有价值的科学结论, 较好的反映了我国基础研究的先进水平.
编辑: 田滢 电编:鲁亚静
| 1. | Rachid R, Umetsu DT. Immunological mechanisms for desensitization and tolerance in food allergy. Semin Immunopathol. 2012;34:689-702. [PubMed] [DOI] |
| 2. | Khoriaty E, Umetsu DT. Oral immunotherapy for food allergy: towards a new horizon. Allergy Asthma Immunol Res. 2013;5:3-15. [PubMed] [DOI] |
| 3. | Clarke S. Food allergy in young people and children. Nurs Times. 2011;107:21. [PubMed] |
| 4. | Arpino JA, Czapinska H, Piasecka A, Edwards WR, Barker P, Gajda MJ, Bochtler M, Jones DD. Structural basis for efficient chromophore communication and energy transfer in a constructed didomain protein scaffold. J Am Chem Soc. 2012;134:13632-13640. [PubMed] [DOI] |
| 5. | Kushwah R, Hu J. Role of dendritic cells in the induction of regulatory T cells. Cell Biosci. 2011;1:20. [PubMed] [DOI] |
| 6. | Worthington JJ, Czajkowska BI, Melton AC, Travis MA. Intestinal dendritic cells specialize to activate transforming growth factor-β and induce Foxp3+ regulatory T cells via integrin αvβ8. Gastroenterology. 2011;141:1802-1812. [PubMed] [DOI] |
| 7. | Yao Y, Levings MK, Steiner TS. ATP conditions intestinal epithelial cells to an inflammatory state that promotes components of DC maturation. Eur J Immunol. 2012;42:3310-3321. [PubMed] [DOI] |
| 8. | Rimoldi M, Chieppa M, Salucci V, Avogadri F, Sonzogni A, Sampietro GM, Nespoli A, Viale G, Allavena P, Rescigno M. Intestinal immune homeostasis is regulated by the crosstalk between epithelial cells and dendritic cells. Nat Immunol. 2005;6:507-514. [PubMed] [DOI] |
| 9. | Wells JM, Rossi O, Meijerink M, van Baarlen P. Epithelial crosstalk at the microbiota-mucosal interface. Proc Natl Acad Sci U S A. 2011;108 Suppl 1:4607-4614. [PubMed] [DOI] |
| 10. | Godlewski MM, Hallay N, Bierła JB, Zabielski R. Molecular mechanism of programmed cell death in the gut epithelium of neonatal piglets. J Physiol Pharmacol. 2007;58 Suppl 3:97-113. [PubMed] |
| 11. | Luo BH, Springer TA. Integrin structures and conformational signaling. Curr Opin Cell Biol. 2006;18:579-586. [PubMed] [DOI] |
| 12. | Munger JS, Huang X, Kawakatsu H, Griffiths MJ, Dalton SL, Wu J, Pittet JF, Kaminski N, Garat C, Matthay MA. The integrin alpha v beta 6 binds and activates latent TGF beta 1: a mechanism for regulating pulmonary inflammation and fibrosis. Cell. 1999;96:319-328. [PubMed] |
| 13. | Bochen A, Marelli UK, Otto E, Pallarola D, Mas-Moruno C, Di Leva FS, Boehm H, Spatz JP, Novellino E, Kessler H. Biselectivity of isoDGR Peptides for Fibronectin Binding Integrin Subtypes α5β1 and αvβ6: Conformational Control through Flanking Amino Acids. J Med Chem. 2013; Feb 18. [Epub ahead of print]. [PubMed] |
| 14. | Yang PC, Xing Z, Berin CM, Soderholm JD, Feng BS, Wu L, Yeh C. TIM-4 expressed by mucosal dendritic cells plays a critical role in food antigen-specific Th2 differentiation and intestinal allergy. Gastroenterology. 2007;133:1522-1533. [PubMed] [DOI] |
| 15. | Yamashita H, Takahashi K, Tanaka H, Nagai H, Inagaki N. Overcoming food allergy through acquired tolerance conferred by transfer of Tregs in a murine model. Allergy. 2012;67:201-209. [PubMed] [DOI] |
| 16. | Chen X, Song CH, Feng BS, Li TL, Li P, Zheng PY, Chen XM, Xing Z, Yang PC. Intestinal epithelial cell-derived integrin αβ6 plays an important role in the induction of regulatory T cells and inhibits an antigen-specific Th2 response. J Leukoc Biol. 2011;90:751-759. [PubMed] [DOI] |
| 17. | Weigmann B, Tubbe I, Seidel D, Nicolaev A, Becker C, Neurath MF. Isolation and subsequent analysis of murine lamina propria mononuclear cells from colonic tissue. Nat Protoc. 2007;2:2307-2311. [PubMed] [DOI] |
| 18. | O'Hara AM, Shanahan F. The gut flora as a forgotten organ. EMBO Rep. 2006;7:688-693. [PubMed] [DOI] |
| 19. | Kelly D, Conway S. Bacterial modulation of mucosal innate immunity. Mol Immunol. 2005;42:895-901. [PubMed] [DOI] |
| 20. | Cani PD, Delzenne NM. Gut microflora as a target for energy and metabolic homeostasis. Curr Opin Clin Nutr Metab Care. 2007;10:729-734. [PubMed] [DOI] |
| 21. | Volchenkov R, Karlsen M, Jonsson R, Appel S. Type 1 regulatory T cells and regulatory B cells induced by tolerogenic dendritic cells. Scand J Immunol. 2013;77:246-254. [PubMed] [DOI] |
| 22. | Iliev ID, Mileti E, Matteoli G, Chieppa M, Rescigno M. Intestinal epithelial cells promote colitis-protective regulatory T-cell differentiation through dendritic cell conditioning. Mucosal Immunol. 2009;2:340-350. [PubMed] [DOI] |
| 23. | Iliev ID, Spadoni I, Mileti E, Matteoli G, Sonzogni A, Sampietro GM, Foschi D, Caprioli F, Viale G, Rescigno M. Human intestinal epithelial cells promote the differentiation of tolerogenic dendritic cells. Gut. 2009;58:1481-1489. [PubMed] [DOI] |
| 24. | Feng BS, Chen X, Li P, Zheng PY, Chong J, Cho DB, He SH, Tang SG, Yang PC. Expression of integrin alphavbeta6 in the intestinal epithelial cells of patients with inflammatory bowel disease. N Am J Med Sci. 2009;1:200-204. [PubMed] |