修回日期: 2013-03-07
接受日期: 2013-05-09
在线出版日期: 2013-06-18
目的: 探讨海洛因戒断、复吸对大鼠胃窦内CD4、CD8和白介素2(interleukin-2, IL-2)表达的影响.
方法: 正常♂SD大鼠35只, 随机分为正常对照组(normal control group, NCG)、盐水对照组(saline control group, SCG)和实验组(experiment group, EG), 将EG大鼠又分为戒断组(heroin withdrawal group, HWG)、脱毒治疗组(methadone detoxication group, MDG)和复吸组(heroin relapse group, HRG). 采用免疫组织化学SABC法及图像分析法, 观察CD4、CD8和IL-2在大鼠胃窦中表达的变化.
结果: 与正常对照组及SCG比较, HWG及HRG大鼠胃窦内的CD4、IL-2阳性细胞数量有所减少(CD4: NCG 15.944±1.661; HWG 8.500±1.150, HRG 10.278±1.074; IL-2: NCG 21.824±2.556; HWG 13.118±3.180; HRG 8.529±1.179), 染色变浅, 表达减弱, 平均灰度值升高(CD4: NCG 135.314±3.595; HWG 154.889±3.238, HRG 155.455±3.176; IL-2: NCG 131.082±4.769; HWG 150.233±4.241; HRG 150.199±4.007); CD8阳性细胞数量增多(NCG 18.611±2.477; HWG 26.167±2.203, HRG 26.778±1.592)染色变深, 表达增强, 平均灰度值下降(CD8: NCG 138.239±4.047; HWG 123.717±4.622, HRG 125.498±3.056). 差异均有统计学意义(P<0.05). MDG与NCG及SCG比较, 大鼠胃窦内的CD4、CD8和IL-2阳性细胞的免疫染色强度无明显变化, 平均灰度值差异无统计学意义(P>0.05).
结论: 在海洛因戒断、复吸期间, CD4、IL-2在胃窦表达减弱, CD8表达增强, 提示海洛因戒断、复吸对大鼠胃黏膜免疫功能造成损伤; MDG大鼠胃窦CD4、CD8和IL-2的表达与正常组差异无显著性, 提示脱毒治疗后胃窦功能逐步趋于正常.
核心提示: 海洛因的滥用能削弱机体的免疫功能, 使各个器官感染的发生率增加. 本实验通过建立海洛因戒断、复吸大鼠模型, 观察了CD4、CD8和白介素2(interleukin-2)在大鼠胃窦黏膜内的表达, 探讨胃窦黏膜免疫功能在此期间的变化, 为由海洛因引起的消化系功能紊乱的治疗提供了相应的理论依据.
引文著录: 夏白娟, 梁文妹, 李一欣, 洪艳, 韩晶, 胡赟. CD4、CD8和IL-2在海洛因戒断、复吸大鼠胃窦的表达. 世界华人消化杂志 2013; 21(17): 1589-1594
Revised: March 7, 2013
Accepted: May 9, 2013
Published online: June 18, 2013
AIM: To detect the expression of CD4, CD8 and interleukin-2 (IL-2) in the gastric antrum of rats during heroin abstinence and relapse.
METHODS: Thirty-five male adult SD rats were randomly divided into three groups: normal control group (NCG), saline control group (SCG) and experiment group (EG). The experiment group was divided into three subgroups: heroin abstinence subgroup (HAS), methadone detoxication subgroup (MDS) and heroin relapse subgroup (HRS). Immunohistochemistry was performed to detect the expression of CD4, CD8 and IL-2 in the gastric antrum of rats of different groups.
RESULTS: Compared to the NCG, the staining intensity of CD4 and IL-2 (CD4: 135.314 ± 3.595 vs 154.889 ± 3.238, 155.455 ± 3.176; IL-2: 131.082 ± 4.769 vs 150.233 ± 4.241, 150.199 ± 4.007; all P < 0.05) and the numbers of CD4- and IL-2-positive cells (CD4: 15.944 ± 1.661 vs 8.500 ± 1.150, 10.278 ± 1.074; IL-2: 21.824 ± 2.556 vs 13.118 ± 3.180, 8.529 ± 1.179; all P < 0.05) in the gastric antrum decreased, and the staining intensity of CD8 (138.239 ± 4.047 vs 123.717 ± 4.622, 125.498 ± 3.056, both P < 0.05) and the number of CD8-positive cells (18.611 ± 2.477 vs 26.167 ± 2.203, 26.778 ± 1.592, both P < 0.05) significantly increased in the HAS and HRS. Compared to the NCG and SCG, there were no obvious changes in the staining intensity of CD4, CD8 and IL-2 and the numbers of CD4-, CD8- and IL-2-positive cells in the MDS (all P > 0.05).
CONCLUSION: The expression of CD4 and IL-2 decreases and that of CD8 increases in the gastric antrum of rats during heroin abstinence and relapse, which suggests that the antrum is damaged during heroin abstinence and relapse. In the MDG, the expression of CD4, CD8 and IL-2 in the MDS is close to that in the NCG and SCG, suggesting that the structure and function of the antrum could be restored after detoxication with methadone.
- Citation: Xia BJ, Liang WM, Li YX, Hong Y, Han J, Hu Y. Expression of CD4, CD8 and IL-2 in the gastric antrum of rats during heroin abstinence and relapse. Shijie Huaren Xiaohua Zazhi 2013; 21(17): 1589-1594
- URL: https://www.wjgnet.com/1009-3079/full/v21/i17/1589.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i17.1589
海洛因成瘾者戒断之后复吸率极高[1], 阿片类物质滥用不但造成一系列社会问题, 还严重危害人体健康, 可致多种疾病, 各种各样的感染是吸毒者发病和死亡的主要原因之一, 研究表明, 各类毒品都不同程度地削弱机体的免疫功能, 使各种器官脏器的机会性感染发生率增加, 应用抗生素也很难治愈, 形成多年不愈的慢性感染, 其毒性作用表现为长期应用后对整个免疫系统包括非特异性和特异性, 包括体液免疫和细胞免疫功能的全面抑制. T细胞是淋巴细胞的一种, 在机体免疫中起着重要作用. 细胞免疫是T细胞受到抗原刺激后, 分化、增殖、转化为致敏T细胞, 发挥其杀伤作用的过程. CD4、CD8是参与细胞免疫最主要的两种T淋巴细胞, 参与机体病毒免疫[2]、抗肿瘤免疫[3]等作用. CD4是辅助性T细胞的表面标志, CD8是杀伤性T细胞的表面标志. 白介素2(interleukin-2, IL-2)是由CD4产生的一种细胞因子, 能活化巨噬细胞、提高CD8的杀伤活性, 并能促进淋巴细胞的增殖. 本实验通过建立相关大鼠模型, 观察海洛因戒断、脱毒和复吸期间, CD4、CD8和IL-2在大鼠胃窦黏膜内的表达, 旨在探讨胃黏膜免疫功能在海洛因戒断和复吸期间的变化.
成年♂SD大鼠35只, 体质量180-220 g, 由贵阳医学院实验动物中心提供. 海洛因粉剂, 纯度61.48%, 临用时用灭菌注射用水溶解; 美沙酮由汉方制药厂提供.
1.2.1 分组: 35只大鼠按配对原则随机分为正常对照组(normal control group, NCG)5只、盐水对照组(saline control group, SCG)15只和实验组(experiment group, EG)15只, EG又分为海洛因戒断组(heroin withdrawal group, HWG)、美沙酮脱毒治疗组(methadone detoxication group, MDG)和海洛因复吸组(heroin relapse group, HRG), 每组5只; 盐水组也相应地分为3组(即SCG1、SCG2、SCG3), 每组5只.
1.2.2 建立海洛因戒断大鼠模型[4]: EG按体质量逐日注射海洛因药液, 首日剂量为3 mg/kg, 2次/d(上午8:00时, 下午15:00时), 每日递增剂量为3 mg/kg, 连续皮下注射海洛因9 d成瘾. 第10天EG取5只大鼠腹腔注射0.8 mg纳洛酮催瘾, 观察并记录戒断症状30 min, 依照Maldonado等[5]的戒断症状评分标准评定, 判定大鼠海洛因戒断模型成功建立. 海洛因戒断大鼠1 h内处死. 美沙酮脱毒治疗[6]: 将已成瘾大鼠注射美沙酮脱毒治疗, 连续注射6 d, 每日剂量递减, 依次为5、4、3、2、1、0.5 mg/kg, 观察并记录大鼠行为表现, 脱毒治疗第7 d, 经注射纳洛酮催瘾并观察, 大鼠无明显戒断症状, 将美沙酮脱毒大鼠取5只处死. 建立海洛因复吸大鼠模型[6]: 将剩余5只美沙酮脱毒6 d后的大鼠再次注射海洛因, 注射剂量9 mg/kg首日, 1次/d(上午8:00时), 逐日递增剂量为3 mg/kg, 让大鼠再次染毒, 制作复吸模型. 复吸7 d后(剂量为27 mg/kg)将HRG大鼠处死. 盐水对照组按体质量每日注射与EG相当剂量的生理盐水, 并与同期各EG同时处死, 每次处死5只; 正常对照组不予任何处理作为对照.
1.2.3 取材和标本制备: 分别取正常对照组、盐水对照组和EG(戒断、脱毒和复吸)大鼠胃窦标本, 多聚甲醛液固定, 常规石蜡包埋, 制成4 µm厚的连续切片, 每例每个观察指标均观察切片3张以上, 切片间隔56 µm.
1.2.4 免疫组织化学SABC法: 按免疫组织化学SABC法进行免疫组织化学染色, 分别显示CD4、CD8和IL-2阳性细胞. 主要步骤为: 切片常规脱蜡至水, 室温10%甲醇-H2O2 10 min, 正常羊血清(1:50)室温下封闭20 min, 分别滴加兔CD4、CD8和IL-2抗血清(1:100, 博士德生物工程公司), 4 ℃孵育过夜; 羊抗兔IgG(1:100)37 ℃孵育20 min, SABC复合物(1:100)37 ℃孵育20 min, DAB-H2O2液显色, 苏木精复染细胞核, 中性树胶封片. 方法对照: PBS缓冲液代替特异性抗血清, 余步骤同上.
1.2.5 图像分析: 随机选取戒断、脱毒和HRG和同期盐水对照组胃窦切片, 各取3例, 正常对照组3例. 在40倍物镜下, 每例切片随机选取5个视野, 用BioMias图像分析系统检测CD4、CD8和IL-2阳性细胞的数量和平均灰度值.
统计学处理 应用SPSS11.5软件包对所得数据进行单因素方差分析mean±SD, P<0.05差异具有统计学意义.
在实验过程中, 实验动物随海洛因剂量加大出现典型的海洛因依赖症状, 表现为给药后动物呆滞、活动减少、嗜睡, 四肢及躯体肌紧张, 尾巴僵直上翘, 两眼凸出、发亮, 眼神迷离无光彩. 上述表现持续约30 min. 后开始出现兴奋状态, 兴奋主要表现为活动增多, 乱窜, 快速不停地转圈运动、舔毛、咬前爪及磕铁笼等. 兴奋持续时间约90 min. 给予纳洛酮注射之后30 min内观察戒断症状的出现: 烦躁不安、毛蓬松, 清理皮毛、湿狗样抖、站立、伸张等次数明显增多. 甚至出现上睑下垂、流涎, 拉稀便等症状. 在整个过程中, 和空白对照组和盐水组相比较, EG体重不增加甚至下降.
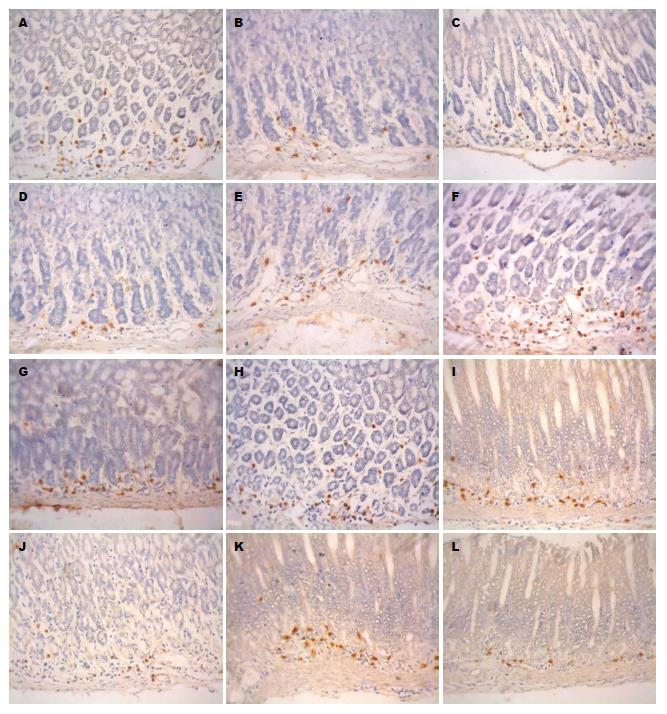
2.2.1 大鼠胃窦CD4阳性细胞: 光镜下, 经免疫组织化学染色之后, NCG大鼠胃窦黏膜中CD4、阳性反应产物呈棕黄色, 主要分布于黏膜内固有层中(图1A). 胞体小, 多呈圆形、椭圆形. SCG各组大鼠胃窦中CD4、阳性细胞的分布及免疫染色强度与其无明显差别; HWG和HRG大鼠胃窦黏膜内的CD4、IL-2阳性细胞数量有所减少, 免疫染色有所减弱(图1B, D); MDG中阳性细胞的数量和染色强度和NCG组相当(图1C).
2.2.2 大鼠胃窦CD8阳性细胞: NCG大鼠胃窦黏膜中CD8阳性反应产物位于细胞胞膜和胞质内, 呈棕黄色或棕黑色, 多位于胃窦黏膜固有层内. SCG各组大鼠胃窦中CD8阳性细胞的分布及免疫染色强度与其无明显差别(图1E); HWG大鼠胃窦黏膜内CD8阳性细胞数量有所增加, 免疫染色有所增强(图1F); MDG阳性细胞的分布和染色强度和NCG、SCG无明显差别(图1G), HRG大鼠CD8阳性细胞染色变深(图1H).
2.2.3 大鼠胃窦IL-2阳性细胞: 光镜下, 大鼠胃窦IL-2阳性细胞经DAB-H2O2液显色, 见免疫反应产物呈棕黄色或棕黑色细颗粒状, 存在于细胞胞质中. 对照切片未见免疫反应阳性细胞. 大鼠胃窦的IL-2阳性细胞多分布于固有层腺底部的结缔组织中(图1I). 与NCG比较, SCG各组中IL-2阳性细胞的分布及免疫反应染色强度均无明显变化. HWG(图1J)、HRG(图1L)胃窦IL-2阳性细胞的免疫反应物为棕黄色颗粒, 免疫染色强度减弱, 细胞数量减少.
2.3.1 各组大鼠胃窦黏膜CD4、CD8和IL-2阳性细胞数量: NCG、SCG各组CD4、IL-2阳性细胞数量的差异无统计学意义(P>0.05). MDG与NCG、SCG之间的差异也无显著性. HWG和HRG中的阳性细胞数量显著减少(P<0.05), 两组之间差异不明显. 与NCG相比较, SCG各组的CD8阳性细胞数量无显著差异; HWG和HRG大鼠胃窦CD8阳性细胞数量明显增加(P<0.05). MDG大鼠胃窦CD8阳性细胞数比HWG、HRG减少, 比NCG、SCG组增多, 与其余各组比较皆有显著差异(P<0.05, 表1).
| 分组 | CD4 | P值 | CD8 | P值 | IL-2 | P值 |
| 正常对照组 | 15.944±1.661 | 18.611±2.477 | 21.824±2.556 | |||
| 盐水对照组1 | 15.167±1.425 | 0.111 | 18.222±1.114 | 0.1507 | 21.000±2.179 | 0.282 |
| 盐水对照组2 | 15.056±1.626 | 0.069 | 18.056±1.211 | 0.344 | 21.353±1.902 | 0.538 |
| 盐水对照组3 | 15.111±1.676 | 0.088 | 18.474±1.679 | 0.812 | 20.647±1.998 | 0.125 |
| 戒断组 | 8.500±1.150 | 0.0001 | 26.167±2.203 | 0.0001 | 13.118±3.180 | 0.0001 |
| 脱毒治疗组 | 14.440±1.423 | 0.002 | 19.882±1.576 | 0.034 | 22.000±2.031 | 0.817 |
| 复吸组 | 10.278±1.074 | 0.0001 | 26.778±1.592 | 0.0001 | 8.5290±1.179 | 0.0001 |
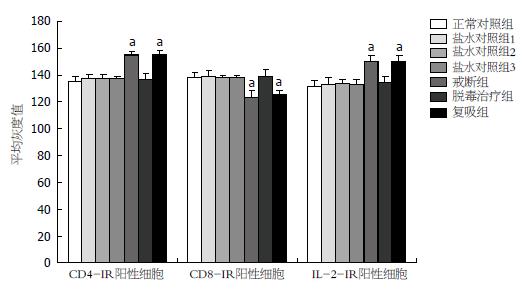
2.3.2 各组大鼠胃窦黏膜CD4、CD8和IL-2阳性细胞平均灰度值: CD4、IL-2阳性细胞在NCG、各组SCG组及MDG之间的平均灰度值差异无显著性(P>0.05); 在HWG和HRG大鼠胃窦阳性细胞平均灰度值增加明显(P<0.05), 但这两组之间无显著差异. CD8-IR阳性细胞在HWG和HRG时平均灰度值显著下降, 差异具有统计学意义(P<0.05). 其余各组无显著差异(图2).
胃肠道内在的神经支配系统-肠神经系统(enteric nervous system, ENS)能使胃肠道在无中枢神经系统支配情况下, 能自主、协调地完成复杂的蠕动、分泌、反射等活动. 胃肠道除了作为重要的消化系统之外, 还是一个复杂的神经-内分泌-免疫系统.
胃肠黏膜T细胞位于上皮和固有层内, 对胃肠免疫起重要的调节作用, 能防御病原菌的入侵, 对黏膜有保护作用. T细胞依其表面标志物不同可分为CD4+ T细胞和CD8+ T细胞两个亚群[7]. CD4阳性T细胞通过分泌细胞因子来调节机体免疫功能, 具有辅助T淋巴细胞转变为效应细胞、辅助B淋巴细胞生成抗体等作用; CD8阳性T细胞具有抑制T细胞活性, 抑制B细胞产生抗体和细胞毒素等作用, 起到抑制细胞和体液免疫的作用, 对免疫应答有负调节效应[8]. 正常人机体内CD4/CD8的比例大约CD4为60%、CD8为30%, 若比例发生改变会导致免疫功能异常. IL-2主要由CD4+ T细胞产生, 生理状态下主要通过自分泌和旁分泌方式作用于局部靶细胞, 起显著增强免疫作用, 其产生水平的高低能反映人体免疫功能状况. 此外, 在胃肠道的组织中还存在大量阿片受体, 他们对消化功能也起着重要调节作用, 当长期大量摄取外源性阿片物质, 可使整个阿片肽系统功能降低. 戒断时, 纳洛酮等竞争性的拮抗各类阿片受体, 使阿片肽系统的调节作用丧失, 出现腹泻等胃肠功能紊乱的戒断症状[9].
有报道[10], 吗啡戒断对免疫系统有损害. 本实验观察到海洛因戒断大鼠出现严重的腹泻等戒断症状, 且HWG大鼠胃窦黏膜中CD4及其细胞因子IL-2阳性细胞表达显著减弱, 提示此阶段, CD4+ T细胞的增殖分化受到抑制, 增殖活性降低导致IL-2水平下降. IL-2的减少会抑制B细胞活化转化为浆细胞, 使抗体分泌减少, 致使胃黏膜的细胞免疫和体液免疫功能受损, 不能有效清除致病因子, 而入侵的病原菌增多使得CD8表达增强.
美沙酮为µ-阿片受体激动剂, 由于其半衰期长、戒断症状轻、脱瘾成功率高而被广泛地用于阿片类成瘾的治疗[11]. 经过长期使用美沙酮脱毒治疗, 海洛因成瘾者的免疫功能有所恢复[12]. 本研究结果, 美沙酮脱毒组大鼠胃窦黏膜内CD4、CD8和IL-2的表达均有所恢复, 与Li等[13]、徐靖等[14]报道结果基本相符, 提示脱毒能有助于CD4、CD8细胞恢复, CD4细胞活性增强产生的IL-2也逐渐增多, 均参与了胃黏膜免疫功能的修复, 改善机体的免疫功能, 有效杀灭致病因子.
研究表明[13,15], 吗啡和海洛因抑制了机体的免疫系统, CD4表达减弱, 分泌IL-2减少; 况应敏等[16]对海洛因依赖者外周血中T细胞亚群进行检测, 发现总T细胞减少, CD4细胞显著降低且CD4/CD8也明显下降, 推测海洛因能加速T细胞凋亡使数量减少. 本实验将美沙酮脱毒大鼠再次注射海洛因成瘾以模拟复吸过程, 结果观察复吸大鼠胃窦CD4、IL-2再次减少, CD8表达增多, 提示复吸对胃窦黏膜免疫功能再次造成损伤. 这也是长期使用海洛因者抗感染力下降, 容易受病毒、细菌感染, 并易出现严重并发症的主要原因.
目前, 外源性阿片类物质的滥用日益严重, 长期摄入毒品形成躯体和精神依赖的患者, 体质虚弱, 免疫功能低下, 各种传染性疾病的易感性较高. 胃肠道作为机体免疫系统的一个重要组成部分, 也受到严重影响. 由于胃肠免疫功能下降所带来的许多胃肠疾病如胃肠道炎症、溃疡、出血等患病率明显增加. 目前对阿片成瘾的胃肠免疫学的研究大多为血清学方面, 但尚未见到海洛因戒断、复吸期间相关T细胞及细胞因子形态学原位研究的报道.
李淳, 副教授, 汕头大学医学院病理学
近年来由于阿片类药物滥用所引起的社会问题和健康问题已引起许多学者的关注, 作为阿片类药物典型代表的海洛因所产生的危害尤为严重. 海洛因依赖、戒断和复吸均会对消化系统免疫功能有一定的影响, 引起不同程度的胃肠功能紊乱.
在正常胃肠道组织中存在着大量的阿片样受体, 海洛因成瘾和戒断都对阿片肽系统的调节产生影响, 引起机体免疫功能的损伤, 抗感染能力下降出现腹泻等症状, 外周血检测发现总T细胞数量下降, 其中CD4显著降低.
本实验结果表明, 海洛因戒断、复吸大鼠胃窦黏膜中CD4、白介素2表达显著减弱, 提示该阶段CD4T细胞的增殖分化受到抑制, 增殖活性降低, 继而IL-2水平下降, 从而引起胃肠免疫功能受损出现一系列消化系症状.
通过观察海洛因戒断、脱毒和复吸期间胃窦部分细胞因子的改变, 为海洛因滥用引起胃肠功能紊乱的机制提供相关的形态学资料, 为临床帮助患者脱毒的同时辅以胃肠免疫治疗提供相应的理论依据.
本文选题较好, 设计合理, 对探讨海洛因对消化系统免疫功能的影响有一定的意义.
编辑: 李军亮 电编:闫晋利
| 1. | Epstein DH, Preston KL, Stewart J, Shaham Y. Toward a model of drug relapse: an assessment of the validity of the reinstatement procedure. Psychopharmacology (Berl). 2006;189:1-16. [PubMed] [DOI] |
| 2. | Rehermann B. Hepatitis C virus versus innate and adaptive immune responses: a tale of coevolution and coexistence. J Clin Invest. 2009;119:1745-1754. [PubMed] [DOI] |
| 3. | Zamarron BF, Chen W. Dual roles of immune cells and their factors in cancer development and progression. Int J Biol Sci. 2011;7:651-658. [PubMed] [DOI] |
| 5. | Maldonado R, Negus S, Koob GF. Precipitation of morphine withdrawal syndrome in rats by administration of mu-, delta- and kappa-selective opioid antagonists. Neuropharmacology. 1992;31:1231-1241. [PubMed] [DOI] |
| 7. | Smith PM, Garrett WS. The gut microbiota and mucosal T cells. Front Microbiol. 2011;2:111. [PubMed] [DOI] |
| 9. | Gallego X, Murtra P, Zamalloa T, Canals JM, Pineda J, Amador-Arjona A, Maldonado R, Dierssen M. Increased opioid dependence in a mouse model of panic disorder. Front Behav Neurosci. 2010;3:60. [PubMed] |
| 10. | Kelschenbach J, Barke RA, Roy S. Morphine withdrawal contributes to Th cell differentiation by biasing cells toward the Th2 lineage. J Immunol. 2005;175:2655-2665. [PubMed] |
| 11. | Stotts AL, Dodrill CL, Kosten TR. Opioid dependence treatment: options in pharmacotherapy. Expert Opin Pharmacother. 2009;10:1727-1740. [PubMed] [DOI] |
| 12. | Neri S, Bruno CM, Pulvirenti D, Malaguarnera M, Italiano C, Mauceri B, Abate G, Cilio D, Calvagno S, Tsami A. Randomized clinical trial to compare the effects of methadone and buprenorphine on the immune system in drug abusers. Psychopharmacology (Berl). 2005;179:700-704. [PubMed] [DOI] |
| 13. | Li HY, Zhang R, Cui CL, Han JS, Wu LZ. Damage of splenic T lymphocyte proliferation and differentiation and its normalization by electroacupuncture in morphine-dependent mice mode. Evid Based Complement Alternat Med. 2011;2011:424092. [PubMed] |
| 14. | 徐 靖, 张 勇, 石 向东, 冯 铁建, 周 海涛. HIV阳性的海洛因依赖者戒毒前后120天CD4+T变化. 中国药物滥用防治杂志. 2008;14:91-93. |
| 15. | Azarang A, Mahmoodi M, Rajabalian S, Shekari MA, Nosratabadi J, Rezaei N. T-helper 1 and 2 serum cytokine assay in chronic opioid addicts. Eur Cytokine Netw. 2007;18:210-214. [PubMed] |
| 16. | 况 应敏, 朱 月春, 况 颖, 孙 源, 华 琛, 何 文倚. 青少年吸毒者免疫细胞、细胞因子和生长激素的改变. 细胞与分子免疫学杂志. 2007;23:821-823. |