修回日期: 2013-04-17
接受日期: 2013-05-12
在线出版日期: 2013-06-08
目的: 评价熊去氧胆酸(ursodeoxycholic acid, UDCA)预防溃疡性结肠炎(ulcerative colitis, UC)癌变的有效性.
方法: 用关键词或主题词检索Cochrane图书馆、Pubmed、Embase、ISI数据库、中国期刊全文数据库、中文科技期刊数据库和万方数据库以获得相关随机对照试验, 检索时间从建库至2012-12. 根据纳入和排除标准由2名研究者独立进行文献质量评价, 应用Review Manager 5.2统计软件分析UDCA预防UC癌变的有效性, 效应量为比值比(odds ratio, OR).
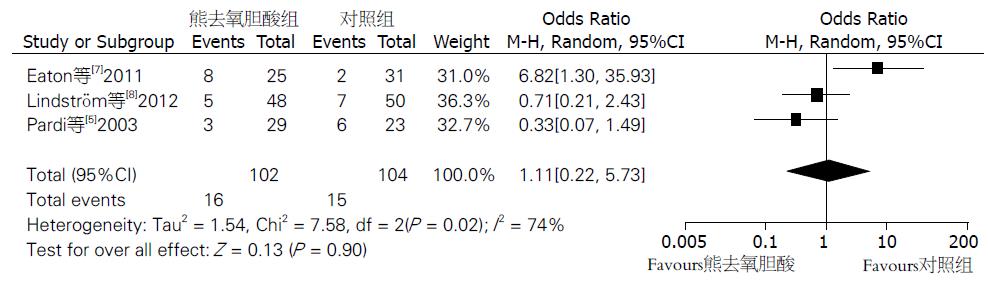
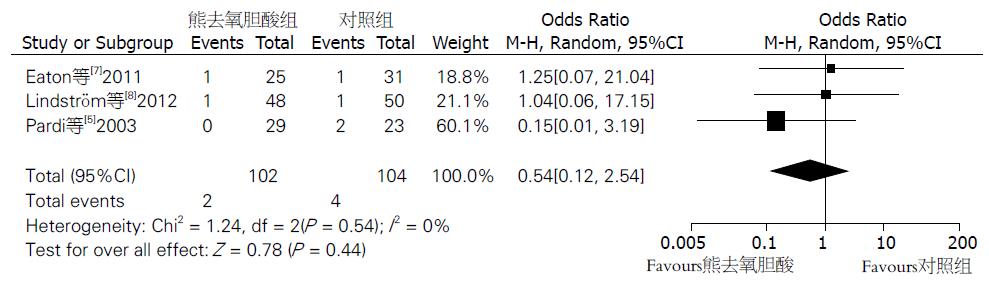
结果: 根据纳入标准纳入3个比较UDCA与安慰剂的随机对照试验. UDCA组结直肠非典型性增生或癌的发病率与安慰剂组无统计学差异(非典型性增生: OR = 1.11, 95%CI: 0.22-5.73, P = 0.90; 癌: OR = 0.54, 95%CI: 0.12-2.54, P = 0.44). 与安慰剂比较, UDCA可减少非典型性增生积分.
结论: UDCA可阻止UC结直肠低度非典型性增生的进展, 但不能降低UC相关性非典型性增生和结直肠癌的发病率.
核心提示: 熊去氧胆酸(ursodeoxycholic acid)有阻止溃疡性结肠炎(ulcerative colitis, UC)结直肠低度非典型性增生的进展可能, 但不能降低UC相关性非典型性增生和结直肠癌的发病率.
引文著录: 崔德军, 黄博, 朱敏, 任映. 熊去氧胆酸预防溃疡性结肠炎癌变的Meta分析. 世界华人消化杂志 2013; 21(16): 1563-1567
Revised: April 17, 2013
Accepted: May 12, 2013
Published online: June 8, 2013
AIM: To evaluate the efficacy of ursodeoxycholic acid (UDCA) in preventing colorectal cancer in patients with ulcerative colitis (UC).
METHODS: Keyword and MeSH searches of the Cochrane Database, Pubmed, Embase, Science Citation Index, Full-text Database of Chinese Journals, the Database of Chinese Science Journals and Wanfang Database from the inception of each database to December 2012 were performed to identify all available randomized controlled trials. Two independent reviewers assessed studies for inclusion and exclusion based on methodological quality criteria. Summary estimates of preventive effects were produced with Review Manager 5.2, using odds ratio (OR).
RESULTS: Three randomized controlled trials comparing UDCA with placebo were qualified for the meta-analysis according to inclusion criteria. Patients who received UDCA had a similar risk of developing colorectal dysplasia or cancer compared with those who received placebo (dysplasia: OR = 1.11, 95%CI: 0.22-5.73, P = 0.90; cancer: OR = 0.54, 95%CI: 0.12-2.54, P = 0.44). UDCA-treated patients had lower progression scores of dysplasia than those treated with placebo.
CONCLUSION: UDCA may prevent further progression of low-grade colorectal dysplasia but does not decrease incidence of colorectal dysplasia or cancer in patients with UC.
- Citation: Cui DJ, Huang B, Zhu M, Ren Y. Ursodeoxycholic acid for preventing colorectal cancer in patients with ulcerative colitis: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2013; 21(16): 1563-1567
- URL: https://www.wjgnet.com/1009-3079/full/v21/i16/1563.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i16.1563
溃疡性结肠炎(ulcerative colitis, UC)是一类病因不很清楚的肠道非特异性炎症性疾病. UC病程常呈慢性迁延过程, 有癌变倾向. UC相关性结直肠癌发病风险随病程逐年增加[1]. 目前采用内镜监测UC癌变[2], 但未见内镜监测可延长UC生存期的确切证据[3]. 因而探索药物预防UC癌变显得很重要. 熊去氧胆酸(ursodeoxycholic acid, UDCA)可用于UC合并原发性硬化性胆管炎的治疗. 目前UDCA预防UC癌变的作用存在争议. 因而, 本研究就UDCA预防UC癌变作一Meta分析, 以期为药物预防UC癌变提供循证医学证据.
检索Cochrane Library、PubMed、Embase、ISI数据库、中国期刊全文数据库、中文科技期刊数据库和万方数据库, 检索时限为从建库至2012-12. 在临床试验注册中心查询正在研究的临床试验. 英文检索词: ulcerative colitis, inflammatory bowel disease, ursodeoxycholic acid; 中文检索词: 溃疡性结肠炎, 炎症性肠病, 熊去氧胆酸. 手工检索相关文献的参考文献和国内外重要胃肠病会议的摘要, 如美国消化疾病周、亚太消化疾病周等. 联系有关医药公司获取熊去氧胆酸相关信息.
1.2.1 纳入与排除标准: 纳入标准: 纳入已发表及未发表的随机对照试验(randomised controlled trials, RCTs), 语言不限. 研究对象为确诊UC的患者, 性别、年龄、人种和国籍等不限. 干预措施为试验组使用熊去氧胆酸治疗, 治疗剂量、疗程、给药途径不限. 对照组采用安慰剂或空白对照. 主要测量指标为癌变发生率、非典型性增生发生率, 具体标准由相应的纳入研究定义. 次要测量指标为不良反应发生率. 排除标准: 排除数据资料不全或未表明终点结局而无法纳入利用的资料. 排除重复的报道.
1.2.2 质量评价: 根据纳入与排除标准由两位研究者独立进行文献质量评价, 有分歧时由第3位研究者参与讨论并最终决定是否纳入文献. 按照Cochrane系统评价员手册(5.0版)[4]对纳入的研究进行文献质量评价. 评价内容为: 随机方法、分配隐藏、盲法、退出与失访、选择性报告和其他偏倚来源. 文献质量分A、B、C 3个等级. 文献质量A级为所有质量评价标准均完全满足, 偏倚可能性最小; B级为任何一条或多条质量评价标准部分满足, 偏倚可能性为中度; C级为任何一条或多条质量评价标准完全不满足, 偏倚可能性为高度.
1.2.3 资料提取: 由两位研究者独立进行资料提取, 交叉核查, 有分歧时征求第3位研究者意见. 资料提取表内容包括: 基本情况、试验对象特征、干预措施、研究特征、研究结果. 对纳入的每一个RCT分别提取数据. 对失访和退出情况, 尽量获得意向性分析(intention-to-treat analysis, ITT)数据. 通过邮件与作者联系以索取缺乏的数据. 涉及多组研究的RCT时, 提取与本研究相关的数据.
统计学处理 采用Cochrane协作网提供的RevMan 5.2软件进行统计分析. 效应量为比值比(odds ratio, OR), 并计算其95%置信区间(confidence interval, CI). 统计学异质性采用卡方检验(chi-square test, χ2), 若P>0.1, I2≤50%时异质性不明显, 采用固定效应模型估计合并效应量; 若P≤0.10, I2>50%)时异质性明显, 选用随机效应模型. 异质性过大时(I2>75%)需要分析异质性原因和来源, 必要时进行亚组分析、敏感性分析, 甚至放弃Meta分析. 合并效应量的检验采用Z检验, P≤0.05有统计学意义. 纳入研究在9篇以上时采用倒漏斗图检验发表偏倚.
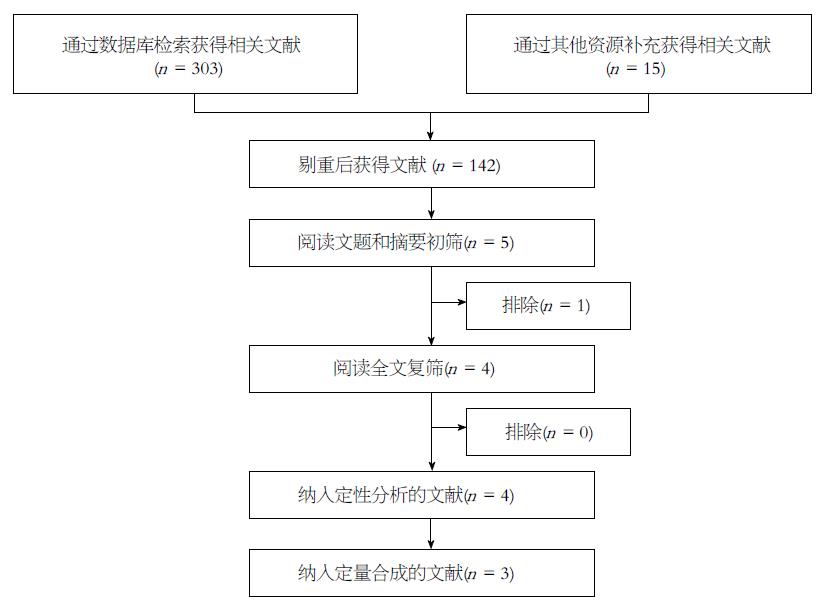
纳入研究的RCTs皆为国外文献, 均为随机、双盲、安慰剂对照试验. 纳入的4个RCTs对隐蔽分组、失访与退出、选择性报告、其他偏倚来源的描述不很清楚, 质量等级皆为B级. 各纳入研究的基本特征与质量评价详见表1.
| 纳入研究 | 样本量 | 试验组 | 对照组 | 基线情况 | 随机方法 | 隐蔽分组 | 盲法 | 失访/退出 | 选择性报告 | 其他偏倚来源 | 质量等级 |
| Pardi等[5]2003 | 52 | UDCA(13-15 mg/kg·d) | 安慰剂 | 可比 | 计算机随机 | unclear | 双盲 | 有描述 | unclear | unclear | B |
| Sjöqvist等[6]2004 | 19 | UDCA(500 mg bid) | 安慰剂 | 可比 | 提及 | unclear | 双盲 | 有描述 | unclear | unclear | B |
| Eaton等[7]2011 | 56 | UDCA(28-30 mg/kg·d) | 安慰剂 | 可比 | 计算机随机 | unclear | 双盲 | 有描述 | unclear | unclear | B |
| Lindström等[8]2012 | 98 | UDCA(17-23 mg/kg·d) | 安慰剂 | 基本可比 | 提及 | unclear | 双盲 | 有描述 | unclear | unclear | B |
2.3.1 UC非典型性增生发生率: 纳入4个RCTs[5-8], 其中1个RCT[6]研究UDCA对已发生非典型性增生或DNA异倍体的炎症性肠病患者的治疗作用, 采用UDCA与安慰剂对照的随机双盲试验. 结果发现UDCA组与安慰剂组无显著差异, 但安慰剂组非典型性增生有加重或转化为异型增生有关的病变或肿块情况, 而UDCA组病灶无加重情况. 该RCT认为UDCA可能会阻止炎症性肠病结直肠低度非典型性增生的发展. 但该RCT与本研究拟探讨的UDCA预防UC癌变作用的目的不一致, 因而未纳入Meta分析.
纳入定量分析的3个研究[5,7,8]皆监测了UDCA组与安慰剂组的非典型性增生发生率. 其中试验组102例, 对照组104例. Meta分析结果显示各组间异质性差异有统计学意义(P<0.10, I2 = 74%), 采用随机效应模型分析. UDCA组与安慰剂组的非典型性增生发生率差异无统计学意义(OR = 1.11, 95%CI: 0.22-5.73, P = 0.90)(图2). 排除含常规剂量UDCA的试验后重新进行Meta分析, 结果稳定性好.
2.3.2 UC癌变发生率: 纳入分析的3个研究[5,7,8]比较了UDCA组与安慰剂组的癌变发生率. Meta分析结果显示各组间异质性差异没有统计学意义(P>0.10, I2 = 0%), 采用固定效应模型分析. UDCA组与安慰剂组的癌变发生率差异没有统计学意义(OR = 0.54, 95%CI: 0.12-2.54, P = 0.44)(图3). 敏感性分析显示结果稳定性好.
2.3.3 UC发表偏倚: 因纳入的RCTs<9个, 未绘制倒漏斗图分析发表偏倚.
UC是一种慢性非特异性结直肠炎, 病程越长、病变范围越大, 患结直肠癌的风险越高. UC并发原发性硬化性胆管炎时癌变风险更高[9,10]. 因而如何预防UC癌变是临床医生亟待解决的难题. UDCA是最早从北极熊胆汁中分离得到的一种亲水二羟胆盐, 有增加胆汁酸的分泌, 抑制肝脏胆固醇的合成等作用. 临床上主要用于原发性胆汁性肝硬化、胆固醇型胆结石、原发性硬化性胆管炎等肝胆系统疾病的治疗. 近来有研究表明, UDCA对结直肠肿瘤、异型增生有化学预防作用[11,12], 欧洲克罗恩病与结肠炎组织和美国胃肠病学会皆推荐UDCA治疗并发原发性硬化性胆管炎的UC患者[13,14]. 近来UDCA预防UC癌变的临床研究结论不完全一致, 甚至有研究发现长期大剂量使用UDCA可增加并发原发性硬化性胆管炎的UC患者的癌变风险[7]. 因而有必要对UDCA预防溃疡性结肠炎癌变的作用作一系统评价, 为UC临床合理用药提供证据.
本研究较全面地检索全世界范围内UDCA预防UC癌变的RCTs. 纳入分析的RCTs都为随机、安慰剂对照试验, 质量等级高. 纳入分析的RCTs皆使用双盲法, 可避免测量性偏倚, 但部分RCTs[6,8]仅提及随机, 未具体描述随机方法, 可能存在选择性偏倚. 隐蔽分组不清楚, 也可导致选择性偏倚. 隐蔽分组不清楚的临床试验的比值比可达30%的偏倚, 隐蔽分组不充分的临床试验中可有41%的偏倚[15]. 纳入Meta分析的RCTs的试验组UDCA用药剂量、时间不一致, 存在一定异质性. 纳入的文献皆为国外文献, 在国外开展的研究. 评价结果是否适用于我国患者, 是否可推广应用, 需要慎重对待.
Meta分析结果表明UDCA组与安慰剂组的非典型性增生发生率差异无统计学意义, 但存在异质性. 考虑异质性与用药剂量、时间、随访时间、内镜监测等有关. 由于I2<75%, 未进一步作敏感性分析和亚组分析. UDCA组与安慰剂组的癌变发生率差异也无统计学意义. 本研究与Ashraf等[16]的研究结果相似. 但本研究纳入的RCTs证据强度较高, 敏感性分析提示稳定性较好, 结果的真实性和可靠性更好. 另外, 本研究定性分析还发现UDCA可能会阻止UC结直肠低度非典型性增生的发展.
本研究就UDCA预防UC癌变作一Meta分析, 前瞻性的UDCA治疗UC非典型性增生或DNA异倍体的RCT少. 纳入的RCTs样本量有限, 且Meta分析为2次研究, 结果证据强度依赖于纳入RCTs的质量, Meta分析在设计、资料收集、质量评价、统计分析可存在偏倚, 因而在评价UDCA预防UC癌变效果时可能存在一定局限性.
总之, UDCA可阻止UC结直肠低度非典型性增生的发展, 但不能降低UC相关性结直肠癌和非典型性增生的发病率. 由于纳入RCTs少, 存在一些方法学上的局限性, 应慎重对待本评价结论. 今后有必要严格按照CONSORT标准[17]开展大样本、多中心、高质量的临床随机对照试验, 并长期随访, 以进一步验证上述结论.
溃疡性结肠炎(ulcerative colitis, UC)是慢性非特异性炎症性疾病, 病程越长、病变范围越大, 患结直肠癌的风险越高, UC合并原发性硬化性胆管炎时癌变风险更高. 熊去氧胆酸(ursodeoxycholic acid, UDCA)常用于治疗合并原发性硬化性胆管炎的UC患者. 目前UDCA预防UC癌变的作用存在争议.
杜奕奇, 副教授, 中国人民解放军第二军医大学长海医院; 刘杰民, 副主任医师, 贵州省人民医院消化内镜科
UDCA预防UC癌变的作用存在量效关系, 甚至长期大剂量使用UDCA可增加UC癌变风险可能. 亟待开展不同剂量UDCA与UC癌变关系的基础和临床研究.
Ashraf等采用Meta分析方法发现UDCA不能降低UC合并原发性硬化性胆管炎患者的腺瘤变或癌变风险.
本文严格评价UDCA预防UC癌变的有效性. 纳入研究证据强度大, 结果的真实性和可靠性好. 本研究为UC临床合理用药提供一定证据, 具有一定创新性.
本研究表明UDCA可阻止UC结直肠低度非典型性增生的发展, 但不能降低UC相关性结直肠癌和非典型性增生的发病率. 本文为UC并发原发性硬化性胆管炎的合理治疗提供参考.
本文就UDCA预防UC癌变作一Meta分析, 研究结论为指导临床用药提供了重要依据.
编辑: 田滢 电编: 闫晋利
| 1. | Herszenyi L, Miheller P, Tulassay Z. Carcinogenesis in inflammatory bowel disease. Dig Dis. 2007;25:267-269. [PubMed] |
| 3. | Danese S, Fiocchi C. Ulcerative colitis. N Engl J Med. 2011;365:1713-1725. [PubMed] [DOI] |
| 4. | Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.0.0 [updated February 2008]. The Cochrane Collaboration, 2008. . |
| 5. | Pardi DS, Loftus EV, Kremers WK, Keach J, Lindor KD. Ursodeoxycholic acid as a chemopreventive agent in patients with ulcerative colitis and primary sclerosing cholangitis. Gastroenterology. 2003;124:889-893. [PubMed] |
| 6. | Sjöqvist U, Tribukait B, Ost A, Einarsson C, Oxelmark L, Löfberg R. Ursodeoxycholic acid treatment in IBD-patients with colorectal dysplasia and/or DNA-aneuploidy: a prospective, double-blind, randomized controlled pilot study. Anticancer Res. 2004;24:3121-3127. [PubMed] |
| 7. | Eaton JE, Silveira MG, Pardi DS, Sinakos E, Kowdley KV, Luketic VA, Harrison ME, McCashland T, Befeler AS, Harnois D. High-dose ursodeoxycholic acid is associated with the development of colorectal neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. Am J Gastroenterol. 2011;106:1638-1645. [PubMed] [DOI] |
| 8. | Lindström L, Boberg KM, Wikman O, Friis-Liby I, Hultcrantz R, Prytz H, Sandberg-Gertzén H, Sangfelt P, Rydning A, Folvik G. High dose ursodeoxycholic acid in primary sclerosing cholangitis does not prevent colorectal neoplasia. Aliment Pharmacol Ther. 2012;35:451-457. [PubMed] [DOI] |
| 9. | Soetikno RM, Lin OS, Heidenreich PA, Young HS, Blackstone MO. Increased risk of colorectal neoplasia in patients with primary sclerosing cholangitis and ulcerative colitis: a meta-analysis. Gastrointest Endosc. 2002;56:48-54. [PubMed] |
| 10. | Silveira MG, Lindor KD. Primary sclerosing cholangitis. Can J Gastroenterol. 2008;22:689-698. [PubMed] |
| 11. | Khare S, Mustafi R, Cerda S, Yuan W, Jagadeeswaran S, Dougherty U, Tretiakova M, Samarel A, Cohen G, Wang J. Ursodeoxycholic acid suppresses Cox-2 expression in colon cancer: roles of Ras, p38, and CCAAT/enhancer-binding protein. Nutr Cancer. 2008;60:389-400. [PubMed] [DOI] |
| 12. | Tung BY, Emond MJ, Haggitt RC, Bronner MP, Kimmey MB, Kowdley KV, Brentnall TA. Ursodiol use is associated with lower prevalence of colonic neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. Ann Intern Med. 2001;134:89-95. [PubMed] |
| 13. | Biancone L, Michetti P, Travis S, Escher JC, Moser G, Forbes A, Hoffmann JC, Dignass A, Gionchetti P, Jantschek G. European evidence-based Consensus on the management of ulcerative colitis: Special situations. J Crohns Colitis. 2008;2:63-92. [PubMed] [DOI] |
| 14. | Farraye FA, Odze RD, Eaden J, Itzkowitz SH, McCabe RP, Dassopoulos T, Lewis JD, Ullman TA, James T, McLeod R. AGA medical position statement on the diagnosis and management of colorectal neoplasia in inflammatory bowel disease. Gastroenterology. 2010;138:738-745. [PubMed] [DOI] |
| 15. | Schulz KF, Chalmers I, Hayes RJ, Altman DG. Empirical evidence of bias. Dimensions of methodological quality associated with estimates of treatment effects in controlled trials. JAMA. 1995;273:408-412. [PubMed] [DOI] |
| 16. | Ashraf I, Choudhary A, Arif M, Matteson ML, Hammad HT, Puli SR, Bechtold ML. Ursodeoxycholic acid in patients with ulcerative colitis and primary sclerosing cholangitis for prevention of colon cancer: a meta-analysis. Indian J Gastroenterol. 2012;31:69-74. [PubMed] [DOI] |