修回日期: 2013-03-26
接受日期: 2013-04-27
在线出版日期: 2013-06-08
目的: 探讨肝细胞癌(hepatocellular carcinoma, HCC)组织及血清中microRNA-183家族的表达与诊断价值.
方法: 采用实时荧光定量PCR法, 检测以自身对照法HCC患者组织(癌、癌周和远癌)和血清中miR-96、miR-182及miR-183的表达, 并与肝硬化、慢性乙型肝炎(chronic hepatitis B, CHB)患者及健康体检者进行比较.
结果: HCC患者的癌组织和血清miR-96和miR-182表达量均明显高于其他组(P<0.001); miR-183癌组织相对表达量显著低于远癌及癌周(P<0.001), 但在血清中各组间差异无统计学意义. HCC患者组织及血清miR-183家族表达呈明显正相关(rmiR-96 = 0.815、rmiR-182 = 0.806、rmiR-183 = 0.851). 血清miR-96、miR-182 ROC曲线下面积分别为0.927和0.940. HCC患者血清miR-183相对表达量与肝外转移相关(P = 0.019).
结论: HCC组织miR-183家族呈异常表达, 呈现miR-96和miR-182升高, miR-183下降; 血miR-96和miR-182异常表达有助于肝癌诊断, 而miR-183降低与HCC转移相关.
核心提示: 人类约50%miRNAs以miRNA家族或称基因簇(miRNA clusters)的形式存在, miR-183家族即是其中之一. miR-183家族基因定位于人类染色体7q32, 编码miR-96、miR-182及miR-183,其序列在不同动物物种中高度保守.
引文著录: 邱历伟, 吴玮, 赛文莉, 杨君伶, 张海健, 顾星, 时运, 陆少林, 姚登福. microRNA-183家族的表达在肝细胞癌临床诊断中的价值. 世界华人消化杂志 2013; 21(16): 1487-1492
Revised: March 26, 2013
Accepted: April 27, 2013
Published online: June 8, 2013
AIM: To investigate the expression of microRNA-183 family members in hepatocellular carcinoma (HCC) and to analyze their diagnostic value.
METHODS: The expression of miR-183 family members (miR-96, miR-182 and miR-183) was examined by real-time reverse transcription-quantitative polymerase chain reaction (RT-qPCR) in HCC and matched tumor-adjacent and tumor-distant tissues, and in 80 serum samples from patients with HCC, cirrhosis or chronic hepatitis B, and health controls.
RESULTS: The levels of miR-96 and miR-182 expression in tissues and sera of HCC patients were significant higher than those in any of other groups (all P < 0.001). The level of miR-183 in the liver was significantly lower in HCC than in matched tumor-adjacent and tumor-distant tissue (both P < 0.001), although there was no significant difference in serum miR-183 between each group. Liver expression of miR-183 family members was positively associated with their serum levels (rmiR-96 = 0.815, rmiR-182= 0.806, rmiR-183 = 0.851) in HCC. The areas under the receiver operating characteristic curve of serum miR-96 and miR-182 were 0.927 and 0.940. The relative level of serum miR-183 was significantly higher in patients with extrahepatic metastasis than in those without extrahepatic metastasis (P < 0.019).
CONCLUSION: Expression of miR-96 and miR-182 is up-regulated and that of miR-183 down-regulated in HCC. Circulating miR-96 and miR-182 are useful biomarkers for HCC diagnosis. Down-regulation of miR-183 is associated with HCC extrahepatic metastasis.
- Citation: Qiu LW, Wu W, Sai WL, Yang JL, Zhang HJ, Gu X, Shi Y, Lu SL, Yao DF. Diagnostic value of expression of microRNA-183 family members in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(16): 1487-1492
- URL: https://www.wjgnet.com/1009-3079/full/v21/i16/1487.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i16.1487
肝细胞癌(hepatocellular carcinoma, HCC)是我国常见的恶性肿瘤, 其发生、发展是多因素、多基因和多步骤的复杂过程[1,2]. MicroRNA(miRNA)是一类内源性非编码小分子RNA, 可经序列特异性翻译抑制或miRNA裂解来调控其靶基因, 他们通过与靶基因miRNA的结合调控其他基因miRNA和蛋白的表达, 参与发育、炎症、肿瘤等多种生理、病理过程. HCC中多个miRNA的异常表达已被证明参与了HCC的发生发展. 我国绝大多数肝癌患者与HBV感染密切相关, 但HBV感染发展到肝硬化或肝癌进程中, 有关miRNA表达研究较少[3-5]. 本文初步分析了miRNA-183家族成员在肝癌不同组织及外周血中的表达及相关性, 旨在探讨该家族在肝癌诊断中的应用价值.
按自身配对法收集2010-03/2011-03南通大学附属医院住院肝癌患者的手术后新鲜组织分为癌灶、癌周(距癌中心≥3 cm)及远癌(距癌中心>5 cm)组并留取血清, 其中男12例, 女8例; 年龄37-77岁, 平均58.5岁±8.4岁. HCC患者术前均未做任何抗HCC治疗, 术后均病理检查证实为HCC. 另从住院患者中收集肝硬化及慢性乙型肝炎(chronic hepatitis B, CHB)患者血清各20例, 其诊断符合中华医学会2010版《慢性乙型肝炎防治指南》标准. 20例健康人血清来自健康体检人群, 无重要器官疾病史, 乙型肝炎病毒表面抗原(hepatitis B surface antigen, HBsAg)和丙氨酸氨基移换酶(alanine aminotransferase, ALT)均正常. miRcute miRNA提取分离试剂盒、miRcute miRNAcDNA第一链合成试剂盒、miRcute miRNA荧光定量检测试剂盒和microRNA特异性引物由北京天根公司提供和合成; miRNeasy mini kit试剂盒购自德国QIAGEN公司; TRIzol LS购自美国Invitrogen公司; Rotor-Gene Q实时荧光定量PCR仪为德国QIAGEN公司产品; 高速冷冻离心机Z300K为德国HERMLE公司产品.
1.2.1 组织及血清miRNA提取: 50 mg肝组织, 加入MZ裂解液1 mL, 置液氮中研磨匀浆后按照miRcute miRNA提取分离试剂盒说明书步骤完成, 提取的小分子RNA溶于20 μL Rnase-free ddH2O中备用. 200 μL新鲜血清加入3倍体积的TRIzol LS后震荡混匀, 加入0.5 mL氯仿后震荡混匀, 12000 r/min 4 ℃离心15 min, 取上清, 加入1.5倍体积的无水乙醇, 按照miRNeasy mini kit试剂盒说明书步骤完成提取, 取得的RNA溶解于200 μL Rnase-free ddH2O中备用.
1.2.2 荧光定量PCR检测组织和血清中miRNA: miRNA逆转录按照miRcute miRNA cDNA第一链合成试剂盒说明书步骤进行. 荧光定量PCR按照miRcute miRNA荧光定量检测试剂盒说明书进行检测检测. 反应体系为20 μL, 包括第一链合成cDNA、miRcute miRNA premix及引物(引物序列见表1). 反应条件: 94 ℃预变性2 min; 然后94 ℃ 20 s、60 ℃ 35 s, 进行35-45个循环反应. 以U6 RNA(组织)及miR-16(血清)作为内参. 组织及血清中miR-96、miR-182及miR-183相对表达量比较采用2-△Ct法, 组织及血清中miR-96、miR-182及miR-183相关分析中, 相对表达量计算公式为RQ = 2-△△Ct[6]. 每个样品以3次重复测定取平均值, 同时做空白组以提高实验可靠性.
| 扩增序列 | 基因序列号 | 引物序列 | |
| 目的基因 | miR-96 | MIMAT0000095 | TATGGCACTGGTAGAATTCACT |
| miR-182 | MIMAT0000259 | TTTGGCAATGGTAGAACTCACA | |
| miR-183 | MIMAT0000261 | TTTGGCACTAGCACATTTTTGCT | |
| 内参基因 | U6 RNA | X07425.1 | CACCACGTTTATACGCCGGTG |
| miR-16 | MIMAT0000069 | TAGCAGCACGTAAATATTGGCG |
统计学处理 计量资料以mean±SD表示. 应用方差分析比较不同组间miRNA相对表达量差异, 通过双变量线性回归与相关分析分析HCC患者癌组织与相应血清miRNA相对表达量的相关性, 应用ROC受试者工作曲线分析血清miRNA诊断价值, 应用两样本t检验比较不同病理指标间miRNA相对表达量差异. 检验水准为α = 0.05. 所有统计学检验应用SPSS12.0软件包进行.
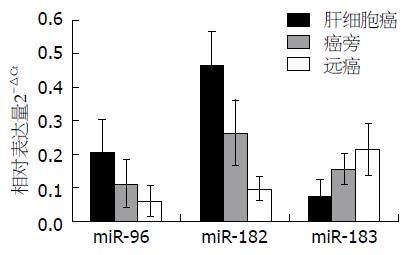
在20例HCC癌组织及配对的癌周及远癌组织中, miR-96及miR-182的相对表达量均表现为癌组织>癌周>远癌的趋势, 其差异均有统计学意义(FmiR-96 = 39.54, FmiR-182 = 100.03, P = 0.0000), 而与此相反, miR-183的相对表达量在癌组织中最低, 明显低于配对的癌周及远癌组织(FmiR-183 = 28.87, P = 0.0000)(图1).
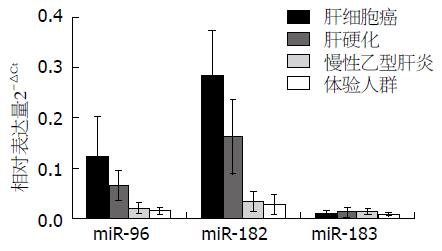
miR-183家族在血清中的表达规律与组织基本一致, HCC患者血清miR-96及miR-182的相对表达量均明显高于肝硬化、CHB及正常体检者, 差异有统计学意义(FmiR-96 = 27.10, FmiR-182 = 84.68, P = 0.0000), 而miR-183相对表达水平在各组血清中均较低, 各组间无统计学差异(FmiR-183 = 2.72, P = 0.0665)(图2).
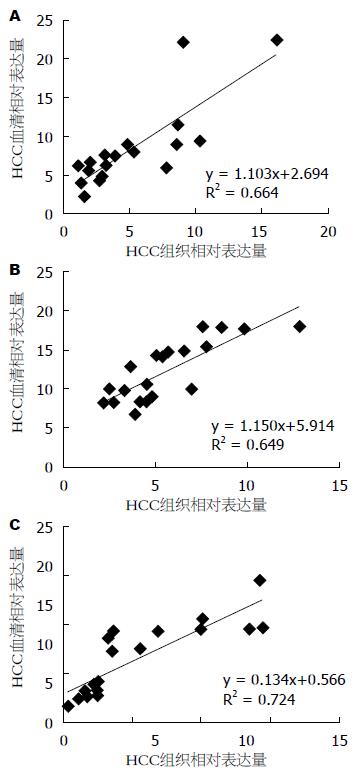
按照计算公式RQ = 2-△△CT, 分别算出miR-96、miR-182及miR-183在20例 HCC患者癌组织及自身血清中的相对表达量(差异倍数), 经过双变量线性回归和相关分析得出HCC患者癌组织与相应血清中的miR-96、miR-182及miR-183相对表达量均呈正相关, 相关系数分别为rmiR-96 = 0.815、rmiR-182 = 0.806、rmiR-183 = 0.851, 经统计学分析, 均P<0.001(图3).
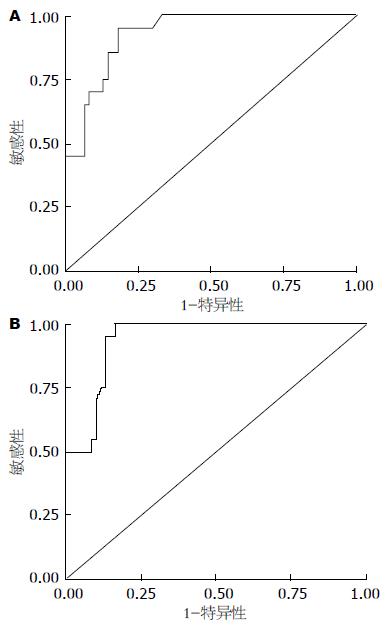
采用受试者工作曲线图分析受试人群中血清miR-96及miR-182相对表达量在肝癌诊断中的应用, 发现血清miR-96及miR-182曲线下面积分别为0.927和0.940. 以血清miR-96相对表达量0.052为临界值, 对肝癌的诊断敏感性为95%, 特异性为81.7%; 以血清miR-182相对表达量0.157为临界值, 对肝癌诊断敏感性为95%, 特异性为83.3%(图4).
HCC患者血清miR-96、miR-182表达水平与肝癌肿瘤直径、血甲胎蛋白(α-fetoprotein, AFP)水平、肿瘤分化程度及是否有肝外转移等病理指标无关(P>0.05). 血清miR-183表达水平与肿瘤直径、AFP及分化程度无关, 但与患者是否有肝外转移有关(P = 0.019, 表2).
| 病理指标 | n | miR-96 | miR-182 | miR-183 |
| 肿瘤直径(cm) | ||||
| >5 | 11 | 0.141±0.104 | 0.280±0.099 | 0.009±0.005 |
| <5 | 9 | 0.101±0.028 | 0.290±0.078 | 0.011±0.006 |
| P值 | 0.279 | 0.808 | 0.426 | |
| 血甲胎蛋白(ng/mL) | ||||
| >400 | 8 | 0.120±0.089 | 0.276±0.081 | 0.010±0.007 |
| ≤400 | 12 | 0.125±0.077 | 0.290±0.096 | 0.010±0.005 |
| P值 | 0.897 | 0.739 | 0.999 | |
| 分化程度 | ||||
| 高中分化 | 11 | 0.100±0.040 | 0.284±0.097 | 0.011±0.007 |
| 低分化 | 9 | 0.151±0.108 | 0.284±0.082 | 0.009±0.004 |
| P值 | 0.163 | 0.999 | 0.457 | |
| 肝外转移 | ||||
| 有 | 5 | 0.107±0.032 | 0.273±0.096 | 0.005±0.001 |
| 无 | 15 | 0.129±0.091 | 0.288±0.089 | 0.012±0.005 |
| P值 | 0.608 | 0.758 | 0.019 |
HCC是我国的高发恶性肿瘤之一, 在所有恶性肿瘤中其发病率为第3位, 死亡率为第2位, 每年约有11万肝癌患者因病死亡[7]. 目前肝癌的治疗仍以手术切除为主, 但由于肝癌有易转移及术后易复发等特点, 术后5年生存率仍不十分理想, 因而对肝癌的治疗效果很大程度上依赖于早期发现、早期诊断和早期手术. 临床用于辅助诊断肝癌的血清标志物较多, 如AFP、血清谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)等, 但对于肝癌的诊断仍存在敏感度较低、特异性不足等问题. 以经典的AFP为例, 研究结果显示其对肝癌诊断的敏感度为55.8%, 特异性76%, 有1/3以上的原发性肝癌患者AFP为阴性[8]. 因此, 找到一种早期诊断肝癌敏感性及特异性更高的肿瘤标志物是迫切需要的.
miRNA由19-26个核苷酸组成, 可调节其下游多个甚至数百个靶基因, miRNA在HCC发生过程中, 既可通过调节细胞凋亡或者细胞周期, 也可经调节癌基因和/或抑癌基因参与肿瘤发生途径, 影响HCC的发生. 因而很多miRNA实质即是肝癌相关的癌基因或抑癌基因, 对这些肝癌相关的miRNA进行检测, 可能对肝癌的诊断以及预后判断等具有一定的价值[9]. 如有学者通过芯片技术鉴定了肝癌和配对非癌肝组织中差异表达的20个miRNA, 发现其中miR-138在77.8%的肝癌组织中表达下调, miR-138作为一种抑癌基因通过影响细胞周期抑制肿瘤形成, 其失活或表达下调可能是肝癌发生的标志[10]. 而对有无早期复发肝癌者大通量miRNA差异分析, 发现miR-29a-5p表达与肝癌术后早期复发密切相关[11], 对其进行检测有助预测术后复发和判断生存率. 但以上这些研究大部分局限于肿瘤组织或肿瘤细胞.
人类约50%miRNAs以miRNA家族或称基因簇(miRNA clusters)的形式存在, miR-183家族即是其中之一. miR-183家族基因定位于人类染色体7q32, 编码miR-96、miR-182及miR-183, 其序列在不同动物物种中高度保守[12]. 已有研究表明, miR-183家族成员在多种肿瘤中有差异表达, 如miR-96和miR-182在结直肠癌、前列腺癌中高表达, miR-183在骨肉瘤、卵巢癌中低表达等均已有报道[13-17]. 本研究通过定量PCR技术发现miR-183家族中miR-96、miR-182的相对表达量在肝癌患者肝组织中呈癌组织>癌周组织>远癌组织的趋势, 各组间的差异有显著性, 而miR-183的相对表达趋势则与此相反, 提示miR-183家族成员可能分别作为癌基因(miR-96和miR-182)和抑癌基因(miR-183)在肝癌发生发展过程中发挥作用.
对于一个良好的诊断标志物而言, 标本留取方便, 检测对象成分稳定易于检出是必不可少的条件; 与检测组织miRNA相比, 患者血清较易取得和检测, 且研究表明肿瘤患者血清中 miRNA的表达与肿瘤组织中超表达的miRNA释放入外周循环有直接的关联[18]. 目前, 肿瘤组织中miRNA释放入外周血的机制主要有两种, 一种为肿瘤细胞在增殖扩散和溶解消散过程中导致miRNA释放入外周血; 另一种为miRNA主要通过超微小泡在细胞间传递, 在传递过程中超微小泡从细胞膜脱落将miRNA释放到胞外和外周血[19,20]. 以往认为miRNA在外周血中不稳定而难于检测, 但近年研究发现miRNA在外周血中非常稳定, 即使在血清中加入RNase、Dnase、盐酸、氢氧化钠等或反复冻融处理后仍能检测到表达稳定的miRNA, 这充分说明血清miRNA 有可能作为一种新的标志物用于肿瘤的诊断[21].
miR-183家族在非小细胞肺癌中是一种潜在的肿瘤标志物, 其表达与肺癌的诊断、预后判断密切相关, 但检测血清miR-183家族在肝癌诊断中的应用尚未见报道[22]. 本研究结果显示, 肝癌患者血清中miR-96和miR-182的相对表达量明显高于肝硬化、CHB和正常体检者, 且肝癌患者血清中miR-96和miR-182的高表达与肿瘤组织中的表达呈正相关关系, 表明血清miR-96和miR-182相对表达水平与肝脏中的表达水平相一致, 能反映肝癌发生发展的情况. ROC工作曲线显示以miR-96和miR-182作为诊断标志物, 其曲线下面积分别达到0.927和0.940; 以miR-96相对表达量0.052和miR-182相对表达量0.157为临界值, 其诊断灵敏度和特异性分别达到95%、95%和81.7%、83.3%. 而肝癌患者血清miR-183相对表达量与其他组相比无明显差异, 但在有肝外转移的HCC患者血清中miR-183相对表达量低于无肝外转移者, 差异有统计学意义.
总之, HCC患者血清中miR-96和miR-182的相对表达量明显高于肝硬化、CHB和正常体检者, 而有肝外转移的肝癌患者其血清miR-183相对表达量明显低于无肝外转移者. 检测血清miR-183家族的表达在肝癌的诊断和预后判断中有较好的应用价值.
miRNA由19-26个核苷酸组成, 可调节其下游多个甚至数百个靶基因, miRNA在肝细胞癌(hepatocellular carcinoma, HCC)发生过程中, 既可通过调节细胞凋亡或者细胞周期, 也可经调节癌基因和/或抑癌基因参与肿瘤的发生途径, 影响肝癌的发生.
唐南洪, 教授, 福建医科大学附属协和医院省肝胆外科研究所
近年研究发现MicroRNA(miRNA)在血中稳定, 即使在血清中加入RNase、Dnase、盐酸、氢氧化钠等或反复冻融处理, 仍能检测到表达稳定的miRNA, 说明血miRNA可作为一种新标志物用于肝癌诊断.
miR-183家族成员在多种肿瘤中有差异表达, 如miR-96和miR-182在结直肠癌、前列腺癌中高表达, miR-183在骨肉瘤、卵巢癌中低表达等. miR-183家族可作为癌基因(miR-96和miR-182)和抑癌基因(miR-183)在肝癌发生发展过程中发挥作用.
miR-183家族在非小细胞肺癌中是一种潜在的肿瘤标志物, 其表达与肺癌的诊断、预后判断密切相关, 但检测血清miR-183家族在肝癌诊断中的应用尚未见报道.
肝癌患者血miR-96和miR-182表达量明显高于肝硬化、慢性肝炎和正常人, 伴肝外转移患者血miR-183表达明显低于无肝外转移者. 血miR-183家族的表达在肝癌诊断和预后判断中有较好的应用价值.
本文具有较好的创新性和良好的应用性, 具有一定的指导意义.
编辑: 田滢 电编: 闫晋利
| 1. | Yao M, Yao DF, Bian YZ, Zhang CG, Qiu LW, Wu W, Sai WL, Yang JL, Zhang HJ. Oncofetal antigen glypican-3 as a promising early diagnostic marker for hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2011;10:289-294. [PubMed] [DOI] |
| 3. | Baer C, Claus R, Plass C. Genome-wide epigenetic regulation of miRNAs in cancer. Cancer Res. 2013;73:473-477. [PubMed] [DOI] |
| 4. | Nana-Sinkam SP, Croce CM. Clinical applications for microRNAs in cancer. Clin Pharmacol Ther. 2013;93:98-104. [PubMed] [DOI] |
| 5. | 马 兆龙, 杨 炼, 陈 立波, 黄 金明, 王 冬冬, 王 国斌. miRNA在HBV从感染经由肝硬化到肝癌进程中表达谱的变化. 世界华人消化杂志. 2009;17:2112-2116. [DOI] |
| 6. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 7. | Zhang HJ, Yao DF, Yao M, Huang H, Wu W, Yan MJ, Yan XD, Chen J. Expression characteristics and diagnostic value of annexin A2 in hepatocellular carcinoma. World J Gastroenterol. 2012;18:5897-5904. [PubMed] [DOI] |
| 8. | Jirun P, Zhang G, Kim HK, Ha SA, Zhongtian J, Shishi Q, Zhuqingqing C, Lei G, Yoo J, Kim S. Clinical utility of alpha fetoprotein and HCCR-1, alone or in combination, in patients with chronic hepatitis, liver cirrhosis and hepatocellular carcinoma. Dis Markers. 2011;30:307-315. [PubMed] |
| 9. | Giordano S, Columbano A. MicroRNAs: new tools for diagnosis, prognosis, and therapy in hepatocellular carcinoma? Hepatology. 2013;57:840-847. [PubMed] [DOI] |
| 10. | Wang W, Zhao LJ, Tan YX, Ren H, Qi ZT. MiR-138 induces cell cycle arrest by targeting cyclin D3 in hepatocellular carcinoma. Carcinogenesis. 2012;33:1113-1120. [PubMed] [DOI] |
| 11. | Zhu HT, Dong QZ, Sheng YY, Wei JW, Wang G, Zhou HJ, Ren N, Jia HL, Ye QH, Qin LX. MicroRNA-29a-5p is a novel predictor for early recurrence of hepatitis B virus-related hepatocellular carcinoma after surgical resection. PLoS One. 2012;7:e52393. [PubMed] [DOI] |
| 12. | Lumayag S, Haldin CE, Corbett NJ, Wahlin KJ, Cowan C, Turturro S, Larsen PE, Kovacs B, Witmer PD, Valle D. Inactivation of the microRNA-183/96/182 cluster results in syndromic retinal degeneration. Proc Natl Acad Sci USA. 2013;110:E507-E516. [PubMed] [DOI] |
| 13. | Xu XM, Qian JC, Deng ZL, Cai Z, Tang T, Wang P, Zhang KH, Cai JP. Expression of miR-21, miR-31, miR-96 and miR-135b is correlated with the clinical parameters of colorectal cancer. Oncol Lett. 2012;4:339-345. [PubMed] |
| 14. | Cekaite L, Rantala JK, Bruun J, Guriby M, Agesen TH, Danielsen SA, Lind GE, Nesbakken A, Kallioniemi O, Lothe RA. MiR-9, -31, and -182 deregulation promote proliferation and tumor cell survival in colon cancer. Neoplasia. 2012;14:868-879. [PubMed] |
| 15. | Mihelich BL, Khramtsova EA, Arva N, Vaishnav A, Johnson DN, Giangreco AA, Martens-Uzunova E, Bagasra O, Kajdacsy-Balla A, Nonn L. miR-183-96-182 cluster is overexpressed in prostate tissue and regulates zinc homeostasis in prostate cells. J Biol Chem. 2011;286:44503-44511. [PubMed] [DOI] |
| 16. | Zhu J, Feng Y, Ke Z, Yang Z, Zhou J, Huang X, Wang L. Down-regulation of miR-183 promotes migration and invasion of osteosarcoma by targeting Ezrin. Am J Pathol. 2012;180:2440-2451. [PubMed] [DOI] |
| 17. | Li J, Liang S, Jin H, Xu C, Ma D, Lu X. Tiam1, negatively regulated by miR-22, miR-183 and miR-31, is involved in migration, invasion and viability of ovarian cancer cells. Oncol Rep. 2012;27:1835-1842. [PubMed] |
| 18. | Healy NA, Heneghan HM, Miller N, Osborne CK, Schiff R, Kerin MJ. Systemic mirnas as potential biomarkers for malignancy. Int J Cancer. 2012;131:2215-2222. [PubMed] [DOI] |
| 19. | Brase JC, Wuttig D, Kuner R, Sültmann H. Serum microRNAs as non-invasive biomarkers for cancer. Mol Cancer. 2010;9:306. [PubMed] [DOI] |
| 20. | Diehl P, Fricke A, Sander L, Stamm J, Bassler N, Htun N, Ziemann M, Helbing T, El-Osta A, Jowett JB. Microparticles: major transport vehicles for distinct microRNAs in circulation. Cardiovasc Res. 2012;93:633-644. [PubMed] [DOI] |
| 21. | Mitchell PS, Parkin RK, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, Peterson A, Noteboom J, O'Briant KC, Allen A. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci USA. 2008;105:10513-10518. [PubMed] [DOI] |
| 22. | Zhu W, Liu X, He J, Chen D, Hunag Y, Zhang YK. Overexpression of members of the microRNA-183 family is a risk factor for lung cancer: a case control study. BMC Cancer. 2011;11:393. [PubMed] [DOI] |