修回日期: 2013-04-10
接受日期: 2013-04-27
在线出版日期: 2013-06-08
目的: 探讨Nesfatin-1对大鼠胃酸分泌的影响.
方法: ♂SD大鼠36只, 随机分为6组, 分别在侧脑室注射Nesfatin-1(0.05 μg/只)、Nesfatin-1(0.5 μg/只)及等量的注射灭菌水(5 μL/只), 外周静脉注射Nesfatin-1(10 μg/kg)、Nesfatin-1(50 μg/kg)及等量的灭菌水(150 μL/只), 每组6只. 采用幽门结扎法收集胃液, 3 h后处死大鼠分别测定胃液胃酸分泌量, H+-K+-ATPase表达量.
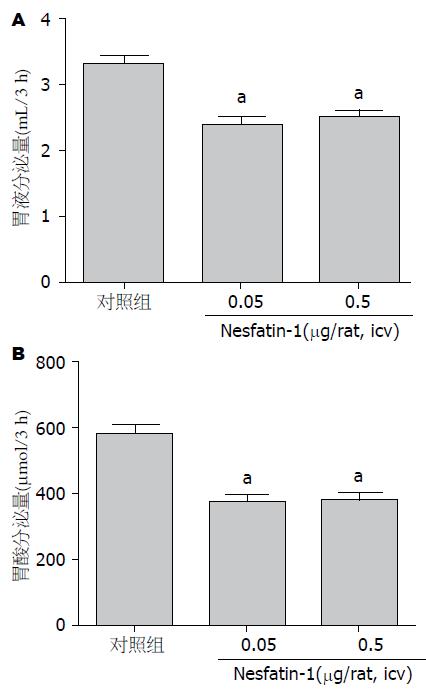
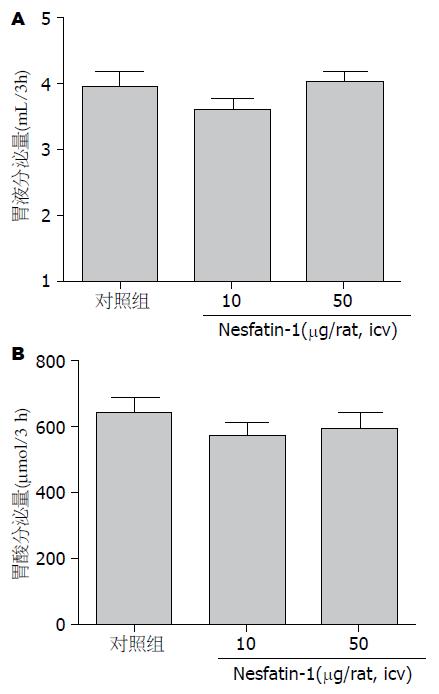
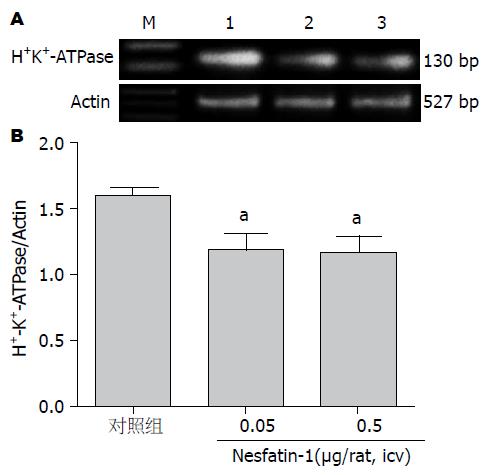
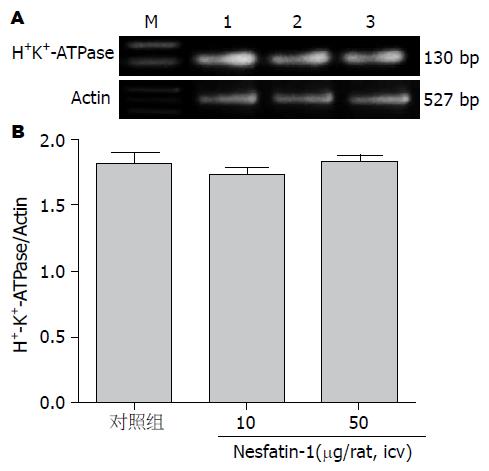
结果: 侧脑室注射Nesfatin-1(0.05 μg/只及0.5 μg/只)后大鼠3 h胃液的分泌量分别为2.4 mL/3 h±0.3 mL/3 h、2.5 mL/3 h±0.3 mL/3 h, 与对照组(3.3 mL/3 h±0.3 mL/3 h)相比, 其分泌量明显减少, 差异具有统计学意义(P<0.05, n = 6). 侧脑室注射Nesfatin-1(0.05 μg/只及0.5 μg/只)后大鼠3 h胃酸的分泌量分别为373.6 μmol/3 h±61.5 μmol/3 h、380.0 μmol/3 h±55.8 μmol/3 h, 与对照组(582.7 μmol/3 h±59.3 μmol/3 h)相比, 其分泌量明显减少, 差异具有统计学意义(P<0.05, n = 6). 外周静脉注射Nesfatin-1(10 μg/kg及50 μg/kg)后大鼠胃液分泌量分别为3.3 mL/3 h±0.4 mL/3 h、3.8 mL/3 h±0.5 mL/3 h与对照组(3.7 mL/3 h±0.7 mL/3 h)相比差异无统计学意义(P>0.05, n = 6). 外周静脉注射Nesfatin-1(2 μg/只及10 μg/只)后大鼠胃酸分泌量分别为573.8 μmol/3 h±97.4 μmol/3 h、594.4 μmol/3 h±121.0 μmol/3 h与对照组(647.6 μmol/3 h±102.8 μmol/3 h)相比差异无统计学意义(P>0.05, n = 6). 侧脑室注射Nesfatin-1(0.05 μg/只及0.5 μg/只)后3 h大鼠胃H+-K+-ATPase mRNA表达明显下调(P<0.05). 外周静脉注射Nesfatin-1(10 μg/kg及50 μg/kg)后3 h大鼠胃H+-K+-ATPase mRNA表达与对照组相比差异无统计学意义(P>0.05).
结论: Nesfatin-1通过中枢注射可以明显抑制大鼠胃酸的分泌.
核心提示: 侧脑室注射Nesfatin-1可明显抑制大鼠胃液胃酸分泌, 而外周静脉注射Nesfatin-1对大鼠胃液胃酸分泌无明显影响, 提示Nesfatin-1通过中枢注射可以明显抑制大鼠胃酸的分泌.
引文著录: 沙杰, 李学良, 朱明辉, 杨爱萍, 陈蕾. Nesfatin-1对大鼠胃酸分泌的影响. 世界华人消化杂志 2013; 21(16): 1473-1479
Revised: April 10, 2013
Accepted: April 27, 2013
Published online: June 8, 2013
AIM: To investigate the effect of Nesfatin-1 on gastric acid secretion in rats.
METHODS: Thirty-six male Sprague-Dawley rats were randomly and equally divided into six groups to receive intracerebroventricular injection of 0.05, 0.5 μg of Nesfatin-1 or sterile water and intravenous injection of 10, 50 μg/kg of Nesfatin-1 or sterile water. Gastric secretion was measured using the pylorus-ligation method. Three hours after treatment, rats were killed to remove the stomach and collect the gastric contents. The volume of gastric secretion was measured and the amount of gastric acid was determined by titration with NaOH. H+-K+-ATPase mRNA expression was detected by RT-PCR.
RESULTS: Intracerebroventricular infusion of 0.05 or 0.5 μg of Nesfatin-1 significantly reduced the volume of gastric juice (3.3 mL/3 h ± 0.3 mL/3 h vs 2.4 mL/3 h ± 0.3 mL/3 h; 3.3 mL/3 h ± 0.3 mL/3 h vs 2.5 mL/3 h ± 0.3 mL/3 h, both P < 0.05), inhibited gastric acid output (582.7 μmol/3 h ± 59.3 μmol/3 h vs 373.6 μmol/3 h ± 61.5 μmol/3h, 582.7 μmol/3 h ± 59.3 μmol/3h vs 380.0 μmol/3 h ± 55.8 μmol/3h, both P < 0.05), and decreased gastric H+-K+-ATPase mRNA expression (both P < 0.05). Intravenous injection of 10 or 50 μg/kg of Nesfatin-1 had no significant effect on the volume of gastric juice (3.7 mL/3 h ± 0.7 mL/3 h vs 3.3 mL/3 h ± 0.4 mL/3 h, 3.7 mL/3 h ± 0.7 mL/3 h vs 3.8 mL/3 h ± 0.5 mL/3 h, both P > 0.05), gastric acid output (647.6 μmol/3 h ± 102.8 μmol/3 h vs 573.8 μmol/3 h ± 97.4 μmol/3 h, 647.6 μmol/3 h ± 102.8 μmol/3 h vs 594.4 μmol/3 h ± 121.0 μmol/3 h, both P > 0.05) and gastric H+-K+-ATPase mRNA expression (both P >0.05 ).
CONCLUSION: Nesfatin-1 acts in the central nervous system to inhibit gastric acid secretion in rats.
- Citation: Sha J, Li XL, Zhu MH, Yang AP, Chen L. Effect of Nesfatin-1 on gastric acid secretion in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(16): 1473-1479
- URL: https://www.wjgnet.com/1009-3079/full/v21/i16/1473.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i16.1473
Nesfatin-1是一种新发现的厌食肽, 他来源于核组蛋白2(nueleobindin-2, NUCB2)N端的1-82氨基酸残基[1]. 在中枢Nesfatin-1主要分布于与摄食和代谢调节密切相关的一些核团, 如下丘脑的弓状核(arcuate nucleus, ARC)、视上核(supraoptic nucleus, SON)、室旁核(paraventricular nucles, PVN)、下丘脑外侧区(lateral hypothalamic area, LHA)以及脑干的迷走神经背核(dorsal motor nucleus of the vagus, DMV)孤束核(nucleus tractus solitarius, NTS)等, 这些核团通常被认为与摄食和代谢调节密切相关[1-4]. Nesfatin-1免疫阳性细胞在外周主要分布在胃黏膜内分泌型细胞, 胰岛及十二指肠布氏腺. Nesfatin-1在胃黏膜中大量与胃泌素共表达, 也有少部分与生长抑素及组胺共表达[5]. 这些结果提示Nesfatin-1可能参与了胃黏膜酸分泌功能的调节, 本研究通过侧脑室及外周静脉注射Nesfatin-1, 以探索其对大鼠胃黏膜泌酸功能的影响.
♂SD大鼠, 体质量200-250 g, 在明暗各12 h(06:00-18:00)周期, 21℃-23 ℃的室温环境中饲养, 侧脑室置管后予以单笼饲养, 实验前大鼠禁食24 h, 禁水2 h. 大鼠购自上海斯莱克实验动物有限公司; 饲料购自南京医科大学实验动物中心; 大鼠脑立体定位仪、大鼠颅钻、套管、套管芯、注射针均为深圳瑞沃德生命科技有限公司产品; 微量注射器为上海关正医疗仪器有限公司产品; Nesfatin-1购自Phoneix Pharmaceuticals公司.
1.2.1 侧脑室置管: 在水合氯醛麻醉下(400 mg/kg, 腹腔内注射), 将大鼠固定在脑立体定位仪上, 右侧侧脑室置管(前囟点后0.8 mm, 右1.5 mm, 深3.5 mm)[6], 2枚不锈钢螺丝固定在套管两侧的颅骨上, 牙科水泥固定. 术后大鼠自由恢复7 d, 体质量不升者予以剔除, 实验结束后沿套管注入20 g/L的美蓝溶液, 取出脑组织, 脑室内壁均染色的大鼠数据为有效数据, 不合格的予以剔除.
1.2.2 分组及给药: 将大鼠随机分为6组, 分别侧脑室注射Nesfatin-1(0.05 μg/只)、Nesfatin-1(0.5 μg/只)及等量的灭菌水(5 μL/只), 阴茎背静脉注射Nesfatin-1(10 μg/kg)、Nesfatin-1(50 μg/kg)及等量的灭菌水(150 μL/只), 每组6只.
1.2.3 胃液收集: 采用幽门结扎法收集胃液[7]. 大鼠乙醚短暂麻醉, 沿腹中线剑突下切开一小口, 暴露幽门, 沿幽门括约肌丝线结扎, 关腹, 给予侧脑室及外周静脉注射, 大鼠注射后约5 min清醒, 自由活动. 3 h后过量乙醚麻醉处死大鼠, 迅速取胃, 沿胃大弯剪开胃壁, 收集胃液, 胃组织-80 ℃冰箱速冻, 留作H+-K+-ATPase mRNA表达检测.
1.2.4 胃酸分泌量检测: 测量胃液分泌量后, 取1 mL胃液, 以1%酚红为指示剂, 用0.01 mol/L NaOH滴定至pH值为7.0(胃液刚变为粉红色, 且持续30 s不退色), 胃液量乘以胃液酸的浓度即为胃酸分泌量.
1.2.5 RT-PCR法检测胃组织中H+-K+-ATPase mRNA: 按TRIzol试剂说明提取各组织中总mRNA, 然后逆转录为cDNA, 以此cDNA为模板行PCR扩增. PCR反应条件: 预变性95 ℃ 5 min; 变性95 ℃ 45 s, 退火56 ℃ 30 s, 延伸72 ℃ 30 s共32个循环; 终末延伸72 ℃ 10 min. PCR产物经3%琼脂糖凝胶电泳, 观察、拍照. H+-K+-ATPase上下游引物: 上游引物5'-CTCTGCTTTGCGGGACTT-3'; 下游引物5'-CCTTGGCTGTGATGGGAT-3', 以Actin为内参照.
统计学处理 所有的测定值均以mean±SD表示, 采用SPSS11.5统计学软件行t检验和方差分析, P<0.05为差异有统计学意义.
侧脑室注射Nesfatin-1(0.05 μg/只及0.5 μg/只)后大鼠胃液分泌量分别为2.4 mL/3 h±0.3 mL/3 h、2.5 mL/3 h 0.3 mL/3 h, 对照组大鼠胃液分泌量为3.3 mL/3 h±0.3 mL/3 h. 侧脑室注射Nesfatin-1(0.05 μg/只、0.5 μg/只)均明显抑制了大鼠3 h胃液分泌量, 与对照组相比差异有统计学意义(P<0.05, n = 6), 但两给药组之间, 即侧脑室注射Nesfatin-1(0.5 μg/只)与侧脑室注射Nesfatin-1(0.05 μg/只)后3 h大鼠的胃液分泌量相比差异无统计学意义(P>0.05, n = 6)(图1A).
侧脑室注射Nesfatin-1(0.05 μg/只及0.5 μg/只)后大鼠胃酸分泌量分别为373.6 μmol/3 h±61.5 μmol/3 h、380.0 μmol/3 h±55.8 μmol/3 h, 对照组大鼠胃酸分泌量为582.7 μmol/3 h±59.3 μmol/3 h. 侧脑室注射Nesfatin-1(0.05 μg/只及0.5 μg/只)均明显抑制了大鼠3 h胃酸的分泌量, 与对照组相比差异有统计学意义(P<0.05, n = 6), 但两给药组之间, 即侧脑室注射Nesfatin-1(0.5 μg/只)与侧脑室注射Nesfatin-1(0.05 μg/只)后3 h大鼠的胃酸分泌量相比差异无统计学意义(P>0.05, n = 6)(图1B).
外周静脉注射Nesfatin-1(10 μg/kg及50 μg/kg)大鼠胃液分泌量分别为3.3 mL/3 h±0.4 mL/3 h、3.8 mL/3 h±0.5 mL/3 h, 对照组大鼠胃液分泌量为3.7 mL/3 h±0.7 mL/3 h. 外周静脉注射Nesfatin-1(10 μg/kg及50 μg/kg)与对照组相比, 大鼠3 h胃液分泌量差异无统计学意义(P>0.05, n = 6)(图2A).
外周静脉注射Nesfatin-1(10 μg/kg及50 μg/kg)大鼠胃酸分泌量分别为573.8 μmol/3 h±97.4 μmol/3 h、594.4 μmol/3 h±121.0 μmol/3 h, 对照组大鼠胃酸分泌量为647.6 μmol/3 h±102.8 μmol/3 h. 外周静脉注射Nesfatin-1(10 μg/kg及50 μg/kg)与对照组相比, 大鼠3 h胃酸分泌量差异无统计学意义(P>0.05, n = 6)(图2B).
侧脑室注射Nesfatin-1(0.05 μg/只及0.5 μg/只)后3 h大鼠胃H+-K+-ATPase mRNA表达明显下调(P<0.05)(图3).
外周静脉注射Nesfatin-1(10 μg/kg及50 μg/kg)后3 h大鼠胃H+-K+-ATPase mRNA表达与对照组相比差异无统计学意义(P>0.05)(图4).
Nesfatin-1是一种新发现的厌食肽, 他来源于NUCB2[1]. NUCB2是一个功能强大的分泌蛋白, 他在维持骨盐代谢和TNF抗体的生成过程中都具有重要的作用[8,9]. 侧脑室注入NUCB2后可以抑制大鼠摄食, 而侧脑室注射NUCB2反义寡核苷酸阻断内源性NUCB2后, 大鼠的摄食量增加[1,10-12]. 这些研究表明, NUCB2参与了大鼠摄食行为的生理调节. NUCB2在前激素酶的作用可以下裂解成3个片段: Nesfatin-1(1-82残基)、Nesfatin-2(85-163残基)和Nesfatin-3(166-396残基), 经侧脑室分别注射Nesfatin-1、Nesfatin-2和Nesfatin-3发现, 注射Nesfatin-1后可剂量依赖性的抑制自由饮食大鼠的摄食量和体质量增长, 而注射Nesfatin-2、Nesfatin2/3或Nesfatin-3的大鼠均未见到摄食抑制, 经侧脑室注射Nesfatin-1特异性的中和抗体后大鼠摄食量明显增加, 提示NUCB2裂解后的3种片段中仅Nesfatin-1具有抑制摄食的功能[1].
在中枢, Nesfatin-1免疫阳性细胞存在于ARC、SON、PVN、LHA以及脑干的DMV、NTS)、EW和尾脊核中, 这些核团通常被认为与摄食和代谢调节密切相关[1-4]. Nesfatin-1侧脑室注射抑制了自由饮食大鼠的夜间摄食量, 而肾上腺皮质激素释放因子(CRF1/CRF2)抑制剂、CRF2抑制剂则使Nesfatin-1对大鼠的抑制摄食作用消失, 提示侧脑室注射Nesfatin-1是通过CRF2依赖途径而影响了自由饮食大鼠的夜间摄食量[13].
Nesfatin-1在大脑中与大量神经递质共表达, 如下丘脑加压素、催产素、促甲状腺激素释放激素、促肾上腺皮质激素释放激素、生长抑素、生长激素释放激素、黑色素激素、可卡因-苯丙胺调节转录肽; EW和DMV中的胆碱乙酰转移酶、NTS中的酪氨酸羟化酶、尾脊核中的5-羟色胺; 以及延髓儿茶酚胺A2细胞群等[2,4,14]. 提示Nesfatin-1还可能参与了神经内分泌的调节以及对内脏疼痛、压力的自主调节.
Nesfatin-1免疫阳性细胞在外周主要分布在胃黏膜内分泌型细胞、胰岛及十二指肠布氏腺, 在胃黏膜中Nesfatin-1免疫阳性细胞主要集中在下1/3至1/2的黏膜腺中, 胃黏膜的这一部位含有大量的内分泌细胞, 诸如分泌胃泌素的G细胞、分泌生长抑素的D细胞、分泌胃泌素的X/A样细胞还有一些小的内分泌细胞如P细胞和D1细胞[15-17]. Nesfatin-1在胃黏膜中大量与胃泌素共表达, 也有少部分与生长抑素及组胺共表达[5].
本研究我们采用了侧脑室及外周静脉给药的方法从两个不同的方面来观察Nesfatin-1对大鼠胃酸分泌功能的影响. 这2种给药方法由于进行的是在体实验, 因而得出的结果较体外实验如细胞培养等更接近正常生理状态下的反应. 侧脑室注射将药物直接注入脑内, 目前多用于观察脑内核团或脑区对某些药物刺激的反应, 药物可直接作用于对其敏感的神经元, 因而比其他途径给药更直接. 我们在脑立体定位仪下将带有套管芯的套管埋置于侧脑室, 用玻璃离子水门汀及螺丝将套管的外露部分固定于颅骨表面, 术后恢复7 d, 一般认为这时手术应激已消失, 血脑屏障已修复, 此法基本避免了应激及血脑屏障的干扰. 目前为公认的脑内直接给药方法, 本研究我们侧脑室给药量(5 μL/只), 亦为大鼠侧脑室给药的常用量[18-21].
胃酸的分泌机能受机体神经和激素共同调节. 在中枢神经系统中与胃酸分泌调节有关的主要神经中枢有迷走神经运动背核、下丘脑和孤束核. 引起胃酸分泌的神经冲动约半数来源于迷走神经运动背核, 这些神经冲动通过迷走神经首先传到胃壁的肠神经系统, 然后抵达胃腺. 迷走神经运动背核能对下丘脑的中枢感觉传入和孤束核的内脏感觉传入进行整合, 从而调节胃酸分泌. 中枢神经系统内促进胃酸分泌的神经递质主要有: 乙酰胆碱、胃泌素、促甲状腺素释放激素、生长抑素和胆囊收缩素等, 而5-羟色胺、去甲肾上腺素、蛙皮素、阿片肽类物质、降钙素等则抑制胃酸的分泌.
胃酸分泌的外周调节主要是食物入胃机械扩张胃体、胃窦以及食糜进入肠内激活肠神经内分泌系统而影响胃酸的分泌. 在外周, 目前已知的促进胃酸分泌的物质主要有: 乙酰胆碱、组胺和胃泌素, 抑制胃酸分泌的物质主要有: 生长抑素、胰泌素、5-HT和前列腺素, 而一些参与摄食调节的神经肽在中枢同样也参与了胃酸分泌的调节. 如中枢注射Ghrelin增加了大鼠摄食量及体质量, 同时也促进了大鼠胃酸的分泌[22-24]. 而可卡因-苯丙胺调节转录肽中枢注射则抑制了大鼠摄食量及大鼠胃酸的分泌[25].
Stengel等[13]报道Nesfatin-1(0.05 μg/只、0.5 μg/只)侧脑室注射抑制了大鼠的胃排空, 我们参照这2种剂量初步探讨了其对大鼠胃酸分泌的影响. 幽门结扎法为一用于研究胃酸分泌的常用方法[7,24-26]. 我们通过结扎大鼠幽门, 侧脑室及外周静脉注射Nesfatin-1, 来观察大鼠3 h的胃酸分泌量. 结果发现, 侧脑室注射Nesfatin-1(0.05 μg/只、0.5 μg/只)明显抑制了大鼠胃酸的分泌, 而外周静脉注射Nesfatin-1即使达到10 μg/只对大鼠胃酸分泌亦无明显影响, 提示Nesfatin-1抑制大鼠胃酸的分泌可能主要是通过中枢神经系统来调节的. 在中枢侧脑室注射Nesfatin-1 0.5 μg/只与Nesfatin-1 0.05 μg/只对大鼠胃酸分泌的抑制并无差别, 可能是由于已达药效平台期.
胃壁细胞H+-K+-ATPase是胃酸分泌最后环节的关键酶, H+-K+-ATPase通过自身的磷酸化和去磷酸化, 将细胞外液中的K+转运入细胞内, 同时逆浓度梯度将细胞内的H+泵出细胞外, 完成H+/K+跨膜离子转运和胃酸分泌功能[27]. 研究发现H+-K+-ATPase的表达变化趋势与胃酸分泌能力相一致[28]. 因此通过测定H+-K+-ATPase的表达可反映胃酸分泌能力. 本研究我们发现, 侧脑室注射Nesfatin-1(0.05 µg/只、0.5 µg/只)后大鼠胃H+-K+-ATPase mRNA表达明显下调, 表明侧脑室注射Nesfatin-1抑制了大鼠胃酸的分泌.
总之, Nesfatin-1侧脑室注射抑制了大鼠胃酸的分泌, 而外周给药在目前的药物浓度下未显示对大鼠胃酸的抑制. 在中枢, 其作用的具体通路和机制仍需进一步研究. 在外周, 其对大鼠胃酸分泌的影响是否存在, 仍需以更广的药物浓度梯度来进行验证.
本研究系在已知的Nesfatin-1摄食抑制功能的基础上进一步探索其对胃黏膜分泌功能的影响, 从而更进一步了解这个新发现的摄食调节肽的更多生理功能.
姜相君, 主任医师, 青岛市市立医院消化科; 唐世刚, 教授, 湖南省人民医院
通过本研究可以进一步增加对胃黏膜胃酸分泌调节机理的认识, 从而为消化科临床酸相关疾病的诊治提供更多的理论基础.
Nesfatin-1在大脑中与大量神经递质共表达. Nesfatin-1免疫阳性细胞在外周主要分布在胃黏膜内分泌型细胞, 胰岛及十二指肠布氏腺. Nesfatin-1在胃黏膜中大量与胃泌素共表达, 也有少部分与生长抑素及组胺共表达.
本研究采用了侧脑室及外周静脉给药的方法, 从两个不同的方面来观察Nesfatin-1对大鼠胃酸分泌功能的影响.
通过本研究可以了解该物质更多的生理功能, 从而为将来有可能开发该物质的临床应用提供更多的理论依据.
本文设计合理, 实验方法可靠, 结果可信, 有一定的理论和实用价值.
编辑: 田滢 电编: 闫晋利
| 1. | Oh-I S, Shimizu H, Satoh T, Okada S, Adachi S, Inoue K, Eguchi H, Yamamoto M, Imaki T, Hashimoto K. Identification of nesfatin-1 as a satiety molecule in the hypothalamus. Nature. 2006;443:709-712. [PubMed] [DOI] |
| 2. | Brailoiu GC, Dun SL, Brailoiu E, Inan S, Yang J, Chang JK, Dun NJ. Nesfatin-1: distribution and interaction with a G protein-coupled receptor in the rat brain. Endocrinology. 2007;148:5088-5094. [PubMed] [DOI] |
| 3. | Kohno D, Nakata M, Maejima Y, Shimizu H, Sedbazar U, Yoshida N, Dezaki K, Onaka T, Mori M, Yada T. Nesfatin-1 neurons in paraventricular and supraoptic nuclei of the rat hypothalamus coexpress oxytocin and vasopressin and are activated by refeeding. Endocrinology. 2008;149:1295-1301. [PubMed] [DOI] |
| 4. | Foo KS, Brismar H, Broberger C. Distribution and neuropeptide coexistence of nucleobindin-2 mRNA/nesfatin-like immunoreactivity in the rat CNS. Neuroscience. 2008;156:563-579. [PubMed] [DOI] |
| 5. | Stengel A, Goebel M, Yakubov I, Wang L, Witcher D, Coskun T, Taché Y, Sachs G, Lambrecht NW. Identification and characterization of nesfatin-1 immunoreactivity in endocrine cell types of the rat gastric oxyntic mucosa. Endocrinology. 2009;150:232-238. [PubMed] [DOI] |
| 6. | Martínez V, Taché Y. Role of CRF receptor 1 in central CRF-induced stimulation of colonic propulsion in rats. Brain Res. 2001;893:29-35. [PubMed] [DOI] |
| 7. | Bilgin HM, Tumer C, Diken H, Kelle M, Sermet A. Role of ghrelin in the regulation of gastric acid secretion involving nitrergic mechanisms in rats. Physiol Res. 2008;57:563-568. [PubMed] |
| 8. | Wendel M, Sommarin Y, Bergman T, Heinegård D. Isolation, characterization, and primary structure of a calcium-binding 63-kDa bone protein. J Biol Chem. 1995;270:6125-6133. [PubMed] [DOI] |
| 9. | Islam A, Adamik B, Hawari FI, Ma G, Rouhani FN, Zhang J, Levine SJ. Extracellular TNFR1 release requires the calcium-dependent formation of a nucleobindin 2-ARTS-1 complex. J Biol Chem. 2006;281:6860-6873. [PubMed] [DOI] |
| 10. | Cowley MA, Grove KL. To be or NUCB2, is nesfatin the answer? Cell Metab. 2006;4:421-422. [PubMed] [DOI] |
| 12. | Colmers WF. Less fat with nesfatin. Trends Endocrinol Metab. 2007;18:131-132. [PubMed] [DOI] |
| 13. | Stengel A, Goebel M, Wang L, Rivier J, Kobelt P, Mönnikes H, Lambrecht NW, Taché Y. Central nesfatin-1 reduces dark-phase food intake and gastric emptying in rats: differential role of corticotropin-releasing factor2 receptor. Endocrinology. 2009;150:4911-4919. [PubMed] [DOI] |
| 14. | Fort P, Salvert D, Hanriot L, Jego S, Shimizu H, Hashimoto K, Mori M, Luppi PH. The satiety molecule nesfatin-1 is co-expressed with melanin concentrating hormone in tuberal hypothalamic neurons of the rat. Neuroscience. 2008;155:174-181. [PubMed] [DOI] |
| 15. | Zhang AQ, Li XL, Jiang CY, Lin L, Shi RH, Chen JD, Oomura Y. Expression of nesfatin-1/NUCB2 in rodent digestive system. World J Gastroenterol. 2010;16:1735-1741. [PubMed] [DOI] |
| 16. | Forssmann WG, Orci L, Pictet R, Renold AE, Rouiller C. The endocrine cells in the epithelium of the gastrointestinal mucosa of the rat. An electron microscope study. J Cell Biol. 1969;40:692-715. [PubMed] [DOI] |
| 17. | Capella C, Solcia E, Vassallo G. Identification of six types of endocrine cells in the gastrointestinal mucosa of the rabbit. Arch Histol Jpn. 1969;30:479-495. [PubMed] [DOI] |
| 18. | Tamura H, Kamegai J, Shimizu T, Ishii S, Sugihara H, Oikawa S. Ghrelin stimulates GH but not food intake in arcuate nucleus ablated rats. Endocrinology. 2002;143:3268-3275. [PubMed] [DOI] |
| 19. | Tamaddonfard E, Hamzeh-Gooshchi N. Effects of intraperitoneal and intracerebroventricular injection of crocin on acute corneal pain in rats. Phytother Res. 2010;24:1463-1467. [PubMed] [DOI] |
| 20. | Hassanzadeh K, Habibi-asl B, Roshangar L, Nemati M, Ansarin M, Farajnia S. Intracerebroventricular administration of riluzole prevents morphine-induced apoptosis in the lumbar region of the rat spinal cord. Pharmacol Rep. 2010;62:664-673. [PubMed] |
| 21. | Yosefi M, Reisi P, Alaei H, Pilehvarian AA, Rashidi B. Treadmill running improves spatial learning and memory in the rats with intracerebroventricular injection of streptozotocin. J Res Med Sci. 2011;16:1386-1387. [PubMed] |
| 22. | Wren AM, Small CJ, Ward HL, Murphy KG, Dakin CL, Taheri S, Kennedy AR, Roberts GH, Morgan DG, Ghatei MA. The novel hypothalamic peptide ghrelin stimulates food intake and growth hormone secretion. Endocrinology. 2000;141:4325-4328. [PubMed] [DOI] |
| 23. | Tschöp M, Smiley DL, Heiman ML. Ghrelin induces adiposity in rodents. Nature. 2000;407:908-913. [PubMed] [DOI] |
| 24. | Date Y, Nakazato M, Murakami N, Kojima M, Kangawa K, Matsukura S. Ghrelin acts in the central nervous system to stimulate gastric acid secretion. Biochem Biophys Res Commun. 2001;280:904-907. [PubMed] [DOI] |
| 25. | Okumura T, Yamada H, Motomura W, Kohgo Y. Cocaine-amphetamine-regulated transcript (CART) acts in the central nervous system to inhibit gastric acid secretion via brain corticotropin-releasing factor system. Endocrinology. 2000;141:2854-2860. [PubMed] [DOI] |
| 26. | Taché Y, Goto Y, Gunion MW, Vale W, River J, Brown M. Inhibition of gastric acid secretion in rats by intracerebral injection of corticotropin-releasing factor. Science. 1983;222:935-937. [PubMed] [DOI] |
| 27. | Yao X, Forte JG. Cell biology of acid secretion by the parietal cell. Annu Rev Physiol. 2003;65:103-131. [PubMed] [DOI] |
| 28. | Hervatin F, Benkouka F, Robert JC, Péranzi G, Soumarmon A. The ontogeny of rat gastric H+/K+-ATPase. Biochim Biophys Acta. 1989;985:320-324. [PubMed] [DOI] |