修回日期: 2013-04-13
接受日期: 2013-04-27
在线出版日期: 2013-05-28
目的: 评价胸苷酸合成酶(thymidylate synthase, TS)和乳腺癌易感基因1(breast cancer susceptibility gene-1, BRCA1)过表达与胃癌患者临床病理参数间的相关性及其临床意义.
方法: 收集2011-01/2012-01在中国人民解放军南京军区福州总医院手术切除的临床资料完整的246例胃腺癌标本, 采用Elivision™ plus免疫组织化学染色方法检测胃癌组织中TS和BRCA1的表达. 使用SPSS16.0软件进行χ2检验分析.
结果: TS和BRCA1在胃癌组织中阳性率分别为39.02%(96/246)、55.69%(137/246); TS蛋白表达与患者性别、年龄、肿瘤部位、TNM分期、分化程度、浸润深度、淋巴结转移、远处转移均无相关性(P>0.05); BRCA1蛋白表达与患者性别、年龄、肿瘤部位、TNM分期、分化程度远处转移无相关性(P>0.05), 而与浸润深度(P<0.01)和TNM分期(P<0.05)相关. 胃癌组织中TS和BRCA1共同表达阳性率为26.02%(64/246), 联合分析显示TS和BRCA1表达呈负相关(P<0.01, Pearson列联系数C = 0.2472).
结论: 胃癌组织中存在TS和BRCA1过表达, BRCA1蛋白表达与TNM分期和浸润深度相关, 提示BRCA1表达和肿瘤侵袭性具有相关性, 可作为评估胃癌生物学行为以及预后的参考指标. BRCA1和TS的表达检测有助于临床化疗药物的选择.
核心提示: 胃癌组织中存在胸苷酸合成酶(thymidylate synthase)和乳腺癌易感基因1(breast cancer susceptibility gene-1)过表达, 并且两者过表达与肿瘤侵袭性具有相关性, 可作为评估胃癌生物学行为以及预后的参考指标, 并为临床选择化疗药物提供参考.
引文著录: 林雅萍, 李厚强, 苏慧君, 钟国栋, 郑圆圆, 刘伟, 齐兴峰, 余英豪. TS和BRCA1在胃癌组织中的表达及其临床意义. 世界华人消化杂志 2013; 21(15): 1421-1427
Revised: April 13, 2013
Accepted: April 27, 2013
Published online: May 28, 2013
AIM: To investigate the correlation between thymidylate synthase (TS) and breast cancer susceptibility gene-1 (BRCA1) expression and clinicopathological characteristics of gastric cancer.
METHODS: Two hundred and forty-six surgical specimens of gastric cancer collected from patients with complete clinical data who were treated at Fuzhou General Hospital of Nanjing Military Command between January 2011 and January 2012 were used in this study. The protein expression of TS and BRCA1 in these specimens was examined by immunohistochemistry. The correlation between TS and BRCA1 protein expression and clinicopathological characteristics of gastric cancer was analyzed.
RESULTS: The rates of TS and BRCA1 overexpression in gastric cancer were 39.02% (96/246) and 55.69% (137/246), respectively. There was no relationship between TS overexpression and sex, age, tumor site, histotype, differentiation, distant metastasis, depth of invasion, TNM stage and lymph node metastasis (all P > 0.05). BRCA1 protein overexpression was associated with depth of invasion (P < 0.01) and TNM stage (P < 0.05), but not with sex, age, tumor site, differentiation, lymph node metastasis or distant metastasis (all P > 0.05). The co-expression rate of TS and BRCA1 in gastric cancer was 26.02% (64/246). The overexpression of TS was negatively correlated with that of BRCA1 (P < 0.01, r = 0.2472).
CONCLUSION: There exists TS and BRCA1 overexpression in gastric cancer. The overexpression of BRCA1was associated with TNM stage and depth of invasion, which implies that BRCA1 overexpression may be related to invasion of gastric cancer. Detection of BRCA1 protein overexpression may be used to assess the malignant biological behavior and prognosis of gastric cancer and help choose chemotherapy drugs.
- Citation: Lin YP, Li HQ, Su HJ, Zhong GD, Zheng YY, Liu W, Qi XF, Yu YH. Clinical significance of TS and BRCA1 protein overexpression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(15): 1421-1427
- URL: https://www.wjgnet.com/1009-3079/full/v21/i15/1421.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i15.1421
胃癌是全球常见的恶性肿瘤之一, 发病率居第4位, 死亡率居第2位, 其中2/3发生在发展中国家,仅中国就占42%[1]. 目前胃癌的治疗仍以手术为主, 化疗为辅. 大量的临床研究是以5-氟尿嘧啶(5-fluorouracil, 5-FU)类为基础的联合化疗, 包括联合铂类、紫杉类等, 但总体来说, 化疗有效率仍不满意, 不同患者之间疗效差异较大, 其主要原因是肿瘤细胞具有内在耐药性. 胸苷酸合成酶(thymidylate synthase, TS)和乳腺癌易感基因1(breast cancer susceptibility gene-1, BRCA1)分别和胃肠道肿瘤化疗基础药物5-FU及顺铂的耐药息息相关, 其检测可为临床选取化疗药物提供重要的依据. 鉴于国内至今没有关于TS和BRCA1在胃癌中联合表达检测的大样本研究报道, 本研究采用免疫组织化学方法检测246例胃腺癌组织中TS和BRCA1蛋白的表达, 探讨其与胃癌的发生发展、浸润转移等临床病理参数的关系, 并以期为临床选取化疗药物提供一定的参考依据.
收集2011-01/2012-01在中国人民解放军南京军区福州总医院手术切除的临床资料完整的胃腺癌病例246例, 手术标本经100 g/L中性甲醛固定, 石蜡包埋, 3 μm厚连续切片, 分别进行HE和免疫组织化学染色; 所有病例数术前均未行放化疗. 患者中男191例, 女55例, 年龄22-86岁, 平均62.25岁. 胃癌TNM分期采用AJCC标准第七版(2010), 在246例胃腺癌病例中随机抽取50例癌旁(距癌灶距离>5 cm)非肿瘤性胃黏膜作为对照. 免疫组织化学试剂购自福州迈新生物科技开发公司, 一抗TS和BRCA1均为鼠抗人单克隆抗体. 石蜡切片机(LEICA RM2245); 显微镜(OLYMPUS BX51); 电热恒温干燥箱(上海-恒科技有限公司). 所有标记均设阳性对照并用PBS缓冲液代替一抗做阴性对照.
1.2.1 EliVision™ plus免疫组织化学染色: 石蜡切片脱蜡、水化, PBS冲洗3 min×3 min; EDTA中(pH = 9.0)热修复20 min; 加30 g/L过氧化氢溶液, 室温下孵育10 min, 以阻断内源性过氧化物酶; PBS冲洗3 min×3 min; 加第一抗体, 室温下孵育60 min; PBS冲洗3 min×5 min; 加聚合物增强剂(试剂A), 室温下孵育20 min; PBS冲洗3 min×3 min; 加酶标抗鼠聚合物(试剂B), 室温下孵育30 min; PBS冲洗3 min×3 min; 加新配制的DAB显色液, 显微镜下观察3-10 min, 阳性显色为棕黄色; 自来水冲洗, 苏木素复染, 0.1%盐酸分化, 自来水冲洗, PBS冲洗返蓝; 梯度乙醇脱水干燥, 中性树脂封片.
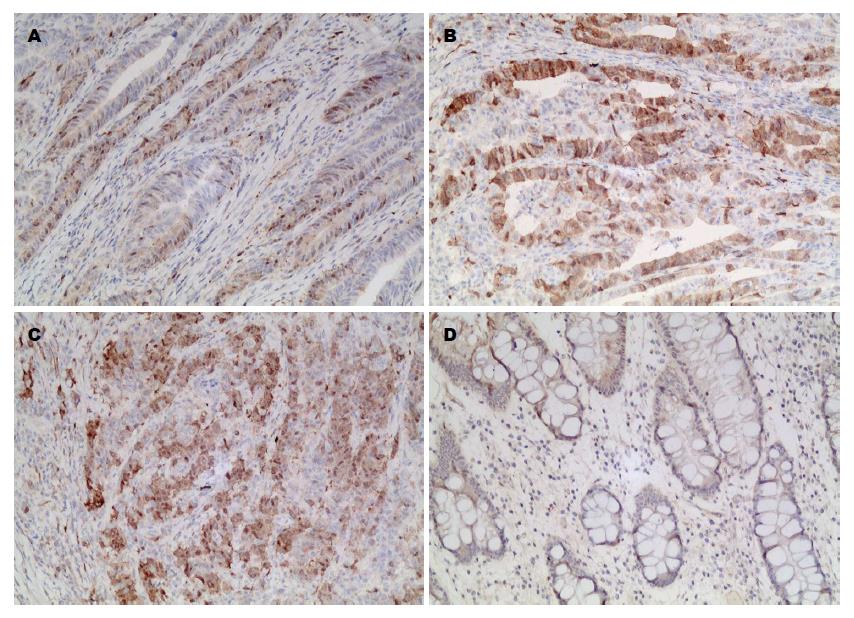
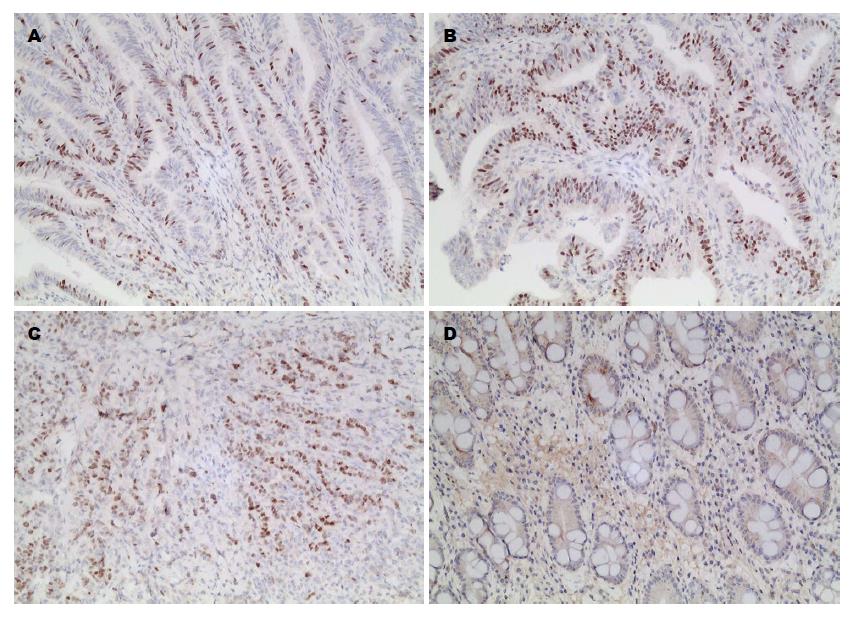
1.2.2 TS和BRCA1过表达的判定标准: TS阳性染色呈棕黄色, 位于细胞核和细胞浆; BRCA1阳性染色为棕黄色, 主要位于细胞核, 少量位于胞浆. TS和BRCA1均以肿瘤细胞不着色或<10%的肿瘤细胞着色为阴性(-), ≥10%肿瘤细胞着色为阳性, 并根据肿瘤阳性细胞数所占比例分为: 10%-30%为弱阳性(+), >30%为强阳性(++).
统计学处理 采用SPSS16.0软件进行χ2检验分析.
TS阳性染色呈棕黄色颗粒, 定位于细胞核和胞质(图1). BRCA1阳性染色呈棕黄色颗粒, 定位于细胞核, 少量位于细胞浆(图2). 其表达呈明显的异质性. 癌旁非肿瘤性胃黏膜TS和BRCA1蛋白的表达均为阴性.
246例胃癌组织中TS阳性表达96例, 表达率为39.02%. BRCA1阳性表达137例, 表达率为55.69%. TS蛋白表达与患者性别、年龄、肿瘤部位、TNM分期、分化程度、浸润深度、淋巴结转移、远处转移均无相关性(表1). BRCA1蛋白表达与患者肿瘤TNM分期和浸润深度相关(P<0.05), 而与患者性别、年龄、肿瘤部位、分化程度、淋巴结转移、远处转移无相关性(P>0.05, 表2).
| 临床病理参数 | n | - | + | ++ | 阳性率n(%) | P值 |
| 性别 | >0.25 | |||||
| 男 | 191 | 113 | 52 | 26 | 78(40.84) | |
| 女 | 55 | 37 | 16 | 2 | 18(32.73) | |
| 年龄(岁) | >0.10 | |||||
| <60 | 86 | 58 | 18 | 10 | 28(32.56) | |
| ≥60 | 160 | 92 | 50 | 18 | 68(42.50) | |
| 肿瘤部位 | >0.25 | |||||
| 胃食管连接部 | 69 | 39 | 24 | 6 | 30(43.48) | |
| 胃部 | 177 | 111 | 44 | 22 | 66(37.29) | |
| TNM分期 | >0.25 | |||||
| 0+Ⅰ+Ⅱ | 168 | 105 | 49 | 14 | 63(37.50) | |
| Ⅲ+Ⅳ | 78 | 45 | 19 | 14 | 33(42.31) | |
| 分化 | >0.50 | |||||
| 高-中分化 | 89 | 56 | 23 | 10 | 33(37.08) | |
| 低-未分化 | 157 | 94 | 45 | 18 | 63(40.13) | |
| 浸润深度 | >0.75 | |||||
| Tis | 0 | 0 | 0 | 0 | 0(0) | |
| T1 | 20 | 11 | 8 | 1 | 9(45.00) | |
| T2 | 56 | 37 | 8 | 11 | 19(33.93) | |
| T3 | 113 | 69 | 35 | 9 | 44(38.94) | |
| T4 | 57 | 33 | 17 | 7 | 24(42.11) | |
| 淋巴结转移 | >0.50 | |||||
| N0 | 61 | 34 | 19 | 8 | 27(44.26) | |
| N1 | 122 | 79 | 36 | 7 | 43(35.25) | |
| N2 | 46 | 28 | 8 | 10 | 18(39.13) | |
| N3 | 17 | 9 | 5 | 3 | 8(47.06) | |
| 远处转移 | >0.90 | |||||
| 有 | 10 | 6 | 4 | 0 | 4(40.00) | |
| 无 | 236 | 144 | 64 | 28 | 92(38.98) |
| 临床病理参数 | n | - | + | ++ | 阳性率n(%) | P值 |
| 性别 | >0.90 | |||||
| 男 | 191 | 85 | 51 | 55 | 106(55.50) | |
| 女 | 55 | 24 | 19 | 12 | 31(56.36) | |
| 年龄(岁) | >0.25 | |||||
| <60 | 86 | 41 | 23 | 22 | 45(52.33) | |
| ≥60 | 160 | 68 | 47 | 45 | 92(57.50) | |
| 肿瘤部位 | >0.25 | |||||
| 胃食管连接部 | 71 | 28 | 24 | 19 | 43(60.56) | |
| 胃部 | 175 | 81 | 46 | 48 | 94(53.71) | |
| TNM分期 | <0.05 | |||||
| 0+Ⅰ+Ⅱ | 168 | 67 | 55 | 46 | 101(60.12) | |
| Ⅲ+Ⅳ | 78 | 42 | 15 | 21 | 36(46.15) | |
| 分化 | >0.25 | |||||
| 高-中分化 | 89 | 39 | 26 | 24 | 50(56.18) | |
| 低-未分化 | 157 | 70 | 44 | 43 | 87(55.41) | |
| 浸润深度 | <0.01 | |||||
| Tis | 0 | 0 | 0 | 0 | 0(0) | |
| T1 | 19 | 4 | 12 | 3 | 15(78.95) | |
| T2 | 57 | 23 | 11 | 23 | 34(59.65) | |
| T3 | 115 | 47 | 38 | 30 | 68(59.13) | |
| T4 | 55 | 35 | 9 | 11 | 20(36.36) | |
| 淋巴结转移 | >0.05 | |||||
| N0 | 60 | 20 | 22 | 18 | 40(66.67) | |
| N1 | 120 | 59 | 33 | 28 | 61(50.83) | |
| N2 | 49 | 19 | 11 | 19 | 30(61.22) | |
| N3 | 17 | 11 | 4 | 2 | 6(35.29) | |
| 远处转移 | >0.25 | |||||
| 有 | 10 | 6 | 1 | 3 | 4(40.00) | |
| 无 | 236 | 103 | 69 | 64 | 133(56.36) |
TS蛋白是一种分子量为72 kDa的二聚体蛋白质, 为一种叶酸依赖性酶. 其编码基因位于人类染色体18p11.32上, TS基因具有多态性, 可造成TS酶活性及功能的多样性, 进而对细胞代谢产生不同的影响, 导致肿瘤发生发展表现出明显的个体差异. TS蛋白在DNA合成与修复、细胞增殖与分化中有十分重要的作用, 是肿瘤化疗药5-FU和甲氨蝶呤等的重要靶酶. 5-FU代谢物氟脲嘧啶脱氧核苷酸(FdUMP)能和TS及甲基辅基形成三聚物TS-FdUMP-CH2H4, 阻断dTMP形成, 最终阻止DNA合成. 肿瘤细胞中5-FU等抗代谢药物可与TS蛋白结合, 结合后的复合物不能与TS mRNA作用, 引起细胞内TS mRNA翻译效率提高, 从而导致细胞内TS蛋白量增加. TS基因高表达时一方面可加速癌症细胞的增殖, 另一方面可调节细胞的基因表达而影响细胞的生物学行为从而使肿瘤细胞产生抗药性[2,3].
许多学者的研究显示TS的表达水平和肿瘤的临床预后、临床病理参数的相关性具有争议. 余之刚等[4]对164例胃癌标本研究发现, TS表达阳性表达率为48.8%(80/164), 其与肿瘤分化程度、浸润深度、淋巴结转移以及临床病理分期密切相关(P<0.001), 然而不少学者的研究显示二者间没有相关性: 华东等[5]对51例胃癌组织中TS表达的研究显示, TS表达与患者年龄、性别、组织学分级、淋巴结转移及临床分期均无相关性. 当前大部分研究[6-8]显示肿瘤组织中TS的含量可能影响患者预后, TS高水平表达往往预示着较差的预后, 远处转移和复发的风险也更高. 然而也有学者的研究认为TS蛋白水平并不能准确预测肿瘤患者的预后[9-12]. 本组实验中, TS阳性表达率为39.02%, 其表达与胃癌患者的年龄、性别、淋巴结转移、组织学分级以及TNM分期等均无相关性. 这提示TS可能不能作为胃癌预后的参考指标, 但其过表达可为患者选取化疗药物提供一定的参考依据.
由于肿瘤细胞中TS过表达, 导致肿瘤细胞对化疗药物敏感度下降, 化疗有效率不理想. 近年来关于逆转肿瘤细胞多耐药作用的研究引起了人们的关注. Wilson等[13]和Miyahara等[14]分别在培美曲塞, 5-FU等耐药研究中证实了脱氧鸟苷三磷酸酶(dUTPase)抑制剂在逆转TS靶向化疗药物中的作用. 抑制mTOR在逆转肿瘤细胞株耐药性的有效性在胃癌, 非小细胞肺癌[15]等肿瘤中也都得到了证实. Di Cresce等[16]的研究中发现肿瘤细胞内联合转染特异性的TS siRNA和TK1/TK2 siRNA后能逆转肿瘤细胞的耐药性. Nabeya等[17]最新研究认为肿瘤细胞对5-FU化疗敏感性和TS-FdUMP复合物有关, 而和TS蛋白的浓度没有关系, 钙蛋白酶可以降低TS-FdUMP的浓度. 因此, 相关的钙蛋白酶抑制剂将在未来的临床化疗中发挥巨大作用. 上述研究在逆转TS介导的多耐药中, 应用的一些新的逆转思路: dUTPase抑制剂、mTOR抑制剂、钙蛋白酶抑制剂等, 而非一些如siRNA、反义寡核苷酸、酶催化下的激活治疗法等的经典逆转方法. 逆转肿瘤细胞多耐药作用的研究方向将更多, TS的作用将更明确.
肿瘤易感基因BRCA-1是重要的肿瘤抑制基因[18], 定位于染色体17q21, 编码一个包含锌指结构由1863个氨基酸残基构成的蛋白质. 大量实验结果表明BRCA1蛋白有抑制肿瘤生长的作用, BRCA1蛋白不仅参与细胞周期调控、DNA损伤修复、基因转录及细胞凋亡等多种重要细胞活动, 而且在维持基因组稳定性中起重要作用[19-22]. 当BRCA1基因发生基因突变使其蛋白质表达结构异常或表达水平下降, 或者由于其他原因导致BRCA-1蛋白表达减少时, 其抑制功能消失或减弱, 从而导致细胞恶变或肿瘤的发生[23]. 本研究表明BRCA1在胃癌组织中阳性率为55.69%(37/246), BRCA1蛋白表达与患者性别、年龄、肿瘤部位、TNM分期、分化程度远处转移无相关性, 而与浸润深度(P<0.01)和TNM分期(P<0.05)相关. 陈永宏等[24]通过检测61例胃癌组织与正常组织中BRCA1的表达, 发现胃癌组织中BRCA1蛋白表达率比正常组织表达率显著降低. 这提示BRCA1在肿瘤中的表达可能肿瘤的侵袭性及患者的预后相关. 有研究表明[25,26]BRCA1甲基化与胃癌形成有关, 此外, Chen等[27]研究显示BRCA1基因微卫星不稳定性(microsatellite instability, MSI)与杂合性缺失(loss of heterozygosity, LOH)与胃癌的TNM分期有密切相关, BRCA1基因LOH在胃癌TNM Ⅰ-Ⅱ期病例中的阳性率低于TNM Ⅲ-Ⅳ期病例, 而BRCA1基因MSI在胃癌TNM Ⅰ-Ⅱ病例中的阳性率远高于TNM Ⅲ-Ⅳ期病例, 但两者与淋巴结转移、组织学类型或肿瘤分化没有明显关系. Hu等[28]的研究发现, 正常胃黏膜的BRCA1蛋白主要在细胞核内表达, 而癌前病变和胃癌的病例在细胞浆内BRCA1蛋白的表达明显. 这种癌前病变和胃癌中BRCA1的异位表达和其他端粒蛋白TIN2、TRF1、TRF2、TERT、Ku70的过表达共同作用, 缩短了端粒长度, 可能有利于胃癌的多阶段癌变.
铂类药物(顺铂和草酸铂)是目前胃癌化疗常用的药物之一. 铂类药物进入肿瘤细胞后与DNA结合, 形成Pt-DNA复合物, 导致DNA的链间或链内交链, 引起DNA复制障碍, 从而抑制肿瘤细胞分裂. 而BRCA1可通过多种复合物参与DNA修复, 从而影响顺铂的耐药性. Shim等[29]研究发现, 在200例应用紫杉烷和顺铂治疗的患者中, BRCA1 TT纯合子突变能显著延长患者总体的生存率和存活期, 而BRCA1 TT这个基因型可能适度成为进展期胃癌的预后标志.
将本研究中TS蛋白和BRCA1蛋白表达进行相关性检验分析发现, TS蛋白的表达和BRCA1蛋白表达呈相关性(P<0.01, Pearson列联系数C = 0.2472), 关于TS蛋白和BRCA1蛋白表达的相关性研究尚未见相关文献报道, 其具体机制有待进一步阐明.
总之, 胃癌是全球高发的肿瘤之一, 胃癌的药物治疗及手术预后的预测成为目前刻不容缓的任务. 虽然本实验中TS与各项病理参数间都无相关性, 并且大量研究表明TS蛋白表达水平目前还不能预测胃癌治疗的预后状况, 但是肿瘤细胞中TS过表达将会导致肿瘤细胞对化疗药物敏感度下降, 化疗有效率不理想. 所以逆转TS介导的多耐药作用可能会是将来关于TS研究的热点. 本实验中BRCA1与胃癌浸润深度(P<0.01)和TNM分期(P<0.05)相关, 通过检测BRCA1的表达情况可用于指导胃癌的个体化治疗以及生存期的预测. 明确BRCA1的致癌机制以适应肿瘤治疗的需要, 将成为今后值得进一步深入研究的问题.
目前胃癌的治疗仍以手术为主, 化疗为辅, 但总体来说, 化疗有效率仍不满意, 不同患者之间疗效差异较大, 其主要原因是肿瘤细胞具有内在耐药性. 检测胃癌组织中的耐药基因, 筛选敏感的化疗药物以提高疗效, 是临床的迫切需要.
陈国忠, 主任医师, 广西中医学院第一附属医院消化内科
本文探讨胸苷酸合成酶(thymidylate synthase, TS)和乳腺癌易感基因1(breast cancer susceptibility gene-1,BRCA1)与胃癌的发生发展、浸润转移等临床病理特征及预后的关系, 并以期为TS和BRCA1临床选择化疗药物提供参考.
余之刚等研究发现, 胃癌组织中TS表达阳性表达率为48.8%(80/164), 其与肿瘤分化程度、浸润深度、淋巴结转移以及临床病理分期密切相关.
目前国内对胃癌组织中TS和BRCA1研究尚少, 本文采用大宗病例研究, 综合分析TS和BRCA1在胃癌中的表达情况,
本文采用免疫组织化学的方法检测TS和BRCA1蛋白在胃癌组织中的表达, 探讨TS和BRCA1与胃癌临床病理参数及预后的相关性.
本文以免疫组织化学研究胃癌组织中存在TS和BRCA1的过表达, 探讨其与胃癌患者临床病理参数间的相关性, 并从肿瘤靶基因多药耐药角度探讨其临床意义, 有较好的科学意义, 研究数据充分, 统计学方法准确, 图片质量较高, 具有一定指导意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | Kuniyasu T, Nakamura T, Tabuchi Y, Kuroda Y. Immunohistochemical evaluation of thymidylate synthase in gastric carcinoma using a new polyclonal antibody: the clinical role of thymidylate synthase as a prognostic indicator and its therapeutic usefulness. Cancer. 1998;83:1300-1306. [PubMed] |
| 3. | Lee KH, Hur HS, Im SA, Lee J, Kim HP, Yoon YK, Han SW, Song SH, Oh DY, Kim TY. RAD001 shows activity against gastric cancer cells and overcomes 5-FU resistance by downregulating thymidylate synthase. Cancer Lett. 2010;299:22-28. [PubMed] [DOI] |
| 6. | Hu HB, Kuang L, Zeng XM, Li B, Liu EY, Zhong MZ. Predictive value of thymidylate synthase expression in gastric cancer: a systematic review with meta-analysis. Asian Pac J Cancer Prev. 2012;13:261-267. [PubMed] [DOI] |
| 7. | Tanaka K, Saigusa S, Toiyama Y, Koike Y, Okugawa Y, Yokoe T, Inoue Y, Kobayashi M, Miki C, Kusunoki M. TS and DPD mRNA levels on formalin-fixed paraffin-embedded specimens as predictors for distant recurrence of rectal cancer treated with preoperative chemoradiotherapy. J Surg Oncol. 2012;105:529-534. [PubMed] |
| 8. | Shimokawa H, Uramoto H, Onitsuka T, Iwata T, Nakagawa M, Ono K, Hanagiri T. TS expression predicts postoperative recurrence in adenocarcinoma of the lung. Lung Cancer. 2011;72:360-364. [PubMed] [DOI] |
| 9. | Kwon HC, Roh MS, Oh SY, Kim SH, Kim MC, Kim JS, Kim HJ. Prognostic value of expression of ERCC1, thymidylate synthase, and glutathione S-transferase P1 for 5-fluorouracil/oxaliplatin chemotherapy in advanced gastric cancer. Ann Oncol. 2007;18:504-509. [PubMed] |
| 10. | Jeong SH, Han JH, Kim JH, Ahn MS, Hwang YH, Lee HW, Kang SY, Park JS, Choi JH, Lee KJ. Bax predicts outcome in gastric cancer patients treated with 5-fluorouracil, leucovorin, and oxaliplatin palliative chemotherapy. Dig Dis Sci. 2011;56:131-138. [PubMed] [DOI] |
| 11. | Kim KH, Kwon HC, Oh SY, Kim SH, Lee S, Kwon KA, Jang JS, Kim MC, Kim SJ, Kim HJ. Clinicopathologic significance of ERCC1, thymidylate synthase and glutathione S-transferase P1 expression for advanced gastric cancer patients receiving adjuvant 5-FU and cisplatin chemotherapy. Biomarkers. 2011;16:74-82. [PubMed] [DOI] |
| 12. | Brücher BL, Keller G, Werner M, Müller U, Lassmann S, Cabras AD, Fend F, Busch R, Stein H, Allescher HD. Using Q-RT-PCR to measure cyclin D1, TS, TP, DPD, and Her-2/neu as predictors for response, survival, and recurrence in patients with esophageal squamous cell carcinoma following radiochemotherapy. Int J Colorectal Dis. 2009;24:69-77. [PubMed] |
| 13. | Wilson PM, LaBonte MJ, Lenz HJ, Mack PC, Ladner RD. Inhibition of dUTPase induces synthetic lethality with thymidylate synthase-targeted therapies in non-small cell lung cancer. Mol Cancer Ther. 2012;11:616-628. [PubMed] [DOI] |
| 14. | Miyahara S, Miyakoshi H, Yokogawa T, Chong KT, Taguchi J, Muto T, Endoh K, Yano W, Wakasa T, Ueno H. Discovery of a novel class of potent human deoxyuridine triphosphatase inhibitors remarkably enhancing the antitumor activity of thymidylate synthase inhibitors. J Med Chem. 2012;55:2970-2980. [PubMed] [DOI] |
| 15. | Markova B, Hähnel PS, Kasper S, Herbertz S, Schuler M, Breitenbuecher F. Pharmacologic inhibition of mTOR antagonizes the cytotoxic activity of pemetrexed in non-small cell lung cancer. J Cancer Res Clin Oncol. 2012;138:545-554. [PubMed] |
| 16. | Di Cresce C, Figueredo R, Ferguson PJ, Vincent MD, Koropatnick J. Combining small interfering RNAs targeting thymidylate synthase and thymidine kinase 1 or 2 sensitizes human tumor cells to 5-fluorodeoxyuridine and pemetrexed. J Pharmacol Exp Ther. 2011;338:952-963. [PubMed] [DOI] |
| 17. | Nabeya Y, Suzuki T, Furuya A, Koide N, Ohkoshi M, Takiguchi M, Ochiai T, Matsubara H, Hiwasa T. Calpain regulates thymidylate synthase-5-fluoro-dUMP complex levels associated with response to 5-fluorouracil in gastric cancer cells. Cancer Sci. 2011;102:1509-1515. [PubMed] [DOI] |
| 18. | Jhanwar-Uniyal M. BRCA1 in cancer, cell cycle and genomic stability. Front Biosci. 2003;8:s1107-s1117. [PubMed] [DOI] |
| 19. | Deng CX. BRCA1: cell cycle checkpoint, genetic instability, DNA damage response and cancer evolution. Nucleic Acids Res. 2006;34:1416-1426. [PubMed] [DOI] |
| 20. | De Siervi A, De Luca P, Byun JS, Di LJ, Fufa T, Haggerty CM, Vazquez E, Moiola C, Longo DL, Gardner K. Transcriptional autoregulation by BRCA1. Cancer Res. 2010;70:532-542. [PubMed] [DOI] |
| 21. | Morris JR, Boutell C, Keppler M, Densham R, Weekes D, Alamshah A, Butler L, Galanty Y, Pangon L, Kiuchi T. The SUMO modification pathway is involved in the BRCA1 response to genotoxic stress. Nature. 2009;462:886-890. [PubMed] [DOI] |
| 22. | Ciechanover A. Intracellular protein degradation: from a vague idea thru the lysosome and the ubiquitin-proteasome system and onto human diseases and drug targeting. Exp Biol Med (Maywood). 2006;231:1197-1211. [PubMed] |
| 23. | Scully R, Livingston DM. In search of the tumour-suppressor functions of BRCA1 and BRCA2. Nature. 2000;408:429-432. [PubMed] |
| 25. | Zavala G L, Luengo J V, Ossandón C F, Riquelme S E, Backhouse E C, Palma V M, Argandoña C J, Cumsille MA, Corvalán R A. [Hierarchical clustering analysis to detect associations between clinical and pathological features of gastric tumors and hypermethylation of suppressor genes]. Rev Med Chil. 2007;135:17-25. [PubMed] |
| 26. | Bernal C, Vargas M, Ossandón F, Santibáñez E, Urrutia J, Luengo V, Zavala LF, Backhouse C, Palma M, Argandoña J. DNA methylation profile in diffuse type gastric cancer: evidence for hypermethylation of the BRCA1 promoter region in early-onset gastric carcinogenesis. Biol Res. 2008;41:303-315. [PubMed] |
| 27. | Chen XR, Zhang WZ, Lin XQ, Wang JW. Genetic instability of BRCA1 gene at locus D17S855 is related to clinicopathological behaviors of gastric cancer from Chinese population. World J Gastroenterol. 2006;12:4246-4249. [PubMed] |
| 28. | Hu H, Zhang Y, Zou M, Yang S, Liang XQ. Expression of TRF1, TRF2, TIN2, TERT, KU70, and BRCA1 proteins is associated with telomere shortening and may contribute to multistage carcinogenesis of gastric cancer. J Cancer Res Clin Oncol. 2010;136:1407-1414. [PubMed] [DOI] |
| 29. | Shim HJ, Yun JY, Hwang JE, Bae WK, Cho SH, Lee JH, Kim HN, Shin MH, Kweon SS, Lee JH. BRCA1 and XRCC1 polymorphisms associated with survival in advanced gastric cancer treated with taxane and cisplatin. Cancer Sci. 2010;101:1247-1254. [PubMed] [DOI] |