修回日期: 2013-03-27
接受日期: 2013-04-19
在线出版日期: 2013-05-08
目的: 探讨溃疡性结肠炎(ulcerative colitis, UC)大鼠肺损伤的细胞凋亡机制, 进一步探究"肺与大肠相表里"理论.
方法: 66只Wistar大鼠, 随机分为6组, 3个观察时间点均设正常组与模型组, 其中正常组均为10只, 模型组均为12只, 模型组大鼠采用结肠黏膜组织致敏加三硝基苯磺酸-50%乙醇灌肠的方法建立大鼠UC模型, 于造模后第0、2、4周动态观察肺、结肠组织病理形态学改变, 采用Western blot法动态观察大鼠肺组织中Bcl-2、Bax蛋白表达变化.
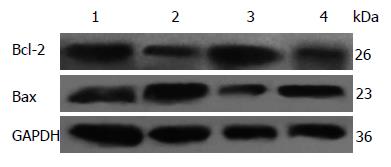
结果: 与正常组比较, 各时间点模型组大鼠肠质量指数明显升高(第0周: 0.00252±0.000557 vs 0.00564±0.00119, P = 0.0000; 第2周: 0.00245±0.000234 vs 0.00573±0.00283, P = 0.0002; 第4周: 0.00237±0.000284 vs 0.00524±0.00310, P = 0.0014)、肺质量指数增加(第0周: 0.00404±0.000399 vs 0.00473±0.000634, P = 0.0088; 第2周: 0.00383±0.000433 vs 0.00472±0.00104, P = 0.0267; 第4周: 0.00347±0.000444 vs 0.00440±0.00106, P = 0.0017), 肺肠组织HE染色均出现明显病理变化, 肺组织Bcl-2蛋白表达水平明显下降(第2周: 1.333±0.114 vs0.947±0.068, P = 0.0072; 第4周: 1.594±0.187 vs 0.982±0.128, P = 0.0094), Bax蛋白表达水平明显上升(第2周: 0.521±0.069 vs 1.078±0.220, P = 0.0139; 第4周: 0.817±0.179 vs 1.491±0.323, P = 0.034), Bcl-2/Bax比值显著降低(第2周: 2.570±0.147 vs 0.895±0.129, P = 0.0001; 第4周: 2.036±0.586 vs 0.668±0.0678, P = 0.016).
结论: 肺组织中Bcl-2和Bax蛋白表达异常并诱导肺组织细胞凋亡可能是UC肺损伤的分子机制之一, 并可能为"肠病及肺"提供理论依据.
核心提示: 肺组织中Bcl-2和Bax蛋白表达异常并诱导肺组织细胞凋亡可能是溃疡性结肠炎(ulcerative colitis, UC)肺损伤的分子机制之一. 因此, 以干预细胞凋亡信号转导途径为中心, 对明确UC肺损伤细胞凋亡的发生机制和"肠病及肺"的现代生物学机制将有较好的启示作用.
引文著录: 盛益华, 王新月, 闫昕, 朱立, 张良登. 从溃疡性结肠炎大鼠肺损伤细胞凋亡机制探讨"肺与大肠相表里". 世界华人消化杂志 2013; 21(13): 1171-1177
Revised: March 27, 2013
Accepted: April 19, 2013
Published online: May 8, 2013
AIM: To discuss mechanism of apoptosis of in lung injury in rats with ulcerative colitis and to further explore the theory of the lung and the large intestine being interior-exteriorly related.
METHODS: Sixty-six Wistar rats were randomly divided into two groups: normal group and model group. Both groups were observed at three time points (10 rats at each time point for the normal group, and 12 rats for the model group). The model was established using immune complex and trinitrobenzenesulfonic acid. Pathological and morphological changes of the lung and the colon were dynamically observed on the 0, 2nd and 4th wk. Protein expression of Bcl-2 and Bax in the lung was tested by Western blot.
RESULTS: Compared to the normal group, intestinal index (week 0: 0.00252 ± 0.000557 vs 0.00564 ± 0.00119, P = 0.0000; week 2: 0.00245 ± 0.000234 vs 0.00573 ± 0.00283, P = 0.0002; week 4: 0.00237 ± 0.000284 vs 0.00524 ± 0.00310, P = 0.0014) and lung index (week 0: 0.00404 ± 0.000399 vs 0.00473 ± 0.000634, P = 0.0088; week 2: 0.00383 ± 0.000433 vs 0.00472 ± 0.00104, P = 0.0267; week 4: 0.00347 ± 0.000444 vs 0.00440 ± 0.00106, P = 0.0017) significantly increased in the model group at various time points. Compared to the normal group, obvious pathological changes appeared in the lung and the colon and there were decreased expression of Bcl-2 (week 2: 1.333 ± 0.114 vs 0.947 ± 0.068, P = 0.0072; week 4: 1.594 ± 0.187 vs 0.982 ± 0.128, P = 0.0094) and Bax (week 2: 0.521 ± 0.069 vs 1.078 ± 0.220, P = 0.0139; week 4: 0.817 ± 0.179 vs 1.491 ± 0.323, P = 0.034) and significantly reduced ratio of Bcl-2 to Bax (week 2: 12.570 ± 0.147 vs 0.895 ± 0.129, P = 0.0001; week 4: 2.036 ± 0.586 vs 0.668 ± 0.0678, P = 0.016).
CONCLUSION: Abnormal expression of Bcl-2 and Bax in the lung that induces cell apoptosis may be one of molecular mechanisms of lung injury in ulcerative colitis and may provide a theoretical basis for enteropathy inducing pneumonopathy.
- Citation: Sheng YH, Wang XY, Yan X, Zhu L, Zhang LD. Discussion on theory of the lung and the large intestine being interior-exteriorly related from mechanism of apoptosis in lung injury in rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2013; 21(13): 1171-1177
- URL: https://www.wjgnet.com/1009-3079/full/v21/i13/1171.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i13.1171
溃疡性结肠炎(ulcerative colitis, UC)又称非特异性溃疡性结肠炎, 是一种直肠和结肠黏膜的慢性非特异性炎症性病变, 其病变主要累及结肠黏膜与黏膜下层[1]. 近年来, 随着我国人民生活水平的提高和生活方式的改变, UC发病率逐年增加[2]. UC的发病原因及发病机制尚未完全明确[3], 目前较公认的是机体免疫系统的激活造成炎症及组织损伤, 并与遗传、环境、免疫、感染、心理等因素密切相关[4]. 其临床症状以反复发作的腹痛、腹泻、黏液脓血便为特点, 病程常反复迁延[5], 并有多种肠外表现[6]. 早在20世纪70年代, Kraft等[7]就明确提出炎症性肠病可累及肺脏的观点, 随后国内外陆续有文献报道UC患者肺部病变的发生[8,9], 但UC肺损伤的发病机制至今依然不明确, 相关动物实验研究方面的报道亦较少见[10]. 本实验采用结肠黏膜组织致敏加三硝基苯磺酸-50%乙醇灌肠的方法制作UC大鼠模型, 动态观察此模型肺、结肠组织的病理形态学改变及凋亡调控蛋白Bcl-2、Bax在肺组织中的表达, 从而初步探讨UC大鼠肺损伤的细胞凋亡机制, 进一步探究"肺与大肠相表里"理论.
SPF级健康♂Wistar大鼠66只, 体质量200 g±10 g, 购自北京维通利华实验动物技术有限公司[许可证号SCXK(京)2012-0001], 饲养于北京中医药大学SPF动物实验中心. 健康♂新西兰家兔10只, 体质量2.5 kg左右, 购自北京金牧阳实验动物养殖有限责任公司[许可证号SCXL(京)2010-0001)]; 2,4,6-三硝基苯磺酸(2, 4, 6-trinitrobenzenesulfonic acid, TNBS)购自Sigma公司产品; 完全弗氏佐剂购自Sigma公司产品; 小鼠抗Bax抗体购自Santa Cruz公司; 兔抗Bcl-2抗体购自Santa Cruz公司; 小鼠抗GAPDH单抗购自中杉金桥; 山羊抗小鼠IgG/辣根酶标记购自购自中杉金桥; HRP标羊抗兔IgG二抗购自北京普利莱基因技术有限公司; 无水乙醇等其他试剂均购自北京化学试剂公司; 湘仪TGL-16台式冷冻离心机购自湖南湘仪离心机仪器有限公司; VCXl30PB Sonics超声波细胞破碎仪(美国)购自上海斯高勒生物科技有限公司; HY-2调速多用振荡器购自江苏金坛金城国胜实验仪器厂; 垂直板电泳槽及电转槽购自美国伯乐(bio-rad)公司.
1.2.1 造模: 模型组大鼠参照宫健伟、段征及景姗等[11-13]制作UC模型的方法, 即肠黏膜组织致敏加三硝基苯磺酸-50%乙醇灌肠的方法复制大鼠UC模型. 选择健康♂新西兰家兔, 以空气栓塞处死, 剖取结肠并刮取结肠黏膜组织, 加等质量生理盐水, 用超声波细胞破碎仪进行组织匀浆, 4 ℃, 3000 r/min离心, 30 min, 取上清, 双缩脲法进行蛋白定量, 加等体积的完全弗氏佐剂, 制备成抗原乳化液. 分别于适应性饲养后第1、15、22天于大鼠双侧腹股沟、足跖部位注射抗原乳化液, 每次每只注射的抗原乳化液含抗原8 mg. 将TNBS配成浓度为120 mg/mL的溶液, TNBS溶液与50%乙醇按体积1:1混合. 第29天禁食不禁水24 h后以10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉, 三硝基苯磺酸-50%乙醇按TNBS 100 mg/kg体质量灌肠. 用硅胶管(直径2 mm, 长约12 cm)由肛门缓慢地插入至肠腔内8 cm处, 每只0.6-0.8 mL, 快速(5 s内)注入, 并将大鼠倒置约1 min, 使药液达全结肠并防止液体流出.
1.2.2 分组UC大鼠模型制备: 66只大鼠适应性饲养1 wk后, 随机分为6组, 3个观察时间点均设正常组与模型组, 其中正常组均为10只, 模型组均为12只, 正常组与模型组同步观察饲养.
1.2.3 取材: 造模完成后, 将大鼠放回饲养笼内平躺直至自然苏醒, 后饲养于SPF级动物房内, 给予正常饮食, 每日观察大鼠精神状态、进食量、活动度、粪便性状等. 造模完成后第3天(0周)、第2周、第4周末禁食不禁水24 h后, 称质量, 10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉, 于冰上快速摘取肺及肛门上2-15 cm结肠组织, 4℃生理盐水冲洗清除肠内容物, 称取结肠、全肺湿质量, 计算结肠、肺质量指数, 肠质量指数 = 结肠湿质量/体质量×100%, 肺质量指数 = 肺湿质量/体质量×100%. 然后取病变较明显处结肠组织约1.0 cm及部分右肺上叶组织, 10%福尔马林溶液固定, 常规石蜡包埋, 5 μm厚组织切片, HE染色, 光学显微镜下观察肺和结肠组织病理学变化. 此外, 收集部分右肺上叶组织置于冻存管内并标记, 于液氮中保存, 用于检测Bcl-2、Bax.
1.2.4 指标观察: 大鼠结肠黏膜组织、肺支气管病理形态学变化, 常规HE染色后光学显微镜下观察各时间点各组组织病理结构变化. Western blot法观察肺组织中Bax、Bcl-2蛋白的表达水平, 包括蛋白提取、电泳和转膜后免疫检测. 第2、4周每组随机选取3个肺组织样品, 每个样品肺组织约50 mg, 将同一时间点同组的3个肺组织样品共约150 mg置于1.5 mL细胞裂解液中, 置于冰水中匀浆, 4 ℃, 12000 r/min, 离心15 min, 取上清, 分装后于-80 ℃保存备用. 将提取的蛋白上清与5×loading buffer 4:1混合, 置于95 ℃水中煮5 min, 使蛋白变性. 采用10%的SDS-PAGE凝胶进行电泳, 电压80 V, 30 min, 100 V 1.5 h, 电泳结束后, PVDF膜甲醇中润湿后进行蛋白质转膜, 电流200 mA, 2 h. 用5%脱脂奶粉制成封闭液室温下封闭PVDF膜1 h, 用TBST洗膜3次, 每次10 min. 将膜与溶于TBST中的一抗4 ℃条件下置于摇床上摇动, 孵育过夜, 次日TBST洗膜3次, 每次10 min. 二抗37 ℃孵育2 h, TBST洗膜3次, 每次10 min. 加入超敏发光液(SuperECL plus)反应3 min, 用保鲜膜包裹, 暗室中进行X线胶片曝光、显影和定影. Bax和Bcl-2蛋白分子量分别为23 kDa和26 kDa. GAPDH蛋白作为内参, 该蛋白分子量为36 kDa. 条带用Image J Analysis software计算灰度值, 以目的蛋白与内参GAPDH蛋白的灰度比值来表示目的蛋白表达的相对量. 重复3次实验取平均值.
统计学处理 应用SPSS17.0统计软件, 结果采用mean±SD表示, 采用单因素方差分析, 样本不符合正态分布或方差不齐时采用Wilcoxon Two-Sample Test检验, P<0.05为有显著统计学差异, P<0.01为有非常显著统计学差异.
各观察时间点正常组大鼠活动灵活, 反应灵敏, 皮毛润泽, 饮水进食良好, 粪便为褐色粒状且质地较硬, 无黏液脓血, 呼吸平稳正常. 三硝基苯磺酸-50%乙醇灌肠后3 d(第0周), 模型组大鼠大部分出现脓血便, 有黏液, 粪便稀软、不成形, 甚至成水样便, 精神萎靡, 不喜活动, 毛色苍黄枯槁, 饮食量减少, 毛发疏松, 形体消瘦. 2 wk末模型大鼠大部分粪便仍稀软、不成形, 部分夹有脓血、黏液, 倦怠少动, 毛色苍黄少泽, 体质量增长明显慢于正常组. 4 wk末模型大鼠粪便仍有部分质地较稀夹有黏液, 反应迟钝, 毛色欠佳.
第0周时模型组大鼠结肠湿质量、肠质量指数与正常组比较显著增加(P = 0.0000, P = 0.0000); 第2周时模型组大鼠结肠湿质量、肠质量指数与正常组比较亦有显著增加(P = 0.0002, P = 0.0002), 第4周时模型组大鼠结肠湿质量、肠质量指数与正常组比较仍有显著增加(P = 0.0043, P = 0.0014, 表1).
第0周时模型组大鼠肺质量指数与正常组比较显著增加(P = 0.0088); 第2周时模型组大鼠肺湿质量、肺质量指数与正常组比较有显著增加(P = 0.0348, P = 0.0267), 第4周时模型组大鼠肺湿质量、肺质量指数与正常组比较仍有显著增加(P = 0.0083, P = 0.0017, 表2).
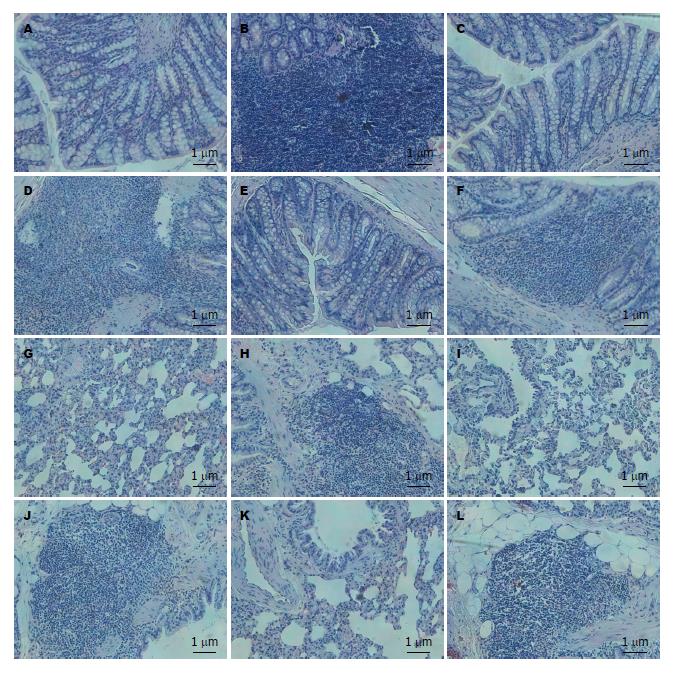
2.3.1 结肠组织病理观察: 病理切片, HE染色, 光学显微镜下观察, 模型组第0周结肠表现为透壁性炎症, 大量炎性细胞浸润, 并浸润黏膜层、黏膜肌层、黏膜下层, 自黏膜层到肌层结构疏松, 黏膜下层水肿, 黏膜固有层腺体萎缩甚至消失, 甚至呈现透壁性坏死, 形成溃疡. 提示大鼠UC发生, 模型制备成功(图1B). 第2周病变较第0周无明显改善, 仍有溃疡、大量炎性细胞浸润(图1D). 第4周时结肠病变较第0周和第2周略有改善, 仍有炎性细胞浸润黏膜层、黏膜下层, 溃疡形成(图1F).
2.3.2 肺组织病理观察: 模型组第0周表现为肺间质炎症, 间质大量炎性细胞浸润, 肺间质充血, 小血栓形成, 小气道损伤, 肺泡间隔增宽, 肺泡变形. 支气管周围、血管周围炎性细胞浸润, 淋巴细胞呈灶状(图1H). 第2、4周模型组大鼠肺组织病理改变无明显改善, 肺间质炎性细胞浸润仍很明显, 血管、支气管外周淋巴细胞呈灶状浸润, 支气管壁增厚变形, 血管壁增厚, 间质纤维组织增生明显, 部分肺组织肺泡融合, 形成肺大泡(图1J, L).
中医脏腑表里相关理论的重要组成部分之一"肺与大肠相表里"的理论源自《黄帝内经》. 近现代众多医家在"肺与大肠相表里"理论指导下进行了大量的临床实践和研究[14-17], 但该理论在现代医学研究领域, 特别是通过动物实验在分子生物学水平对"肺与大肠相表里"理论的生物学基础研究仍十分欠缺. 《灵枢·本输》中有"肺合大肠, 大肠者, 传导之腑"的记载, "肺合大肠"的理论基础源于肺与大肠在经络上的相互络属. 《灵枢·经脉》: "肺手太阴之脉, 起于中焦, 下络大肠, 还循胃口, 上隔属肺", "大肠手阳明之脉, 起于大指次指之端......下入缺盆络肺, 下隔属大肠"可见肺与大肠在功能上通过经络建立了紧密的联系. 肺与大肠一脏一腑, 一阴一阳, 表现为生理功能上相得益彰, 互为表里. 肺气宣发肃降正常, 大肠得肺肃降之气的推动, 则大肠传导有节; 大肠传导正常则有助于肺气的宣肃. 同样, 两者在病理也互相影响, 大肠病可及肺, 腑气不通, 浊气上逆犯肺则肺失宣降, 可见咳嗽、咯痰、气促喘鸣等呼吸系统症状. 例如《内经·至真要大论》曰: "寒厥于肠, 上冲胸中, 甚则喘不能久立", 说明邪犯大肠, 能上逆犯肺致喘, 又有《灵枢·四时气》: "腹中肠鸣, 气上冲胸, 喘不能久立, 邪在大肠"的论述. UC病位在大肠, 其发病病机多为饮食不节、感受外邪或情志失调[18], 导致肺气失于宣肃, 肝气失于调达, 脾胃失于运化, 湿热、积滞等病邪客于肠道, 与肠道气血搏结, 大肠传导失司, 气血凝滞, 脂膜血络损伤, 血败肉腐, 壅滞成脓, 内溃成疡, 而形成本病[19]. UC久病耗气, 势必损伤肺脾之气, 影响肺之宣发肃降, 且肺主治节, 为水之上源, 不能通调水道、下输膀胱, 水液停留而致痰饮积滞.
本实验采用TNBS-乙醇诱导复合结肠黏膜组织致敏UC大鼠模型, 此模型可达到全身免疫异常与局部炎症病变共存, 产生与人类UC较为接近的临床症状及肠道病变, 符合人UC病变由B细胞介导的体液免疫反应和T细胞介导的细胞免疫反应共同作用的病变机制. 本研究发现, 与正常组比较, 模型组肺质量指数显著升高, HE染色肺间质有大量的炎性细胞浸润、支气管壁增厚, 纤维组织增生等病理变化, 提示模型组大鼠可能由于湿热毒邪上扰, 肺气宣肃不利, 不能通调水道, 水液停留, 痰瘀互结, 在一定程度上说明肠病及肺, 从该角度为"肺与大肠相表里"提供了理论基础.
细胞凋亡是由一系列基因控制的细胞主动死亡的过程, 接受来自细胞外部或内部的凋亡信号, 使细胞内编码的自杀程序激活, 从而促发凋亡的过程. 近几年来, 对调控细胞凋亡相关基因的基础研究已受到极大的关注与重视, 因此也成为研究的热点. 其中, 原癌基因Bcl-2蛋白家族是极为重要的一类调控凋亡的因子, 通过该家族成员相互之间或与其他凋亡因子的作用, 发挥调控凋亡的作用. Bcl-2蛋白家族中的各凋亡因子也是在细胞凋亡相关基因的研究中被研究最多的一类凋亡因子[20]. Bcl-2基因家族在细胞凋亡的基因调控网络中发挥关键性的作用[21]. Bcl-2和Bax是凋亡调控基因Bcl-2家族的2个重要成员, Bcl-2家族中Bcl-2基因抑制凋亡, 而Bax基因诱发凋亡. Bcl-2基因位于染色体18q21, 编码产物分子量为26 kDa的蛋白. Bcl-2的主要生物学功能为延长细胞寿命, 使细胞增加对各种凋亡刺激因素的抵抗性, Schwarz等[22]基因转染实验显示Bcl-2高表达可广泛抑制大多数刺激剂诱导的细胞凋亡. Bax基因作为Bcl-2相关X蛋白基因, 通过对抗Bcl-2的活性, 可提高细胞的凋亡敏感性, 能直接促进细胞凋亡, Bcl-2和Bax二者形成一个凋亡调控系统: 当Bax形成同源二聚体时, 诱导凋亡; 随着Bcl-2蛋白表达量上升, Bcl-2和Bax形成异源二聚体, Bcl-2/Bax二者蛋白比例可以调节细胞凋亡的速率, 决定细胞存活或死亡[21]. 因此, 减少Bax表达和升高Bcl-2/Bax比率有利于抵抗细胞凋亡的发生[23-25].
本实验第2、4周UC模型大鼠肺组织Bcl-2蛋白表达水平明显下降, Bax蛋白表达水平明显上升, Bcl-2/Bax比值显著降低, Bcl-2/Bax<1, 细胞凋亡占优势[26], 提示Bcl-2、Bax蛋白表达异常并诱导肺组织细胞凋亡可能是UC肺损伤的重要病理机制之一. 近年来关于Bcl-2、Bax和Caspase-3参与细胞凋亡信号转导的研究进一步深入[27]. Bcl-2、Bax可调控cyt-c的释放和下游Caspase-3蛋白酶的活化,参与对Caspase-3活性的调节[28,29]. 其中, Caspase-3又称为半胱氨酸蛋白酶32(CPP32), 是Caspase家族中重要的效应蛋白酶, 也是多种凋亡途径的共同下游"死亡执行蛋白酶", 在细胞凋亡的发生过程中发挥关键的作用[30]. 活化后的Caspase-3酶解切割DNA依赖的蛋白激酶和聚腺苷二磷酸核糖多聚酶等, 从而影响细胞DNA复制、转录和损伤修复[31]. 有研究表明, 博莱霉素诱导肺纤维化大鼠肺组织细胞中Bax蛋白表达明显上调, Bcl-2 mRNA及蛋白表达明显减弱, 并且细胞凋亡明显增加[32]. 因此, 本实验中Bcl-2与Bax的异常表达很可能是通过对Caspase-3的异常活化最终介导细胞的存活或死亡.
因此, 以干预细胞凋亡信号转导途径为中心, 抑制肺组织细胞凋亡, 促进炎性细胞凋亡的研究, 可能是UC肺损伤及"肺与大肠相表里"理论相关研究的主要内容之一, 对明确UC肺损伤细胞凋亡的发生机制和"肠病及肺"的现代生物学机制将有较好的启示作用. 然而, UC肺损伤的发病机制十分复杂, 且肺与大肠表里关系是多种物质和机制共同作用的结果, 仅仅从细胞凋亡角度开展研究尚不能全面揭示肺与大肠表里关系的生物学机制内涵, 有待于今后从更广更深层面开展综合性的相关研究.
早在20世纪70年代, 国外就有学者明确提出炎症性肠病可累及肺脏的观点, 随后国内外陆续有文献报道溃疡性结肠炎(ulcerative colitis, UC)患者肺部病变的发生, 但UC肺损伤的发病机理至今依然不明确, 相关动物实验研究方面的报道亦较少见.
缪应雷, 主任医师, 昆明医科大学第一附属医院消化内科; 刘杰民, 副主任医师, 贵州省人民医院消化内镜科
目前国内外关于UC的临床及动物实验研究均已发现UC肺损伤的存在, 但UC肺损伤的发生机制尚不明确, 且临床治疗仍多采用氨基水杨酸类药物和皮质类固醇药物, 治疗效果不理想, 因此明确UC肺损伤的发生机制非常重要.
景姗报道了结肠黏膜组织致敏加三硝基苯磺酸-50%乙醇灌肠诱导复制UC大鼠模型后1 wk, 观察发现肺、结肠组织病理均表现出组织损伤, UC大鼠肺功能异常及sIgA明显降低, 提示肠病及肺.
本实验通过建立肠黏膜组织致敏加三硝基苯磺酸-50%乙醇灌肠的方法复制大鼠UC模型, 观察UC大鼠肺损伤的病理形态学改变, 凋亡相关蛋白Bcl-2和Bax在肺组织中的表达情况, 初步探究UC肺损伤发生的可能的细胞凋亡机制.
本实验通过对UC大鼠肺组织病理及凋亡相关蛋白的观察, 初步明确细胞凋亡异常可能参与UC肺损伤的发生. 因此, 以干预细胞凋亡信号转导途径为中心, 抑制肺组织细胞凋亡, 可能是UC肺损伤及"肺与大肠相表里"相关研究的主要内容之一, 为临床治疗提供依据.
本文新颖性好, 可读性佳, 为"肠病及肺"提供了理论依据, 为临床UC肺损伤"从肠而治"提供了思路, 对后续研究有很好的启示作用.
编辑: 田滢 电编: 鲁亚静
| 5. | 朱 立, 王 新月, 于 玫, 安 贺军. 120例溃疡性结肠炎患者病因及临床特征分析. 中国中医基础医学杂志. 2009;15:841-842. |
| 6. | 杨 雪, 王 新月, 朱 立. 炎症性肠病的肺部损害及机制探讨. 中国中西医结合消化杂志. 2011;19:133-136. |
| 7. | Kraft SC, Earle RH, Roesler M, Esterly JR. Unexplained bronchopulmonary disease with inflammatory bowel disease. Arch Intern Med. 1976;136:454-459. [PubMed] [DOI] |
| 10. | 杨 雪, 王 新月, 朱 立, 景 姗, 周 波, 杨 舒. 从肺论治法对溃疡性结肠炎大鼠结肠组织VIP水平的影响及意义. 中国中医基础医学杂志. 2011;17:282-283. |
| 20. | Ishii HH, Gobe GC, Yoneyama J, Mukaide M, Ebihara Y. Role of p53, apoptosis, and cell proliferation in early stage Epstein-Barr virus positive and negative gastric carcinomas. J Clin Pathol. 2004;57:1306-1311. [PubMed] [DOI] |
| 21. | Cvejic D, Selemetjev S, Savin S, Paunovic I, Petrovic I, Tatic S. Apoptosis and proliferation related molecules (Bcl-2, Bax, p53, PCNA) in papillary microcarcinoma versus papillary carcinoma of the thyroid. Pathology. 2008;40:475-480. [PubMed] [DOI] |
| 22. | Schwarz M, Andrade-Navarro MA, Gross A. Mitochondrial carriers and pores: key regulators of the mitochondrial apoptotic program? Apoptosis. 2007;12:869-876. [PubMed] |
| 23. | Merritt AJ, Potten CS, Watson AJ, Loh DY, Nakayama K, Nakayama K, Hickman JA. Differential expression of bcl-2 in intestinal epithelia. Correlation with attenuation of apoptosis in colonic crypts and the incidence of colonic neoplasia. J Cell Sci. 1995;108:2261-2271. [PubMed] |
| 24. | Itoh J, de La Motte C, Strong SA, Levine AD, Fiocchi C. Decreased Bax expression by mucosal T cells favours resistance to apoptosis in Crohn's disease. Gut. 2001;49:35-41. [PubMed] [DOI] |
| 28. | Zhao H, Yenari MA, Cheng D, Sapolsky RM, Steinberg GK. Bcl-2 overexpression protects against neuron loss within the ischemic margin following experimental stroke and inhibits cytochrome c translocation and caspase-3 activity. J Neurochem. 2003;85:1026-1036. [PubMed] |
| 29. | Kawatani M, Imoto M. Deletion of the BH1 domain of Bcl-2 accelerates apoptosis by acting in a dominant negative fashion. J Biol Chem. 2003;278:19732-19742. [PubMed] |
| 30. | Odonkor CA, Achilefu S. Modulation of effector caspase cleavage determines response of breast and lung tumor cell lines to chemotherapy. Cancer Invest. 2009;27:417-429. [PubMed] [DOI] |
| 31. | Hashimoto S, Setareh M, Ochs RL, Lotz M. Fas/Fas ligand expression and induction of apoptosis in chondrocytes. Arthritis Rheum. 1997;40:1749-1755. [PubMed] [DOI] |
| 32. | 江 瑛, 祁 鑫, 王 丽京, 邱 桐. 博莱霉素肺损伤大鼠细胞凋亡及bcl-2/bax基因的表达. 西北师范大学学报(自然科学版). 2001;2:65-70. |