修回日期: 2013-03-18
接受日期: 2013-04-13
在线出版日期: 2013-04-28
目的: 探讨外周单核细胞Rho相关激酶(Rho-associated kinases, ROCKs)与胰岛素抵抗、胰岛素β细胞功能的关系.
方法: 研究对象来自于2010-10/2010-12被明确诊断为糖尿病的门诊与体检患者, 受试者均为采用空腹血糖检查和高效液相法测定糖化血红蛋白水平. 应用Western blot检测新诊断2型糖尿病患者外周单核细胞磷酸化肌球蛋白亚基(phosphor-myosin-binding subunit, p-MBS)与总肌球蛋白亚基(total myosin-binding subunit, t-MBS)蛋白水平, 并借由两者的比率反映ROCK活性, 分析其与稳态胰岛素评价指数(HOMA-IR)、胰岛素分泌功能指数(HOMA-%B)和胰岛素敏感指数(HOMA-%S)间相关关系.
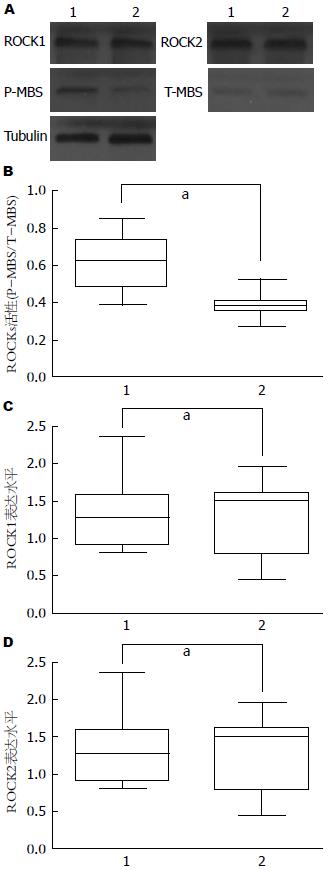
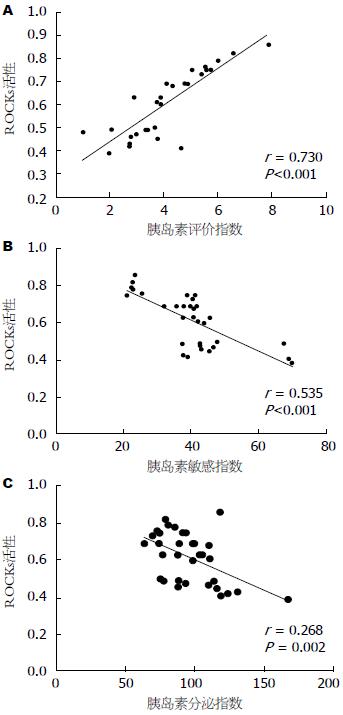
结果: 与健康对照组相比, 糖尿病组总胆固醇、低密度脂蛋白胆固醇、甘油三酯和空服血糖水平显著升高(5.4±0.8 vs 4.1±0.6, 3.7±0.8 vs 2.8±0.6, 1.7±0.3 vs 1.1±0.2, 8.1±0.9 vs 5.4±0.4, P<0.001), 高密度脂蛋白胆固醇水平则显著降低(0.7±0.1 vs 1.2±0.1, P<0.001); 与健康对照组相比, 糖尿病组HOMA-IR显著增高(4.3±1.5 vs 2.4±1.1, P<0.001), 而HOMA-%B与HOMA-%S则显著降低(95.5±21.4 vs 118.2±16.9, 40.2±11.9 vs 65.9±7.7, P<0.001); 糖尿病组与健康组相比ROCK活性显著升高(0.63±0.15 vs 0.40±0.12, P<0.05); total-MBS、ROCK1和ROCK2表达水平两者间无显著性差异; 在糖尿病患者中, ROCK活性与HOMA-IR呈正相关、与HOMA-%B/HOMA-%S则呈负相关.
结论: 2型糖尿病的胰腺β-细胞功能障碍与ROCKs活性密切相关.
核心提示: 本研究结果提示在糖尿病患者中, Rho相关激酶((Rho-associated kinases, ROCKs))与HOMA-IR呈正相关、与HOMA-%B/HOMA-%S则呈负相关. 我们认为2型糖尿病的胰腺β-细胞功能障碍与ROCKs活性密切相关.
引文著录: 吴斌, 高倩, 楚晓婧, 张玫, 黄亨建, 李贵星, 王兰兰. 新诊断2型糖尿病患者外周单核细胞ROCK活性与胰岛素抵抗以及胰岛β细胞功能的关系. 世界华人消化杂志 2013; 21(12): 1146-1151
Revised: March 18, 2013
Accepted: April 13, 2013
Published online: April 28, 2013
AIM: To observe the correlation of peripheral mononuclear cells' Rho-associated kinase activity in peripheral mononuclear cells with HOMA-IR, HOMA-%S and HOMA-%B in patients with newly diagnosed type 2 diabetes (T2D) and healthy subjects.
METHODS: For this study, 33 patients with T2D and 33 healthy participants were enrolled and evaluated for clinical and metabolic parameters. Biochemical quantifications and fasting plasma insulin measurement were performed with ROCHE DDP and E601 auto-analyzers, respectively. Rho-associated kinase activity was evaluated in peripheral mononuclear cells by Western blot and defined as the ratio of phosphor myosin-binding subunit on myosin light chain phosphatase to total myosin-binding subunit. HOMA-IR, HOMA-%S and HOMA-%B were calculated with a HOMA2 calculator.
RESULTS: The levels of total cholesterol, LDL-cholesterol, triglycerides and fasting glucose were significantly raised (5.4 ± 0.8 vs 4.1 ± 0.6, 3.7 ± 0.8 vs 2.8 ± 0.6, 1.7 ± 0.3 vs 1.1 ± 0.2, 8.1 ± 0.9 vs 5.4 ± 0.4, all P < 0.001) and HDL-cholesterol significantly decreased (0.7 ± 0.1 vs 1.2 ± 0.1, P < 0.001) in T2D subjects compared with healthy subjects. HOMR-IR significantly increased (4.3 ± 1.5 vs 2.4 ± 1.1, P < 0.001) and HOMA-%B and HOMA-%S significantly declined (95.5 ± 21.4 vs 118.2 ± 16.9, 40.2 ± 11.9 vs 65.9 ± 7.7, both P < 0.001) in T2D subjects compared with healthy subjects. ROCK activity was more markedly raised in T2D subjects than in healthy subjects (0.63 ± 0.15 vs 0.40 ± 0.12, P < 0.05). The expression of total MBS, ROCK1 and ROCK2 did not differ significantly between the two groups. In diabetic subjects, ROCK activity was positively correlated with HOMA-IR and negatively with HOMA-%B.
CONCLUSION: Our findings suggest that pancreatic β-cell dysfunction and the development of type 2 diabetes are associated with ROCK activity in peripheral mononuclear cells.
- Citation: Wu B, Gao Q, Chu XJ, Zhang M, Huang HJ, Li GX, Wang LL. Correlation of insulin resistance, pancreatic β-cell function and insulin sensitivity with increased Rho-associated kinase activity in PBMCs in patients with newly diagnosed type 2 diabetes. Shijie Huaren Xiaohua Zazhi 2013; 21(12): 1146-1151
- URL: https://www.wjgnet.com/1009-3079/full/v21/i12/1146.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i12.1146
Rho相关激酶(Rho-associated kinases, ROCKs)属于丝氨酸/苏氨酸激酶家族, 是小GTP酶RhoA下游反应信号蛋白[1]. ROCKs在肌动蛋白细胞骨架的组织起着重要的作用, 涉及范围广泛的基本细胞功能, 如收缩, 黏附, 迁移, 增殖和基因表达[2]. ROCKs有两个亚型, ROCK1和ROCK2, 一般认为两个亚型为功能上基本一致, 依据是两者具有类似的酶激动剂、高度同源结构域[3]. Liao等[4]证实化学抑制剂Y27632(法舒地尔, fasudil)能够有效的抑制ROCK1和ROCK2. ROCKs常用于预测心血管疾病, 包括动脉粥样硬化和心肌缺血再灌注损伤. 现在的观点认为心血管疾病患者若合并糖尿病, 心血管事件的发生率显著性上升. 在糖尿病动物模型中ROCKs参与了糖尿病所致的心脏损伤[5], 然而我们现在不确定ROCKs活性变化是否在糖尿病发生早期出现显著变化, 是否与胰岛素抵抗, 胰岛β-细胞功能和胰岛素敏感性相关. 因此, 我们的目的是观察初诊2型糖尿病的患者和正常健康志愿者外周单核细胞ROCKs活性同HOMA-IR, HOMA-%B(反映胰岛β细胞功能)与HOMA-%S(反映胰岛素敏感性)等相关性, 以此为ROCKs激酶在2型糖尿病患者糖尿病初诊后的治疗和病理生理变化提供初步的研究结果.
2型糖尿病患者33例, 依照世界卫生组织1999年诊断标准在四川大学华西医院内分泌代谢科和华中科技大学同济医学院附属同济医院内分泌科确诊, 其中男17例, 女16例, 平均年龄51.9岁±4.8岁, 体质量指数24.1 kg/m2±4.2 kg/m2.
正常对照组33名来自四川大学华西医院健康体检中心, 与2型糖尿病患者年龄、性别匹配, 其中男17名, 女16名, 年龄52.9岁±4.6岁, 体质量指数23.8 kg/m2±3.3 kg/m2. 选自无糖尿病、自身免疫性疾病及其相关家族史的体检志愿者. 75 g OGTT空服血糖<5.6 mmol/L, 糖负荷2 h血糖<7.8 mmol/L. 所有研究对象均知情同意.
淋巴细胞分离液、DTT和蛋白酶抑制剂购自Sigma-Aldrich公司; fasudil购自Asshi Chemical公司; M199培养基购自Life technology公司; phosphor-Thr853-MBS抗体、抗T-MBS抗体、抗Tubulin抗体、ROCK1和ROCK2抗体购自Cell Signaling公司; 三氯乙酸购自国药集团化学试剂北京有限公司.
1.2.1 标本收集: 收集符合入选条件的正常对照者和2型糖尿病患者外周血40-80 mL, 同时进行详尽的病史采集、体格检查、实验室检查. 使用淋巴细胞分离液, 其中加入10 nmol/L fasudil并按照Ficoll-Hypaque密度梯度离心法分离PBMC. 采用M199培养基重悬PBMC, 镜检后将细胞稀释至5×106个/mL. 配制固定液(50%三氯乙酸、50 mmol/L DTT和蛋白酶抑制剂)按比例加入细胞悬液分装冻存于超低温冰箱(-80 ℃)[6], 以备Western blot分析.
1.2.2 p-MBS/t-MBS和ROCK1/ROCK2检测: 如前所述进行Western blot分析, 使用phospho-Thr853-MBS抗体或抗-MBS抗体、ROCK1和ROCK2抗体[6]. NIH 3T3细胞裂解物用作阳性对照. Rho激酶活性表示为:
ROCK活性 = (Ap-MBS-样品/Ap-MBS-阳性对照)/(At-MBS-样品/At-MBS-阳性对照), 其中A为灰度扫描所得数值.
统计学处理 采用SPSS13.0分析, 数据以means±SE表示. 本研究所采用的统计方法: 两组数据之间的比较采用独立样本t检验. 通过Pearson相关分析ROCK激酶活性与HOMA-IR、HOMA-%B、HOMA-%S(反映胰岛素敏感性)之间的关系, P<0.05表示为统计学意义.
从表1可知, 与正常对照组相比, 2型糖尿病患者收缩压和舒张压水平则显著增高(P<0.001). 初诊2型糖尿病的患者HbA1c%、总胆固醇、LDL-C、甘油三酯、空服血糖、血浆胰岛素等水平显著高于正常健康志愿者(P<0.001, 表1); HDL-C水平则显著降低(P<0.001, 表1). 根据以上实验室指标计算胰岛功能相关指数, 入选的33名健康志愿者的HOMA-%B/HOMA-%S明显高于初诊的2型糖尿病患者, 而2型糖尿病患者的HOMA-IR指数则显著升高(P<0.001, 表1). 初诊为2型糖尿病的患者与正常对照志愿者相比, 年龄、体质量指数(body mass index, BMI)、腰围和腰臀比等指标均为无明显差异(P>0.05, 表1).
| 变量 | 健康人群 | 2型糖尿病患者 | P值 |
| 年龄(岁) | 52.9±4.6 | 51.9±4.8 | >0.05 |
| 质量指数(kg/m2) | 23.8±3.3 | 24.1±4.2 | >0.05 |
| 腰围(cm) | 81.2±8.1 | 82.3±8.7 | >0.05 |
| 腰臀比 | 0.88±0.07 | 0.88±0.08 | >0.05 |
| 收缩压(mmHg) | 125±15 | 130±12 | <0.001 |
| 舒张压(mmHg) | 79±5 | 83±7 | <0.001 |
| 糖化血红蛋白(%) | 5.5±0.3 | 7.3±0.5 | <0.001 |
| 总胆固醇(mmol/L) | 4.1±0.6 | 5.4±0.8 | <0.001 |
| 低密度脂蛋白-胆固醇(mmol/L) | 2.8±0.6 | 3.7±0.8 | <0.001 |
| 高密度脂蛋白-胆固醇(mmol/L) | 1.2±0.1 | 0.7±0.1 | <0.001 |
| 甘油三酯(mmol/L) | 1.1±0.2 | 1.7±0.3 | <0.001 |
| 空腹血糖(mmol/L) | 5.4±0.4 | 8.1±0.9 | <0.001 |
| 胰岛素(uIU/mL) | 13.3±1.5 | 23.6±2.1 | <0.001 |
| 胰岛素评价指数 | 2.4±1.1 | 4.3±1.5 | <0.001 |
| 胰岛素分泌指数 | 118.2±16.9 | 95.5±21.4 | <0.001 |
| 胰岛素敏感指数 | 65.9±7.7 | 40.2±11.9 | <0.001 |
与正常对照组ROCK活性(0.40±0.12)比较, 初诊2型糖尿病患者组外周单核细胞ROCK活性(0.63±0.15)显著升高(P<0.001, 图1), 而ROCK1与ROCK2蛋白表达水平两者无明显差异(P>0.05, 图1).
Pearson相关分析显示(图2), 2型糖尿病患者外周单核细胞ROCK活性与HOMA-IR呈正相关(r = 0.730, P<0.001), 与HOMA-%B、HOMA-%S呈负相关(r = 0.535, P<0.001; r = 0.268, P = 0.002).
我们发现初诊为2型糖尿病的患者外周单核细胞ROCK1与ROCK2蛋白表达水平并无明显差异, 依此推测, ROCKs激酶蛋白表达水平与糖尿病发生早期的胰岛功能的变化相关性不明显. 然而, ROCK活性改变则显著升高, 导致其相关信号通路变化, 从而引起胰岛素信号途径异常或诱发炎症等. 本研究也证实, ROCK活性与胰岛素抵抗指数明显呈正相关, 即胰岛素抵抗程度愈严重, ROCK活性则愈强, 两者间相互作用则进一步加重胰岛素抵抗, 导致糖尿病症状的加重. ROCKs活性的增加则可能抑制胰岛β细胞功能和/或导致肝脏、骨骼肌、脂肪组织、血管和心脏等对胰岛素的作用产生抵抗.
最近, Rho/Rho激酶信号通路吸引了大量的关注并因此开展了众多糖尿病并发症的相关研究[7]. 1型或2型糖尿病的动物模型与高浓度葡萄糖刺激体外培养细胞等均发ROCKs的活性和基因表达的上调[8-10]; 另一方面, Zucker肥胖型大鼠在口服ROCKs抑制剂盐酸法舒地尔后可以显著性抑制肌肉组织胰岛素受体底物-1丝氨酸磷酸化从而改善胰岛素抵抗[11]. 同样的研究证据亦显示糖尿病小鼠模型口服ROCKs抑制剂显著改善糖尿病所致的肾小球基底膜增厚和保护足细胞, 从而改善肾小球硬化和间质纤维化[12]. Chun等[13]的研究则提示健康人与肥胖人群肌肉ROCK1活性变化与大剂量胰岛素刺激呈正相关, 而2型糖尿病患者肌肉组织则恰好相反. 那么, 是否可以认为2型糖尿病影响了体内胰岛素对ROCKs相关激酶活性的调节, 导致ROCKs活性发生缺陷? 这可能需要我们进一步提供相关临床研究证据.
伴随对ROCKs的深入研究, 越来越多的研究者将重点从剖析ROCKs的生物学功能转向其作为临床治疗靶点、各类相关疾病生物标志物等方面.哈佛大学医学院James和Liao等发现ROCKs活性的变化可以用来判断动脉粥样硬化患者服用锐速伐他汀和阿托伐他汀的治疗效果[14]; Kikuchi等[15]则认为中性粒细胞ROCKs是作为诊断血管痉挛性心绞痛的实用型生物标志物.
总之, 我们认为通过检测外周单核细胞ROCKs活性变化可以来判断早期糖尿病治疗效果. 我们进一步发现ROCK活性变化同胰岛素抵抗指数HOMA-IR呈正相关、与胰岛素敏感指呈负相关, 那么是否可以对注射不同类型胰岛素或服用双胍类、磺脲类以及最近正在临床逐步使用的GLP-1、DPP-4抑制剂等糖尿病患者, 检测外周ROCK活性以判断该药物的使用情况和状态. 将该指标纳入会更加有利于专科医师为患者提供个体化治疗的方案. 我们相信ROCK作为重要的角色作为2型糖尿病的病理生理研究、诊断和治疗将愈加明显.
Rho相关激酶(Rho-associated kinases, ROCKs)常用于预测心血管疾病, 包括动脉粥样硬化和心肌缺血再灌注损伤. 现在的观点认为心血管疾病患者若合并糖尿病, 心血管事件的发生率显著性上升.
于珮, 主任医师, 天津医科大学代谢病医院; 傅志仁, 主任医师, 上海长征医院器官移植科
ROCKs活性的增加可能抑制胰岛β细胞功能和/或导致肝脏、骨骼肌、脂肪组织、血管和心脏等对胰岛素的作用产生抵抗. 然而, ROCKs在糖尿病临床诊断、治疗方面的研究较少, 是否可以作为诊断生物标志物或观察治疗效果的靶点尚不确定.
Soga等的研究提示不断累积心血管疾病的风险可能会增加ROCK活性、引起内皮功能障碍, 导致严重的心血管疾病进展和转归. 哈佛大学学者发现ROCKs活性的变化可以用来判断动脉粥样硬化患者服用锐速伐他汀和阿托伐他汀的治疗效果; 日本的研究小组则将ROCKs作为诊断血管痉挛性心绞痛的实用型生物标志物.
已有众多的基于糖尿病动物模型的研究报道, 但将ROCKs用于预测、判断和分析其与初诊2型糖尿病患者早期胰岛素抵抗、胰岛功能和胰岛素敏感等指标的临床小样本研究则相对较少. 本研究提示可进一步将其作为早期糖尿病诊断或相应治疗的生物标志物.
检测外周血ROCKs活性的技术方法相当简便、成熟; 若能将其运用在分析不同糖尿病治疗药物(例如: 各种类型胰岛素、磺脲类、双胍类和GLP-1等)效果方面前景相当广阔.
本文研究了2型糖尿病患者外周ROCK活性与胰岛素抵抗及胰岛细胞功能的关系,具有一定的新颖性及研究价值.
编辑: 田滢 电编:闫晋利
| 1. | Breitenlechner C, Gassel M, Engh R, Bossemeyer D. Structural insights into AGC kinase inhibition. Oncol Res. 2004;14:267-278. [PubMed] |
| 2. | Wettschureck N, Offermanns S. Rho/Rho-kinase mediated signaling in physiology and pathophysiology. J Mol Med (Berl). 2002;80:629-638. [PubMed] [DOI] |
| 3. | Shi J, Wei L. Rho kinase in the regulation of cell death and survival. Arch Immunol Ther Exp (Warsz). 2007;55:61-75. [PubMed] [DOI] |
| 4. | Liao JK, Seto M, Noma K. Rho kinase (ROCK) inhibitors. J Cardiovasc Pharmacol. 2007;50:17-24. [PubMed] [DOI] |
| 5. | Zhou H, Li YJ, Wang M, Zhang LH, Guo BY, Zhao ZS, Meng FL, Deng YG, Wang RY. Involvement of RhoA/ROCK in myocardial fibrosis in a rat model of type 2 diabetes. Acta Pharmacol Sin. 2011;32:999-1008. [PubMed] [DOI] |
| 6. | Nohria A, Grunert ME, Rikitake Y, Noma K, Prsic A, Ganz P, Liao JK, Creager MA. Rho kinase inhibition improves endothelial function in human subjects with coronary artery disease. Circ Res. 2006;99:1426-1432. [PubMed] [DOI] |
| 7. | Rajagopalan LE, Davies MS, Kahn LE, Kornmeier CM, Shimada H, Steiner TA, Zweifel BS, Wendling JM, Payne MA, Loeffler RF. Biochemical, cellular, and anti-inflammatory properties of a potent, selective, orally bioavailable benzamide inhibitor of Rho kinase activity. J Pharmacol Exp Ther. 2010;333:707-716. [PubMed] [DOI] |
| 8. | Didion SP, Lynch CM, Baumbach GL, Faraci FM. Impaired endothelium-dependent responses and enhanced influence of Rho-kinase in cerebral arterioles in type II diabetes. Stroke. 2005;36:342-347. [PubMed] [DOI] |
| 9. | Didion SP, Lynch CM, Faraci FM. Cerebral vascular dysfunction in TallyHo mice: a new model of Type II diabetes. Am J Physiol Heart Circ Physiol. 2007;292:H1579-H1583. [PubMed] [DOI] |
| 10. | Naik JS, Xiang L, Hester RL. Enhanced role for RhoA-associated kinase in adrenergic-mediated vasoconstriction in gracilis arteries from obese Zucker rats. Am J Physiol Regul Integr Comp Physiol. 2006;290:R154-R161. [PubMed] [DOI] |
| 11. | Kanda T, Wakino S, Homma K, Yoshioka K, Tatematsu S, Hasegawa K, Takamatsu I, Sugano N, Hayashi K, Saruta T. Rho-kinase as a molecular target for insulin resistance and hypertension. FASEB J. 2006;20:169-171. [PubMed] [DOI] |
| 12. | Komers R, Oyama TT, Beard DR, Tikellis C, Xu B, Lotspeich DF, Anderson S. Rho kinase inhibition protects kidneys from diabetic nephropathy without reducing blood pressure. Kidney Int. 2011;79:432-442. [PubMed] [DOI] |
| 13. | Chun KH, Choi KD, Lee DH, Jung Y, Henry RR, Ciaraldi TP, Kim YB. In vivo activation of ROCK1 by insulin is impaired in skeletal muscle of humans with type 2 diabetes. Am J Physiol Endocrinol Metab. 2011;300:E536-E542. [PubMed] [DOI] |
| 14. | Liu B, Cao HM, Li GY, Liu M, Feng J, Li J, Wang Q. Effects of rosuvastatin versus atorvastatin on rho-associated coiled-coil containing protein kinase activity and endothelial function in patients with atherosclerosis. J Int Med Res. 2011;39:2314-2322. [PubMed] |
| 15. | Kikuchi Y, Yasuda S, Aizawa K, Tsuburaya R, Ito Y, Takeda M, Nakayama M, Ito K, Takahashi J, Shimokawa H. Enhanced Rho-kinase activity in circulating neutrophils of patients with vasospastic angina: a possible biomarker for diagnosis and disease activity assessment. J Am Coll Cardiol. 2011;58:1231-1237. [PubMed] [DOI] |