修回日期: 2013-03-20
接受日期: 2013-03-29
在线出版日期: 2013-04-18
目的: 研究二十二碳六烯酸(docosahexaenoic acid, DHA)联合去甲斑蝥素体外抗胃癌细胞的作用.
方法: 以人胃癌细胞BGC-823为模型, 利用NADH酶染色、吖啶橙染色显微镜观察人胃癌细胞BGC-823经DHA联合去甲斑蝥素治疗前后的形态, 采用MTT法和流式细胞检测肿瘤细胞周期及凋亡情况.
结果: DHA联合去甲斑蝥素可显著降低肿瘤细胞存活率, NADH酶染色、吖啶橙染色可见细胞凋亡现象, 流式细胞检测Bcl-2基因蛋白表达明显下降, G0/G1细胞明显增加, G2/M和S期细胞明显减少.
结论: DHA联合去甲斑蝥素诱导人胃癌BGC-823细胞凋亡及抑制其增殖具有协同作用.
核心提示: DHA联合去甲斑蝥素(norcantharidin)诱导人胃癌BGC-823细胞凋亡及抑制其增殖具有协同作用.
引文著录: 王晨宇, 李猛, 王天阳, 闫启超, 康建省. DHA联合去甲斑蝥素对人胃癌细胞BGC-823增殖及凋亡的影响. 世界华人消化杂志 2013; 21(11): 1008-1013
Revised: March 20, 2013
Accepted: March 29, 2013
Published online: April 18, 2013
AIM: To investigate the synergistic effect of docosahexaenoic acid (DHA) and norcantharidin on cell growth and apoptosis in human gastric cancer cell line BGC-823 in vitro.
METHODS: BGC-823 cells were stained with NADH enzyme and acridine orange to observe their morphology under a microscope before and after treatment with DHA and norcantharidin. MTT assay and flow cytometry were used to measure cell proliferation and apoptosis, respectively.
RESULTS: Treatment with DHA and norcantharidin significantly reduced BGC-823 cell survival. After NADH enzyme and acridine orange staining, apoptotic cells were visible. Bcl-2 protein expression was significantly decreased. The percentage of cells at G2/M phase and S phase was significantly decreased, whereas that of cells at G0/G1 phase was increased.
CONCLUSION: Treatment with DHA and norcantharidin synergistically inhibits cell proliferation and promotes apoptosis in human gastric cancer cell line BGC-823.
- Citation: Wang CY, Li M, Wang TY, Yan QC, Kang JS. DHA combined with norcantharidin inhibits cell growth and promotes apoptosis in human gastric cancer cell line BGC-823. Shijie Huaren Xiaohua Zazhi 2013; 21(11): 1008-1013
- URL: https://www.wjgnet.com/1009-3079/full/v21/i11/1008.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i11.1008
二十二碳六烯酸(docosahexaenoic acid, DHA)是ω-3系多不饱和脂肪酸, 由于含有6个不饱和键的特有结构, 他对人类健康有特殊的作用和影响[1]. 去甲斑蝥素(norcantharidin, NCTD)是从斑蝥中提取后经人工合成的一种新型低毒抗肿瘤药物[2]. 本文研究联合应用DHA和去甲斑蝥素对肿瘤细胞的影响.
人胃癌BGC-823细胞株购自中国科学院上海生命科学研究所; DHA和去甲斑蝥素均购自SIGMA公司; DHA用无水乙醇溶解充氮气后-20 ℃避光保存; 去甲斑蝥素溶于二甲基亚砜(DMSO)-20 ℃保存; 四甲基偶氮唑蓝(MTT)购自BIOSHARP公司; 吖啶荧光染料购自罗莱宝科技有限公司; NADH酶染料据《临床肌肉病理学》配制; 小鼠抗人Bcl-2单克隆抗体为Santa Cruz公司产品; RPMI 1640培养基购自GIBCO公司, 用时加入10%小牛血清.
1.2.1 实验分组: 根据预实验和文献报道[3]用RPMI 1640培养基配置4组DHA, 终浓度分别为10、20、0、50 μg/mL, 空白组为等体积培养基, 对照组为不加处理的细胞, 用RPMI 1640培养基配置4组用DMSO溶解后的去甲斑蝥素, 终浓度为5、10、20、40 μg/mL得出各药的半对数抑制浓度(IC50)值, 选用均低于单药IC50值的DHA(30 μg/mL)联合去甲斑蝥素(5 μg/mL), 对照组加入含无水乙醇(<0.5%, V/V)和DMSO(<1%, V/V).
1.2.2 NADH酶染色: 将1×105个BGC-823细胞接种于含盖玻片的6孔板中, 使其爬行呈单层贴壁且处于对数生长期, 加药继续培养24 h, 取出盖玻片, 冰0.1 mol/L PBS溶液冲洗2遍, NADH酶孵育液置37 ℃水浴箱45 min, 树胶封片显微镜观察.
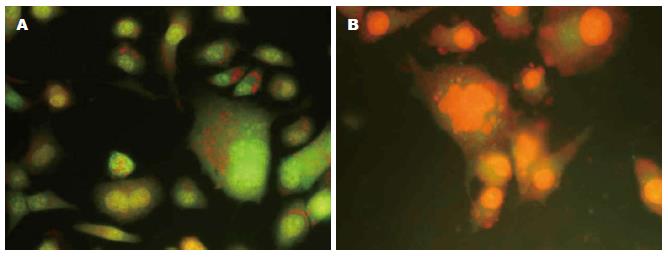
1.2.3 吖啶橙染色: 将1×105个BGC-823细胞接种于含盖玻片的6孔板中, 使其爬行呈单层贴壁且处于对数生长期, 加药24 h后取出盖玻片, 冰0.1 mol/L PBS溶液冲洗2遍, 95%乙醇溶液固定5 min, 滴加0.01%吖啶橙染液染色1 min, 荧光显微镜观察并拍照保存.
1.2.4 MTT实验: 将培养瓶中贴壁细胞用0.25%胰蛋白酶和0.02%EDTA混合液消化, 收集后用细胞计数板计数, 用1640培养液调整细胞浓度为1×105个/mL, 分装到96孔平底型培养板, 每孔加液量100 μL, 继续培养24 h, 使细胞呈单层贴壁且处于对数生长期. 根据实验分组设计加药, 继续培养24 h, 终止反应时每孔加浓度为2 mg/mL的MTT 10 μL, 继续培养4 h, 弃上清, 每孔加二甲基亚砜150 μL, 酶标仪振荡器摇振10 min以使甲瓒产物充分溶解. 波长490 nm条件下测定吸光度(A)值. 细胞抑制率 = (实验组A值/对照组A值)×100%.
1.2.5 流式细胞检测: 细胞样品制备: 收集24 h实验组细胞1×105个/mL, 以冰0.01%PBS洗涤细胞2次, 重悬于700 mL/L预冷乙醇固定[4], PI一步法染色, 流式细胞仪检测亚二倍体峰的比例并拟合细胞周期曲线. 蛋白含量以平均荧光强度表示, 平均荧光强度 = [lg(X-Mode)]×340.
统计学处理 所得数据用mean±SD表示, 采用SPSS16统计软件包行单因素方差分析. 在某些实验中采用双因素方差分析、Pearson相关分析, P<0.05表示有统计学意义.
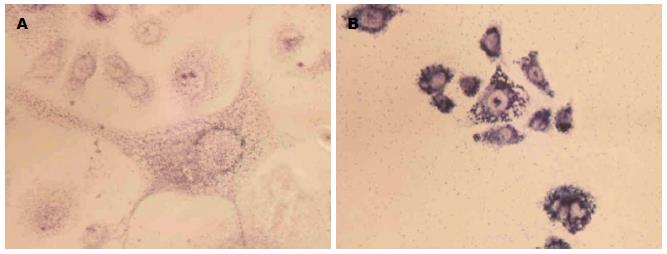
对照组细胞呈正常伸展状态(图1A), 染色颗粒均匀, 胞核规则圆形, 位于细胞中央, 核膜清楚. 经DHA联合NCTD治疗后, 可见细胞裂解, 胞核分裂、胞膜边界清的凋亡小体, 细胞体积缩小, 形态不一, 胞质颗粒深染, 密度增加. 核膜核仁破碎, 结构更加紧密, 细胞核固缩呈均一的颗粒物(图1B).
对照组细胞呈现典型的肿瘤细胞特征(图2A), 细胞大小不等, 细胞核呈规则的圆形, 位于细胞中央. 经DHA联合NCTD治疗后, 可见细胞胞体肿胀, 胞核变形, 呈肾形、马蹄形(凋亡小体形成和核破碎)(图2B).
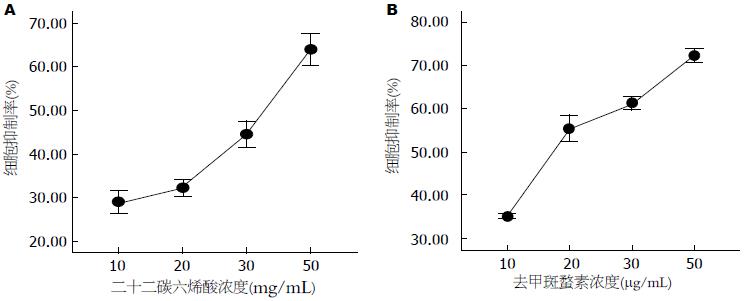
用MTT法分别测定DHA 4个浓度(10、20、30、50 mg/mL)和NCTD 4个浓度(5、10、20、40 μg/mL)对BGC-823细胞作用24 h后的抑制率(图3), DHA和NCTD均抑制细胞生长, 得出DHA和NCTD的IC50值分别为45.37 μg/mL和7.85 μg/mL, 联合用药组细胞生长抑制率较单药明显升高, 作用效果以公式联合指数(CI) = AB%/A%×B%计算, (CI = 1表示相加, <1表示协同, >1表示拮抗). 选用均低于单药IC50值的DHA(30 μg/mL)联合NCTD(5 μg/mL)对细胞抑制率的CI为0.187±0.052(P<0.01), 说明联合用药的效果是协同作用.
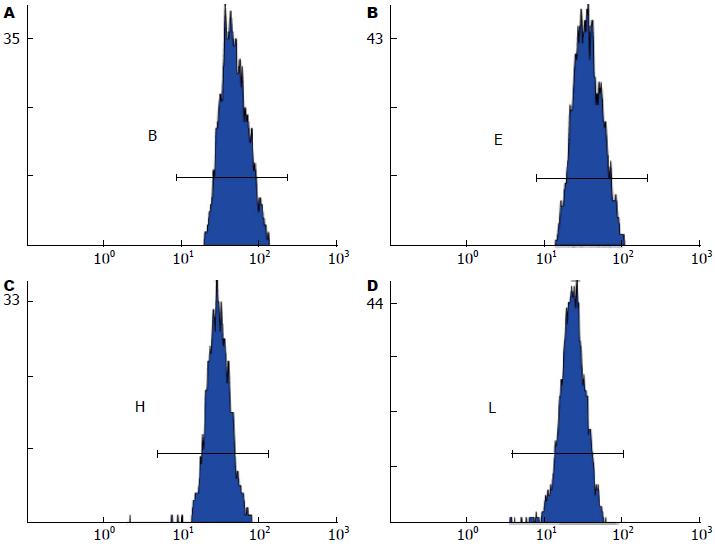
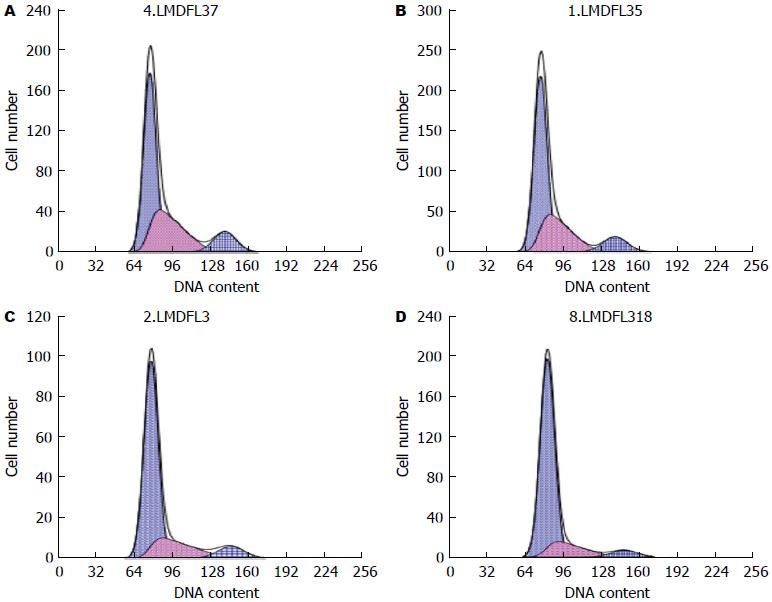
流式细胞检测Bcl-2基因蛋白表达明显下降(图4); DHA、NCTD以及DHA联合NCTD处理细胞后在G0/G1期出现明显的亚二倍体凋亡峰, 分别为5.3%、6.1%、14.1%, 同时3组的细胞凋亡率均高于对照组的细胞凋亡率(3.4%). 拟合细胞周期曲线, 对照组、DHA和NCTD的G0/Gl期比例分别为42.3%、53.9%和66.2%, S期的比例分别为55.9%、36.7%和32.5%, 而联合组的G0/Gl期上升至69.8%, S期则下降至27.8%(图5).
ω-3系多不饱和脂肪酸是人体必须从体外获得的脂肪酸, 包括3种: α-亚麻酸、DHA、二十碳五烯酸(EPA). 现研究表明他们可预防和治疗不同种类的癌症[5-7], 并显示出相同和不同的机制[8]. 然而DHA抗癌机制未完全阐明, 可能与肿瘤细胞膜脂质化、阻断肿瘤血管形成有关[9,10], 但大多数结果表明DHA具有最强抗肿瘤作用. DHA还在冠心病、动脉粥样硬化和2型糖尿病的发病机制中起重要作用. 肿瘤的发生、发展和形成, 取决于肿瘤细胞增生与细胞凋亡的相互作用. 因此, 通过药物治疗选择性的诱导肿瘤细胞凋亡, 可以改善肿瘤患者的预后. 随着人们对细胞凋亡的不断深入研究, 发现促进肿瘤细胞发生凋亡, 也是治疗肿瘤的一个有效途径. 胃癌作为一种临床常见的恶性肿瘤, 对传统化疗药物耐受性高, 化疗效果不理想. 这与其逃避化疗药物诱发的凋亡有很大关系. 所以, 寻求高效的促细胞凋亡药物或者增强传统化疗药物诱导凋亡活性的新药, 对解决目前胃癌治疗窘境有重要的临床意义. NCTD具有显著的抗癌作用, 同时具有上调白细胞、保护肝细胞、调节免疫功能等作用. 临床上主要用于胃癌、肝癌及乳腺癌等的治疗. 通过本文研究, DHA有助于增强经典抗癌药物的作用, 他通过简单相加或者共价结合等不同形式与具有明确抗癌效果的药物联合, 达到增强抗癌作用、降低药物毒性、解决耐药性的目的. 并且, DHA可改善化疗患者营养状况、食欲、生活质量和预防术后并发症的发生, 对化疗引起的周围神经病变、肌痛、脱发等也有缓解[11-13]. 联合化疗的优势: 一方面, 多种药物从不同通路、机制抑制肿瘤生长, 可以优势互补, 而且降低了肿瘤耐药的发生; 另一方面, 联合方案中, 各化疗药物的用药剂量可以适当减少, 对机体的非特异性毒性也相对降低. 从化疗药物问世的近50年中, 联合化疗一直是肿瘤化疗的主流. 已有临床研究显示: 在癌症患者中, 通过饮食或者药物的形式补充DHA可以改善生活质量、生化指标(血浆EPA、C-反应蛋白和胃蛋白酶原)及延长生存期[14,15]. 同时, DHA具有抗炎作用, 尤其是对幽门螺杆菌感染和炎症引起的胃炎效果较明显[16]. 因此, 化疗患者结合DHA营养支持治疗, 不仅可提高患者化疗效果, 还可提高患者耐受力, 作为一种新型治疗手段, 可能具有潜在的应用前景.
ω-3系多不饱和脂肪酸, 可预防和治疗不同种类的癌症, 并呈现相同或不同的作用机制. 然而二十二碳六烯酸(DHA)抗癌机制可能与肿瘤细胞膜脂质化、阻断肿瘤血管形成有关, 但大多数结果表明DHA具有较强的抗肿瘤作用.
唐世刚, 教授, 湖南省人民医院; 张志坚, 教授, 福州总医院消化内科
自1978年Dyerberg发表有关爱斯基摩人的流行病学新调查以来,对DHA的生理和药理作用的研究已取得显著成就,研究范围从基础研究、药理和临床研究, 逐步扩大到作为医药品、高级营养品的应用研究.
ω-3系多不饱和脂肪酸对人胃癌BGC-823细胞周期及凋亡的作用机制可能是ω-3系多不饱和脂肪酸改变了肿瘤细胞Bcl-2基因蛋白的表达和细胞周期.
本文利用NADH酶染色、吖啶橙染色显微镜观察人胃癌细胞BGC-823经DHA联合去甲斑蝥素治疗前后的形态, 采用MTT法和流式细胞检测肿瘤细胞周期及凋亡情况, 证明DHA联合去甲斑蝥素诱导人胃癌BGC-823细胞凋亡及抑制增殖具有协同作用.
本文化疗患者结合DHA营养支持治疗, 不仅可提高患者的化疗效果, 还可提高患者耐受力, DHA可改善化疗患者营养状况、食欲、生活质量和预防术后并发症的发生, 对化疗引起的周围神经病变、肌痛、脱发等不良反应也有缓解. 作为一种新型治疗手段, 具有潜在应用前景.
本文方法可靠、技术成熟,结果可信, 为临床胃癌的化疗提供了比较实用客观的实验数据, 有一定的实用价值.
编辑: 田滢 电编: 鲁亚静
| 1. | Simopoulos AP. Genetic variants in the metabolism of omega-6 and omega-3 fatty acids: their role in the determination of nutritional requirements and chronic disease risk. Exp Biol Med (Maywood). 2010;235:785-795. [PubMed] [DOI] |
| 2. | Li JL, Cai YC, Hu ZM, Gao JM. [Norcantharidin inhibits DNA replication initiation protein Cdc6 in cancer cells]. Nanfang Yike Daxue Xuebao. 2010;30:1851-1853. [PubMed] |
| 3. | 巩 涛, 李 勇, 郭 建文, 范 立桥, 赵 群, 王 力利, 宋 振川, 焦 志凯, 刘 羽. ω-3多不饱和脂肪酸对人胃癌BGC-823细胞周期及凋亡的影响. 中国临床营养杂志. 2006;14:77-81. |
| 5. | Mu D, Chen W, Yu B, Zhang C, Zhang Y, Qi H. Calcium and survivin are involved in the induction of apoptosis by dihydroartemisinin in human lung cancer SPC-A-1 cells. Methods Find Exp Clin Pharmacol. 2007;29:33-38. [PubMed] [DOI] |
| 6. | Heinze VM, Actis AB. Dietary conjugated linoleic acid and long-chain n-3 fatty acids in mammary and prostate cancer protection: a review. Int J Food Sci Nutr. 2012;63:66-78. [PubMed] [DOI] |
| 7. | Jiao Y, Ge CM, Meng QH, Cao JP, Tong J, Fan SJ. Dihydroartemisinin is an inhibitor of ovarian cancer cell growth. Acta Pharmacol Sin. 2007;28:1045-1056. [PubMed] [DOI] |
| 8. | Serini S, Fasano E, Piccioni E, Cittadini AR, Calviello G. Differential anti-cancer effects of purified EPA and DHA and possible mechanisms involved. Curr Med Chem. 2011;18:4065-4075. [PubMed] [DOI] |
| 9. | Chapkin RS, Seo J, McMurray DN, Lupton JR. Mechanisms by which docosahexaenoic acid and related fatty acids reduce colon cancer risk and inflammatory disorders of the intestine. Chem Phys Lipids. 2008;153:14-23. [PubMed] |
| 10. | Spencer L, Mann C, Metcalfe M, Webb M, Pollard C, Spencer D, Berry D, Steward W, Dennison A. The effect of omega-3 FAs on tumour angiogenesis and their therapeutic potential. Eur J Cancer. 2009;45:2077-2086. [PubMed] [DOI] |
| 11. | Bradley MO, Swindell CS, Anthony FH, Witman PA, Devanesan P, Webb NL, Baker SD, Wolff AC, Donehower RC. Tumor targeting by conjugation of DHA to paclitaxel. J Control Release. 2001;74:233-236. [PubMed] [DOI] |
| 12. | Biondo PD, Brindley DN, Sawyer MB, Field CJ. The potential for treatment with dietary long-chain polyunsaturated n-3 fatty acids during chemotherapy. J Nutr Biochem. 2008;19:787-796. [PubMed] [DOI] |
| 13. | Bougnoux P, Hajjaji N, Maheo K, Couet C, Chevalier S. Fatty acids and breast cancer: sensitization to treatments and prevention of metastatic re-growth. Prog Lipid Res. 2010;49:76-86. [PubMed] |
| 14. | Colomer R, Moreno-Nogueira JM, García-Luna PP, García-Peris P, García-de-Lorenzo A, Zarazaga A, Quecedo L, del Llano J, Usán L, Casimiro C. N-3 fatty acids, cancer and cachexia: a systematic review of the literature. Br J Nutr. 2007;97:823-831. [PubMed] [DOI] |
| 15. | Jones RJ, Hawkins RE, Eatock MM, Ferry DR, Eskens FA, Wilke H, Evans TR. A phase II open-label study of DHA-paclitaxel (Taxoprexin) by 2-h intravenous infusion in previously untreated patients with locally advanced or metastatic gastric or oesophageal adenocarcinoma. Cancer Chemother Pharmacol. 2008;61:435-441. [PubMed] |
| 16. | Kuriki K, Wakai K, Matsuo K, Hiraki A, Suzuki T, Yamamura Y, Yamao K, Nakamura T, Tatematsu M, Tajima K. Gastric cancer risk and erythrocyte composition of docosahexaenoic acid with anti-inflammatory effects. Cancer Epidemiol Biomarkers Prev. 2007;16:2406-2415. [PubMed] |