修回日期: 2013-02-16
接受日期: 2013-03-14
在线出版日期: 2013-04-08
中医学认为肺与肠具有生理上和病理上的密切相关性, 在肺与肠的疾病治疗中, 常常借助这种相关性而取得出人意料的临床疗效. 慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)和炎症性肠病(inflammatory bowel disease, IBD)是分别影响呼吸道和胃肠道黏膜组织的慢性炎症性疾病. 由于呼吸道和胃肠道系统的共同生理特性决定了慢性COPD和IBD在病理特征上有许多相似性, 表现为炎症的反复发作致组织损伤和重构, 使症状逐渐加重. 这两种疾病均无治愈方法并需要终身健康维护, 目前的治疗方法不是最理想的. 因此, 探讨慢性COPD和IBD病理过程的相关性研究有助于我们寻找这两类疾病的治疗的新途径.
核心提示: 本文从"肺与大肠相表里"的中医理论基础、西医理论基础、慢性阻塞性肺病(chronic obstructive pulmonary disease)和炎症性肠病(inflammatory bowel disease)病理串扰的机制分析等方面深入分析了"肺肠串扰"的中医、西医理论基础, 探讨了"肺肠串扰"的分子机制, 揭示了"肺与大肠相表里"的科学性, 对基础医学脏器关系的研究有新的提示.
引文著录: 刘元, 王新月. 从"肺与大肠相表里"理论谈COPD和IBD病理过程的肺肠串扰. 世界华人消化杂志 2013; 21(10): 886-893
Revised: February 16, 2013
Accepted: March 14, 2013
Published online: April 8, 2013
Traditional Chinese medicine theory believes that the lung and intestine are closely related physiologically and pathologically. With the help of this, unexpected clinical efficacy can be achieved in the treatment of lung and intestinal diseases. Chronic obstructive pulmonary disease (COPD) and inflammatory bowel disease (IBD) are chronic inflammatory diseases of mucosal tissues that affect the respiratory and gastrointestinal tracts, respectively. Both COPD and IBD are driven by recurrent cycles of inflammation that lead to tissue damage and remodeling and progressively worsen symptoms. There have been no cures for either disease and both require lifelong health maintenance. Exploration of the correlation in the pathological process between COPD and IBD will help us find new ways of treatment of these two diseases.
- Citation: Liu Y, Wang XY. Pulmonary-intestinal crosstalk in the pathological process of COPD and IBD: A perspective from the lung and the large intestine being interior-exteriorly related theory. Shijie Huaren Xiaohua Zazhi 2013; 21(10): 886-893
- URL: https://www.wjgnet.com/1009-3079/full/v21/i10/886.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i10.886
中医学认为肺与大肠之间的表里关系, 在肺与肠生理、病理等多方面相互影响, 互为补充, 形成了一种密不可分的依赖关系. 当前该理论一直有效地指导着临床实践, 在肺与肠的疾病治疗中, 常常借助这种相关性而取得出人意料的临床疗效. 慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)和炎症性肠病(inflammatory bowel disease, IBD)是分别影响呼吸道和胃肠道黏膜组织的慢性炎症性疾病. 由于呼吸道和胃肠道系统的共同生理特性决定了COPD和IBD在病理特征上有许多相似性, 表现为炎症的反复发作致组织损伤和重构, 使症状逐渐加重. 这两种疾病均无治愈方法并需要终身健康维护, 目前的治疗方法不是最理想的. 因此, 探讨COPD和IBD病理过程的相关性研究有助于我们寻找这两类疾病治疗的新途径.
中医学说认为, 人体是一整体, 皮肤、经络、脏腑、骨髓等存在着连接内外, 表里沟通的关系, 诊疗疾病中的"有诸内必形于外"即是这一思想的重要应用. 《灵枢•本输》曰: "肺合大肠", 也就是后世的"肺与大肠相表里", 意指肺与大肠相互关联, 相互影响, 从而维持人体正常生命和功能活动. 肺居于人体上焦, 为五脏六腑之华盖, 主宣发肃降; 大肠传导之官, 变化出焉, 其生理功能为传化糟粕、主津. 肺与大肠通过经脉的络属而构成表里相合关系. 生理上大肠以通为用, 肺气以降为和, 两者通降相互联系, 互为因果. 肺之肃降有助于大肠的传导, 大肠传导功能正常, 有助于肺气肃降. 《医经精义•脏腑之官》曰: "大肠之所以能传导者, 以其为肺之腑. 肺气下达, 故能传导". 病理上, 两者相互影响, 即肺病及肠, 肠病亦可及肺. 如《灵枢•四时气》曰: "腹中常鸣, 气上冲胸, 喘不能久立, 邪在大肠. "
中医学主要从功能角度认识人体, 其所说的脏腑主要指人体共同完成某类功能的器官或组织的集合体. 从当前的研究看, "肺"的定位主要与呼吸系统相关, "大肠"的定位主要与整个胃肠道相关. 只有明确了隶属中医概念的肺与大肠的定位, 下一步的研究才更有针对性和一致性.
一段时期以来, 国内不少学者在"肺与大肠相表里"理论指导下, 广泛开展了肺与大肠常见病的临床疗效观察研究, 如COPD和IBD, 对肺与大肠的难治性疾病通过辨证, 采用肺病治肠、肠病治肺或肺肠同治的中医治疗取得了满意的疗效, 证实了该理论在临床上具有重要的实用价值[1-4]. 国外医学界也认识到呼吸系统与消化系统之间的相关性, 为此开展了广泛而深入的研究[5].
呼吸道和胃肠道有许多组织结构上的相似性. 二者均有广泛的高度血管化的管腔表面积, 由选择性上皮屏障和覆盖其上的黏液层保护, 免于共生菌、病原体和外来抗原的侵袭. 这些上皮细胞表面覆盖了一层疏松结缔组织和黏膜相关淋巴组织构成的黏膜下层, 由常驻淋巴细胞组成. 这些淋巴组织调控抗原提呈、淋巴细胞转运和黏膜宿主防御. 呼吸道和胃肠道的上皮由原肠内胚层分化而成[6,7], 可能是二者在生理上相似的原因. 然而最有可能的是, 这些器官相似的炎症和免疫成分是造成呼吸系统和肠道黏膜疾病病理变化相似的原因.
COPD和IBD均是多因素疾病, 二者之间受很多共同危险因素影响, 如环境、遗传和微生物等. 此外, 这两种疾病在病理学上均表现出明确的免疫功能障碍.
COPD是以持续存在的气流受限和肺容积功能丧失为特征的一系列疾病的总称. 患者患有慢性支气管炎和肺气肿, 导致呼吸困难. 烟草烟雾等有害气体或颗粒的吸入造成了慢性炎症反应, 细菌或病毒感染引发的病情周期性恶化导致了这些症状的发生. 在西方国家, 吸烟是COPD发生的主要危险因素, 但是在其他国家或地区有害烟雾、空气污染和某些遗传因素也可增加COPD发病的危险性[8]. 近来研究表明, 儿童期严重的呼吸道感染也会导致COPD的发生[9,10]. 下呼吸道的菌落已被认为是COPD发病机制之一, 这与传统理解有所出入, 传统研究主要基于对健康肺的无菌环境的细胞培养, 对独立的细胞培养技术的微生物分析的进展表明健康肺是其自身微生物菌群的宿主, 但疾病时会发生显著变化[11,12]. 然而, 肺微生物菌群在COPD发病机制中的具体作用和感染导致的COPD恶化的具体机制却知之甚少.
IBD是一系列胃肠道炎症性疾病的总称, 溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD)是IBD最常见的两种形式, 均表现为每天过度排便、剧烈腹痛、腹泻、消瘦、营养不良和肠出血. 从生理上来说, UC和CD是截然不同的. UC是发生在结肠部位的连续浅表性溃疡, CD则是发生在消化道任何部位的透壁性散发病变. 肠道微生物菌群的变化与IBD的发病也存在一定的关系[13,14]. 微生物菌群失调导致了IBD的发生, 而慢性炎症又导致了微生物菌群多样性的丢失, 使疾病反复发作. 在COPD和IBD中肺与肠微生物的优势菌群发生了变化并使多样性减少, 但微生物数量并没有减少. 这些变化是炎症发生的原因还是结果尚不清楚, 但一个健康的微生物菌群在维持呼吸道和胃肠道健康方面起着重要作用. 借助粪便细菌疗法, 将一个已恢复健康的患者的微生物菌群移植到一个绞痛患者身上, 作为对UC的治疗方法已经在个案研究中显示出希望, 这表明微生物的构成在肠道炎症上发挥了重要作用, 健康微生物菌群的恢复可以促进病情的缓解[15,16].
上皮屏障功能正常是维持呼吸道和胃肠道黏膜健康状态的关键, 这是因为上皮屏障分隔了间质组织和黏膜腔中的抗原物质. 黏膜炎症的结果是屏障功能的丧失, 进而导致这些疾病转变为慢性. COPD患者易患支气管炎, 吸烟导致呼吸道上皮屏障损伤. Shaykhiev等[17]发现吸烟导致编码紧密连接蛋白和黏附蛋白的基因下调, 这在吸烟的COPD患者中尤为明显. 香烟提取物对支气管上皮细胞原代培养的体外实验表明内源性钙蛋白酶介导了紧密连接复合物的降解. IBD患者上皮通透性增加促进了慢性炎症的发生. Söderholm等[18]发现IBD患者的非炎症肠组织的上皮紧密连接更易被管腔抗原刺激破坏. 上皮的破坏导致细菌入侵感染, 经肠道微生物刺激患者体内产生较高浓度的IgG, 组织病理学结果显示紧密连接完整性的丧失. 以上研究提示上皮功能障碍是COPD和IBD的共有病理表现.
在COPD和IBD上继发性器官疾病的发生已被广泛认可, 越来越多的临床资料开始关注COPD的肠道表现和IBD的肺部炎症的发生率. 在流行病学方面, COPD和CD的发病率有很强的关联性, Ekbom等[19]以人群为基础做了群组研究, 结果发现COPD患者罹患CD的风险是健康对照组的2.72倍; 家族因素也是危险因素之一, 如COPD患者一级血亲罹患CD的风险明显增加, 可能与共同居住环境有关. COPD是CD患者死亡的一个重要因素, 可使CD人群的死亡率提高2.5-3.5倍. Kuzela等[20]证明CD和UC患者肺功能异常的发病率很高. Tzanakis等[21]也发现类似的结果, 并建议IBD患者进行包括体检、胸片和肺功能测试在内的肺评估. Black等[22]进行了文献调研, 确定了55篇文章列有IBD患者出现胸腔疾病, 其中大气道病变占39%. 随机抽取的3项研究发现IBD患者肺受累的发病率分别为44%[23]、48%[24]和50%[25], 表现为间质性肺疾病、肺泡淋巴细胞数量增加、肺弥散能力降低. 因此, 在炎症性疾病中, 呼吸道和胃肠道之间确实存在一定的关系, 这已在临床治疗中被验证, 但对所涉及的炎症串扰机制尚缺乏基础方面的研究.
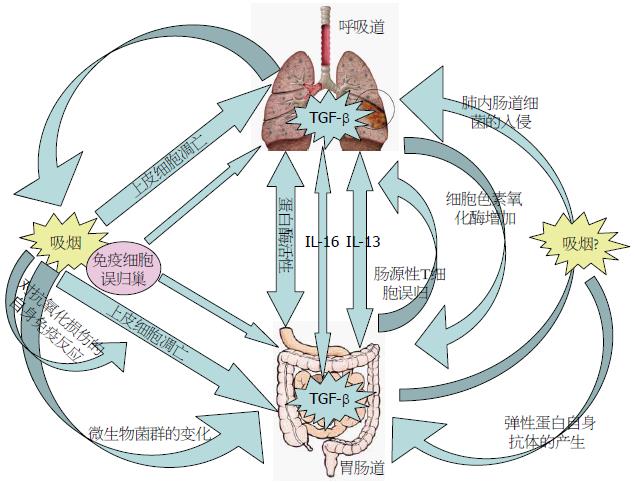
虽然呼吸道和胃肠道具有共同的生理特性, COPD和IBD具有共同的致病因素 以及COPD和IBD发病过程中炎性串扰病理学现象的发生, 但是尚缺乏任何机制来解释肺肠器官之间的串扰. 而参与串扰的途径是多方面的, 如呼吸道和胃肠道黏膜均属于公共黏膜免疫系统的一部分, 可能参与肺肠之间的串扰(图1).
模式识别受体是一类高度保守的由先天免疫细胞表达的蛋白质家族, 可以识别病原相关分子模式, 如微生物、细胞刺激信号和受损组织. 他们可能是膜或胞浆结合受体, 当被激活时产生和分泌炎症介质和信号分子. 其中, 胞浆内NOD样受体家族和细胞膜上的Toll样受体家族在黏膜炎症反应中发挥了重要作用[26].
COPD患者肺部感染的风险增加, 具体机制不清. Kinose等[27]最近发现COPD患者核苷酸结合寡聚化结构2(nucleotide-binding oligomerization domain containing 2, NOD2) rs1077861单核苷酸多态性(single-nucleotide polymorphism, SNP)可使患病率增加. NOD2识别胞壁酰二肽, 他是细菌胞壁的重要组成成分, SNP可致NOD2构象变化, 引起一系列下游反应, 导致核因子κB活化和炎症反应扩大. NOD2与CD也有密切关系. NOD2信号缺陷导致上皮屏障功能受损, 白介素(interleukin, IL)-1β增加, TLR2过度代偿, 血清IL-12增加[28,29]. 15%的CD患者出现NOD2突变. 虽然Kinose并没有检查COPD的TLR2或IL-12, 但IL-12在COPD患者和小鼠模型上已被证明与CD8+ T细胞毒性增加和自然杀伤细胞(natural killer cell, NKC)活化相关, 这是否与NOD2基因多态性有关需要进一步调查. 因此, NOD2可能是COPD和CD之间的共同连接点.
TLRs可识别病毒和细菌的蛋白质并维持黏膜的动态平衡, COPD和IBD患者存在TLRs的基因变异. 感染是COPD发病的主要原因, COPD患者TLRs降低了肺泡巨噬细胞对脂多糖(lipopolysaccharide, LPS)的表达和反应[30], 这表明COPD患者黏膜内源性反应是有缺陷的. COPD患者与健康对照组相比TLR2上调外周血单核细胞, 表明这些患者有全身炎症. TLR4能识别LPS, 促进COPD发病. TLR2和TLR4在小儿IBD患者的结肠黏膜表达. Cantó等[31]确定外周血单核细胞TLR2表达增加, 这与活动期的UC和CD中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)浓度增高相关, 这表明全身炎症反应可能参与IBD发病. TLR4的D299G和T399I SNPs已被证明与UC和CD相关[32], 而T399I也已确定在COPD患者上表达, 这可能是COPD和IBD的共同连接点. 炎性细胞因子信号使TLR4在UC和CD患者肠上皮和固有层的巨噬细胞上的表达增加, 对LPS的反应增加. 因此, TLR4可能在黏膜炎性疾病上发挥了一个共同作用, 如炎性入侵和TLR4基因变异可导致肺和肠的过度免疫反应.
COPD和IBD均属于全身炎症性疾病, 外周血淋巴细胞活性可以诱导发病. 呼吸道和胃肠道黏膜都是公共黏膜免疫系统的一部分, 当一处黏膜发生炎症反应时, 可以通过黏膜免疫归巢迁移的途径影响传变到另一处. 肠道相关淋巴组织与支气管相关淋巴组织和其他部位黏膜的淋巴组织一起, 形成一个相对独立的免疫应答网络, 共同调节人体黏膜的免疫应答. 现代研究发现, 肺与大肠之所以相互联系, 主要通过黏膜免疫细胞的迁移而使消化道和呼吸道黏膜相互联系而实现的, 这使肺与大肠通过免疫途径生理上相互联系, 病理上彼此传变[33].
在健康状态下, 淋巴细胞通过循环系统不断迁移, 进入和退出抗原暴露的组织. 为了控制淋巴细胞转运至组织, 这些细胞表达特有的归巢受体, 在免疫反应过程中, 通过归巢分子与特异性受体-配体的结合, 淋巴细胞将返回其来源组织. 虽然在COPD体内循环的淋巴细胞的亚型和表型还没有被阐明, 但是有证据表明外周淋巴细胞功能异常可能导致COPD患者肺外疾病的发生. Sauleda等[34]发现外周血淋巴细胞的细胞色素氧化酶(cytochrome oxidase, CytOx)活性的增加与COPD的发病相关. 有趣的是, 在其他慢性炎性疾病中也观察到外周血中淋巴细胞的氧化反应增强, 如哮喘和风湿性关节炎.
对于IBD患者来说, 淋巴细胞-内皮细胞之间相互作用的选择性丧失. Salmi等[35]发现IBD患者肠道淋巴细胞归巢受体的表达并没有显示出组织特异性, 这种非特异归巢可能是IBD肠外疾病形成的原因. 据了解, 肠源性淋巴细胞具有结合滑膜和肝组织的能力, 这可以解释在IBD发病时这些器官也发生病变. IBD患者的支气管肺泡灌洗结果显示淋巴细胞数量增加, 痰的分析表明65%患者CD4+/CD8+ T细胞在肺组织中的比值增加[36], 这是否例证了淋巴细胞误归巢参与了IBD的肺表现需要被进一步确认. 最近的研究发现, UC患者人类原肌球蛋白亚型(human tropomyosin, hTM1-5)能够诱导自身抗体和T细胞反应[37], 解释了在炎性疾病中器官之间串扰的可能原因.
TNF-α与COPD并发症的发生密切相关, 也是CD病程进展的关键. TNF△ARE小鼠模型是一种过表达TNF-α的转基因小鼠模型, 表现为同时发生的克罗恩样回肠炎和近结肠炎[38]. 在此模型上已观察到眼和关节的受累, 但并没有累及到呼吸系统. 因此, 作为IBD并发症的肺表现, 呼吸道的累及可能需要亚临床、病理组织学和肺功能的进一步检测.
IL-6在炎症的急性期发挥了重要作用, 与COPD和IBD的发病相关. 肺气肿患者IL-6表达水平在整体上提高, 可与作为T辅助细胞的Th17亚群产生的转化生长因子β(transforming growth factor-β, TGF-β)结合[39]. Th17细胞是T细胞亚群的效应子, 可分泌IL-17A、IL-17F、IL-21、IL-22、IL-26、TNF-α, 促进中性粒细胞趋化. 最近的工作已经确定COPD患者外周血Th17细胞增加. IL-6和Th17细胞也与CD和UC相关. 在IBD患者的炎症及非炎症黏膜和血液中发现与IL-6和Th17相关的细胞因子有高水平表达, 在动物模型上阻断IL-6通路有一定的治疗作用. 事实上IL-6在IBD患者非炎症肠黏膜的升高但未造成组织损伤, 这提示可能是继发组织侵袭. 由于TGF-β调节黏膜组织重构并与COPD和IBD密切相关, 可以想象的是全身IL-6的增加, 加上黏膜表面的TGF-β产生, 可能诱导继发器官T细胞向Th17细胞分化而发生炎症反应.
IL-13可能促进COPD的发展, 其启动子的基因突变可能促进这一疾病的发生. T细胞受体-NK细胞或DCs被呼吸道的细菌或病毒感染所活化, 分泌IL-13激活巨噬细胞, 反过来又导致IL-13的产生, 使信号转导和转录激活因子(signal-transducer and activator of transcription, STAT)6依赖的杯状细胞增生、平滑肌过度反应及气道重构. IL-13也参与了UC的发病, 微生物刺激了异常免疫反应, 导致肠上皮NK细胞的直接细胞不良反应, 分泌IL-13导致上皮屏障功能障碍, 增强了NK细胞的细胞不良反应. STAT6介导了上皮细胞IL-13的作用, 对COPD和UC来说STAT6通路是潜在的治疗靶点[40]. 此通路是否在COPD和IBD的作用是全身性的尚不可知, 但在COPD上血清IL-13含量增加, 可能驱动了NK细胞不良反应和巨噬细胞对各器官的异常反应.
目前为止, COPD已被确定有4个遗传危险因素. α1-抗胰蛋白酶(α1 anti-trypsin, A1AT)是一种血清胰蛋白酶抑制剂, 可以保护呼吸道免于被蛋白酶重构, 他的缺乏解释了2%的COPD患病的原因[41]. α-烟碱乙酰胆碱受体(α-nicotinic acetylcholine receptor, CHRNA3/5)[42], 音猬因子相互作用蛋白(hedgehog-interacting protein, HHIP)[43]和铁调节蛋白-2(iron-regulatory protein 2, IREB2)[44]基因已被证明是COPD潜在的易感基因位点. IBD亦有已知的遗传危险因素. NOD2[29]、自噬相关蛋白16-1(autophagy-related protein 16-1, ATG16L1)[45]、白介素23受体(interleukin-23 receptor, IL23R)[46]和免疫相关的鸟嘌呤核苷-5'-三磷酸酯酶家族M蛋白[47]的基因突变大大提高了CD的患病风险. 最近的一项研究也发现COPD患者的NOD2突变, 这可能是COPD和CD之间的关联点. 编码蛋白质的这些基因控制了肠黏膜感染和自噬, 细菌清除缺陷可能是触发CD发病的关键之一. 人类白细胞抗原类基因多态性也与UC密切相关, 表明淋巴细胞的调节是UC发病的重要因素之一. 近来遗传与UC关系的研究已取得实质性进展, 已确定新的易感基因位点有层粘连蛋白亚基β-1[48]、细胞外基质蛋白1(extracellular matrix protein 1, ECM1)[49]、肝细胞核因子4-α[48]、钙黏着蛋白-1(cadherin-1, CDH1)和CDH3[48]. 这些基因参与并维持上皮屏障的完整性, 表明上皮屏障功能障碍易患UC.
这些遗传危险因素也可能是COPD和IBD发生关联的原因. 如HHIP参与肠隐窝轴的发育, 因此需要确定该基因是否参与了COPD和IBD的共同发病. COPD和IBD的基因易感位点的多样性表明这些疾病的易感性可能涉及多个基因或等位基因, 在环境因素的诱导下导致了一些个体疾病的发生.
蛋白酶活性的失调可能在COPD和IBD发病中发挥了作用. 在COPD患者和动物模型上已被证明升高的蛋白酶水平可破坏结缔组织成分, 尤其是基质金属蛋白酶(matrix metalloproteinase, MMP)家族可降解胶原蛋白、弹性蛋白、纤维连接蛋白、明胶等维持黏膜结构完整性的重要成分. 上皮细胞和白细胞上MMP-2、MMP-9和MMP-12高水平表达与COPD和IBD的发病相关, 导致"失控重构"的发生. A1AT在COPD上的作用已被确定, 但其参与IBD的发病有待进一步确定. A1AT中和蛋白酶, 如中性粒细胞弹性蛋白酶和MMP-12, 并参与组织重构[50]. 在黏膜炎症期间, A1AT产生不足, 在组织重构过程未被遏制的情况下导致广泛组织损伤. A1AT的缺乏导致肺气肿和COPD病情发展. 由于其在发炎组织重构中的作用, 粪便A1AT水平作为CD患者疾病严重程度的指标之一. 虽然一些研究表明UC患者体内高表达A1AT, 但是与A1AT缺陷相关的等位基因的高患病率以及带有这种等位基因的UC患者结肠炎发展为更严重的形式, 这需要进一步工作来解决分歧.
COPD和IBD患者的器官外炎症反应被这两种疾病复杂病因所混淆, 他们均受环境刺激产生相似的免疫和病理反应. "肺与大肠相表里"是中医学脏腑相关理论的重要内容之一, 近年来国内不少学者从肺肠相关角度开展了肺与大肠常见病的临床疗效观察, 对肺与大肠的难治性疾病通过辨证, 采用肺病治肠、肠病治肺或肺肠同治的中医治疗, 取得了满意的疗效, 一方面证实了该理论在临床上具有重要的实用价值, 验证了"肺与大肠相表里"的科学性; 另一方面提示我们属于不同系统的相同胚层来源的脏器组织具有在病理上的相互感应, 这种关系具有相对特异性, 不仅给了基础医学脏器关系的研究新的提示, 也为临床复杂疾病特别是多系统损害病理转变提供了一个新的治疗思路.
中医学认为肺与肠具有生理上和病理上的密切相关性, 在肺与肠的疾病治疗中, 常常借助这种相关性而取得出人意料的临床疗效.
范恒, 教授, 主任医师, 华中科技大学同济医学院附属协和医院中西医结合科; 王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
本文通过提出"肺肠串扰"的概念, 并对其分子机制进行深入的探讨, 对肺与肠的难治性疾病提供新的治疗途径, 也为临床复杂疾病特别是多系统损害病理转变提供了一个新的治疗思路.
近年来国内不少学者从肺肠相关角度开展了肺与大肠常见病的临床疗效观察, 对肺与大肠的难治性疾病通过辨证, 采用肺病治肠、肠病治肺或肺肠同治的中医治疗, 取得了满意的疗效.
本文针对COPD和IBD在病理过程的相关性提出"肺肠串扰"的概念, 并提出肺肠器官之间病理串扰的可能机制, 具有重要的临床指导意义.
本文探讨COPD和IBD病理过程的相关性, 有助于寻找这两类疾病治疗的新途径.
COPD: 以持续存在的气流受限和肺容积功能丧失为特征的一系列疾病的总称.
本文对COPD和IBD炎症串扰的机制进行总结, 具有较高的理论创新性.
编辑: 田滢 电编:闫晋利
| 1. | 李 宇航, 钟 相根, 贾 旭, 孙 燕, 郑 丰杰, 王 蔚, 周 晓卫, 祝 小惠, 田 彦, 刘 晓辉. "通利大肠"对慢性阻塞性肺疾病模型大鼠氧化应激的影响. 中华中医药杂志. 2010;25:1196-1198. |
| 2. | 杨 雪, 王 新月, 朱 立, 景 姗, 周 波, 杨 舒. 从肺论治法对溃疡性结肠炎大鼠结肠组织VIP水平的影响及意义. 中国中医基础医学杂志. 2011;17:282-283. |
| 5. | Keely S, Talley NJ, Hansbro PM. Pulmonary-intestinal cross-talk in mucosal inflammatory disease. Mucosal Immunol. 2012;5:7-18. [PubMed] [DOI] |
| 6. | Ramalho-Santos M, Melton DA, McMahon AP. Hedgehog signals regulate multiple aspects of gastrointestinal development. Development. 2000;127:2763-2772. [PubMed] |
| 7. | Shu W, Lu MM, Zhang Y, Tucker PW, Zhou D, Morrisey EE. Foxp2 and Foxp1 cooperatively regulate lung and esophagus development. Development. 2007;134:1991-2000. [PubMed] [DOI] |
| 8. | Yang IV, Schwartz DA. Epigenetic control of gene expression in the lung. Am J Respir Crit Care Med. 2011;183:1295-1301. [PubMed] [DOI] |
| 9. | Horvat JC, Starkey MR, Kim RY, Phipps S, Gibson PG, Beagley KW, Foster PS, Hansbro PM. Early-life chlamydial lung infection enhances allergic airways disease through age-dependent differences in immunopathology. J Allergy Clin Immunol. 2010;125:617-625, 625. e1-e6. [PubMed] |
| 10. | O'Reilly M, Hooper SB, Allison BJ, Flecknoe SJ, Snibson K, Harding R, Sozo F. Persistent bronchiolar remodeling following brief ventilation of the very immature ovine lung. Am J Physiol Lung Cell Mol Physiol. 2009;297:L992-L1001. [PubMed] [DOI] |
| 11. | Harris JK, De Groote MA, Sagel SD, Zemanick ET, Kapsner R, Penvari C, Kaess H, Deterding RR, Accurso FJ, Pace NR. Molecular identification of bacteria in bronchoalveolar lavage fluid from children with cystic fibrosis. Proc Natl Acad Sci U S A. 2007;104:20529-20533. [PubMed] [DOI] |
| 12. | Huang YJ, Kim E, Cox MJ, Brodie EL, Brown R, Wiener-Kronish JP, Lynch SV. A persistent and diverse airway microbiota present during chronic obstructive pulmonary disease exacerbations. OMICS. 2010;14:9-59. [PubMed] [DOI] |
| 13. | Frank DN, Robertson CE, Hamm CM, Kpadeh Z, Zhang T, Chen H, Zhu W, Sartor RB, Boedeker EC, Harpaz N. Disease phenotype and genotype are associated with shifts in intestinal-associated microbiota in inflammatory bowel diseases. Inflamm Bowel Dis. 2011;17:179-184. [PubMed] [DOI] |
| 14. | Sartor RB. Genetics and environmental interactions shape the intestinal microbiome to promote inflammatory bowel disease versus mucosal homeostasis. Gastroenterology. 2010;139:1816-1819. [PubMed] [DOI] |
| 15. | Borody TJ, Warren EF, Leis SM, Surace R, Ashman O, Siarakas S. Bacteriotherapy using fecal flora: toying with human motions. J Clin Gastroenterol. 2004;38:475-483. [PubMed] [DOI] |
| 16. | Grehan MJ, Borody TJ, Leis SM, Campbell J, Mitchell H, Wettstein A. Durable alteration of the colonic microbiota by the administration of donor fecal flora. J Clin Gastroenterol. 2010;44:551-561. [PubMed] [DOI] |
| 17. | Shaykhiev R, Otaki F, Bonsu P, Dang DT, Teater M, Strulovici-Barel Y, Salit J, Harvey BG, Crystal RG. Cigarette smoking reprograms apical junctional complex molecular architecture in the human airway epithelium in vivo. Cell Mol Life Sci. 2011;68:877-892. [PubMed] [DOI] |
| 18. | Söderholm JD, Olaison G, Peterson KH, Franzén LE, Lindmark T, Wirén M, Tagesson C, Sjödahl R. Augmented increase in tight junction permeability by luminal stimuli in the non-inflamed ileum of Crohn's disease. Gut. 2002;50:307-313. [PubMed] [DOI] |
| 19. | Ekbom A, Brandt L, Granath F, Löfdahl CG, Egesten A. Increased risk of both ulcerative colitis and Crohn's disease in a population suffering from COPD. Lung. 2008;186:167-172. [PubMed] [DOI] |
| 20. | Kuzela L, Vavrecka A, Prikazska M, Drugda B, Hronec J, Senkova A, Drugdova M, Oltman M, Novotna T, Brezina M. Pulmonary complications in patients with inflammatory bowel disease. Hepatogastroenterology. 1999;46:1714-1719. [PubMed] |
| 21. | Tzanakis NE, Tsiligianni IG, Siafakas NM. Pulmonary involvement and allergic disorders in inflammatory bowel disease. World J Gastroenterol. 2010;16:299-305. [PubMed] [DOI] |
| 22. | Black H, Mendoza M, Murin S. Thoracic manifestations of inflammatory bowel disease. Chest. 2007;131:524-532. [PubMed] [DOI] |
| 23. | Songür N, Songür Y, Tüzün M, Doğan I, Tüzün D, Ensari A, Hekimoglu B. Pulmonary function tests and high-resolution CT in the detection of pulmonary involvement in inflammatory bowel disease. J Clin Gastroenterol. 2003;37:292-298. [PubMed] [DOI] |
| 24. | Douglas JG, McDonald CF, Leslie MJ, Gillon J, Crompton GK, McHardy GJ. Respiratory impairment in inflammatory bowel disease: does it vary with disease activity? Respir Med. 1989;83:389-394. [PubMed] [DOI] |
| 25. | Ceyhan BB, Karakurt S, Cevik H, Sungur M. Bronchial hyperreactivity and allergic status in inflammatory bowel disease. Respiration. 2003;70:60-66. [PubMed] [DOI] |
| 26. | Bauer S, Müller T, Hamm S. Pattern recognition by Toll-like receptors. Adv Exp Med Biol. 2009;653:15-34. [PubMed] [DOI] |
| 27. | Kinose D, Ogawa E, Hirota T, Ito I, Kudo M, Haruna A, Marumo S, Hoshino Y, Muro S, Hirai T. A NOD2 gene polymorphism is associated with the prevalence and severity of chronic obstructive pulmonary disease in a Japanese population. Respirology. 2012;17:164-171. [PubMed] [DOI] |
| 28. | Eckmann L, Karin M. NOD2 and Crohn's disease: loss or gain of function? Immunity. 2005;22:661-667. [PubMed] [DOI] |
| 29. | Strober W, Kitani A, Fuss I, Asano N, Watanabe T. The molecular basis of NOD2 susceptibility mutations in Crohn's disease. Mucosal Immunol. 2008;1 Suppl 1:S5-S9. [PubMed] [DOI] |
| 30. | Droemann D, Goldmann T, Tiedje T, Zabel P, Dalhoff K, Schaaf B. Toll-like receptor 2 expression is decreased on alveolar macrophages in cigarette smokers and COPD patients. Respir Res. 2005;6:68. [PubMed] [DOI] |
| 31. | Cantó E, Ricart E, Monfort D, González-Juan D, Balanzó J, Rodríguez-Sánchez JL, Vidal S. TNF alpha production to TLR2 ligands in active IBD patients. Clin Immunol. 2006;119:156-165. [PubMed] [DOI] |
| 32. | Shen X, Shi R, Zhang H, Li K, Zhao Y, Zhang R. The Toll-like receptor 4 D299G and T399I polymorphisms are associated with Crohn's disease and ulcerative colitis: a meta-analysis. Digestion. 2010;81:69-77. [PubMed] [DOI] |
| 33. | Rothfuss KS, Stange EF, Herrlinger KR. Extraintestinal manifestations and complications in inflammatory bowel diseases. World J Gastroenterol. 2006;12:4819-4831. [PubMed] |
| 34. | Sauleda J, García-Palmer FJ, González G, Palou A, Agustí AG. The activity of cytochrome oxidase is increased in circulating lymphocytes of patients with chronic obstructive pulmonary disease, asthma, and chronic arthritis. Am J Respir Crit Care Med. 2000;161:32-35. [PubMed] |
| 35. | Salmi M, Granfors K, MacDermott R, Jalkanen S. Aberrant binding of lamina propria lymphocytes to vascular endothelium in inflammatory bowel diseases. Gastroenterology. 1994;106:596-605. [PubMed] |
| 36. | Fireman Z, Osipov A, Kivity S, Kopelman Y, Sternberg A, Lazarov E, Fireman E. The use of induced sputum in the assessment of pulmonary involvement in Crohn's disease. Am J Gastroenterol. 2000;95:730-734. [PubMed] [DOI] |
| 37. | Mirza ZK, Sastri B, Lin JJ, Amenta PS, Das KM. Autoimmunity against human tropomyosin isoforms in ulcerative colitis: localization of specific human tropomyosin isoforms in the intestine and extraintestinal organs. Inflamm Bowel Dis. 2006;12:1036-1043. [PubMed] [DOI] |
| 38. | Pizarro TT, Arseneau KO, Cominelli F. Lessons from genetically engineered animal models XI. Novel mouse models to study pathogenic mechanisms of Crohn's disease. Am J Physiol Gastrointest Liver Physiol. 2000;278:G665-G669. [PubMed] |
| 39. | Vargas-Rojas MI, Ramírez-Venegas A, Limón-Camacho L, Ochoa L, Hernández-Zenteno R, Sansores RH. Increase of Th17 cells in peripheral blood of patients with chronic obstructive pulmonary disease. Respir Med. 2011;105:1648-1654. [PubMed] [DOI] |
| 40. | Rosen MJ, Frey MR, Washington MK, Chaturvedi R, Kuhnhein LA, Matta P, Revetta FL, Wilson KT, Polk DB. STAT6 activation in ulcerative colitis: a new target for prevention of IL-13-induced colon epithelial cell dysfunction. Inflamm Bowel Dis. 2011;17:2224-2234. [PubMed] [DOI] |
| 41. | de Serres FJ, Blanco I, Fernández-Bustillo E. Estimating the risk for alpha-1 antitrypsin deficiency among COPD patients: evidence supporting targeted screening. COPD. 2006;3:133-139. [PubMed] [DOI] |
| 42. | Pillai SG, Ge D, Zhu G, Kong X, Shianna KV, Need AC, Feng S, Hersh CP, Bakke P, Gulsvik A. A genome-wide association study in chronic obstructive pulmonary disease (COPD): identification of two major susceptibility loci. PLoS Genet. 2009;5:e1000421. [PubMed] [DOI] |
| 43. | Van Durme YM, Eijgelsheim M, Joos GF, Hofman A, Uitterlinden AG, Brusselle GG, Stricker BH. Hedgehog-interacting protein is a COPD susceptibility gene: the Rotterdam Study. Eur Respir J. 2010;36:89-95. [PubMed] [DOI] |
| 44. | Chappell SL, Daly L, Lotya J, Alsaegh A, Guetta-Baranes T, Roca J, Rabinovich R, Morgan K, Millar AB, Donnelly SC. The role of IREB2 and transforming growth factor beta-1 genetic variants in COPD: a replication case-control study. BMC Med Genet. 2011;12:24. [PubMed] [DOI] |
| 45. | Prescott NJ, Fisher SA, Franke A, Hampe J, Onnie CM, Soars D, Bagnall R, Mirza MM, Sanderson J, Forbes A. A nonsynonymous SNP in ATG16L1 predisposes to ileal Crohn's disease and is independent of CARD15 and IBD5. Gastroenterology. 2007;132:1665-1671. [PubMed] [DOI] |
| 46. | Yano T, Kurata S. An unexpected twist for autophagy in Crohn's disease. Nat Immunol. 2009;10:134-136. [PubMed] [DOI] |
| 47. | Parkes M, Barrett JC, Prescott NJ, Tremelling M, Anderson CA, Fisher SA, Roberts RG, Nimmo ER, Cummings FR, Soars D. Sequence variants in the autophagy gene IRGM and multiple other replicating loci contribute to Crohn's disease susceptibility. Nat Genet. 2007;39:830-832. [PubMed] [DOI] |
| 48. | Barrett JC, Lee JC, Lees CW, Prescott NJ, Anderson CA, Phillips A, Wesley E, Parnell K, Zhang H, Drummond H. Genome-wide association study of ulcerative colitis identifies three new susceptibility loci, including the HNF4A region. Nat Genet. 2009;41:1330-1334. [PubMed] [DOI] |
| 49. | Fisher SA, Tremelling M, Anderson CA, Gwilliam R, Bumpstead S, Prescott NJ, Nimmo ER, Massey D, Berzuini C, Johnson C. Genetic determinants of ulcerative colitis include the ECM1 locus and five loci implicated in Crohn's disease. Nat Genet. 2008;40:710-712. [PubMed] [DOI] |
| 50. | Churg A, Wang X, Wang RD, Meixner SC, Pryzdial EL, Wright JL. Alpha1-antitrypsin suppresses TNF-alpha and MMP-12 production by cigarette smoke-stimulated macrophages. Am J Respir Cell Mol Biol. 2007;37:144-151. [PubMed] [DOI] |