修回日期: 2013-01-04
接受日期: 2013-01-05
在线出版日期: 2013-04-08
目的: 探讨瞬时受体电位通道(transient receptor potential channels, TRPC)和胆碱能毒蕈碱受体(muscarinic acetylcholine receptors, CHRM)在人类胃肠道间质瘤(gastrointestinal stromal tumor, GIST)中的表达及相关性.
方法: 以免疫组织化学的方法检测TRPC及CHRM在GIST肿瘤细胞中的表达及相关性分析.
结果: 人类GIST细胞中存在TRPC1、TRPC3、CHRM2、CHRM3的表达, 阳性率分别为57.5%、47.5%、22.5%、55.0%, 且随着GIST生物学行为恶性潜能分级的增高其表达水平分别下降.
结论: 本研究证明人类GIST细胞中存在TRPC和CHRM的表达, 为GIST起源于Cajal间质细胞(interstitial cells of Cajal, ICC)提供了新的证据, 为GIST是否保留了部分ICC的胃肠起搏和介导神经递质传递功能奠定了基础.
核心提示: 本研究首次探讨了人类胃肠道间质瘤(gastrointestinal stromal tumor, GIST)中瞬时受体电位通道和胆碱能毒蕈碱受体表达的相关性. 不仅为GIST起源于Cajal间质细胞(interstitial cells of Cajal, ICC)或向ICC分化的潜能干细胞提供了佐证; 也提示GIST细胞很可能保留了ICC的部分生物学活性, 推测其具备细胞兴奋性和神经递质介导的功能.
引文著录: 徐昕, 王邦茂, 俞清翔, 孙超. TRPC和CHRM在人类胃肠道间质瘤中的表达. 世界华人消化杂志 2013; 21(10): 845-850
Revised: January 4, 2013
Accepted: January 5, 2013
Published online: April 8, 2013
AIM: To investigate the expression of transient receptor potential channels (TRPCs) and cholinergic muscarinic acetylcholine receptors (CHRMs) in human gastrointestinal stromal tumors (GISTs).
METHODS: Immunohistochemical method was used to detect the expression of TRPC and CHRM in GISTs.
RESULTS: GISTs expressed TRPC1, TRPC3, CHRM2 and CHRM3, and the positive rate was 57.5%, 47.5%, 22.5% and 55.0%, respectively. The expression levels of TRPC and CHRM decreased as the malignant potential grade of biological behaviors GISTs increased.
CONCLUSION: Our finding that GISTs express TRPC1, TRPC3, CHRM2 and CHRM3 provides new evidence for the origination of GIST from interstitial cells of Cajal.
- Citation: Xu X, Wang BM, Yu QX, Sun C. Expression of transient receptor potential channels and cholinergic muscarinic acetylcholine receptors in human gastrointestinal stromal tumors. Shijie Huaren Xiaohua Zazhi 2013; 21(10): 845-850
- URL: https://www.wjgnet.com/1009-3079/full/v21/i10/845.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i10.845
胃肠道间质瘤(gastrointestinal stromal tumor, GIST)是消化系最常见的间叶组织源性肿瘤, 年发病率为1.2-1.4/10万[1], 目前普遍认为GIST起源于Cajal间质细胞(interstitial cells of Cajal, ICC)或向ICC分化的潜能干细胞[2]. ICC通过发挥胃肠道基本电节律的起搏和介导神经递质传递的功能而调控胃肠道动力, 而研究证实瞬时受体电位通道(transient receptor potential channels, TRPC)和胆碱能毒蕈碱受体(muscarinic acetylcholine receptors, CHRM)为ICC发挥以上作用的相关结构蛋白. 本研究旨在探讨TRPC和CHRM在GIST细胞中的表达及相关性分析, 探讨人类GIST细胞是否保留了ICC发挥胃肠起搏和介导神经递质传递功能的相关结构.
收集2006-01/2010-12我院病理科资料完整、诊断明确的40例GIST标本. 对照组为40例胃肠道平滑肌瘤标本. 一抗及SABC免疫组织化学染色试剂盒均为武汉博士德生物公司产品.
1.2.1 免疫组织化学法: 40例GIST标本均经10%甲醛固定, 常规石蜡包埋切片, HE染色和免疫组织化学染色. 免疫组织化学染色采用SABC法, 分别标记TRPC1、TRPC3、CHRM2和CHRM3. 阴性对照采用抗体稀释液代替一抗, 阳性对照采用已知的胃肠道平滑肌瘤组织标本. 免疫组织化学结果分析标准: TRPC1、TRPC3、CHRM2和CHRM3受体阳性表达棕黄色颗粒定位于胞膜或胞浆. 反应强度划分为4级: 阴性(-), 瘤细胞无阳性反应或阳性数<10%; 弱阳性(+), 瘤细胞阳性数10%-25%; 中度阳性(++), 瘤细胞阳性数25%-50%; 强阳性(+++), 瘤细胞阳性数≥50%.
1.2.2 GIST生物学行为恶性潜能分级标准[3]: 极低风险性: 肿块最大直径<2 cm, 核分裂相<5/50 HPF; 低风险性: 肿块最大直径2-5 cm, 核分裂相<5/50 HPF; 中风险性: 肿块最大直径5-10 cm, 核分裂相<5/50 HPF或最大直径<5 cm, 核分裂相6-10/50 HPF; 高风险性: 肿块任何大小、核分裂相>10/50 HPF或肿块最大直径>10 cm或肿块最大直径>5 cm, 核分裂相>5/50 HPF.
统计学处理 采用SPSS13.0统计软件, 应用χ2检验精确概率法, P<0.05认为有统计学意义.
本组GIST 40例, 其中男19例, 女21例, 年龄26-73岁, 平均54.6岁, 中位年龄53.5岁. 其中16例以不同程度的消化道出血为主要临床表现, 13例表现为腹胀、上腹不适、消化不良等非特异性消化系症状, 6例表现为腹痛, 5例无任何症状仅为内镜检查时偶然发现.
本组GIST 40例, 位于胃21例, 小肠15例, 食管4例, 均无转移灶. 肿瘤最大直径为0.4-15.0 cm, 平均5.3 cm. 大多数GIST肿瘤呈膨胀性生长、无包膜, 切面灰白、实性、质韧. 镜检下肿瘤细胞形态有2种: 一种为梭形, 核呈杆状, 两端尖或钝圆, 胞浆略嗜酸性或嗜碱性, 排列呈交叉束状、漩涡状、车辐状; 一种为上皮样细胞呈圆形或多角形, 核圆, 胞浆丰富淡染, 常见空泡形成, 呈弥漫片状、巢索状排列. 本组40例GIST肿瘤标本, 27例为梭形细胞型, 4例为上皮样细胞型, 9例为混合型. 根据GIST生物学行为恶性潜能分级标准, 本组极低风险性9例, 低风险性11例, 中风险性10例, 高风险性10例.
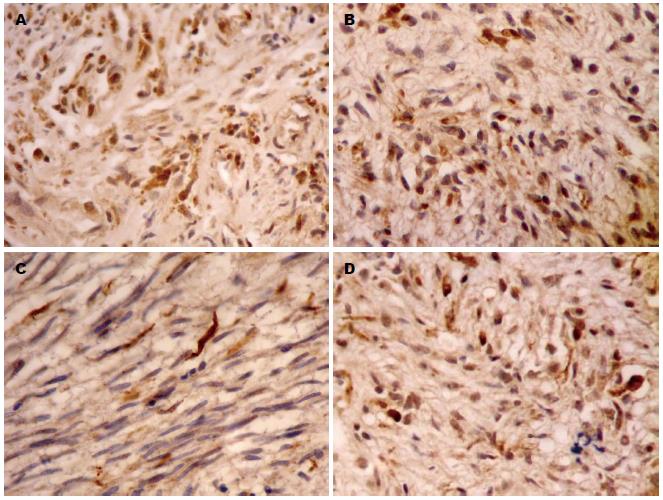
2.3.1 TRPC和CHRM在GIST中的表达: 本组40例GIST中TRPC1表达阳性率57.5%(图1A), TRPC3表达阳性率47.5%(图1B). 阳性颗粒主要定位于胞质和胞膜, 呈棕黄色颗粒分布, 大多表现为弱阳性及中度阳性表达. 与对照组胃肠道平滑肌瘤相比, GIST组TRPC表达水平相对较高, 差异有统计学意义(χ2 = 5.051, P<0.05; χ2 = 4.381, P<0.05).
本组40例GIST中CHRM2表达阳性率22.5%(图1C), CHRM3表达阳性率55.0%(图1D). 阳性颗粒主要定位于胞质和胞膜, 呈棕黄色颗粒分布, 大多表现为弱阳性及中度阳性表达. 与对照组胃肠道平滑肌瘤相比, GIST组CHRM蛋白表达水平较对照组表达水平相对较高, 差异有统计学意义(χ2 = 4.679, P<0.05; χ2 = 5.920, P<0.05).
2.3.2 TRPC和CHRM与GIST临床病理特征的关系: 根据GIST临床病理学特征进行分类分组, 结果得出: TRPC在GIST性别分组和不同年龄分组中表达无显著性差异(P>0.05); 就GIST肿瘤部位而言, 胃内GIST较食管和小肠GIST, 表达TRPC相对较高, 差异有统计学意义(χ2 = 6.369、5.600, P<0.05); 就组织学类型而言, 梭形细胞型GIST较上皮细胞型和混合型GIST表达TRPC相对较高, 差异有统计学意义(χ2 = 4.856、4.495, P<0.05); 就生物学行为恶性潜能分级而言, 极低危险度和低危险度GIST相对于中危险度和高危险度GIST, 表达TRPC较高, 差异有显著统计学意义(χ2 = 8.286、14.545, P<0.01, 表1).
| 临床病理特征 | n | TRPC1 | TRPC3 | ||||||||
| - | + | ++ | +++ | n(%) | - | + | ++ | +++ | n(%) | ||
| 性别 | |||||||||||
| 男 | 19 | 8 | 4 | 5 | 2 | 11(57.9) | 10 | 4 | 3 | 2 | 9(47.4) |
| 女 | 21 | 9 | 4 | 6 | 2 | 12(57.1) | 11 | 5 | 2 | 3 | 10(47.6) |
| 年龄(岁) | |||||||||||
| <54 | 20 | 9 | 3 | 6 | 2 | 11(55.0) | 11 | 3 | 3 | 3 | 9(45.0) |
| ≥54 | 20 | 8 | 5 | 5 | 2 | 12(60.0) | 10 | 6 | 2 | 2 | 10(50.0) |
| 部位 | |||||||||||
| 食管 | 4 | 4 | 0 | 0 | 0 | 0(0.0) | 3 | 0 | 1 | 0 | 1(25.0) |
| 胃 | 21 | 4 | 6 | 8 | 3 | 17(80.9) | 7 | 7 | 3 | 4 | 14(66.7) |
| 小肠 | 15 | 9 | 2 | 3 | 1 | 6(40.0) | 11 | 2 | 1 | 1 | 4(26.7) |
| 组织学 | |||||||||||
| 梭型 | 27 | 7 | 7 | 9 | 4 | 20(74.1) | 10 | 8 | 4 | 5 | 17(62.9) |
| 上皮型 | 4 | 4 | 0 | 0 | 0 | 0(0.0) | 3 | 0 | 1 | 0 | 1(0.0) |
| 混合型 | 9 | 6 | 1 | 2 | 0 | 3(33.3) | 8 | 1 | 0 | 0 | 1(11.1) |
| 风险分级 | |||||||||||
| 极低 | 9 | 2 | 2 | 2 | 3 | 7(77.8) | 2 | 2 | 2 | 3 | 7(77.8) |
| 低 | 11 | 2 | 3 | 5 | 1 | 9(81.8) | 3 | 4 | 2 | 2 | 8(72.7) |
| 中等 | 10 | 5 | 2 | 3 | 0 | 5(50.0) | 7 | 2 | 1 | 0 | 3(30.0) |
| 高 | 10 | 8 | 1 | 1 | 0 | 2(20.0) | 9 | 1 | 0 | 0 | 1(10.0) |
CHRM在GIST性别分组和不同年龄分组中表达差异无显著性(P>0.05); 胃内GIST较食管和小肠GIST、CHRM3表达量较高, 差异有统计学意义(χ2 = 4.822, P<0.05); 梭形细胞型GIST中CHRM3的表达量较上皮细胞型和混合型GIST中的高, 差异有统计学意义(χ2 = 7.636, P<0.01); 极低危险度和低危险度GIST相对于中危险度和高危险度GIST、CHRM的表达量高, 差异有显著统计学意义(χ2 = 7.025、10.101, P<0.01, 表2).
| 临床病理特征 | n | CHRM2 | CHRM3 | ||||||||
| - | + | ++ | +++ | n(%) | - | + | ++ | +++ | n(%) | ||
| 性别 | |||||||||||
| 男 | 19 | 15 | 2 | 2 | 0 | 4(21.1) | 8 | 4 | 3 | 4 | 11(57.9) |
| 女 | 21 | 16 | 2 | 3 | 0 | 5(23.8) | 10 | 3 | 4 | 4 | 11(52.3) |
| 年龄(岁) | |||||||||||
| <54 | 20 | 15 | 2 | 3 | 0 | 5(25.0) | 10 | 3 | 4 | 3 | 10(50.0) |
| ≥54 | 20 | 16 | 2 | 2 | 0 | 4(20.0) | 8 | 4 | 3 | 5 | 12(60.0) |
| 部位 | |||||||||||
| 食管 | 4 | 4 | 0 | 0 | 0 | 0(0.0) | 4 | 0 | 0 | 0 | (0.0) |
| 胃 | 21 | 14 | 2 | 5 | 0 | 7(33.3) | 5 | 5 | 4 | 7 | 16(76.2) |
| 小肠 | 15 | 13 | 2 | 0 | 0 | 2(13.3) | 9 | 2 | 3 | 1 | 6(40.0) |
| 组织学 | |||||||||||
| 梭型 | 27 | 19 | 4 | 4 | 0 | 8(29.6) | 8 | 5 | 6 | 8 | 19(70.4) |
| 上皮型 | 4 | 4 | 0 | 0 | 0 | 0(0.0) | 3 | 1 | 0 | 0 | 1(25.0) |
| 混合型 | 9 | 8 | 0 | 1 | 0 | 1(11.1) | 7 | 1 | 1 | 0 | 2(22.2) |
| 风险分级 | |||||||||||
| 极低 | 9 | 6 | 1 | 2 | 0 | 3(33.3) | 2 | 3 | 1 | 3 | 7(77.8) |
| 低 | 11 | 6 | 2 | 3 | 0 | 5(45.5) | 2 | 2 | 3 | 4 | 9(81.8) |
| 中等 | 10 | 9 | 1 | 0 | 0 | 1(10.0) | 5 | 1 | 3 | 1 | 5(50.0) |
| 高 | 10 | 0 | 0 | 0 | 0 | 0(0.0) | 9 | 1 | 0 | 0 | 1(10.0) |
GIST是一种常见的消化系间叶组织源性肿瘤, 年发病率为1.2-1.4/10万[1], 占消化系所有恶性肿瘤的1%-3%[4]. GIST微小瘤, 可伴发于散发性GIST或仅在胃肠道术后标本或尸检中偶然发现, 检出率达9.1%-35.0%[5-8]. GIST可发生于全胃肠道, 主要位于胃, 其次为小肠, 少数发生于结直肠及食管, 临床症状主要包括消化道出血、腹痛、腹胀、腹部不适、肠梗阻及非特异性乏力体重减轻等[9]. 目前普遍认为GIST为起源于ICC或多潜能干细胞向ICC分化的肿瘤[2], ICC是一类特殊的胃肠道间质细胞, 呈网状结构分布于胃肠道肌层之间, 负责胃肠道基本电节律的起搏及介导神经递质的传递[10]. ICC产生起搏电流的机制目前主要认为其与细胞内三磷酸肌醇介导的钙库、线粒体和细胞膜上的非选择性阳离子通道3者有关[11], 而TRPC为其中重要的非选择性阳离子通道之一[12]. ICC的另一功能是接受肠神经系统神经元的信号传递, 神经冲动可通过ICC传至平滑肌, 并引发胃肠平滑肌细胞的收缩. 细胞分离和培养发现, ICC细胞膜上可表达多种受体如CHRM、神经激肽受体、血管活性肠肽受体等[13].
目前普遍认为GIST为起源于ICC或多潜能干细胞向ICC分化的肿瘤, 且有研究认为弥漫性ICC增生即为GIST的瘤前形式[6]. 二者不仅具有相似的细胞超微结构, 共同表达KIT和CD34, 而ICC是胃肠道中唯一表达KIT和CD34的细胞. 新近发现干蛋白、PKθ也可同时在ICC和GIST表达, 钾离子通道基因KCNK3、KCNK2亦同时表达于ICC和GIST[14]. DOG1是新近发现表达于GIST的一种钙离子调节相关门控蛋白, 对GIST的诊断具有特异性, 而其在动物及人类胃肠道各型ICC同样特异性表达, 也证实了ICC与GIST的高度同源性[15]. 本研究首次证实人类GIST细胞表达TRPC1、TRPC3、CHRM2、CHRM3蛋白, 如前所属TRPC和CHRM分别为ICC所表达且为发挥电节律起搏和传递功能的关键结构. 因此, 本研究首先为GIST起源于ICC提供了新的证据.
TRPC为近年来发现存在于细胞膜或胞内细胞器膜上的一类非选择性阳离子通道[16], 为钙库操控离子通道的一种, 参与ICC胃肠起搏机制[17]. 研究发现, 当胞内钙库被耗竭时, TRPC会引起一个增强的内向电流, 并伴随着[Ca2+]水平上升[18], 且胞内钙库上的三磷酸肌醇与TRPC有相互作用, 进而引起胞外钙内流[19,20]. Kim等[21]发现小鼠胃肠道ICC起搏机制与非选择性阳离子通道TRPC4、TRPM7密切相关, 而TRPC4-/-小鼠慢波表现异常. Chen等[22]发现小鼠小肠ICC中TRPC1、TRPC4的mRNA水平表达增高. Furuzonoc等[23]发现人类GIST细胞表达TRPC1、TRPC3、TRPC6、TRPC7等离子通道蛋白, 认为GIST保留了ICC潜在起搏活性的离子机制. 胆碱能神经为肠神经系统最重要的神经调节之一, 肠神经系统释放乙酰胆碱激活CHRM, 作用于ICC进一步引起平滑肌的收缩[24]. 研究证实, 在ICC缺乏的情况下, 胃底和胃窦部对胆碱能兴奋引起的突触后神经反应被极大减弱或者消失[25,26], 而在野生型动物缺少ICC的胃窦部纵形肌层对胆碱能反应也是减弱的[27]. Ward等[28]报道小鼠胃肠道ICC上的CHRM可接受乙酰胆碱刺激, 从而介导胆碱能神经的调节. Kim等[29]发现胆碱能刺激可以增加胃窦部和体部ICC的起搏频率, 且其效应是由CHMR3介导的. Mckay等[30]最新发现接受胆碱能神经调节的ICC通过激活CHRM3及下游磷脂酶C, 可进一步影响细胞内钾离子电流, 从而影响ICC细胞的兴奋性.
可见, TRPC和CHRM分别为ICC发挥胃肠起搏和介导神经递质传递功能的重要受体蛋白. 本研究发现人类GIST表达有TRPC和CHRM, 且生物学行为恶性潜能分级越低危的GIST表达TRPC和CHRM相对较高. 由此可见, GIST为起源于ICC的肿瘤, 且在其分化发展过程中保留了ICC发挥功能的相关受体蛋白TRPC和CHRM, GIST肿瘤很可能亦保留了部分ICC发挥胃肠起搏和介导胃肠神经递质传递的功能, 从而影响胃肠道慢波运动; 且生物学行为恶性潜能分级越低危的GIST越可能更好的保留其来源细胞ICC的结构, 越可能具备细胞兴奋性而发挥影响胃肠道正常慢波活动的作用, 从而影响正常胃肠道慢波活动, 进一步引起胃肠道运动功能紊乱, 有待于进一步研究.
胃肠道间质瘤(GIST)是消化系最常见的间叶组织源性肿瘤, 年发病率为1.2-1.4/10万. GIST具有潜在恶性的生物学行为, 目前普遍认为GIST起源于Cajal间质细胞(ICC)或向ICC分化的潜能干细胞. ICC是一类特殊的介于神经细胞与成纤维细胞之间的间质细胞, 通过发挥胃肠道基本电节律的起搏和介导神经递质传递的功能而调控胃肠道动力.
陈其奎, 教授, 中山大学附属第二医院消化内科
本研究通过检测瞬时受体电位通道(TRPC)及胆碱能毒蕈碱受体(CHRM)在人类GIST肿瘤细胞中的表达情况, 分析TRPC及CHRM表达与GIST临床病理学特征的相关性, 探讨人类GIST肿瘤细胞是否在其分化发展过程中保留了ICC发挥胃肠起搏和介导神经递质传递功能的关键结构, 旨在为进一步研究GIST肿瘤细胞的电生理学特性奠定基础.
Furuzonoc等分离GIST细胞进行培养后, 应用全细胞膜片钳技术显示GIST细胞存在电压依赖性外向电流; 细胞内Ca2+浓度测量显示GIST细胞具有自发振荡样改变, 认为GIST细胞保留了一些ICC起搏活性的离子机制.
GIST保留了ICC发挥起搏胃肠道慢波运动和介导神经递质传递功能的结构, 那么, GIST很可能具备自律性电活动的生物学功能, 从而影响胃肠道正常慢波活动, 进一步影响正常的胃肠肌电活动. 因此, 本研究可能为功能性胃肠病的病因学研究和治疗开辟一条全新的思路.
瞬时受体电位通道家族: 近年来发现存在于细胞膜或胞内细胞器膜上的一类非选择性阳离子通道, 主要通透钙离子、钠离子和镁离子. TRP通道的人类同源物TRPC及其他类似物, 构成TRP通道超家族, 包括以下几个型: TRPC、TRPV、TRPM、TRPP、TRPML和TRPA. 最新研究结果证实, TRPC通道可能是钙库操控的离子通道中的一种, 是细胞转运钙离子的新通道.
本文可能为功能性胃肠病的病因学研究和治疗开辟一条全新的思路, 具有一定的指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Nilsson B, Bümming P, Meis-Kindblom JM, Odén A, Dortok A, Gustavsson B, Sablinska K, Kindblom LG. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era--a population-based study in western Sweden. Cancer. 2005;103:821-829. [PubMed] [DOI] |
| 2. | Robinson TL, Sircar K, Hewlett BR, Chorneyko K, Riddell RH, Huizinga JD. Gastrointestinal stromal tumors may originate from a subset of CD34-positive interstitial cells of Cajal. Am J Pathol. 2000;156:1157-1163. [PubMed] [DOI] |
| 3. | Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol. 2008;39:1411-1419. [PubMed] [DOI] |
| 4. | Cassier PA, Ducimetière F, Lurkin A, Ranchère-Vince D, Scoazec JY, Bringuier PP, Decouvelaere AV, Méeus P, Cellier D, Blay JY. A prospective epidemiological study of new incident GISTs during two consecutive years in Rhône Alpes region: incidence and molecular distribution of GIST in a European region. Br J Cancer. 2010;103:165-170. [PubMed] [DOI] |
| 5. | Agaimy A, Wünsch PH. Sporadic Cajal cell hyperplasia is common in resection specimens for distal oesophageal carcinoma. A retrospective review of 77 consecutive surgical resection specimens. Virchows Arch. 2006;448:288-294. [PubMed] [DOI] |
| 6. | Agaimy A, Wünsch PH, Hofstaedter F, Blaszyk H, Rümmele P, Gaumann A, Dietmaier W, Hartmann A. Minute gastric sclerosing stromal tumors (GIST tumorlets) are common in adults and frequently show c-KIT mutations. Am J Surg Pathol. 2007;31:113-120. [PubMed] [DOI] |
| 7. | Kawanowa K, Sakuma Y, Sakurai S, Hishima T, Iwasaki Y, Saito K, Hosoya Y, Nakajima T, Funata N. High incidence of microscopic gastrointestinal stromal tumors in the stomach. Hum Pathol. 2006;37:1527-1535. [PubMed] [DOI] |
| 8. | Rossi S, Gasparotto D, Toffolatti L, Pastrello C, Gallina G, Marzotto A, Sartor C, Barbareschi M, Cantaloni C, Messerini L. Molecular and clinicopathologic characterization of gastrointestinal stromal tumors (GISTs) of small size. Am J Surg Pathol. 2010;34:1480-1491. [PubMed] [DOI] |
| 9. | Lamba G, Gupta R, Lee B, Ambrale S, Liu D. Current management and prognostic features for gastrointestinal stromal tumor (GIST). Exp Hematol Oncol. 2012;1:14. [PubMed] [DOI] |
| 10. | Yin J, Chen JD. Roles of interstitial cells of Cajal in regulating gastrointestinal motility: in vitro versus in vivo studies. J Cell Mol Med. 2008;12:1118-1129. [PubMed] [DOI] |
| 11. | Sanders KM, Koh SD, Ward SM. Interstitial cells of cajal as pacemakers in the gastrointestinal tract. Annu Rev Physiol. 2006;68:307-343. [PubMed] [DOI] |
| 12. | Liu HN, Ohya S, Furuzono S, Wang J, Imaizumi Y, Nakayama S. Co-contribution of IP3R and Ca2+ influx pathways to pacemaker Ca2+ activity in stomach ICC. J Biol Rhythms. 2005;20:15-26. [PubMed] [DOI] |
| 13. | Faussone-Pellegrini MS. Relationships between neurokinin receptor-expressing interstitial cells of Cajal and tachykininergic nerves in the gut. J Cell Mol Med. 2006;10:20-32. [PubMed] [DOI] |
| 14. | Allander SV, Nupponen NN, Ringnér M, Hostetter G, Maher GW, Goldberger N, Chen Y, Carpten J, Elkahloun AG, Meltzer PS. Gastrointestinal stromal tumors with KIT mutations exhibit a remarkably homogeneous gene expression profile. Cancer Res. 2001;61:8624-8628. [PubMed] |
| 15. | Gomez-Pinilla PJ, Gibbons SJ, Bardsley MR, Lorincz A, Pozo MJ, Pasricha PJ, Van de Rijn M, West RB, Sarr MG, Kendrick ML. Ano1 is a selective marker of interstitial cells of Cajal in the human and mouse gastrointestinal tract. Am J Physiol Gastrointest Liver Physiol. 2009;296:G1370-G1381. [PubMed] [DOI] |
| 16. | Holzer P. TRP channels in the digestive system. Curr Pharm Biotechnol. 2011;12:24-34. [PubMed] [DOI] |
| 17. | Villereal ML. Mechanism and functional significance of TRPC channel multimerization. Semin Cell Dev Biol. 2006;17:618-629. [PubMed] [DOI] |
| 18. | Zitt C, Zobel A, Obukhov AG, Harteneck C, Kalkbrenner F, Lückhoff A, Schultz G. Cloning and functional expression of a human Ca2+-permeable cation channel activated by calcium store depletion. Neuron. 1996;16:1189-1196. [PubMed] [DOI] |
| 19. | Kiselyov K, Xu X, Mozhayeva G, Kuo T, Pessah I, Mignery G, Zhu X, Birnbaumer L, Muallem S. Functional interaction between InsP3 receptors and store-operated Htrp3 channels. Nature. 1998;396:478-482. [PubMed] [DOI] |
| 20. | Trost C, Bergs C, Himmerkus N, Flockerzi V. The transient receptor potential, TRP4, cation channel is a novel member of the family of calmodulin binding proteins. Biochem J. 2001;355:663-670. [PubMed] |
| 21. | Kim BJ, So I, Kim KW. The relationship of TRP channels to the pacemaker activity of interstitial cells of Cajal in the gastrointestinal tract. J Smooth Muscle Res. 2006;42:1-7. [PubMed] [DOI] |
| 22. | Chen H, Ordög T, Chen J, Young DL, Bardsley MR, Redelman D, Ward SM, Sanders KM. Differential gene expression in functional classes of interstitial cells of Cajal in murine small intestine. Physiol Genomics. 2007;31:492-509. [PubMed] [DOI] |
| 23. | Furuzono S, Ohya S, Inoue S, Nakao A, Imaizumi Y, Nakayama S. Inherent pacemaker function of duodenal GIST. Eur J Cancer. 2006;42:243-248. [PubMed] [DOI] |
| 24. | Ward SM, Beckett EA, Wang X, Baker F, Khoyi M, Sanders KM. Interstitial cells of Cajal mediate cholinergic neurotransmission from enteric motor neurons. J Neurosci. 2000;20:1393-1403. [PubMed] |
| 25. | Beckett EA, Horiguchi K, Khoyi M, Sanders KM, Ward SM. Loss of enteric motor neurotransmission in the gastric fundus of Sl/Sl(d) mice. J Physiol. 2002;543:871-887. [PubMed] [DOI] |
| 26. | Beckett EA, McGeough CA, Sanders KM, Ward SM. Pacing of interstitial cells of Cajal in the murine gastric antrum: neurally mediated and direct stimulation. J Physiol. 2003;553:545-559. [PubMed] [DOI] |
| 27. | Suzuki H, Ward SM, Bayguinov YR, Edwards FR, Hirst GD. Involvement of intramuscular interstitial cells in nitrergic inhibition in the mouse gastric antrum. J Physiol. 2003;546:751-763. [PubMed] [DOI] |
| 28. | Ward SM, Sanders KM. Interstitial cells of Cajal: primary targets of enteric motor innervation. Anat Rec. 2001;262:125-135. [PubMed] [DOI] |
| 29. | Kim TW, Koh SD, Ordög T, Ward SM, Sanders KM. Muscarinic regulation of pacemaker frequency in murine gastric interstitial cells of Cajal. J Physiol. 2003;546:415-425. [PubMed] [DOI] |
| 30. | McKay CM, Huizinga JD. Muscarinic regulation of ether-a-go-go-related gene K+ currents in interstitial cells of Cajal. J Pharmacol Exp Ther. 2006;319:1112-1123. [PubMed] [DOI] |