修回日期: 2012-12-28
接受日期: 2012-12-28
在线出版日期: 2013-01-08
目的: 观察龙血素A/B对肝星状细胞(hepatic stellate cells, HSC)增殖及各种物质表达的影响.
方法: 将HSC分为3组: 空白对照组、细胞对照组、药物干预组. 用MTT法观察龙血素A/B对HSC-T6增殖的影响, 并检测细胞上清中透明质酸酶(hyaluronidase, HA)、层粘连蛋白(hyaluronidase, LN)、Ⅳ型胶原(collegen type Ⅳ, Ⅳ-C)的含量. 采用Real time-PCR检测HSC经龙血素A/B处理前后血管内皮生长因子(blood vessel endothelium, VEGF165)和低氧诱导因子(histoplasma tissue inhibitory factor, HIF-1)mRNA表达的影响.
结果: HSC的抑制率均随龙血素A/B的浓度增高而增高, 且龙血素A的IC50约为0.3 µg/µL, 龙血素B的IC50约为0.1 µg/µL; 与正常对照组相比, 药物干预组的HA、LN、Ⅳ-C含量降低(31.10±4.32 vs 43.05±4.96, 441.28±25.38 vs 302.98±29.59, 17.96±3.00 vs 25.23±4.96, 均P<0.05); VEGF和HIF-1 2-△△Ct值明显降低, 且龙血素B组较龙血素A明显.
结论: 龙血素A/B均可抑制HSC的增值, 龙血素A抑制较龙血素B明显; 其还可下调HSC中HA、LN、Ⅳ-C及VEGF165和HIF-1 mRNA的表达, 龙血素B较龙血素A下调效果明显.
引文著录: 李玉莲, 宋正己, 范红, 彭伟, 高建梅, 沈涛. 龙血素对肝星状细胞的影响. 世界华人消化杂志 2013; 21(1): 87-92
Revised: December 28, 2012
Accepted: December 28, 2012
Published online: January 8, 2013
AIM: To investigate the effects of treatment with loureirin A/B on rat hepatic stellate cells (HSCs) in vitro.
METHODS: HSC-T6 cells were cultured in 96-well plates for 24 h and then incubated with different concentrations of loureirin A/B for 48 h. MTT assay was used to assess the proliferation of HSCs. The contents of hyaluronic acid, laminin and collagen type IV in culture supernatants were measured by radioimmunoassay. The mRNA expression of blood vessel endothelium (VEGF165) and histoplasma tissue inhibitory factor (HIF-1) was detected by real-time fluorescence quantitative PCR.
RESULTS: The half maximal inhibitory concentrations (IC50) of loureirin A/B were 0.3 and 0.1 µg/µL respectively. Treatment with loureirin A/B significantly inhibited HSC proliferation, the secretion of hyaluronic acid, laminin and collagen type IV (31.1 ± 4.32 vs 43.05 ± 4.96, 441.28 ± 25.38 vs 302.98 ± 29.59, 17.96 ± 3.00 vs 25.23 ± 4.96, all P < 0.05), and the mRNA expression of VEGF165 and HIF-1. The effects of loureirin B were stronger than those of loureirin A.
CONCLUSION: Treatment with loureirin A/B could significantly inhibit the proliferation of HSCs, the secretion of hyaluronic acid, laminin and collagen type IV, and the mRNA expression of VEGF165 mRNA and HIF-1 mRNA, and the effects of loureirin B were stronger than those of loureirin A.
- Citation: Li YL, Song ZJ, Fang H, Peng W, Gao JM, Shen T. Influence of treatment with loureirin on rat hepatic stellate cells in vitro. Shijie Huaren Xiaohua Zazhi 2013; 21(1): 87-92
- URL: https://www.wjgnet.com/1009-3079/full/v21/i1/87.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i1.87
肝纤维化是肝组织慢性损伤后反复的愈合修复和间质重塑过程, 肝星状细胞(hepatic stellate cell, HSC)活化和表型改变是肝纤维化的中心事件, 活化HSC增殖、细胞迁移、收缩性增加, 并产生过量的细胞外基质(extracellular matrix, ECM)聚集于Dissc间隙, 引起窦毛细血管内皮窗孔关闭, 血窦内压力增加, 肝细胞营养障碍[1]. 近年研究发现, HSC活化同时伴有的内皮细胞(endothelial cell, EC)活化和新生血管形成是进展性肝纤维化间质重建中最突出的病理特征, 在肝纤维化病理生理中起重要作用[2-4]. 前期试验也表明龙血竭对硫代乙酰胺诱导的肝纤维化有一定的预防和治疗作用. 本实验在此基础上, 通过研究传统中药龙血竭主要成分龙血素A/B对HSC生长、分泌, 及其中血管内皮生长因子(blood vessel endothelium, VEGF165)和低氧诱导因子(histoplasma tissue inhibitory factor, HIF-1) mRNA表达的影响, 初步探讨龙血竭改善纤维化的机制.
HSC-T6 细胞系购自中国科学院昆明细胞库. 龙血素A/B中药化学对照品, 中国药品生物制品检定所(用甲醇配成10 µg/µL的原液, 4 ℃储存); DMEM高糖培养液、PBS缓冲液, 均购自北京海克隆; 新西兰新生牛血清购自美国Gibco公司; 青霉素-链霉素溶液、0.25%胰蛋白酶溶液均购自Bioind公司; 四甲基偶氮唑蓝(MTT)购自sigma公司(用前配成0.5%贮存液微孔滤膜(0.22 µm)过滤后, -20 ℃储存备用); SW-CJ-2F标准型净化工作台(吴江市绿岛净化设备厂); 倒置显微镜(Olympus, BX60); 美国Thermo Scientific Forma series Ⅱ水套CO2培养箱; 细胞基因组总RAN提取试剂盒(离心柱型)、 Fermentas K1622逆转录试剂盒、2×Taq PCR Mastermix; SYBR GreenⅡ(宝生物)、琼脂糖、DNA分子标准Marker, TBE缓冲液.
1.2.1 MTT法测定龙血素对HSC增殖的影响: (1)细胞的复苏: 细胞自液氮中取出, 立即放入37 ℃水中快速溶化, 离心1 000 r/min, 5 min, 移去上清液后, 加入含10%小牛血清的DMEM高糖培养液, 移入25 cm2培养瓶, 放入37 ℃, 50 mL/L CO2的培养箱中培养. 记录复苏日期, 次日换液. 当细胞铺满整个培养瓶80%-90%后, 0.25%胰蛋白酶消化约30 s, 传代培养; (2)MTT比色法检测HSC 的增殖: 复苏后至少传代培养一代, 将处于对数生长期的HSC用含10%小牛血清的DMEM高糖培养液配成1×105细胞悬液, 接种于96孔板, 每孔100 µL. 将培养的HSC分为3组: 空白对照组、细胞对照组、甲醇组(排外甲醇对细胞的影响); 药物干预组. 各组干预情况见表1. 置于37 ℃、饱和湿度、50 mL/L CO2培养箱内培养, 24 h后将不同浓度的药物(设0.5、0.4、0.2、0.1、0.05、0.025 µg/µL, 6个药物终浓度)加入药物干预组培养孔, 各浓度均设5个复孔. 48 h后每孔加0.5%MTT贮存液20 µL, 继续孵育4 h后弃上清, 每孔加入二甲基亚砜(DMSO)150 µL溶解细胞内结晶, 微型振荡器震荡10 min后, 用全自动酶标仪在490 nm波长处比色法测定各孔A值, 测得的各复孔A值取平均数. 抑制率(IE) = (对照孔A490-实验孔A490/对照孔A490×100%. 观察药物对细胞生长的影响.
| 分组 | 干预情况 |
| 空白对照组 | 100 μL培养基, 24 h后加入培养基100 μL |
| 细胞组 | 100 μL 1×105个/ mL细胞悬液细胞, 24 h后加入培养基100 μL |
| 甲醛组 | 100 μL 1×105个/ mL细胞悬液细胞, 24 h后加入加含不同浓度(1/25; 1/100; 1/500)甲醛培养基100 μL |
| 药物干预组(龙血素A) | 100 μL 1×105个/ mL细胞悬液细胞, 24 h后加含不同浓度龙血素A(设0.5、0.4、0.2、0.1、0.05、0.025 μg/μL, 6个药物终浓度)的培养基100 μL |
| 药物干预组(龙血素B) | 100 μL 1×105个/ mL细胞悬液细胞, 24 h后加含不同浓度龙血素B的培养基100 μL |
1.2.2 Real-time PCR: (1)总RNA提取: 将处于对数生长期的HSC-T6用配成2×105细胞悬液, 接种于6孔板, 每孔2 mL. 将培养的HSC分为2组: 正常对照组、药物干预组. 24 h后正常对照组加入培养液, 药物干预组加入含龙血素A/B的培养液各200 µL, 药物终浓度龙血素A为0.3 µg/µL. 龙血素B为0.1 µg/µL. 各浓度均设5个复孔. 细胞培养48 h后, 取上清每孔800, 放免发检测细胞上清中HA、LN、Ⅳ-C的含量. 剩余上清弃去, PBS洗两遍后, 按细胞基因组RNA提取试剂盒说明提取总RNA, 微量核酸蛋白分析仪测定总RNA浓度和纯度, -80 ℃保存备用; (2)单链DNA(cDNA)合成: 取1 µg总RNA进行逆转录, 反应体系20 µL: 其中总RNA 3 oligo(dt)18 primer 1、DEPC-treat water 8、5×Reaction Buffer 4 、Ribolock RNase inhibitor 1、10Mm dNTP Mix 2、 RevertAid M-MuLv Reverse transcriptase 1 µL. 反应条件: 42 ℃ 60 min, 72 ℃ 5 min; (3)引物特异性检测: 取cDNA进行常规PCR反应. 引物用BLAST软件进行在线核实其特异性后由中美泰和生物技术服务有限公司合成(表2). 反应体系20 µL: 2×Taq PCR Master mix 5 µL, 上、下游引物各1 µL, 模板DNA 2.0 µL, ddH2O 1 µL. 阴性对照管中模板cDNA用ddH2O 2 µL代替. 反应条件: 94 ℃预变性3 min, 94 ℃变性30 s, 内参基(GAPDH)59 ℃、VEGF165 62 ℃、HIF-1 63 ℃退火30 s, 72 ℃延伸30 s, 循环40次, 72 ℃后延伸3 min, -4 ℃保存. 取PCR反应产物5 µL与溴酚蓝2 µL混匀上样, 在1.5%琼脂糖凝胶中电泳, 电泳在1×TBE缓冲液中进行, 电压100 V, 时间45 min, 电泳结束后用凝胶成像分析系统摄像; (4)Real-time PCR: 将逆转录的到的cDNA原液按1、1×10-1、1×10-2、1×10-3梯度稀释后, 各取2 µL稀释好的cDNA进行RT-PCR反应, 检测发现目的基因的扩增效率和管家基因的扩增效率一致, 可应用2-∆∆Ct方法进行相对定量. 采用SYBR@Premix Ex TaqTM Ⅱ试剂盒, 在罗氏LightCycler®480荧光定量系统上进行检测, 反应条件如下: 荧光染料5 µL, 上、下游引物各0.75 µL, 模板DNA取2.0 µL, ddH2O 1.5 µL, 反应体积为10 µL. 反应条件: 95 ℃预变性3 min, 95 ℃变性10 s, 均为63 ℃退火20 s, 72 ℃延伸30 s, 循环40次, 72 ℃后延伸3 min. 反应完毕后根据溶解曲线分析PCR产物的特异性, 并由Light Cycler PCR仪分析定量结果, 以达到阈值的最低循环数(Ct值)计算样本中mRNA拷贝数相对量. 每个样本的Ct值由目的基因和管家基因决定, 即∆Ct(目的基因) = Ct(目的基因)-Ct(管家基因), ∆∆Ct(目的基因) = ∆Ct(目的基因)-∆Ct(标准值). 样品中目的基因的相对拷贝量为2-∆∆Ct. 记录各组Ct值, 通过2-∆∆Ct, 计算各组细胞VEGF165和HIF-1的mRNA表达水平.
| 目的基因 | 引物序列 | 退火温度(℃) | 产物长度(bp) |
| 内参基(GAPDH) | F: 5'-CTCCCATTCCTCCACCTTTG-3' | 59 | 110 |
| R: 3'-ATGAGGTCCACCACCCTGTT-5' | |||
| VEGF165 | F: 5'-CCGCAGACGTGTAAATGTTCC-3' | 62 | 207 |
| R: 3'-GACGGTGACGATGGTGGTGT-5' | |||
| HIF-1 | F: 5'-CAGTTACAGGATTCCAGCAGAC-3' | 63 | 152 |
| R: 3'-TACTTGGGTAGAAGGTGGAGAT-5' |
统计学处理 数据用mean±SD表示, 采用SPSS17.0统计分析软件的配对t检验比较, P<0.05表示差别有统计学意义.
IC50在凋亡方面, 是指一定浓度的某种药物诱导细胞凋亡50%, 该浓度称为50%抑制浓度, 即凋亡细胞与全部细胞数之比等于50%时所对应的浓度, 可以用来衡量药物诱导凋亡的能力, 即诱导能力越强, 该数值越低, 也可以反向说明某种细胞对药物的耐受程度. 实验表明龙血素A/B均可抑制HSC的增值, 排外甲醇对细胞的影响, 抑制率均随药物浓度增高而增高, IC50龙血素A为0.3 µg/µL. 龙血素B为0.1 µg/µL, 龙血素B抑制效果较龙血素A明显(表3).
龙血素A/B处理细胞后可不同程度抑制HSC分泌透明质酸、层粘连蛋白和Ⅳ胶原, 且龙血素B的抑制效果优于龙血素A(表4).
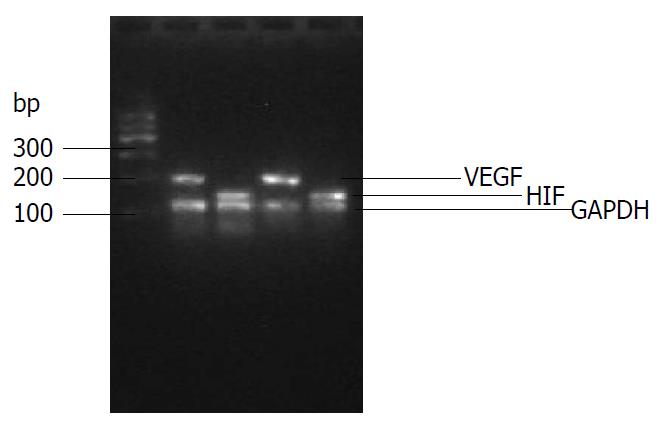
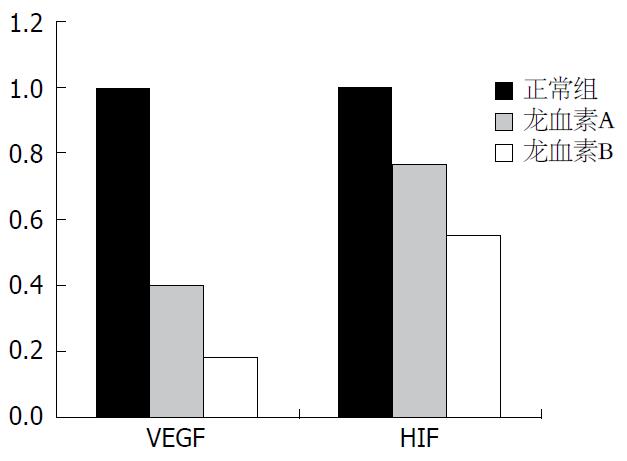
用1.5%琼脂糖凝胶电泳分析各组常规PCR产物, 以Marker为标准. 可见常规PCR产物均显示特异性条带, 与预期的DNA片段长度相吻合(图1). 药物干预后, 通过2-∆∆Ct, 计算各组HSC VEGF及HIF mRNA表达水平. 与正常对照组相比, 龙血素A/B均能降低VEGF和HIF-1的2-∆∆Ct值, 龙血素B的抑制效果较龙血素A明显, 具有统计学意义(P<0.001, 图2).
"龙血竭"具有活血、化瘀、止血、补血的功效, 被誉为"活血圣药"[5]. 其主要化学成分和生理活性成分是酚类化合物[6], 主要为总黄酮, 龙血素A、龙血素B是龙血竭黄酮的主要成分, 主要分布于血流量大的脏器, 如肝脏、肾脏等[7]. 多种黄酮类化合物被证实具有明显的防治肝纤维化的作用[8]. 龙血竭能有效地减轻肺纤维化大鼠肺组织的纤维化程度[9], 龙血素B还能对硫代乙酰胺诱导的大鼠肝纤维化有一定的预防和治疗作用[10]. 龙血素A对局灶性脑缺血再灌注引起的损伤具有一定的保护作用[11]. 但其具体机制尚不明确.
HSC是肝组织内的窦周细胞, 其激活是肝纤维化发生、发展的中心环节和共同通路, 他的活化表型或肌成纤维样细胞表型在调控间质血管生成方面起着积极作用[12], 而间质血管的改建与肝纤维化进展关系密切. 活化的HSC在慢性肝损伤时分泌VEGF、转化生长因子β、血小板衍生生长因子等多种细胞因子, 他们能同时促进星状细胞活化和血管生成. 抑制HSC的活化或促进其凋亡, 及减少其分泌的促微血管新生的细胞因子, 能改善肝纤维化的发展. 本实验通过MTT法检测龙血素A/B对肝星状细胞生长的抑制作用, 表明: 龙血素A/B均可抑制HSC 增值及活化, 且龙血竭主要成分龙血素B的抑制作用较龙血素A明显, 龙血素B对HSC的抑制可能成为临床抗肝纤维化的新途径.
HA由间质细胞合成HSC是肝脏间质细胞的一种, 约占肝脏间质细胞的1/3), 是反映肝损害严重程度、判断有无活动性肝纤维化的定量指标, 可较准确地反映肝内已生成的纤维量及肝细胞受损状况. Ⅳ-C为构成基底膜主要成份, 可反映基底膜胶原更新率, 含量增高可较灵敏反映出肝纤过程, 是肝纤的早期标志之一. LN为基底膜中特有的非胶原性结构蛋白, 可以反映肝纤维化的进展与严重程度. 血清HA、Ⅳ-C、LN联合检测可对肝纤维化程度的判定、肝硬化的早期诊断具有一定的临床意义, 是判断肝纤维化的敏感可靠指标[13]. 本实验结果显示: 血竭素A/B均可抑制HSC的增值, 还可不同程度的降低HSC细胞上清中HA、LN、Ⅳ-C的含量, 在IC50水平抑制效果最明显, 龙血素B的抑制效果优于龙血素A.
肝脏纤维化后, 血管经纤维条索压迫后扭曲, 血运不畅, 出现缺氧情况, 引起肝组织血管新生[14]. 缺氧反应基因的调控主要是由HIF-1来实现. 有研究表明HIF-l-VEGF信号通路基因和蛋白表达上调是血管新生的部分机制[15], 在纤维化形成过程中, 肝血窦的Disse间隙内过多ECM沉积, 使肝脏组织缺氧, 诱导HIF-l 产生, 进而VEGF表达增加, 诱导新生血管的形成[16], 机制可能为HIF-1启动VEGF的转录, 其次是缺氧时VEGF mRNA的稳定性增加, 最后HIF-1还可以上调VEGF受体Flt-1的转录, 该受体可增强VEGF的生物学效应. 其中HIF-1诱导VEGF转录活性的增强和表达增加在肿瘤血管生成中起重要作用.
在缺氧情况下, 组织细胞可出现变性坏死, 同时自由基产生增加, 从而诱发炎症反应, 这些炎症介质能刺激静止的HSC活化, 活化的HSC以及内皮细胞合成并分泌VEGF, 从而促进血管的生成, 分泌的VEGF又能促进活化的HSC增殖. 肝硬化炎症介质的释放, 细胞因子的作用及缺氧共同促成了微血管的新生. 由于肝纤维化区域的新生血管本身未成熟, 无法改善局部的组织缺氧, 呈现血管新生增加, 肝纤维化未消退反而增加的现象. 病理性血管新生可作为慢性肝脏疾病的潜在治疗靶标. HIF-1是相对较新的促血管生长因子的上游调控因子, 纠正肝脏缺氧状态或降低HIF的表达可以使HSC活化减少, 纤维化延缓; 抑制HSC的活化或促进活化HSC凋亡, 下调VEGF165和HIF-1在HSC中的表达可能成为抗血管新生和抗肝纤维化的有效途径. 本实验采用RT-PCR检测HSC药物处理前后VEGF165和HIF-1 mRNA表达的影响, 结果显示药物处理后HSC细胞中VEGF165和HIF-1 mRNA的表达明显下调, 且龙血素B较龙血素A下调效果明显, 说明龙血素A/B可能通过抑制HSC的活化或促进活化HSC凋亡, 下调VEGF165和HIF-1在HSC中的表达来抑制血管新生和抗肝纤维化.
综上所述, 本研究初步观察了龙血素A/B对HSC生长、VEGF165和HIF-1 mRNA表达及HSC上清中纤维化标志物的影响. 结果发现: 龙血素A/B均可抑制HSC的增值并降低其细胞上清中纤维化标志物的含量, 还可下调HSC中VEGF165和HIF-1 mRNA的表达, 且龙血素B的效果较龙血素A明显. 以上作用可能与龙血竭胶囊抑制肝纤维化过程中微血管的新生并延缓肝纤维化有关.
龙血素B是龙血竭黄酮的主要成分, 主要分布于血流量大的脏器, 如肝脏、肾脏等. 多种黄酮类化合物被证实具有明显的防治肝纤维化的作用. 龙血竭能有效地减轻肺纤维化大鼠肺组织的纤维化程度, 龙血素B还能对硫代乙酰胺诱导的大鼠肝纤维化有一定的预防和治疗作用.
管冬元, 副教授, 上海中医药大学基础医学院实验中医学教研室
近年研究发现, 肝星状细胞(HSC)活化同时伴有的内皮细胞活化和新生血管形成是进展性肝纤维化间质重建中最突出的病理特征, 在肝纤维化病理生理中起重要作用. 也有研究表明龙血竭对硫代乙酰胺诱导的肝纤维化有一定的预防和治疗作用.
本实验通过MTT法检测龙血素A/B对肝星状细胞生长的抑制作用, 表明: 龙血素A/B均可抑制HSC增值及活化, 且龙血竭主要成分龙血素B的抑制作用较龙血素A明显, 龙血素B对HSC的抑制可能成为临床抗肝纤维化的新途径.
龙血素A/B均可抑制HSC的增值并降低其细胞上清中纤维化标志物的含量, 还可下调HSC中VEGF165和HIF-1 mRNA的表达, 且龙血素B的效果较龙血素A明显. 以上作用可能与龙血竭胶囊抑制肝纤维化过程中微血管的新生并延缓肝纤维化有关.
本文对中药血竭有效成分龙血素抗肝星状细胞的作用加以研究, 研究目标明确, 具有一定的创新性和科学意义.
编辑: 翟欢欢 电编: 鲁亚静
| 1. | Bataller R, Brenner D A. Liver fibrosis. The Journal of Clinical Investigation. 2005;115:208-218. [DOI] |
| 2. | Medina J, Arroyo AG, Sánchez-Madrid F, Moreno-Otero R. Angiogenesis in chronic inflammatory liver disease. Hepatology. 2004;39:1185-1195. [PubMed] [DOI] |
| 3. | Vanheule E, Geerts AM, Van Huysse J, Schelfhout D, Praet M, Van Vlierberghe H, De Vos M, Colle I. An intravital microscopic study of the hepatic microcirculation in cirrhotic mice models: relationship between fibrosis and angiogenesis. Int J Exp Pathol. 2008;89:419-432. [PubMed] [DOI] |
| 4. | Fernández M, Semela D, Bruix J, Colle I, Pinzani M, Bosch J. Angiogenesis in liver disease. J Hepatol. 2009;50:604-620. [PubMed] [DOI] |
| 5. | 国家药典委员会. 中华人民共和国药典(一部). 北京: 化学工业出版社 2000; 110. |
| 6. | Zheng QA, Li HZ, Zhang YJ, Yang CR. Dracaenogenins A and B, new spirostanols from the red resin of Dracaena cochinchinensis. Steroids. 2006;71:160-164. [PubMed] [DOI] |
| 11. | 杨 波, 郭 建恩, 韩 俊婷, 王 晓峰, 武 冬慧, 赵 文杰, 朱 铁梁. 龙血素A对大鼠局灶性脑缺血再灌注引起的脑损伤及机制探讨. 中药新药与临床药理. 2010;21:103-107. |
| 12. | Lee JS, Semela D, Iredale J, Shah VH. Sinusoidal remodeling and angiogenesis: a new function for the liver-specific pericyte? Hepatology. 2007;45:817-825. [PubMed] [DOI] |
| 14. | Fong GH. Mechanisms of adaptive angiogenesis to tissue hypoxia. Angiogenesis. 2008;11:121-140. [PubMed] [DOI] |
| 16. | Corpechot C, Barbu V, Wendum D, Kinnman N, Rey C, Poupon R, Housset C, Rosmorduc O. Hypoxia-induced VEGF and collagen I expressions are associated with angiogenesis and fibrogenesis in experimental cirrhosis. Hepatology. 2002;35:1010-1021. [PubMed] [DOI] |