修回日期: 2012-02-18
接受日期: 2012-03-06
在线出版日期: 2012-03-28
目的: 研究Fascin蛋白和基质金属蛋白酶9(matrix metallo proteinase-9, MMP-9)在肝门胆管癌组织中的表达及其与肝门胆管癌的临床生物学行为的关系.
方法: 应用SP法检测56例肝门胆管癌及14例正常胆管上皮组织中Fascin和MMP-9的表达.
结果: Fascin和MMP-9在肝门胆管癌中的表达阳性率都明显高于正常胆管上皮组织(58.9% vs 0%, P<0.05)和(73.2% vs 14.3%, P<0.05); 且Fascin和MMP-9在肝门胆管癌中的表达与肿瘤的组织分化程度、淋巴结转移、门静脉浸润有关(P<0.05); Fascin和MMP-9在肝门胆管癌组织中的表达呈正相关(P<0.05).
结论: Fascin和MMP-9在肝门胆管癌的进展、转移中起重要作用, 两者之间起相互协同促进作用.
引文著录: 刘俊, 李灼日, 毛先海. Fascin和MMP-9在肝门胆管癌组织中的表达及临床意义. 世界华人消化杂志 2012; 20(9): 795-799
Revised: February 18, 2012
Accepted: March 6, 2012
Published online: March 28, 2012
AIM: To detect the expression of fascin and matrix metalloproteinase-9 (MMP-9) in hilar cholangiocarcinoma and to analyze their clinical significance.
METHODS: The expression of fascin and MMP-9 was examined by immunohistochemistry in 56 cases of hilar cholangiocarcinoma and 14 cases of normal tissue of the bile duct.
RESULTS: The positive rates of fascin and MMP-9 expression in hilar cholangiocarcinoma were obviously higher than those in normal tissue of the bile duct (58.9% vs 0%, 73.2% vs 14.3%, both P < 0.05). Both fascin and MMP-9 expression were associated with histological grade, lymph node metastasis, and portal vein invasion (all P < 0.05). In hair cholangiocarcinoma, the expression of fascin was positively correlative with that of MMP-9 (P < 0.05).
CONCLUSION: The expression of fascin and MMP-9 in hilar cholangiocarcinoma plays important roles in tumor progression and metastasis.
- Citation: Liu J, Li ZR, Mao XH. Clinical significance of expression of fascin and MMP-9 in hilar cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(9): 795-799
- URL: https://www.wjgnet.com/1009-3079/full/v20/i9/795.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i9.795
肝门胆管癌是胆道外科一种常见的恶性肿瘤, 约占肝外胆管癌的58%-75%[1]. 关于肝门胆管癌的病因至今仍然不清楚, 在我国, 胆管结石、病毒性肝炎、原发性硬化性胆管炎、致癌物质等都可能是其发病原因[2]. 肝门胆管癌早期的浸润转移一个多分子参与的过程. 近年来, 随着分子生物学的发展, 人们对肝内外胆管癌浸润转移的分子机制进行了较为深入的研究, 但对其发生发展的机制仍然不是很清楚. 本研究采用免疫组织化学法检测56例肝门胆管癌组织及14例正常胆管组织中Fascin和基质金属蛋白酶9(metrix metallo proteinase-9, MMP-9)的表达, 旨在探讨其在肝门胆管癌形成过程中的变化规律及其与临床病理特征的相互关系.
收集湖南省人民医院2005-01/2009-01行肝门胆管根治术、病理证实为肝门部胆管癌的存档蜡块56例, 作为实验组进行研究; 另取胆管结石和胆道外伤行内引流术经病理证实的肝门部正常胆管组织14例作为对照组. 56例肝门胆管癌患者中男34例, 女22例. 年龄36-78岁, 中位年龄58岁, 平均肿瘤直径2 cm. Bismuth-Corlette分型:Ⅰ型10例, Ⅱ型12例, Ⅲa型19例, Ⅲb型15例, Ⅳ型0例. 根据Bloom-Richardson分类标准组织分级: 低分化10例, 中分化26例, 高分化20例; 切除标本中伴淋巴结转移24例, 门静脉浸润26例. 所有患者术前均未接受放、化疗及中医中药治疗. 实验组与对照组标本均经过体积分数10%的甲醛溶液固定、石蜡包埋, 4 µm厚连续切片. 鼠抗人Fascin单克隆抗体、鼠抗人MMP-9单克隆抗体、DAB显示剂、即用型免疫组织化学试剂盒均购自福州迈新生物技术公司.
SP染色主要步骤参考试剂盒说明进行, 高倍镜下观察实验结果. 用已知阳性切片作为阳性对照, PBS代替一抗作为阴性对照.
参照文献[3]制定免疫组织化学半定量标准, 根据阳性细胞数所占的百分率和染色强度分别计分. 染色强度分数标准: 棕褐色为3分, 棕黄色为2分, 淡黄色为1分, 无色为0分; 物镜下阳性表达的细胞数占切片总细胞数比例分为5级:无表达细胞为0分, 表达的细胞数占切片总细胞数<25%为1分, 25%-50%为2分, 50%-75%为3分, >75%为4分. 将染色强度积分与阳性数量积分相乘, 所得乘积分为4个级别: 0分记"-"为阴性, l-4分记"+"为弱阳性, 5-8分记"++"为阳性, 9-12分以上记"+++"为强阳性.
统计学处理 应用SPSS17.0统计学软件. χ2检验分析各研究对象间Fascin和MMP-9的表达差异, P<0.05为差异有统计学意义, Fascin和MMP-9之间的相关性用spearman等级相关分析.
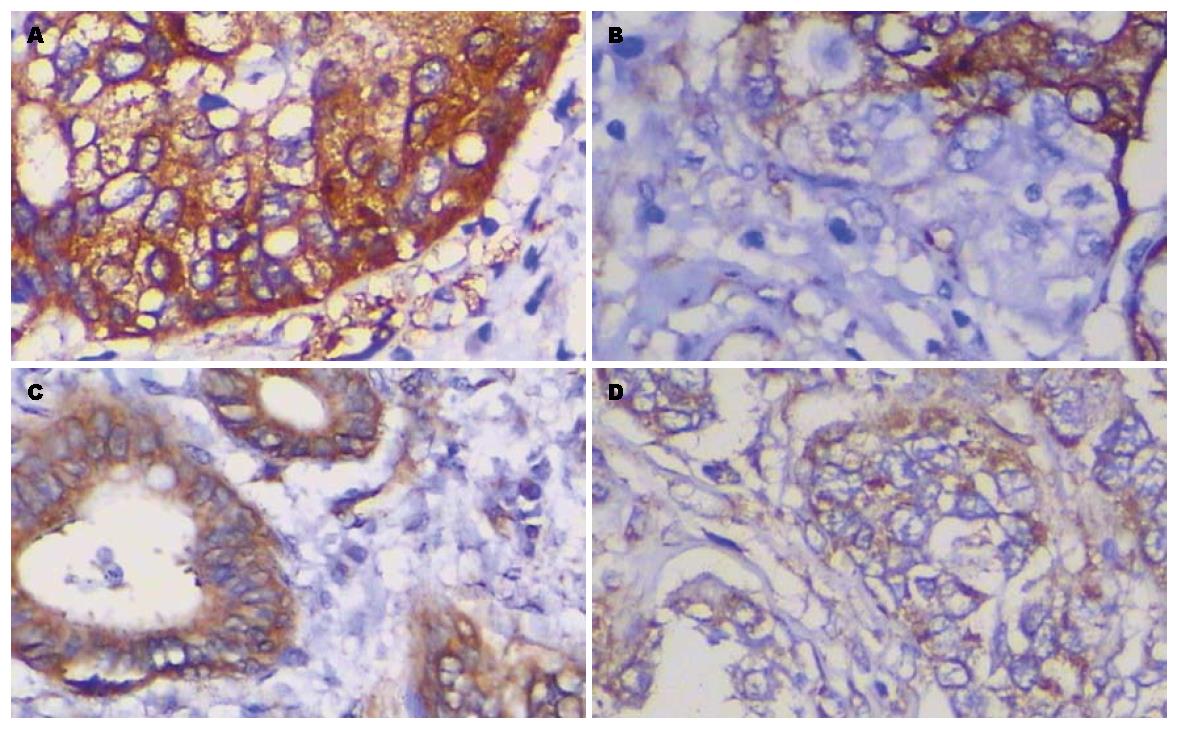
Fascin和MMP-9在肝门胆管癌组织中呈阳性表达的免疫组织化学染色(图1).
Fascin在肝门胆管癌组织中的表达明显增高(58.9% vs 0%, P<0.05), Fascin在肝门胆管癌组织中的表达与患者年龄、性别、肿瘤大小、Bismuth-Corlette分型差异无统计学意义; 与肿瘤组织分化程度、有无门静脉浸润、淋巴结转移差异有统计学意义(表1).
| 临床资料 | n | Fascin表达 | P值 | MMP-9表达 | P值 | ||
| 阳性数 | 阴性数 | 阳性数 | 阴性数 | ||||
| 年龄(岁) | |||||||
| ≤58 | 20 | 11 | 9 | 0.656 | 13 | 7 | 0.427 |
| >58 | 36 | 22 | 14 | 27 | 9 | ||
| 性别 | |||||||
| 男 | 34 | 21 | 13 | 0.592 | 28 | 6 | 0.055 |
| 女 | 22 | 12 | 10 | 13 | 9 | ||
| 肿瘤大小 | |||||||
| ≥2 cm | 19 | 9 | 10 | 0.208 | 12 | 7 | 0.223 |
| <2 cm | 37 | 24 | 13 | 29 | 8 | ||
| 组织学分级 | |||||||
| 高分化 | 20 | 6 | 14 | 0.002 | 9 | 11 | 0.002 |
| 中分化 | 26 | 18 | 8 | 23 | 3 | ||
| 低分化 | 10 | 9 | 1 | 9 | 1 | ||
| Bismuth分型 | |||||||
| Ⅰ型 | 10 | 4 | 6 | 0.533 | 6 | 4 | 0.492 |
| Ⅱ型 | 12 | 7 | 5 | 9 | 3 | ||
| Ⅲa型 | 19 | 13 | 6 | 16 | 3 | ||
| Ⅲb型 | 15 | 9 | 6 | 10 | 5 | ||
| 门静脉浸润 | |||||||
| 有 | 26 | 19 | 7 | 0.045 | 24 | 2 | 0.003 |
| 无 | 30 | 14 | 16 | 17 | 13 | ||
| 淋巴结转移 | |||||||
| 有 | 24 | 18 | 6 | 0.034 | 21 | 3 | 0.037 |
| 无 | 32 | 15 | 17 | 20 | 12 | ||
MMP-9在肝门胆管癌组织中的表达明显增高(73.2% vs 14.3%, P<0.05), MMP-9在肝门胆管癌组织中的表达与患者年龄、性别、肿瘤大小、Bismuth-Corlette分型差异无统计学意义; 与肿瘤组织分化程度、有无门静脉浸润、淋巴结转移差异有统计学意义(表1).
Fascin蛋白属于肌动蛋白结合蛋白家族中的一员, 自20世纪70年代Opassiri等[4]从海胆卵母细胞的细胞质中发现并提纯, 到目前为止, 人类共发现3种不同Fascin编码基因. 人类Fascin基因定位于染色体7q22, 最早从人类畸胎瘤中克隆, 其编码一种进化相对保守的细胞骨架蛋白, 定位于细胞质张力纤维和细胞膜皱褶边缘的丝状伪足(Filipodium)、微棘的核心肌动蛋白束中[5]. 研究表明, Fascin在细胞的运动, 黏附以及细胞间的信息交流中担任着重要角色[6].
Fascin在不同类型的细胞中表达不一致, 在一些正常上皮组织来源的细胞中不表达或低表达, 而在一些血管内皮细胞、骨骼平滑肌细胞、神经胶质细胞中高表达[7]. 近年来研究发现Fascin蛋白在许多上皮性肿瘤细胞中也表达上调, 并与肿瘤侵袭及转移有关. Fascin蛋白的表达上调具有一定的组织特异性, 在不同组织来源的肿瘤细胞中, Fascin蛋白的表达率具有较大差异性. 例如, 侵袭性胰腺导管癌中有95%出现Fascin蛋白过表达[8],Ⅰ期非小细胞肺癌中Fascin蛋白阳性表达率约89%[9], 而在胃癌组织中, Fascin蛋白阳性表达率仅为29%左右[10].
肿瘤细胞浸润、转移是一个动态的、复杂的多阶段过程. 通常认为, 在这个过程中肿瘤细胞必须先从原始位置脱离下来, 穿过细胞外基质和基膜, 并浸润周围其他组织、淋巴管和血管. 基底膜和细胞外基质的降解是组织浸润过程中的关键步骤. MMPs是一组在结构上具有较高的同源性、几乎能够水解绝大多数细胞外基质(extracellular matrix, ECM)的内肽酶的总称, 其结构的完整性有赖于锌离子的存在[11]. 到目前为止, 人类至少发现MMPs有28种之多, 按作用底物的不同主要分为5大类[12]: 胶原酶类、明胶酶类、基质降解素类、膜型基质金属蛋白酶类和其他酶类, 其中MMP-9属于明胶酶类.
MMPs具有广泛的生物学效应, 参与许多生理及病理过程, 如胚胎发育、创伤修复、血管形成、组织模型再塑及恶性肿瘤浸润转移等. MMP-9分子量为92 kDa, 作为基质金属蛋白酶家族成员中重要一员, 因其主要生理功能可以降解Ⅳ型胶原和明胶, 亦称Ⅳ型胶原酶或明胶酶B[13]. 而MMP-9通过对细胞外基质的降解促使肿瘤细胞对周围组织浸润, 进而向远处浸润转移[14]. 随着对MMPs家族研究的深入, MMP-9被认为是肿瘤侵袭和转移的一个重要分子靶标. 如果能降低其表达, 有可能会有效地抑制肿瘤的侵袭和转移.
国内外关于Fascin与MMP-9的相关性表达研究较少, Xie等[15]应用RNA干扰技术使食管癌细胞株EC109中高表达的Fascin基因沉默, 发现培养的肿瘤细胞形态发生改变, 细胞膜的前突减少, 进一步研究发现降低Fascin的表达可以导致MMP-9和MMP-2不易激活, 最终导致侵袭降低. 虽然具体的作用机制还不清楚, 但是可以推测两者之间表达可能存在着某种联系. 通过本研究提示, Fascin与MMP-9在肝门胆管癌中的表达呈正相关, 两者共同表达于癌细胞的胞浆中, 可能Fascin的表达上调可激活MMP-9, 而MMP-9的激活导致细胞基底膜的降解, 促使肿瘤细胞的侵袭转移, 另外Fascin本身也可以通过增加细胞的运动活性, 促使肿瘤细胞的转移. 以上假设尚需进一步实验研究证实. 本文关于Fascin和MMP-9在肝门胆管癌组织中的研究还不足以解释肿瘤细胞的发生发展机制, 且两者在促进肿瘤发生发展的具体机制还有待于进一步研究.
肝门胆管癌是胆道外科一种常见的恶性肿瘤, 其恶性程度高、病变进展快. 因而, 临床需要有更多更好的检测手段来评价预后、指导治疗.
张国梁, 主任医师, 天津市第一中心医院消化内科
近年来, 随着分子生物学的发展, 人们对肝内外胆管癌浸润转移的分子机制进行了较为深入的研究, 但对其发生发展的机制仍然不是很清楚.
本文着重研究Fascin及MMP-9这2个指标在肝门胆管癌中的表达, 结果显示, 两者在肝门胆管癌的进展、转移中起重要作用, 联合检测可用于评价肝门胆管癌的预后、指导治疗.
本文主要研究Fascin和MMP-9在肝门胆管癌组织中的表达情况, 设计合理, 层次分明, 具有一定创新性.
编辑: 张珊珊 电编: 闫晋利
| 2. | Singh P, Patel T. Advances in the diagnosis, evaluation and management of cholangiocarcinoma. Curr Opin Gastroenterol. 2006;22:294-299. [PubMed] [DOI] |
| 4. | Opassiri R, Pomthong B, Akiyama T, Nakphaichit M, Onkoksoong T, Ketudat Cairns M, Ketudat Cairns JR. A stress-induced rice (Oryza sativa L.) beta-glucosidase represents a new subfamily of glycosyl hydrolase family 5 containing a fascin-like domain. Biochem J. 2007;408:241-249. [PubMed] [DOI] |
| 5. | Hashimoto Y, Skacel M, Adams JC. Roles of fascin in human carcinoma motility and signaling: prospects for a novel biomarker? Int J Biochem Cell Biol. 2005;37:1787-1804. [PubMed] [DOI] |
| 6. | Vignjevic D, Kojima S, Aratyn Y, Danciu O, Svitkina T, Borisy GG. Role of fascin in filopodial protrusion. J Cell Biol. 2006;174:863-875. [PubMed] [DOI] |
| 7. | Gunal A, Onguru O, Safali M, Beyzadeoglu M. Fascin expression [corrected] in glial tumors and its prognostic significance in glioblastomas. Neuropathology. 2008;28:382-386. [PubMed] [DOI] |
| 8. | Grothey A, Hashizume R, Sahin AA, McCrea PD. Fascin, an actin-bundling protein associated with cell motility, is upregulated in hormone receptor negative breast cancer. Br J Cancer. 2000;83:870-873. [PubMed] [DOI] |
| 9. | Li R, Li G, Deng L, Liu Q, Dai J, Shen J, Zhang J. IL-6 augments the invasiveness of U87MG human glioblastoma multiforme cells via up-regulation of MMP-2 and fascin-1. Oncol Rep. 2010;23:1553-1559. [PubMed] [DOI] |
| 10. | Hashimoto Y, Shimada Y, Kawamura J, Yamasaki S, Imamura M. The prognostic relevance of fascin expression in human gastric carcinoma. Oncology. 2004;67:262-270. [PubMed] [DOI] |
| 11. | Mitsiades N, Yu WH, Poulaki V, Tsokos M, Stamenkovic I. Matrix metalloproteinase-7-mediated cleavage of Fas ligand protects tumor cells from chemotherapeutic drug cytotoxicity. Cancer Res. 2001;61:577-581. [PubMed] |
| 12. | Hagemann C, Anacker J, Haas S, Riesner D, Schömig B, Ernestus RI, Vince GH. Comparative expression pattern of Matrix-Metalloproteinases in human glioblastoma cell-lines and primary cultures. BMC Res Notes. 2010;3:293. [PubMed] [DOI] |
| 13. | Nguyen J, Gogusev J, Knapnougel P, Bauvois B. Protein tyrosine kinase and p38 MAP kinase pathways are involved in stimulation of matrix metalloproteinase-9 by TNF-alpha in human monocytes. Immunol Lett. 2006;106:34-41. [PubMed] [DOI] |
| 14. | Tummalapalli P, Gondi CS, Dinh DH, Gujrati M, Rao JS. RNA interference-mediated targeting of urokinase plasminogen activator receptor and matrix metalloproteinase-9 gene expression in the IOMM-lee malignant meningioma cell line inhibits tumor growth, tumor cell invasion and angiogenesis. Int J Oncol. 2007;31:5-17. [PubMed] [DOI] |
| 15. | Xie JJ, Xu LY, Zhang HH, Cai WJ, Mai RQ, Xie YM, Yang ZM, Niu YD, Shen ZY, Li EM. Role of fascin in the proliferation and invasiveness of esophageal carcinoma cells. Biochem Biophys Res Commun. 2005;337:355-362. [PubMed] [DOI] |