修回日期: 2012-02-18
接受日期: 2012-03-06
在线出版日期: 2012-03-28
目的: 研究HBV cccDNA水平及临床因素对肝细胞癌术后预后的影响.
方法: 回顾性分析2003-2006年我院收治60例术后病理证实原发性肝癌患者, 采用荧光定量PCR检测乙型肝炎病毒(hepatitis B virus, HBV)共价闭合环状DNA(cccDNA)和HBV DNA; 55例获得完整随访, 选择血清HBV DNA、肝组织cccDNA及临床、病理特征等指标分析其对无瘤生存率、总体生存率的影响. 采用Kaplan-Meier法计算无瘤生存率、总体生存率, Log-rank检验比较组间差异, 多因素分析采用Cox回归模型.
结果: 血清cccDNA仅有1例阳性(1/35), 肝癌组织cccDNA阳性率20.0%(11/55), 肝癌组织cccDNA与血清HBV DNA之间存在相关性(r = 0.364; P = 0.006). 全组1、3、5年总体生存率为73%、51%和38%, 无瘤生存率为63%、29%和19%; 多因素分析结果表明, 肿块数目(P = 0.011)、血管侵犯(P = 0.001)是影响术后总体生存率的独立危险因素; 癌组织cccDNA水平(P = 0.007)、生长方式(P = 0.002)是影响术后无瘤生存率的独立危险因素.
结论: 单发肿瘤、无血管侵犯的患者术后总体生存率较高. 癌组织cccDNA水平<3log10 copies/μg、肝癌膨胀性生长的患者术后无瘤生存率较高.
引文著录: 白彦楼, 高英堂, 李莹, 王毅军, 韩涛, 任超逸, 杜智. HBV cccDNA的水平及临床因素对肝细胞癌术后预后的判断价值. 世界华人消化杂志 2012; 20(9): 729-736
Revised: February 18, 2012
Accepted: March 6, 2012
Published online: March 28, 2012
AIM: To investigate the correlation of HBV cccDNA and clinical factors with the survival of patients with hepatocellular carcinoma (HCC) after hepatectomy.
METHODS: A retrospective analysis was carried out in 60 HCC patients who underwent radical operation from 2003 to 2006 at our hospital. Serum HBV DNA and covalently closed circular DNA (cccDNA) levels were detected by real-time PCR. In 55 patients with complete follow-up data, serum HBV DNA, cccDNA in liver tissue and clinical characteristics were retrospectively analyzed. The overall survival and recurrence-free survival (RFS) were calculated using the Kaplan-Meier method. All the data were analyzed using Log-rank test and Cox regression model.
RESULTS: HBV cccDNA was positive in only one serum sample (1/35) and in 20% (11/55) of tumor tissues. There was a significant correlation between intrahepatic cccDNA in tumor tissue and total HBV DNA in serum (r = 0.364, P = 0.006). The 1-, 3-, 5-year overall survival and RFS rates for 55 patients after HCC resection were 73%, 51% and 38%, and 63%, 29% and 19%, respectively. The independent prognostic factor influencing RFS was the level of intrahepatic cccDNA in tumor tissue. The independent prognostic factors influencing overall survival were tumor numbers and vessel invasion.
CONCLUSION: HCC patients with solitary tumor and without vessel invasion showed a higher overall survival. HCC patients with an intrahepatic HBV cccDNA level of less than 1 000 copies/μg had a higher RFS.
- Citation: Bai YL, Gao YT, Li Y, Wang YJ, Han T, Ren CY, Du Z. Significance of HBV cccDNA and clinical factors in evaluating prognosis of hepatocelluar carcinoma following surgical resection. Shijie Huaren Xiaohua Zazhi 2012; 20(9): 729-736
- URL: https://www.wjgnet.com/1009-3079/full/v20/i9/729.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i9.729
手术切除为肝细胞癌(hepatocellular carcinoma, HCC)的主要治疗手段, 随着手术和围手术期管理技术的提高, 在一定程度上提高了患者术后长期生存率[1]. 与其他肿瘤相比, HCC有较高复发率并缺乏有效的辅助治疗, HCC患者术后长期生存率仍不满意[2]. 术后高复发率是最终导致患者死亡的重要原因. 目前文献报道与肝癌术后复发相关的主要因素包括: 肿瘤大小、结节数目、血管浸润、肿瘤有无包膜和术前AFP水平等[3-5]. 在我国, 乙型肝炎病毒(hepatitis B virus, HBV)感染及其导致的肝脏病变与肝癌密切相关, Kubo等[6,7]报道高水平HBeAg、HBV DNA是影响肝癌术后预后的独立危险因素. 但对作为HBV复制模板的共价闭合环状DNA(covalently closed circular DNA, cccDNA)与肝癌术后预后的关系, 仅有Hosaka等[8]报道在接受抗病毒治疗的肝癌患者中, 经局部消融治疗或手术治疗后, 高水平的肝组织内cccDNA有较高复发率(P = 0.0438). 本文对我院肝胆外科收治的60例经根治性切除的HCC患者, 定量测定肝组织cccDNA水平, 回顾性分析临床病理因素, 以期发现影响肝癌切除术预后的因素, 特别是cccDNA对肝癌切除术预后的影响, 为原发性肝癌的临床综合治疗及判断预后提供依据.
收集60例天津市第三中心医院2003-12/2006-08住院的乙型肝炎相关性HCC患者, 诊断依据病史、临床表现、实验室检查、B超或CT等影像学检查、组织学病理检查结果[9]. 记录患者术前Child-Pugh分级、是否肝硬化、AFP、肿瘤数目、大小、生长方式等指标, 所有HCC病例留取新鲜的癌组织、癌旁组织和外周血标本, 于-80 ℃冰箱保存. 组织病理学诊断均为原发性肝细胞癌, 肿瘤组织切除完整, 手术切缘处无癌细胞残留. 所有标本取材均通过医院伦理委员会审核, 家属签字知情同意. HBV DNA荧光定量检测试剂盒购自上海科华公司; 限制性内切酶Hind Ⅲ酶购自Toyobo公司; 不降解质粒的ATP依赖的DNA酶购自Epioentre公司; Realtime PCR Master Mix购自Toyobo公司; ABI7000荧光定量PCR扩增仪购自ABI公司.
1.2.1 HBV DNA、cccDNA定量检测: 参照文献[10]进行实时荧光定量PCR分析, 简述如下: (1)血清标本处理: 参照HBV DNA荧光定量检测试剂盒说明书提取血清HBV DNA, -20 ℃保存; (2)肝组织标本处理: 提取肝组织DNA, 行限制性内切酶Hind Ⅲ酶切及不降解质粒的ATP依赖的DNA酶(Plasmid-safeTM ATP-Dependent DNase, PSAD)酶切, 设置阴性空白对照和重组质粒阳性对照; (3)荧光定量PCR检测: 应用ABI7000荧光定量PCR扩增仪进行检测. 反应体系: 上游引物1 μL、下游引物1 μL、探针1 μL、Realtime PCR Master Mix 20 μL、模板2 μL, 总反应体积25 μL. 反应条件: 37 ℃保温5 min; 94 ℃预变性2 min, 然后94 ℃变性15 s、60 ℃延伸40 s, 45个循环. 每次实验检测均设空白对照.
1.2.2 随访观察: 所有患者均在门诊检测复发指标, 每月复查血清AFP, 2-4 mo复查1次B超或强化CT, 必要时行MRI、肝动脉造影, 未能按时复查者则电话随访. 总体生存时间计算: 自手术至死亡或最后随访日. 复发以影像学检查(B超、CT、胸片)发现复发病灶, 必要时行经皮穿刺组织学活检. 无瘤生存时间的计算: 自手术至复发事件出现之日. 随访截止日期为2011-08-17.
统计学处理 所有资料应用SPSS16.0统计软件分析, 符合正态分布数据, 变量值用mean±SD表示, 两组间比较采用t检验; 不符合正态分布计量资料, 用四分位数表示, 2组间比较采用Mann-Whitney检验; 相关性分析采用Spearman检验; 计数资料分析采取χ2检验或Fisher确切概率法; 累积生存率采用寿命表法; 单因素分析采用Kaplan-Meier, 差异显著性用Log-rank法检验, 将单因素分析有统计学意义的变量引人Cox比例风险模型, 进行多因素分析, P<0.05为差异有统计学意义.
60例患者中男性51人, 女性9人, 年龄22-75岁, 平均年龄53.37岁±11.49岁. 5例死因与癌无关, 其余病例经过规律随访, 获得完整的随访资料, 最长随访时间88 mo. HCC患者癌组织cccDNA<3log10 copies/μg组及≥3log10 copies/μg组的组间血清HBV DNA、癌组织总HBV DNA、癌旁组织总HBV DNA、癌旁组织cccDNA差异有统计学意义, 其余临床资料差异无统计学意义(表1). 1、3、5年无瘤生存率分别为63%、29%和19%, 中位无瘤生存期16.0 mo; 1、3、5年总体生存率分别为73%、51%和38%, 中位总体生存期36.3 mo, 生存期超过6年9例, 生存期超过7年2例.
| 因素 | 癌组织cccDNA | ||
| <3log10 copies/μg(n = 44) | ≥3log10 copies/μg(n = 11) | P值 | |
| 性别 男(%) | 37(84.1) | 9(81.8) | 1.000 |
| 年龄(年) | 52.4±11.5 | 51.4±9.7 | 0.770 |
| 表面抗原 阳性(%) | 33(75) | 11(100) | 0.096 |
| Child分级A(%) | 34(77.3) | 10(90.9) | 0.555 |
| AFP(μg/L) | 70.72(10.66-4001) | 401(14.04-1144.9) | 0.552 |
| 肝硬化 有(%) | 39(88.6) | 11(100) | 0.571 |
| 生长方式 膨胀性(%) | 20(45.5) | 7(63.6) | 0.281 |
| 肿块直径(cm) | 9.2±6.0 | 8.1±4.9 | 0.603 |
| 肿块数目 单发(%) | 29(65. 9) | 6(54.5) | 0.726 |
| 血管侵犯 无(%) | 30(68.2) | 7(63.6) | 1.000 |
| TNM分期 I(%) | 21(47.7) | 4(36.4) | 0.498 |
| 病理分级 | 0.788 | ||
| 1 | 16(36.4) | 4(36.4) | |
| 2 | 16(36.4) | 5(45.5) | |
| 3 | 12(27.3) | 2(18.2) | |
| 血清HBV DNA | |||
| (log10 copies/mL) | 3.59(0-5.24) | 5.07(4.78-6.36) | 0.007 |
| 癌组织总HBV DNA | |||
| (log10 copies/μg) | 6.258±1.512 | 7.71±0.850 | 0.003 |
| 癌旁组织总HBV DNA | |||
| (log10 copies/μg) | 6.062±1.458 | 7.68±1.515 | 0.001 |
| 癌旁组织cccDNA | |||
| (log10 copies/μg) | 0(0-2.93) | 3.90(0-4.32) | 0.020 |
血清HBV DNA阳性率69.1%(38/55), 38例阳性病例定量值(5.0±1.4) copies/mL, 而35例血清中cccDNA仅有1例阳性(1/35), 定量值2.7log10 copies/mL; 癌组织总HBV DNA阳性率100.0%(55/55), 定量值(6.6±1.5)log10 copies/μg, 癌组织cccDNA阳性率20.0%(11/55), 11例阳性病例定量值(4.71±1.64)log10 copies/μg; 癌旁组织总HBV DNA阳性率100.0%(55/55), 定量值(6.4±1.5)log10 copies/μg, 癌旁组织cccDNA阳性率36.4%(20/55), 20例阳性病例定量值(4.22±1.13)log10 copies/μg. 癌组织cccDNA与血清HBV DNA之间存在相关性(r = 0.364; P = 0.006); 癌组织cccDNA与癌旁cccDNA之间存在相关性(r = 0.319; P = 0.018).
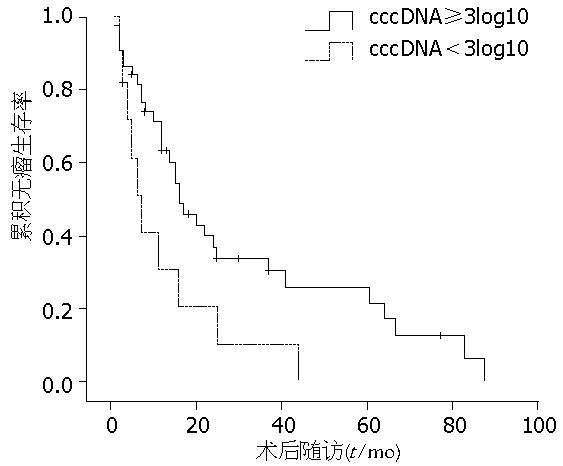
单因素分析显示术前AFP水平(P = 0.039)、生长方式(P<0.001)、肿块数目(P = 0.005)、血管侵犯(P<0.001)、TNM分期(P = 0.007)、肿块直径(P = 0.028)是影响术后总体生存率的预后因素(表2). Cox模型多因素分析显示肿块数目(P = 0.011)、血管侵犯(P = 0.001)是影响术后总体生存率的危险因素(表3). 单因素分析显示癌组织cccDNA水平(P = 0.028)、术前AFP水平(P = 0.021)、生长方式(P = 0.019)、肿块数目(P = 0.006)、血管侵犯(P = 0.048)、TNM分期(P = 0.027)、病理分级(P = 0.030)是术后无瘤生存率的预后因素(表4, 图1). Cox模型多因素分析显示癌组织cccDNA水平(P = 0.007)、生长方式(P = 0.002)是影响术后无瘤生存率的危险因素(表5).
| 因素 | 1年总体生存率 | 3年总体生存率 | 5年总体生存率 | χ2值 | P值 |
| 性别 | |||||
| 男 | 74 | 52 | 37 | 0.015 | 0.901 |
| 女 | 67 | 44 | 44 | ||
| 年龄 | |||||
| ≥60 | 86 | 64 | 50 | 1.236 | 0.266 |
| <60 | 68 | 46 | 34 | ||
| 表面抗原 | |||||
| 阳性 | 69 | 44 | 36 | 0.042 | 0.838 |
| 阴性 | 67 | 67 | 50 | ||
| Child 分级 | |||||
| A | 73 | 50 | 39 | 0.009 | 0.922 |
| B | 73 | 55 | 36 | ||
| 术前AFP水平(μg/ L) | |||||
| ≥400 | 52 | 39 | 26 | 4 247 | 0.039 |
| <400 | 88 | 59 | 47 | ||
| 肝硬化 | |||||
| 有 | 72 | 50 | 36 | 0.782 | 0.377 |
| 无 | 80 | 60 | 60 | ||
| 生长方式 | |||||
| 浸润 | 54 | 29 | 18 | 14.481 | <0.001 |
| 膨胀 | 93 | 74 | 59 | ||
| 肿块数目 | |||||
| 1 | 80 | 60 | 51 | 7.787 | 0.005 |
| >1 | 60 | 35 | 15 | ||
| 肿块直径 | |||||
| ≥5 | 67 | 42 | 30 | 4.848 | 0.028 |
| <5 | 92 | 83 | 67 | ||
| 血管侵犯 | |||||
| 有 | 33 | 22 | 17 | 14.773 | <0.001 |
| 无 | 92 | 65 | 48 | ||
| TNM分期 | |||||
| 1 | 92 | 68 | 56 | 7.337 | 0.007 |
| 2 | 57 | 37 | 23 | ||
| 病理分级 | |||||
| 1 | 90 | 70 | 55 | 5.666 | 0.059 |
| 2 | 62 | 29 | 24 | ||
| 3 | 64 | 57 | 36 | ||
| 血清总HBV DNA(log10 copies/mL) | |||||
| ≥5 | 63 | 37 | 32 | 1.065 | 0.425 |
| <5 | 78 | 58 | 41 | ||
| 癌组织总HBV DNA(log10 copies/μg) | |||||
| ≥5 | 74 | 48 | 37 | 0.176 | 0.675 |
| <5 | 67 | 67 | 44 | ||
| 癌旁组织总HBV DNA(log10 copies/μg) | |||||
| ≥5 | 76 | 51 | 38 | 0.001 | 0.979 |
| <5 | 60 | 50 | 40 | ||
| 癌组织cccDNA(log10 copies/μg) | |||||
| ≥3log10 | 55 | 45 | 27 | 0.77 | 0.38 |
| <3log10 | 77 | 52 | 41 | ||
| 癌旁组织cccDNA(log10 copies/μg) | |||||
| ≥3log10 | 71 | 53 | 41 | 0.068 | 0.794 |
| <3log10 | 74 | 50 | 37 | ||
| 因素 | 回归系数 | 标准误 | Wald值 | P值 | 相对危险度 |
| 肿块数目 | 0.889 | 0.349 | 6.467 | 0.011 | 2.432 |
| 血管侵犯 | 1.248 | 0.360 | 12.019 | 0.001 | 3.483 |
| 因素 | 1年无瘤生存率 | 3年无瘤生存率 | 5年无瘤生存率 | χ2值 | P值 |
| 性别 | |||||
| 男 | 63 | 35 | 24 | 1.392 | 0.238 |
| 女 | 66 | 0 | 0 | ||
| 年龄 | |||||
| ≥60 | 71 | 27 | 27 | 0.656 | 0.418 |
| <60 | 60 | 30 | 15 | ||
| 表面抗原 | |||||
| 阳性 | 60 | 30 | 19 | 0.138 | 0.710 |
| 阴性 | 73 | 20 | 20 | ||
| Child 分级 | |||||
| A | 62 | 25 | 13 | 3.5 | 0.061 |
| B | 68 | 43 | 43 | ||
| 肝硬化 | |||||
| 有 | 63 | 30 | 20 | 0.399 | 0.527 |
| 无 | 60 | 0 | 0 | ||
| 术前AFP水平(μg/L) | |||||
| ≥400 | 37 | 21 | 11 | 5.353 | 0.021 |
| <400 | 80 | 33 | 23 | ||
| 生长方式 | |||||
| 浸润 | 44 | 17 | 17 | 5.465 | 0.019 |
| 膨胀 | 81 | 40 | 23 | ||
| 肿块数目 | |||||
| 1 | 76 | 34 | 30 | 7.537 | 0.006 |
| >1 | 38 | 17 | 0 | ||
| 肿块直径(cm) | |||||
| ≥5 | 58 | 29 | 17 | 2.243 | 0.134 |
| <5 | 81 | 28 | 28 | ||
| 血管侵犯 | |||||
| 有 | 38 | 15 | 15 | 3.917 | 0.048 |
| 无 | 74 | 34 | 22 | ||
| TNM分期 | |||||
| 1 | 87 | 34 | 27 | 4.887 | 0.027 |
| 2 | 41 | 24 | 12 | ||
| 病理分级 | |||||
| 1 | 84 | 37 | 37 | 7.033 | 0.030 |
| 2 | 54 | 20 | 0 | ||
| 3 | 47 | 29 | 10 | ||
| 血清总HBV DNA(log10 copies/mL) | |||||
| ≥5 | 42 | 7 | 7 | 4.51 | 0.125 |
| <5 | 74 | 39 | 25 | ||
| 癌组织总HBV DNA(log10 copies/μg) | |||||
| ≥5 | 65 | 22 | 22 | 0.001 | 0.975 |
| <5 | 62 | 31 | 18 | ||
| 癌旁组织总HBV DNA(log10 copies/μg) | |||||
| ≥5 | 61 | 26 | 26 | 1.023 | 0.312 |
| <5 | 66 | 32 | 13 | ||
| 癌组织cccDNA(log10 copies/μg) | |||||
| ≥3 | 31 | 10 | 0 | 4.802 | 0.028 |
| <3 | 71 | 33 | 25 | ||
| 癌旁组织cccDNA(log10 copies/μg) | |||||
| ≥3 | 61 | 23 | 23 | 0.462 | 0.497 |
| <3 | 64 | 31 | 18 | ||
| 因素 | 回归系数 | 标准误 | Wald值 | P值 | 相对危险度 |
| 生长方式 | 1.491 | 0.488 | 9.332 | 0.002 | 4.442 |
| 癌组织cccDNA | 1.248 | 0.466 | 7.184 | 0.007 | 3.484 |
影响肝癌术后预后的因素较多, 在肿瘤性因素中, 如肿瘤大小、结节数目、血管浸润、肿瘤有无包膜、术前AFP水平等对总体生存率和无瘤生存率有着显著影响[3-5]. 在非肿瘤性因素中, HBV感染与肝癌预后有密切的联系[11], 高水平HBeAg、HBV DNA病例肝癌预后较差[5,12]. Hosaka等[8]报道高水平的肝组织内cccDNA患者有较高复发率, 但仅55例病例纳入研究, 结论尚需进一步论证.
在本研究的55例获完整随访病例中, 最长随访时间88 mo, 5年生存率38%, 与樊嘉等[13](41.76%)报道近似. 在肿瘤因素方面, Shah等[14]报道肿瘤数目、血管侵犯是影响HCC切除术后患者总体生存率的重要因素. Ercolani等[4]报道肿瘤包膜与无瘤生存率显著相关. 本组资料通过多因素分析结果证实, 肿块数目、血管侵犯是影响肝癌术后总体生存率的独立危险因素, 生长方式(即肿瘤有无包膜)是影响肝癌术后无瘤生存率的独立危险因素, 提示尽管手术已切除肿瘤, 但肿瘤细胞在术前已沿血管或淋巴管播散至肝内外, 并继续发展, 形成复发转移灶. 部分临床因素对肝癌预后的影响文献报道不一, Hanazaki等[15]报道AFP>1000 μg/L和血管浸润是影响患者生存的独立负相关因素; 而>1 000 μg/L是唯一影响无瘤生存期的独立预后因素. 然国内多因素研究未见AFP值与预后有关[16]. Kim等[17]报道, 肿瘤的大小与HCC患者的无瘤生存期有着密切关系, 而Ercolani等[4]报道未见肿瘤的大小与HCC患者的无瘤生存期有关. 本组资料未见AFP、肿瘤的大小与预后有关.
由于抗病毒治疗在较短时间内可引起HBV DNA载量较大变化, 单次测定很难反映较长时间内HBV DNA水平. 相对于单次测定HBV DNA载量, 持续监测可能更好地反映HBV引起的慢性肝脏损害以及由于慢性肝脏损害而导致的肝硬化及HCC. Kim等[18]报道在除外抗病毒治疗病例后, 持续高载量血清HBV DNA是增加肝癌术后晚期复发率的独立危险因素. Hosaka等[8]报道在接受抗病毒治疗的患者中, 多因素分析表明血清HBV DNA水平与肝癌复发无相关性, 而高水平肝组织内cccDNA的患者有较高复发率(P = 0.0438). 在本组病例中血清总HBV DNA水平、肝组织总HBV DNA水平不是影响肝癌术后预后的因素, 可能与本组部分患者HBV DNA水平波动有关. HBV cccDNA在被感染肝细胞内的持续存在是慢性乙型肝炎患者持续感染的原因[19], 而抗病毒药物对肝组织cccDNA水平影响较小[20,21], 术后肝组织cccDNA水平可以代表较长时间内cccDNA水平. 在血清HBV DNA存在波动时, 肝组织内cccDNA仍可独立影响肝癌预后. 在本研究中肝癌组织cccDNA水平是影响肝癌术后无瘤生存率的独立危险因素(P = 0.007), 肝癌组织cccDNA水平<3log10 copies/μg组患者术后无瘤生存率较高. 虽然在总体生存率方面, cccDNA<3log10 copies/μg组患者术后1、3、5年总体生存率均较高, 但对肝癌术后总体生存率影响无统计学意义, 延长随访时间可能会更好的界定这些患者的生存获益.
肝癌组织cccDNA影响肝癌预后的原因可能有以下几个方面: (1)cccDNA的形成是HBV侵入细胞后在细胞内进行复制的起始步骤, 是建立病毒感染状态的最重要标志[22], 也是HBV持续和稳定存在的标志[23]. Kim等[18]报道血清乙型肝炎病毒持续存在是肝癌术后晚期复发的独立危险因素. cccDNA可能通过整合入肝细胞基因组导致肝癌, 文献报道在81%的肿瘤组织中, HBV仅以cccDNA的形式存在, cccDNA在肝癌的形成中可能起直接的作用[24]; (2)cccDNA也可以转录编码HBsAg、HBcAg、HBeAg的RNA, HBsAg、HBcAg、HBeAg可以加重炎症反应, 持续的炎症反应和纤维化可加重患者病情并促进肿瘤的发生[25]; (3)cccDNA可以转录编码HBx的RNA, HBx蛋白与肿瘤新生血管的生成和侵袭转移密切相关[26]. 潘爱萍等[27]报道在癌及癌旁组织中, HBx蛋白表达阳性者cccDNA水平均明显高于HBx蛋白表达阴性者(P<0.05), 同时发现HBx蛋白的表达与cccDNA水平呈正相关(r = 0.778, P<0.01), 推测cccDNA可能通过增加HBx蛋白的表达而致癌.
本研究同时发现肝癌组织cccDNA水平与血清HBV DNA之间存在相关性, 但相关系数仅为0.364, 两者相关度较低, 变化并不完全一致, 单纯血清HBV DNA很难反应肝癌组织cccDNA水平, 这与Chan等[28]持相同观点. 肝癌组织cccDNA水平的定量测定是有必要的.
总之, 尽管本组病例样本量较小, 但通过5年以上的随访观察, 单发肿瘤、无血管侵犯的患者术后总体生存率较高; 癌组织cccDNA水平<3log10 copies/μg、肝癌膨胀性生长的患者术后无瘤生存率较高. 更准确的结果有待大样本、多中心的临床病例分析.
与肝癌术后复发相关的主要因素包括: 肿瘤大小、结节数目、血管浸润、肿瘤有无包膜和术前AFP水平等. HBeAg、HBV DNA、cccDNA也是影响肝癌预后的相关因素.
杨江华, 副教授, 皖南医学院弋矶山医院感染科
Hosaka等报道在接受抗病毒治疗的患者中, 多因素分析表明血清HBV DNA水平与肝癌复发无相关性, 而高水平肝组织内cccDNA的患者有较高复发率.
本研究应用实时荧光定量PCR法检测肝癌组织cccDNA水平, 证明其是影响肝癌术后无瘤生存率的独立危险因素.
抗病毒药物对肝组织cccDNA水平影响较小, 术后肝组织cccDNA水平可以代表较长时间内cccDNA水平. 在血清HBV DNA存在波动时, 肝组织内cccDNA水平仍可用于评价肝癌预后.
HBV cccDNA: 乙型肝炎病毒共价闭合环状DNA. 病毒颗粒脱去外膜进入胞质, 在胞质内脱去核壳, 形成HBV rcDNA. rcDNA进入肝细胞核解脱负链5'端连接的末端蛋白、正链5'端的RNA寡聚物, 在宿主和病毒DNA聚合酶作用下, 以负链DNA为模板, 延长正链DNA, 将缺口封闭, 形成cccDNA. cccDNA是HBV的原始复制模板.
本研究有一定的创新性, 对临床上肝癌的早期诊断和治疗提供了较可靠的参考依据.
编辑: 张珊珊 电编: 闫晋利
| 1. | Fan ST, Mau Lo C, Poon RT, Yeung C, Leung Liu C, Yuen WK, Ming Lam C, Ng KK, Ching Chan S. Continuous improvement of survival outcomes of resection of hepatocellular carcinoma: a 20-year experience. Ann Surg. 2011;253:745-758. [PubMed] [DOI] |
| 2. | Poon RT. Prevention of recurrence after resection of hepatocellular carcinoma: a daunting challenge. Hepatology. 2011;54:757-759. [PubMed] [DOI] |
| 3. | Yamanaka N, Okamoto E, Toyosaka A, Mitunobu M, Fujihara S, Kato T, Fujimoto J, Oriyama T, Furukawa K, Kawamura E. Prognostic factors after hepatectomy for hepatocellular carcinomas. A univariate and multivariate analysis. Cancer. 1990;65:1104-1110. [PubMed] [DOI] |
| 4. | Ercolani G, Grazi GL, Ravaioli M, Del Gaudio M, Gardini A, Cescon M, Varotti G, Cetta F, Cavallari A. Liver resection for hepatocellular carcinoma on cirrhosis: univariate and multivariate analysis of risk factors for intrahepatic recurrence. Ann Surg. 2003;237:536-543. [PubMed] [DOI] |
| 5. | Poon RT, Fan ST, Lo CM, Liu CL, Ng IO, Wong J. Long-term prognosis after resection of hepatocellular carcinoma associated with hepatitis B-related cirrhosis. J Clin Oncol. 2000;18:1094-1101. [PubMed] |
| 6. | Kubo S, Hirohashi K, Yamazaki O, Matsuyama M, Tanaka H, Horii K, Shuto T, Yamamoto T, Kawai S, Wakasa K. Effect of the presence of hepatitis B e antigen on prognosis after liver resection for hepatocellular carcinoma in patients with chronic hepatitis B. World J Surg. 2002;26:555-560. [PubMed] [DOI] |
| 7. | Yeh CT, So M, Ng J, Yang HW, Chang ML, Lai MW, Chen TC, Lin CY, Yeh TS, Lee WC. Hepatitis B virus-DNA level and basal core promoter A1762T/G1764A mutation in liver tissue independently predict postoperative survival in hepatocellular carcinoma. Hepatology. 2010;52:1922-1933. [PubMed] [DOI] |
| 8. | Hosaka T, Suzuki F, Kobayashi M, Hirakawa M, Kawamura Y, Yatsuji H, Sezaki H, Akuta N, Suzuki Y, Saitoh S. HBcrAg is a predictor of post-treatment recurrence of hepatocellular carcinoma during antiviral therapy. Liver Int. 2010;30:1461-1470. [PubMed] [DOI] |
| 9. | Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology. 2005;42:1208-1236. [PubMed] [DOI] |
| 10. | Gao YT, Han T, Li Y, Yang B, Wang YJ, Wang FM, Jing X, Du Z. Enhanced specificity of real-time PCR for measurement of hepatitis B virus cccDNA using restriction endonuclease and plasmid-safe ATP-dependent DNase and selective primers. J Virol Methods. 2010;169:181-187. [PubMed] [DOI] |
| 11. | Ou DP, Yang LY, Huang GW, Tao YM, Ding X, Chang ZG. Clinical analysis of the risk factors for recurrence of HCC and its relationship with HBV. World J Gastroenterol. 2005;11:2061-2066. [PubMed] [DOI] |
| 12. | Huang Y, Wang Z, An S, Zhou B, Zhou Y, Chan HL, Hou J. Role of hepatitis B virus genotypes and quantitative HBV DNA in metastasis and recurrence of hepatocellular carcinoma. J Med Virol. 2008;80:591-597. [PubMed] [DOI] |
| 13. | 樊 嘉, 周 俭, 吴 志全, 汤 钊猷, 周 信达, 马 曾辰, 钦 伦秀, 王 征. 原发性肝癌的外科治疗: 20年7566例的临床经验. 中华消化外科杂志. 2009;8:99-102. |
| 14. | Shah SA, Cleary SP, Wei AC, Yang I, Taylor BR, Hemming AW, Langer B, Grant DR, Greig PD, Gallinger S. Recurrence after liver resection for hepatocellular carcinoma: risk factors, treatment, and outcomes. Surgery. 2007;141:330-339. [PubMed] [DOI] |
| 15. | Hanazaki K, Kajikawa S, Koide N, Adachi W, Amano J. Prognostic factors after hepatic resection for hepatocellular carcinoma with hepatitis C viral infection: univariate and multivariate analysis. Am J Gastroenterol. 2001;96:1243-1250. [PubMed] [DOI] |
| 17. | Kim H, Choi GH, Na DC, Ahn EY, Kim GI, Lee JE, Cho JY, Yoo JE, Choi JS, Park YN. Human hepatocellular carcinomas with "Stemness"-related marker expression: keratin 19 expression and a poor prognosis. Hepatology. 2011;54:1707-1717. [PubMed] [DOI] |
| 18. | Kim BK, Park JY, Kim DY, Kim JK, Kim KS, Choi JS, Moon BS, Han KH, Chon CY, Moon YM. Persistent hepatitis B viral replication affects recurrence of hepatocellular carcinoma after curative resection. Liver Int. 2008;28:393-401. [PubMed] [DOI] |
| 19. | Chou YC, Jeng KS, Chen ML, Liu HH, Liu TL, Chen YL, Liu YC, Hu CP, Chang C. Evaluation of transcriptional efficiency of hepatitis B virus covalently closed circular DNA by reverse transcription-PCR combined with the restriction enzyme digestion method. J Virol. 2005;79:1813-1823. [PubMed] [DOI] |
| 20. | Werle-Lapostolle B, Bowden S, Locarnini S, Wursthorn K, Petersen J, Lau G, Trepo C, Marcellin P, Goodman Z, Delaney WE. Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovir dipivoxil therapy. Gastroenterology. 2004;126:1750-1758. [PubMed] [DOI] |
| 21. | Wursthorn K, Lutgehetmann M, Dandri M, Volz T, Buggisch P, Zollner B, Longerich T, Schirmacher P, Metzler F, Zankel M. Peginterferon alpha-2b plus adefovir induce strong cccDNA decline and HBsAg reduction in patients with chronic hepatitis B. Hepatology. 2006;44:675-684. [PubMed] [DOI] |
| 23. | Laras A, Koskinas J, Dimou E, Kostamena A, Hadziyannis SJ. Intrahepatic levels and replicative activity of covalently closed circular hepatitis B virus DNA in chronically infected patients. Hepatology. 2006;44:694-702. [PubMed] [DOI] |
| 24. | Wong DK, Yuen MF, Poon RT, Yuen JC, Fung J, Lai CL. Quantification of hepatitis B virus covalently closed circular DNA in patients with hepatocellular carcinoma. J Hepatol. 2006;45:553-559. [PubMed] [DOI] |
| 25. | Portolani N, Coniglio A, Ghidoni S, Giovanelli M, Benetti A, Tiberio GA, Giulini SM. Early and late recurrence after liver resection for hepatocellular carcinoma: prognostic and therapeutic implications. Ann Surg. 2006;243:229-235. [PubMed] [DOI] |
| 26. | Xie H, Song J, Liu K, Ji H, Shen H, Hu S, Yang G, Du Y, Zou X, Jin H. The expression of hypoxia-inducible factor-1alpha in hepatitis B virus-related hepatocellular carcinoma: correlation with patients' prognosis and hepatitis B virus X protein. Dig Dis Sci. 2008;53:3225-3233. [PubMed] [DOI] |
| 28. | Chan HL, Wong VW, Tse AM, Tse CH, Chim AM, Chan HY, Wong GL, Sung JJ. Serum hepatitis B surface antigen quantitation can reflect hepatitis B virus in the liver and predict treatment response. Clin Gastroenterol Hepatol. 2007;5:1462-1468. [PubMed] [DOI] |