修回日期: 2011-12-24
接受日期: 2012-03-10
在线出版日期: 2012-03-18
目的: 探讨YB-1和P53蛋白在结直肠肿瘤不同发展阶段表达水平的差异及其与结直肠癌临床病理特征的关系.
方法: 采用免疫组织化学方法检测结直肠20例正常组织、30例低级别上皮内瘤变组织、30例高级别上皮内瘤变组织和50例癌组织中YB-1和P53蛋白的表达.
结果: YB-1蛋白在结直肠正常组织(NCM)、低级别上皮内瘤变组织(LGIN)、高级别上皮内瘤变组织(HGIN)和癌组织(CRC)中的强阳性率分别为0%、76.7%、80.0%、80.0%, 低级别、高级别上皮内瘤变组织和癌组织中的强阳性表达率均与正常组织比较差异有统计学意义(P<0.05), 且在癌组织中其强阳性表达与淋巴结转移和TNM分期有关(P<0.05); P53蛋白在结直肠正常组织、低级别上皮内瘤变组织、高级别上皮内瘤变组织、癌组织中表达分别为0%、6.7%、40.0%、60.0%, 高级别上皮内瘤变组织和癌组织中其表达率均与正常组织和低级别上皮内瘤变组织比较差异有统计学意义(P<0.05), 其在癌组织中的表达与分化程度、淋巴结转移和TNM分期有关(P<0.05).在癌组织中YB-1和P53的表达呈正相关性(r = 0.306, P<0.05)
结论: YB-1和P53蛋白在结直肠癌的发生发展、转移中起重要作用, YB-1和P53蛋白的联合检测可能为判断结直肠癌恶性程度和转移提供重要参考.
引文著录: 刘露露, 房新志, 郭云泉, 王晓璐, 杨丽丽. YB-1和P53蛋白在结直肠肿瘤中的表达及意义. 世界华人消化杂志 2012; 20(8): 703-707
Revised: December 24, 2011
Accepted: March 10, 2012
Published online: March 18, 2012
AIM: To investigate the expression of YB-1 and P53 in colorectal carcinoma (CRC) of different stages and to analyze their correlation with clinicopathological features of CRC.
METHODS: Expression of YB-1 and P53 proteins in normal colorectal mucosa (NCM, n = 20), low-grade colorectal intraepithelial neoplasia (LGIN, n = 30), high-grade colorectal intraepithelial neoplasia (HGIN, n = 30), and colorectal carcinoma (CRC, n = 50) was detected by immunohistochemistry.
RESULTS: The strong positive rate of YB-1 expression in NCM was significantly lower than those in LGIN, HGIN, and CRC (0% vs 76.7%, 80.0%, 80.0%, all P < 0.05). The strong positive expression of YB-1 was statistically correlated with lymph node metastasis and TNM stage in CRC (both P > 0.05). The positive rate of P53 in NCM was significantly lower than those in LGIN, HGIN, and CRC (0% vs 6.7%, 40.0%, 60.0%, all P < 0.05). The positive expression of P53 was statistically correlated with degree of tumor differentiation, lymph node metastasis and TNM stage in CRC (all P < 0.05). The expression of YB-1 was positively correlated with that of P53 in CRC (r = 0.306, P < 0.05).
CONCLUSION: YB-1 and P53 play an important role in the development and metastasis of colorectal carcinoma. Combined detection of YB-1 and P53 proteins may be useful for judging the severity and prognosis of colorectal cancer.
- Citation: Liu LL, Fang XZ, Guo YQ, Wang XL, Yang LL. Clinical significance of expression of YB-1 and P53 in colorectal tumors. Shijie Huaren Xiaohua Zazhi 2012; 20(8): 703-707
- URL: https://www.wjgnet.com/1009-3079/full/v20/i8/703.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i8.703
结直肠癌是消化系统常见的恶性肿瘤之一. 近年来, 随着我国生活水平的不断提高及饮食习惯的改变, 结直肠癌的发病率及死亡率呈上升趋势[1], 严重危害人们的健康. 研究发现, 结直肠癌的发生发展除了涉及以癌基因和抑癌基因协同作用为基础的基因水平外, 还与多种蛋白质表达的差异相关. 这些蛋白质往往具有不同的功能, 常与肿瘤的发生、发展、生物学行为和预后有关. 本研究应用免疫组织化学方法检测结直肠肿瘤中YB-1和P53蛋白的表达, 旨在探讨二者在结直肠癌的发生发展过程中的差异及其与临床病理参数的关系和意义.
2009-01/2010-12新疆医科大学附属肿瘤医院手术切除结直肠癌标本及内镜活检标本130例, 结直肠低级别上皮内瘤变30例, 高级别上皮内瘤变30例, 癌50例, 20例正常结直肠黏膜组织作为对照. 50例结直肠癌中, 结肠癌25例, 直肠癌25例; 男26例, 女24例; 年龄36-81岁, 平均年龄为59.14岁; 均为腺癌, 高分化9例, 中分化22例, 低分化19例; Ⅰ-Ⅱ期20例, Ⅲ-Ⅳ期30例; 有淋巴结转移22例, 无淋巴结转移28例. 所有患者均为散发病例, 术前未作任何抗肿瘤治疗. 兔抗人单克隆抗体YB-1购自美国Abcam公司, 兔抗人单克隆抗体P53及通用型两步法HRP二抗均购自北京中杉金桥生物制品有限公司.
将10%中性甲醛固定、石蜡包埋的标本4 μm连续切片, 采用PV-9000二步法, 一抗分别为YB-1、P53兔抗人单克隆抗体, 用PBS替代一抗做阴性对照, 用已知乳腺癌阳性切片作阳性对照. P53表达在细胞核, YB-1主要表达在细胞浆, 结果判断标准参考许良中等[2]的免疫组织化学反应结果的判断标准, 以细胞浆或细胞核出现黄至棕褐色颗粒为阳性显色, 结合染色强度和阳性细胞百分比来评定阳性表达病例. 光镜下每张切片中选取癌细胞较多的5个高倍视野, 每个视野计数100个细胞. 染色强度分级如下: 无着色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分; 阳性细胞百分比分级为: 无阳性细胞为0分, 阳性细胞数≤10%为1分, 11%-50%为2分, 51%-75%为3分, >75%为4分. 两项得分相乘结果≥3分为阳性表达病例, <3分为阴性表达病例, 其中0-2为(-), 3-4为(+), 6-8为(++), 9-12为(+++). 本文根据结果分析将YB-1表达为(++-+++)者分为强阳性组, 将P53表达为(+-+++)者归为阳性组.
统计学处理 采用SPSS19.0统计软件, 计数资料率的比较采用χ2检验, 相关性分析采用Spearman相关检验, P<0.05为差异有统计学意义.
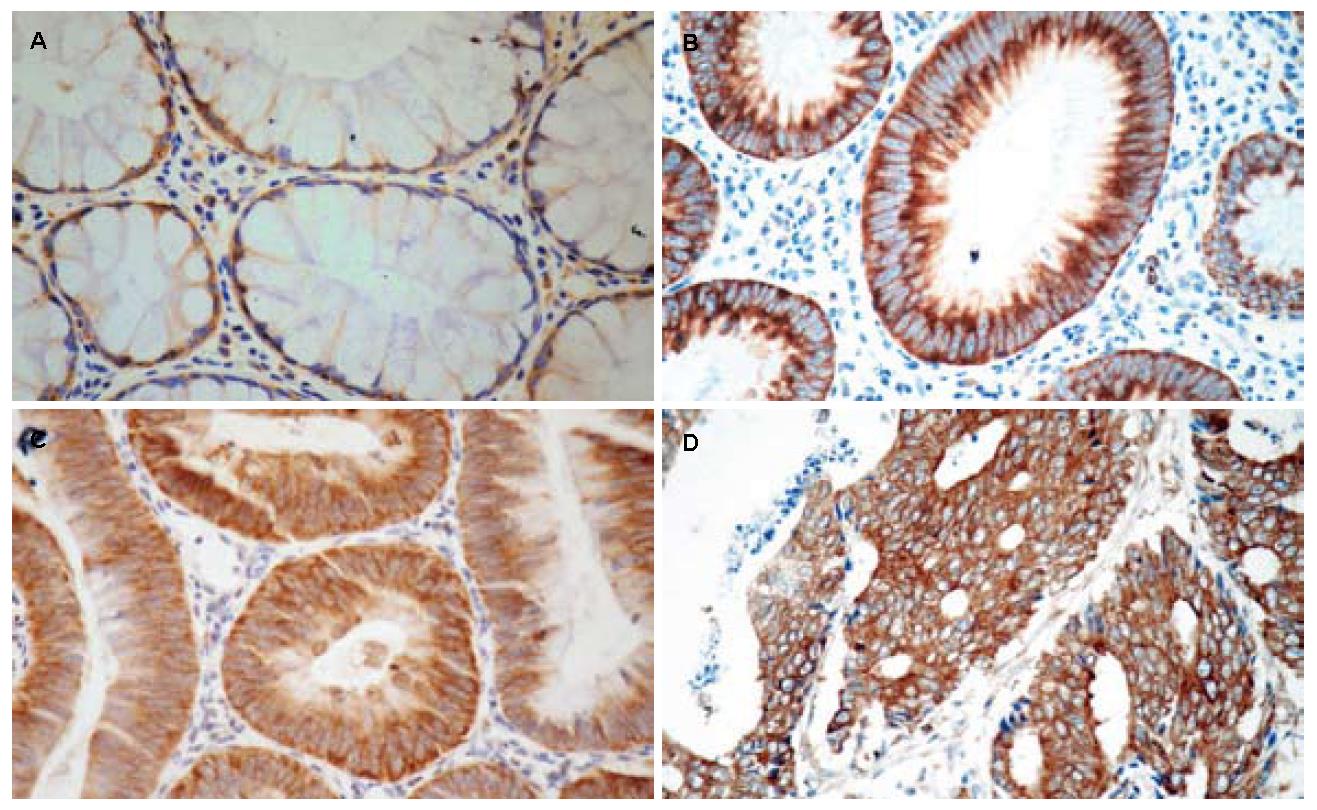
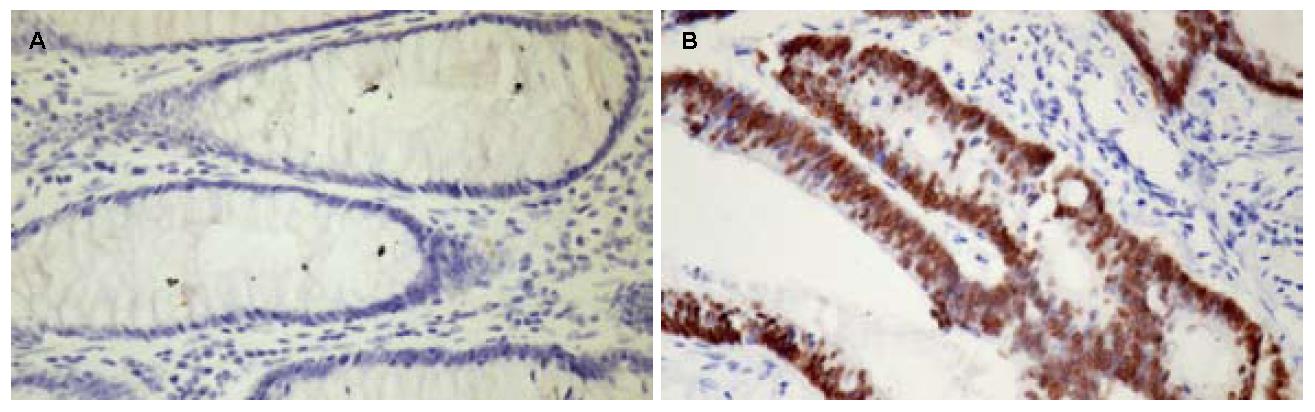
YB-1在结直肠正常组织(normal colorectal mucosa, NCM)、低级别上皮内瘤变组织(low-grade colorectal intraepithelial neoplasia, LGIN)、高级别上皮内瘤变组织(high-grade colorectal intraepithelial neoplasia, HGIN)和癌组织(colorectal carcinoma, CRC)中均表达, 但根据其表达强度不同, 其强阳性表达率(++-+++)在4种组织中不同. LGIN、HGIN和CRC中的强阳性表达率均与NCM比较差异有统计学意义(P<0.05), 但其3者之间比较差异无统计学意义(P>0.05, 图1, 表1). P53在NCM中无表达, 在LGIN和HGIN中少量表达; 在HGIN和CRC中的阳性表达率均与NCM比较差异有统计学意义(P<0.05); 而在LGIN和HGIN及HGIN和CRC之间差异无统计学意义(P>0.05. 图2, 表1).
在结直肠癌组织中YB-1强阳性表达率与淋巴结转移和TNM分期有关(P<0.05); 而与年龄、性别、肿瘤部位和分化程度无关(P>0.05). P53阳性率则与分化程度、淋巴结转移和TNM分期有关(P<0.05), 与其他病理参数无关(P>0.05, 表2).
| 参数 | n | YB-1 | χ值 | P值 | P53 | χ2值 | P值 | ||
| + | (++)-(+++) | - | (+)-(+++) | ||||||
| 年龄 | |||||||||
| ≥60 | 28 | 6 | 22 | 10 | 18 | ||||
| <60 | 22 | 4 | 18 | 0.000 | 1.000 | 10 | 12 | 0.487 | 0.485 |
| 性别 | |||||||||
| 男 | 26 | 8 | 18 | 11 | 15 | ||||
| 女 | 24 | 2 | 22 | 2.649 | 0.104 | 9 | 15 | 0.120 | 0.729 |
| 肿瘤部位 | |||||||||
| 结肠 | 25 | 6 | 19 | 12 | 13 | ||||
| 直肠 | 25 | 4 | 21 | 0.500 | 0.480 | 8 | 17 | 1.333 | 0.248 |
| 分化程度 | |||||||||
| 高-中分化 | 31 | 7 | 24 | 16 | 15 | ||||
| 低分化 | 19 | 3 | 16 | 0.000 | 1.000 | 4 | 15 | 4.584 | 0.032 |
| 淋巴结转移 | |||||||||
| 有 | 22 | 1 | 21 | 1 | 21 | ||||
| 无 | 28 | 9 | 19 | 4.266 | 0.039 | 19 | 9 | 20.576 | 0.000 |
| TNM分期 | |||||||||
| Ⅰ-Ⅱ | 20 | 8 | 12 | 12 | 8 | ||||
| Ⅲ-Ⅳ | 30 | 2 | 28 | 6.380 | 0.012 | 8 | 22 | 5.556 | 0.018 |
在结直肠癌组织中, YB-1和P53表达呈正相关性(r = 0.306, P<0.05, 表3).
| P53 | YB-1 | r值 | P值 | |
| + | (++)-(+++) | |||
| + | 9 | 21 | ||
| - | 1 | 19 | 0.306 | 0.045 |
在结直肠癌组织中, YB-1和P53的共表达率(YB-1++-+++和P53+-+++)与淋巴结转移和TNM分期有关, 有淋巴结转移组高于无淋巴结转移组, TNM分期Ⅲ-Ⅳ期组高于Ⅰ-Ⅱ期组(P<0.05, 表4); 而与年龄等无关.
| 参数 | YB-1/P53(n) | P值 | |
| (+)-(+++/+)(21) | +/-(1) | ||
| 年龄 | |||
| ≥60 | 12 | 0 | |
| <60 | 9 | 1 | 0.455 |
| 性别 | |||
| 男 | 11 | 1 | |
| 女 | 10 | 0 | 1.000 |
| 肿瘤部位 | |||
| 结肠 | 8 | 1 | |
| 直肠 | 13 | 0 | 0.409 |
| 分化程度 | |||
| 高-中分化 | 3 | 1 | |
| 低分化 | 18 | 0 | 0.182 |
| 淋巴结转移 | |||
| 有 | 21 | 0 | |
| 无 | 0 | 1 | 0.045 |
| TNM分期 | |||
| Ⅰ-Ⅱ | 0 | 1 | |
| Ⅲ-Ⅳ | 21 | 0 | 0.045 |
YB-1属于Y-box结合蛋白家族成员, 是一类特异性结合目的基因启动子和增强子内部Y-box(CTGATTGGCCAA)序列的转录因子. YB-1存在于从细菌到人类的多种物种中, 可参与mRNA的选择性剪接、稳定和翻译功能调控、DNA的修复、细胞增殖和再生调节, 表现出多功能核转录调控因子特性[3]. 研究证明, YB-1在癌旁正常组织低表达甚至不表达[4], 但在多种应激、致癌因素及化疗药物作用下, 通过多种信号传导途径, 将诱导YB-1在细胞质中过表达[5,6]. YB-1已被证实和多种恶性肿瘤的发生发展相关, 如肺癌、乳腺癌、骨肉瘤和肠癌[7,8]等. 本研究结果显示, YB-1蛋白在结直肠正常黏膜组织中全呈弱表达, 这一点与YB-1在乳腺癌等的研究中完全不同, 原因可能归因于组织特异性[9], 因为肠黏膜腺体不断增殖和脱落再生, 而乳腺腺体的生长却分为静止期和活动期. YB-1在低级别、高级别上皮内瘤变组织和癌组织中均呈强阳性表达, 且3者之间比较强阳性表达率差异无统计学意义(P>0.05), 但3者均与正常黏膜组织比较差异有统计学意义(P<0.05). 提示YB-1蛋白的检测在正常结直肠和结直肠低级别上皮内瘤变的鉴别诊断中具有重要意义. 在50例结直肠癌组织中, 我们研究发现随着临床分期的增加, YB-1蛋白的强阳性表达率也逐渐增加, 提示YB-1蛋白表达升高与结直肠癌的进展有关, 其可能在促进肿瘤细胞浸润中起到了一定的作用. 而且, 有淋巴结转移组的YB-1蛋白强阳性表达率(95.5%)显著高于无淋巴结转移组67.9%(P<0.05), 表明YB-1蛋白在肿瘤的转移、侵袭等活动中发挥作用.
p53基因是一种抑癌基因, 编码一种分子量为53 kDa的蛋白质, 因此命名为p53[10,11]. 正常细胞中P53蛋白是无突变的野生型P53, 他通过参与细胞周期的负调控而调节细胞的增殖与分化, 具有肿瘤生长抑制功能; 当发生缺失或突变后转变为突变型P53, 可促使细胞无限制生长, 引起癌变, 对肿瘤发生、发展起重要作用. 当组织中有P53蛋白的高表达时, 即表明有p53基因的突变. 研究表明, p53基因突变是癌变进程中的早期事件, 且随着肿瘤的发展, P53蛋白的阳性表达率明显升高. 本研究用免疫组织化学方法检测结直肠正常黏膜组织、低级别、高级别上皮内瘤变组织及癌组织中P53的表达水平, 发现他们之间存在显著差异(P<0.05). 表明p53基因突变在结肠癌的形成、发生发展中起重要作用. 在本研究中也发现, P53蛋白在TNM分期的Ⅲ-Ⅳ期中的阳性表达率为73.3%, 梅高于TNM分期中的Ⅰ-Ⅱ期; 低分化组、有淋巴结转移组的阳性率也都明显升高(分别为78.9%、95.5%), 统计学差异明显(P<0.05), 且肿瘤分化程度越低, P53阳性表达率越高; 而与患者的性别、年龄、肿瘤部位无关(P>0.05), 与文献报道一致[12]. 说明P53在结直肠癌组织中的表达与TNM分期、淋巴结转移和分化程度均有相关性, 提示p53基因突变对癌细胞增殖的抑制作用减弱, 促进了癌细胞浸润及转移, 是结直肠癌发生发展及转移中的一个重要因素, 可能是反应结直肠癌生物学行为和预测预后的重要参数.
研究表明, YB-1蛋白可以作为抑癌基因p53的负调节因子[13], 结合启动子, 从而抑制其转录[14]. YB-1蛋白减少了内生P53的水平, 从而降低了P53的活性, 这对依赖P53来达到细胞死亡的路径来说有着重要意义. 本研究也发现, YB-1与P53蛋白之间具有正相关(P<0.05), 提示YB-1可能会通过对P53的调节而促进肿瘤的发生发展. 有研究发现, 在鼠细胞中, YB-1可以和AP2、P53形成复合体, 然后结合到MMP2基因的增强子上从而激活MMP2的转录[15], 而MMP2在肿瘤的侵袭和转移中起关键作用. 在本研究发现YB-1与P53蛋白的共表达均与肿瘤淋巴结转移和TNM分期密切相关(P<0.05), 由此推断, YB-1和P53的协同作用与结直肠癌组织的侵袭能力、转移倾向密切相关. 总而言之, YB-1和P53在结直肠的发生发展中具有重要意义, 联合检测可以作为判断结直肠癌恶性程度和转移的重要参考.
结直肠癌的发生发展是一个多阶段的过程, 涉及癌基因、抑癌基因、错配修复基因、细胞周期调节基因还有一些蛋白质的改. p53是与肿瘤关系最为亲密的抑癌基因, 而YB-1作为细胞周期的重要正向调控因子, 其在肿瘤发生、发展、调控细胞生长, 介导耐药, 参与DNA的转录和修复等方面也发挥重要作用.
黄培林, 教授, 东南大学
结直肠癌患者的生存率是关注的重点, 所以YB-1和P53蛋白的表达与患者的预后及其影响因素有待深入研究.
本研究用免疫组织化学的方法检测YB-1和P53在结直肠癌组织中的表达, 有助于探讨其在结直肠癌发生、发展中的作用, 并为结直肠癌恶性程度判断和评估预后提供参考.
YB-1蛋白: 即Y-box binding protein-1结合蛋白, 他结合在人类MHC ClassII基因的启动子区, 即Y-box DNA序列(CTGATTGGCCAA), 作为顺式作用元件在基因转录调控中扮演重要角色.
本文联合检测YB-1和P53在结直肠癌中的表达, 更有助于结直肠癌浸润转移的判断, 立意新颖, 数据可信, 论证有据.
编辑: 曹丽鸥 电编: 鲁亚静
| 3. | Kohno K, Izumi H, Uchiumi T, Ashizuka M, Kuwano M. The pleiotropic functions of the Y-box-binding protein, YB-1. Bioessays. 2003;25:691-698. [PubMed] [DOI] |
| 4. | Shibahara K, Sugio K, Osaki T, Uchiumi T, Maehara Y, Kohno K, Yasumoto K, Sugimachi K, Kuwano M. Nuclear expression of the Y-box binding protein, YB-1, as a novel marker of disease progression in non-small cell lung cancer. Clin Cancer Res. 2001;7:3151-3155. [PubMed] |
| 5. | Bader AG, Vogt PK. Phosphorylation by Akt disables the anti-oncogenic activity of YB-1. Oncogene. 2008;27:1179-1182. [PubMed] [DOI] |
| 6. | McCubrey JA, Steelman LS, Abrams SL, Lee JT, Chang F, Bertrand FE, Navolanic PM, Terrian DM, Franklin RA, D'Assoro AB. Roles of the RAF/MEK/ERK and PI3K/PTEN/AKT pathways in malignant transformation and drug resistance. Adv Enzyme Regul. 2006;46:249-279. [PubMed] [DOI] |
| 7. | Gu C, Oyama T, Osaki T, Kohno K, Yasumoto K. Expression of Y box-binding protein-1 correlates with DNA topoisomerase IIalpha and proliferating cell nuclear antigen expression in lung cancer. Anticancer Res. 2001;21:2357-2362. [PubMed] |
| 8. | Huang J, Tan PH, Li KB, Matsumoto K, Tsujimoto M, Bay BH. Y-box binding protein, YB-1, as a marker of tumor aggressiveness and response to adjuvant chemotherapy in breast cancer. Int J Oncol. 2005;26:607-613. [PubMed] [DOI] |
| 9. | Shibao K, Takano H, Nakayama Y, Okazaki K, Nagata N, Izumi H, Uchiumi T, Kuwano M, Kohno K, Itoh H. Enhanced coexpression of YB-1 and DNA topoisomerase II alpha genes in human colorectal carcinomas. Int J Cancer. 1999;83:732-737. [PubMed] [DOI] |
| 13. | Lasham A, Moloney S, Hale T, Homer C, Zhang YF, Murison JG, Braithwaite AW, Watson J. The Y-box-binding protein, YB1, is a potential negative regulator of the p53 tumor suppressor. J Biol Chem. 2003;278:35516-35523. [PubMed] [DOI] |
| 14. | Guay D, Gaudreault I, Massip L, Lebel M. Formation of a nuclear complex containing the p53 tumor suppressor, YB-1, and the Werner syndrome gene product in cells treated with UV light. Int J Biochem Cell Biol. 2006;38:1300-1313. [PubMed] [DOI] |
| 15. | Matsumoto K, Abiko S, Ariga H. Transcription regulatory complex including YB-1 controls expression of mouse matrix metalloproteinase-2 gene in NIH3T3 cells. Biol Pharm Bull. 2005;28:1500-1504. [PubMed] [DOI] |