修回日期: 2012-01-15
接受日期: 2012-03-10
在线出版日期: 2012-03-18
目的: 探讨PRL-3的过表达或敲低对结直肠癌细胞增殖能力的影响.
方法: 利用MTT法、平板克隆形成实验检测PRL-3对细胞体外增殖的影响; 应用流式细胞术检测PRL-3对细胞周期的影响.
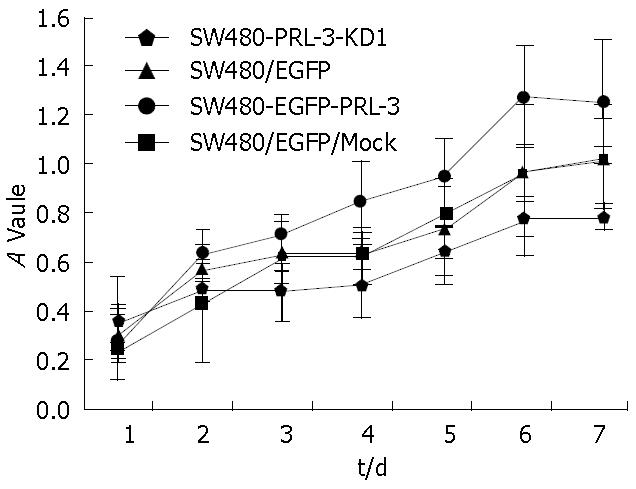
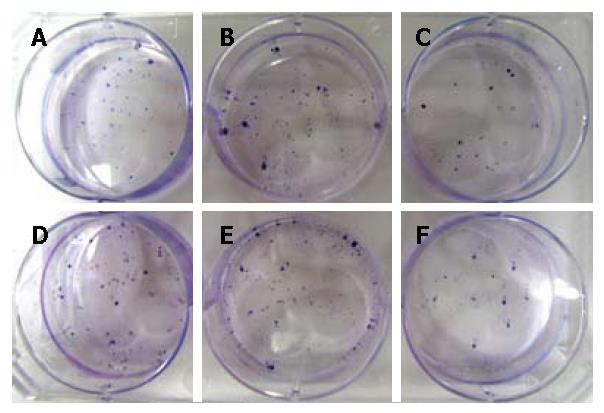
结果: 应用MTT法, 检测PRL-3对SW480/EGFP、SW480-EGFP-PRL-3、SW480/EGFP/Mock及SW480-PRL-3-KD1细胞体外增殖能力的影响, 经析因方差分析, 4组差异具有显著性(F = 23.463, P = 0.000); 不同时间点对细胞体外增殖的影响差异具有显著性(F = 71.515, P = 0.000); 各组细胞与各时间组两因素交互效应显著(F = 2.128, P = 0.008); 除第1天外, 其他各时间点细胞组间的细胞增殖差异具有显著性. 经LSD法多重比较, 结果表明, 与SW480/EGFP/Mock和SW480/EGFP细胞相比, SW480-EGFP-PRL-3细胞的增殖速度加快, 而SW480-PRL-3-KD1细胞的增殖速度减慢. 平板克隆形成实验显示SW480-EGFP-PRL-3细胞克隆形成能力明显增强, 而SW480-PRL-3-KD1细胞克隆形成能力显著下降, 差异具有显著的统计学意义(F = 44.411, P = 0.000).
结论: PRL-3基因可促进结直肠癌细胞的增殖.
引文著录: 柳玉红, 温寿青, 陈蕾, 邱立, 汪春福, 曹亚平, 邹桂华. PRL-3基因对结直肠癌细胞增殖能力的影响. 世界华人消化杂志 2012; 20(8): 680-684
Revised: January 15, 2012
Accepted: March 10, 2012
Published online: March 18, 2012
AIM: To establish human colon cancer SW480 cell lines in which the phosphatase of regenerating liver-3 (PRL-3) gene is stably overexpressed or knocked down to study the role of this gene in regulating the biological behaviors of SW480 cells.
METHODS: The impact of PRL-3 overexpression and knockdown on cell proliferation was assessed by MTT assay, colony formation assay and flow cytometry in vitro.
RESULTS: Knockdown of the PRL gene significantly reduced the proliferation of SW480 cells when compared to control cells. In addition, knockdown of the PRL gene significantly impaired the ability of SW480 cells to form colonies compared to control cells.
CONCLUSION: The PRL-3 gene plays an important role in the proliferation of human colon cancer SW480 cells.
- Citation: Liu YH, Wen SQ, Chen L, Qiu L, Wang CF, Cao YP, Zou GH. Role of the PRL-3 gene in the proliferation of human colon cancer SW480 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(8): 680-684
- URL: https://www.wjgnet.com/1009-3079/full/v20/i8/680.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i8.680
PRL-3(phosphatase of regenerating liver-3, PRL-3)是现已发现与结直肠癌转移相关的少数特异性表达分子之一[1,2], 研究发现, 将PRL-3转染到上皮细胞, 可引起细胞形态发生改变, 且形态改变与细胞运动能力相关[3]; 另外, PRL-3可调节肿瘤细胞与细胞外基质的粘附[3]. Fagerli等[4]将PRL-3特异性小干扰RNA转染到多发性骨髓瘤细胞系INA-6中, 发现下调细胞PRL-3的表达降低了细胞的迁移能力. 我们已经建立了PRL-3基因过表达[5]及基因敲低[6]2种细胞模型, 利用这2种细胞模型, 我们从正反两方面来研究PRL-3对结肠癌细胞的增殖能力的影响.
胎牛血清、DMEM细胞干粉培养基购自美国HyClone公司; MTT购自Sigma公司; Transwell Chamber购自Chemicon公司.
1.2.1 噻唑蓝(MTT)比色试验检测细胞增殖能力: 以每孔1×103个细胞接种于96孔培养板中, 每孔体积200 µL, 每组4孔, 同时设空白对照(仅加培养液), 置CO2培养箱中孵育, 分别于1 d, 2 d, 3 d, 4 d, 5 d, 6 d, 7 d取出, 每孔加入5 g/L的四氮唑蓝盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT)20 µL, 37 ℃继续孵育4 h, 终止培养, 小心吸弃孔内培养上清液, 加入二甲基亚砜(dimethyl sulfoxide, DMSO)150 µL, 室温孵育10 min, 振荡10 min, 使结晶物充分溶解, 以空白对照孔调零, 酶标仪上490 nm测定各孔吸光度(A)值, 以相对应A比值表示细胞增殖能力大小. 各组取4孔平均值, 绘制增殖曲线.
1.2.2 平板克隆形成实验: 生长状态良好的培养细胞, 用D-Hanks液洗3次, 0.25%胰酶消化, 细胞悬液反复吹打, 使细胞充分分散, 接种100个细胞到6孔培养板中, 每种细胞接种3孔, 十字形轻轻晃动培养板, 使细胞分散均匀, 37 ℃、50 mL/L CO2培养箱中培养2 wk. 出现肉眼可见的细胞克隆时, 终止培养, 弃去培养液, 用PBS液洗2次, 空气干燥; 甲醇固定15 min, 弃甲醇后空气干燥; 用Giemsa应用液染色15 min, 流水缓慢洗去染液, 空气干燥; 在显微镜下对形成的克隆计数(≥50个细胞为1个克隆), 平板克隆形成率 = 形成克隆数/接种细胞数×100%, 实验重复3次.
1.2.3 利用流式细胞术检测细胞生长周期: 生长状态良好的培养细胞, 用D-Hanks液洗3次, 0.25%胰酶消化, 细胞悬液离心, PBS洗3次, 用750 mL/L乙醇固定, 标本送中山医中心实验室检测.
统计学处理 用SPSS 13.0软件进行数据分析, 细胞体外生长实验采用析因方差检验, 细胞生长周期、平板克隆形成实验、细胞粘附实验及运动小室实验采用One-Way ANOVA检验.
经析因方差分析, 4组差异具有显著性(F = 23.463, P = 0.000); 不同时间点对细胞体外增殖的影响差异具有显著性(F = 71.515, P = 0.000); 各组细胞与各时间组两因素交互效应显著(F = 2.128, P = 0.008); 除第1天外, 其他各时间点细胞组间的细胞增殖差异具有显著性(表1, 图1). 经LSD法多重比较, 结果表明, 与SW480/EGFP/Mock和SW480/EGFP细胞相比, SW480-EGFP-PRL-3细胞的增殖速度加快, 而SW480-PRL-3-KD1细胞的增殖速度减慢. 平板克隆形成实验, 经One-Way ANOVA检验, 3组差异具有显著性(F = 44.411, P = 0.000); 经LSD多重比较显示SW480-PRL-3-KD1细胞的增殖速度较其他组缓慢, 差异有统计学意义(51.667%±3.786% vs 64.000%±3.606%, 76.667%±2.082%, F = 44.411, P = 0.000, 图2).
| SW480/EGFP cells | SW480-EGFP-PRL-3 cells | SW480-PRL-3-KD1 cells | SW480/EGFP/Mock cells | 合计 | F值 | P值 | |
| 第1天 | 0.294±0.097 | 0.261±0.147 | 0.353±0.125 | 0.245±0.128 | 0.288±0.125 | 0.861 | 0.478 |
| 第2天 | 0.570±0.045 | 0.628±0.050 | 0.4853±0.061 | 0.417±0.238 | 0.5250±0.144 | 3.217 | 0.045 |
| 第3天 | 0.623±0.075 | 0.704±0.090 | 0.480±0.115 | 0.6173±0.121 | 0.606±0.126 | 4.966 | 0.010 |
| 第4天 | 0.636±0.059 | 0.844±0.165 | 0.510±0.147 | 0.618±0.107 | 0.652±0.170 | 7.326 | 0.002 |
| 第5天 | 0.714±0.216 | 0.944±0.158 | 0.637±0.105 | 0.773±.172 | 0.767±0.194 | 3.633 | 0.031 |
| 第6天 | 0.957±0.098 | 1.274±0.201 | 0.797±0.131 | 0.966±0.268 | 0.998±0.247 | 7.639 | 0.001 |
| 第7天 | 1.020±0.223 | 1.245±0.244 | 0.779±0.045 | 1.004±0.185 | 1.012±0.245 | 5.962 | 0.004 |
| 合计 | 0.6875±0.261 | 0.843±0.366 | 0.574±0.181 | 0.663±0.310 | 0.696±0.302 | 23.463 | 0.0001 |
| F值 | 19.930 | 28.980 | 13.808 | 13.697 | 71.515 | 2.128 | |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.0001 | 0.0082 |
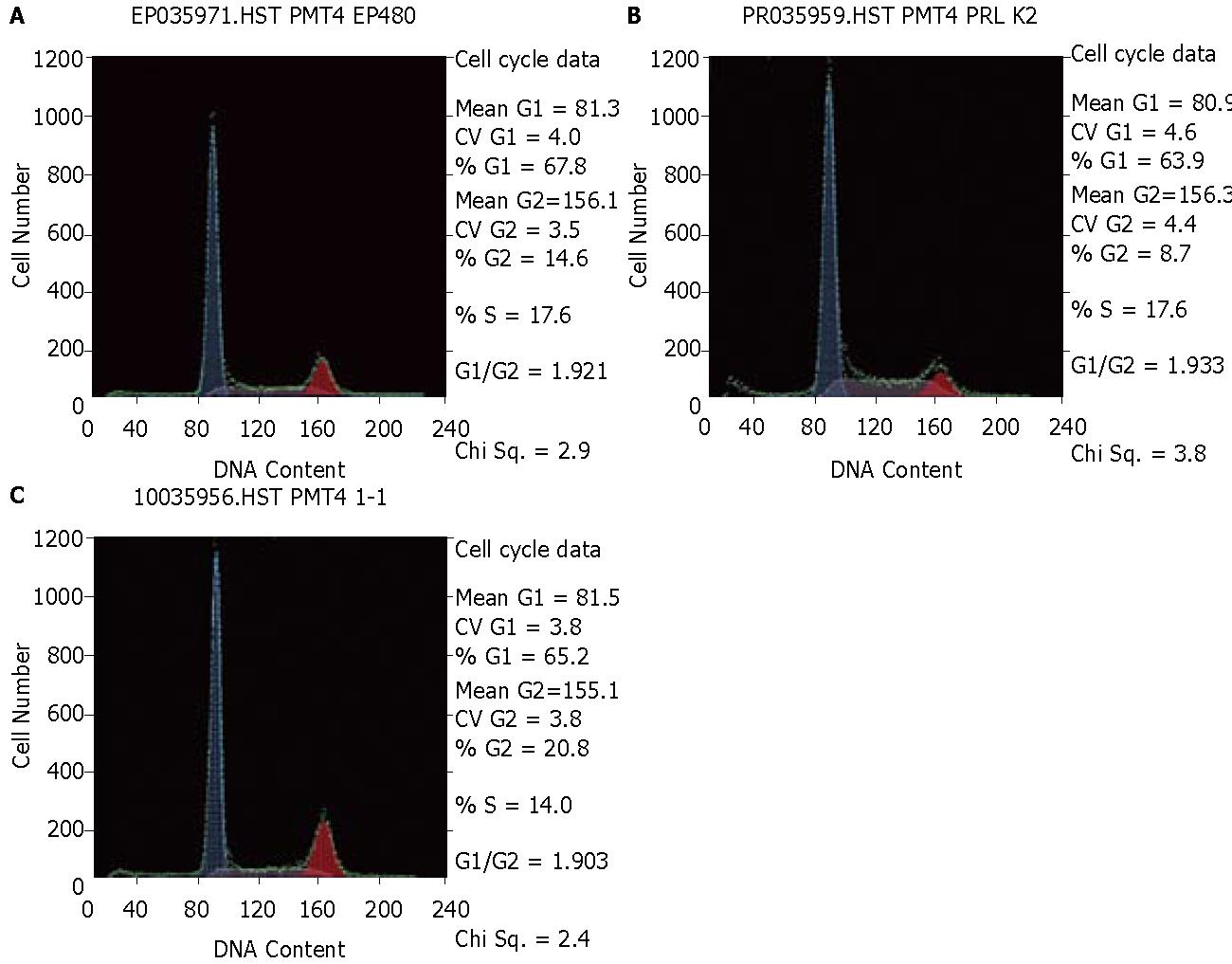
SW480/EGFP、SW480-EGFP-PRL-3、SW480/EGFP/Mock和SW480-PRL-3-KD1 4种细胞的S期细胞平均比例分别为17.633%±0.351%、27.467%±0.503%、18.600%±0.400%和14.067%±0.306%, 统计分析结果显示4种细胞的S期差异有统计学意义(F = 617.59, P = 0.000, 图3), 同时, 4种细胞的流式分析结果中均未见到细胞凋亡峰的存在, 表明PRL-3基因的表达变化并不导致细胞凋亡的出现.
PRL-3又称为PTP4A3, 属于蛋白质酪氨酸磷酸酶(protein tyrosine phosphatase, PTP)家族成员, 家族中3个成员PRL-1、PRL-2及PRL-3蛋白质分子量大约为20 kDa, 具有超过75%的同源性, 在功能上具有相似性[7-9]. 本实验对PRL-3基因过表达与敲低的SW480细胞体外生物学特性进行了对比实验研究, 从正反2个方面确定PRL-3对结直肠癌细胞增殖等生物学特性的影响, 希望能为进一步揭示PRL-3与结直肠癌的关系提供新的实验依据, 并为探讨结直肠癌侵袭转移的具体机制提供新的思路.
肿瘤的主要特征是细胞的无限增殖能力. 肿瘤增殖标签(proliferation signature)概念的提出, 最初是在分析乳腺癌基因表达谱时发现的肿瘤组织中存在一类与肿瘤增殖率高度相关的基因群, 将这一类基因群命名为增殖标签[10]. 虽然增殖标签在肿瘤发病机制中的作用及增殖标签作为肿瘤诊断和预后的标志物(biomarker)可行性仍待进一步研究, 但肿瘤生长动力学的大量研究已经显示, 肿瘤细胞的增殖能力和肿瘤的浸润、转移及复发等生物学行为密切相关, 也与患者的预后显著相关[11,12]. Rhodes等[13]利用荟萃分析(meta-analysis)的方法对40个已公布的肿瘤芯片表达谱数据库(包含3 700个肿瘤样本)进行数据分析, 结果发现, 这群增殖标签基因高表达于肿瘤组织中, 并且随着肿瘤恶性程度的增加而表达上调. 由于增殖相关基因的鉴定简便, 展示了广阔的临床应用前景, 如Ki-67, 核增殖抗原(proliferating cell nuclear antigen, PCNA)已经广泛应用于肿瘤的辅助诊断中. 因此, 如果能明确鉴定更多的肿瘤相关增殖基因, 并结合基因芯片技术, 建立增殖标签芯片, 不仅有助于更好地理解肿瘤发生的分子机制, 而且也可以作为临床上肿瘤诊断及预后判断的重要工具.
在本研究中, 我们观察到PRL-3基因与结直肠癌细胞的增殖相关. 我们以真核表达载体在SW480细胞中稳定过表达PRL-3基因和慢病毒干扰载体稳定沉默结直肠癌细胞株PRL-3的表达, 通过MTT法, 我们检测了PRL-3对结直肠癌细胞增殖的影响, 通过7 d的连续观察及比较, 我们发现PRL-3沉默明显降低了结直肠细胞的增殖能力. 平板克隆形成实验结果也显示PRL-3基因敲低的细胞其生存活力显著下降. 流式细胞术检测细胞周期发现PRL-3基因沉默的细胞其S期比例明显减少, 表明其细胞DNA合成减少. 这些结果均说明PRL-3表达水平沉默后, 能显著性地抑制肿瘤细胞体外生长, 这与其他小组的研究也是一致的[14,15]. 结果表明PRL-3基因可促进结直肠癌细胞的增殖.
PRL-3属于蛋白质酪氨酸磷酸酶家族成员, 与大肠癌的肝转移关系密切. PRL-3基因是大肠癌转移治疗的重要潜在靶点, 其参与的信号通路还不清楚.
郝立强, 副教授, 上海长海医院普外二科
PRL-3基因可促进结直肠癌细胞的增殖, 为进一步揭示PRL-3与结直肠癌的关系提供新的实验依据.
最新研究报道PRL-3通过上调MMP-7促进结肠癌细胞侵袭与转移.
本研究利用已经建立起来的PRL-3基因过表达及基因敲低的2种细胞模型, 从正反两方面来研究PRL-3对结直肠癌细胞增殖能力的影响.
本文立题明确, 实验方法得当, 结果可靠, 初步揭了PRL-3基因具有促进细胞增殖的功能.
编辑: 曹丽鸥 电编: 鲁亚静
| 1. | Kozlov G, Cheng J, Ziomek E, Banville D, Gehring K, Ekiel I. Structural insights into molecular function of the metastasis-associated phosphatase PRL-3. J Biol Chem. 2004;279:11882-11889. [PubMed] [DOI] |
| 2. | Kim KA, Song JS, Jee J, Sheen MR, Lee C, Lee TG, Ro S, Cho JM, Lee W, Yamazaki T. Structure of human PRL-3, the phosphatase associated with cancer metastasis. FEBS Lett. 2004;565:181-187. [PubMed] [DOI] |
| 3. | Li Z, Zhan W, Wang Z, Zhu B, He Y, Peng J, Cai S, Ma J. Inhibition of PRL-3 gene expression in gastric cancer cell line SGC7901 via microRNA suppressed reduces peritoneal metastasis. Biochem Biophys Res Commun. 2006;348:229-237. [PubMed] [DOI] |
| 4. | Saha S, Bardelli A, Buckhaults P, Velculescu VE, Rago C, St Croix B, Romans KE, Choti MA, Lengauer C, Kinzler KW. A phosphatase associated with metastasis of colorectal cancer. Science. 2001;294:1343-1346. [PubMed] [DOI] |
| 6. | Liu YH, Li JM, Zhou J, Ding YQ. [Construction of a lentiviral vector for RNA interference of PRL-3 gene and its stable expression in SW480 cells]. Nanfang Yike Daxue Xuebao. 2008;28:509-512. [PubMed] |
| 7. | Diamond RH, Cressman DE, Laz TM, Abrams CS, Taub R. PRL-1, a unique nuclear protein tyrosine phosphatase, affects cell growth. Mol Cell Biol. 1994;14:3752-3762. [PubMed] [DOI] |
| 8. | Cates CA, Michael RL, Stayrook KR, Harvey KA, Burke YD, Randall SK, Crowell PL, Crowell DN. Prenylation of oncogenic human PTP(CAAX) protein tyrosine phosphatases. Cancer Lett. 1996;110:49-55. [PubMed] [DOI] |
| 9. | Zeng Q, Si X, Horstmann H, Xu Y, Hong W, Pallen CJ. Prenylation-dependent association of protein-tyrosine phosphatases PRL-1, -2, and -3 with the plasma membrane and the early endosome. J Biol Chem. 2000;275:21444-21452. [PubMed] [DOI] |
| 10. | Bardelli A, Saha S, Sager JA, Romans KE, Xin B, Markowitz SD, Lengauer C, Velculescu VE, Kinzler KW, Vogelstein B. PRL-3 expression in metastatic cancers. Clin Cancer Res. 2003;9:5607-5615. [PubMed] |
| 11. | Zeng Q, Dong JM, Guo K, Li J, Tan HX, Koh V, Pallen CJ, Manser E, Hong W. PRL-3 and PRL-1 promote cell migration, invasion, and metastasis. Cancer Res. 2003;63:2716-2722. [PubMed] |
| 12. | Wu X, Zeng H, Zhang X, Zhao Y, Sha H, Ge X, Zhang M, Gao X, Xu Q. Phosphatase of regenerating liver-3 promotes motility and metastasis of mouse melanoma cells. Am J Pathol. 2004;164:2039-2054. [PubMed] [DOI] |
| 13. | Guo K, Li J, Tang JP, Koh V, Gan BQ, Zeng Q. Catalytic domain of PRL-3 plays an essential role in tumor metastasis: formation of PRL-3 tumors inside the blood vessels. Cancer Biol Ther. 2004;3:945-951. [PubMed] [DOI] |
| 14. | Lai W, Chen S, Wu H, Guan Y, Liu L, Zeng Y, Zhao H, Jiang J, Chu Z. PRL-3 promotes the proliferation of LoVo cells via the upregulation of KCNN4 channels. Oncol Rep. 2011;26:909-917. [PubMed] |
| 15. | Wang Z, Cai SR, He YL, Zhan WH, Chen CQ, Cui J, Wu WH, Wu H, Song W, Zhang CH. High expression of PRL-3 can promote growth of gastric cancer and exhibits a poor prognostic impact on patients. Ann Surg Oncol. 2009;16:208-219. [PubMed] [DOI] |