修回日期: 2012-01-10
接受日期: 2012-03-10
在线出版日期: 2012-03-18
目的: 研究帕瑞昔布(parecoxib, PCB)对人胰腺癌细胞株BxPC-3和AsPC-1的增殖、凋亡及其可能的分子机制.
方法: BxPC-3、AsPC-1细胞用不同浓度PCB的培养液孵育后, 利用MTT法测定细胞活性, 计算IC50值, TUNEL法检测处理后细胞的凋亡情况, RT-PCR验证相关蛋白的变化表达.
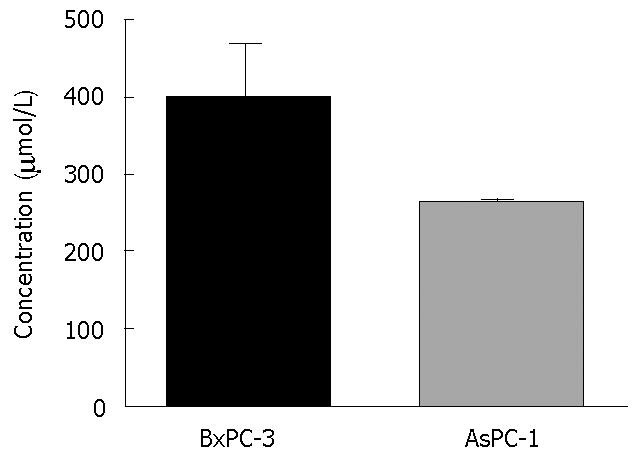
结果: PCB对两种细胞生长呈时间和计量依赖性抑制; PCB处理后BxPC-3、AsPC-1两种细胞IC50值为: 400.98 μmol/L±10.78 μmol/L、256.3 μmol/L±2.98 μmol/L; TUNEL法检测证明凋亡率增加; RT-PCR显示COX-2表达明显降低.
结论: PCB可以抑制胰腺癌细胞增殖, 并诱导其凋亡生长, 其可能机制是通过抑制COX-2表达来实现的.
引文著录: 李鹏, 刘江伟, 许永华, 朱淑萍, 郭飞, 董翔. 帕瑞昔布对人胰腺癌细胞株BxPC-3、AsPC-1增殖凋亡的影响及其机制. 世界华人消化杂志 2012; 20(8): 675-679
Revised: January 10, 2012
Accepted: March 10, 2012
Published online: March 18, 2012
AIM: To investigate the effect of parecoxib on cell proliferation and apoptosis in human pancreatic cancer cell lines BxPC-3 and AsPC-1 and to explore possible mechanisms involved.
METHODS: After BxPC-3 and AsPC-1 cells were incubated with different concentrations of parecoxib, cell viability was measured by MTT assay to calculate the half maximal inhibitory concentration (IC50); cell apoptosis was evaluated by TUNEL assay; and the expression of COX-2 was detected RT-PCR.
RESULTS: Cell viability was apparently inhibited by parecoxib in both cell types, and the inhibitory effect was time- and dose-dependent. The IC50 values in the two cell lines were 400.98 μmol/L ± 10.78 μmol/L and 256.3 μmol/L ± 2.98 μmol/L, respectively. Treatment with parecoxib increased apoptosis rate and down-regulated COX-2 expression in both cell lines.
CONCLUSION: Parecoxib potently inhibits cell proliferation and induces apoptosis in human pancreatic cancer cell lines BxPC-3 and AsPC-1 possibly by suppressing the expression of COX-2.
- Citation: Li P, Liu JW, Xu YH, Zhu SP, Guo F, Dong X. Parecoxib inhibits cell proliferation and induces apoptosis in human pancreatic cancer cell lines BxPC-3 and AsPC-1. Shijie Huaren Xiaohua Zazhi 2012; 20(8): 675-679
- URL: https://www.wjgnet.com/1009-3079/full/v20/i8/675.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i8.675
胰腺癌(pancreatic cancer, PC)是一种起源于胰腺导管上皮的恶性肿瘤, 恶性程度高, 侵袭和转移率高, 早期诊断困难, 进展期症状缺乏特异性, 是消化系统治疗效果差的恶性肿瘤之一. 胰腺癌已成为全球第4大死因[1], 5年生存率仅1%-4%[2]. 胰腺癌由于诊断困难、预后差、发生率高成为了一个世界性的健康问题[3,4]. 胰腺癌明确诊断时已经为晚期, 还可能发生远处转移. 因此手术切除已经不能延长大多数患者的生存时间. 药物治疗是胰腺癌治疗的基础, 尽管开展很多大规模的药物临床试验, 但结果却令人沮丧. 因此, 寻找有效的口服药物成为治疗胰腺癌的必经之路. 帕瑞昔布(parecoxib, PCB)是非甾体抗炎药的其中一个亚型, 选择性COX-2抑制剂[5]. 非甾体抗炎药物抑制COX-1、COX-2, 仅有COX-2抑制剂发挥止痛、抗炎、解热的功效. PCB是一种COX-2抑制剂的新药, 广泛应用于术后镇痛. 流行病研究显示非甾体抗炎药能够降低结直肠癌的风险[3,4]. 非甾体抗炎药是花生四烯酸转化成前列腺素过程中的关键酶, COX有2种亚型: COX-1和COX-2, 之前的报道显示胰腺癌中COX-2 mRNA和蛋白的表达增加, 且COX-2高表达与肿瘤细胞凋亡相关[5-9]. 自美国FDA将塞来昔布(celecoxib, CCB)的适用范围扩大, 用于治疗家族性腺瘤病, COX-2抑制剂的应用范围较之前更为广阔, 也成为了众多学者研究的焦点所在. COX-2抑制剂显示了强大的解热镇痛作用. 而在大多数的研究中, COX-2抑制剂也不负重望地发挥了抗肿瘤作用. PCB的上市为患者术后镇痛带来了福音, 但其在肿瘤中的作用仍未见相关文献报道. 为此, PCB能否像CCB那样发挥抗肿瘤的作用, 其抗肿瘤的可能机制是我们研究的着眼点.
PCB购自辉瑞制药; 高糖DMEM培养基和胎牛血清购自Gibco公司; 四甲基偶氮唑盐(MTT)及二甲基亚砜(DMSO)购自Amersco; Trizol及琼脂糖购自Invitrogen; RT-PCR试剂盒、Marker购自TaKaRa; TUNEL试剂盒购自Promega; β-actin、COX-2引物由上海生工合成; 所用仪器包括C1000核酸扩增仪、酶标仪、电泳槽(Bio-Rad, 美国).
1.2.1 细胞系和细胞培养: 在含有50 mL/L CO2 37 ℃ 95%湿度培养箱中培养. 培养液为含100 mL/L胎牛血清和双抗(100 U/mL青霉素和100 U/mL链霉素)的高糖DMEM培养基. 当细胞融合90%时, 用0.25%胰酶消化传代, 对数生长期的细胞为实验对象.
1.2.2 PCB药液配置: PCB用高糖DMEM稀释为不同浓度, 针式过滤后, 4 ℃保存.
1.2.3 MTT法检测药物对细胞抑制率: 细胞接种于96孔板中(5×103/孔). 贴壁24 h后, 分别加入含有不同浓度(0、10、40、160、320、640、1 000 μmol/L)PCB孵育, 分别加入MTT, 再孵育4 h, 弃去孔内液体, 加入二甲基亚砜, 在酶标仪490 nm波长处检测各孔吸光度(A)值, 抑制率 = (1-实验组A/对照组)×100%.
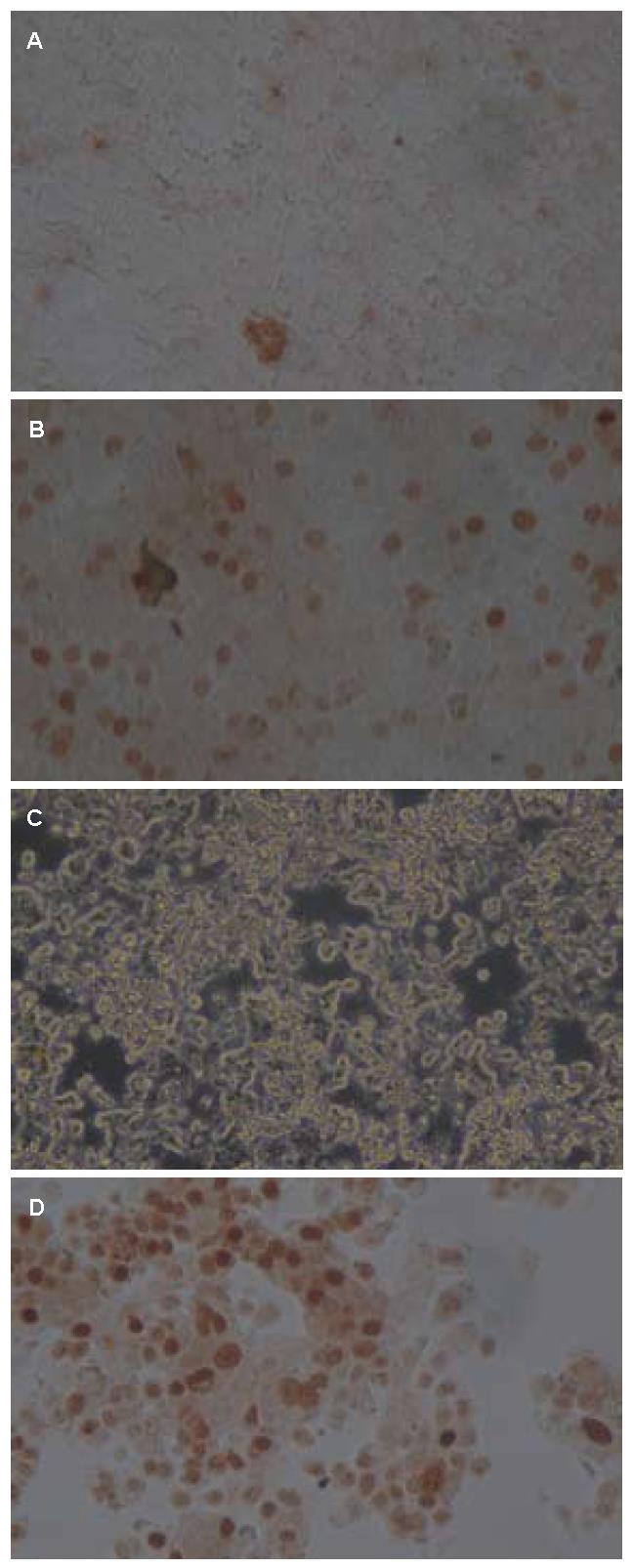
1.2.4 TUNEL法检测细胞凋亡: 细胞接种于24孔板, 贴壁后分别用不同浓度(0、10、40、160、320、640、1000 μmol/L)PCB孵育. 48 h后弃去孔内培养液, 按照TUNEL试剂盒方法操作, DAB显色后镜下观察并照相.
1.2.5 RT-PCR法检测COX-2表达: 细胞接种于6孔板中, 贴壁后分别用1/2 PCBIC50孵育48 h. 收获细胞1×106, TRIzol法提取RNA后反转录为cDNA, 反转录体系为: 5×PrimeScript Buffer 5 μL, PrimeScript Enzyme MixⅠ1.25 μL, Oligo dT primer 1.25 μL, Random 6 mers 5 μL, RNA 500 ng, dd H2O(免酶)补齐至25 μL. PCR反应体系: TaKaRa Ex Taq 0.125 μL, 10×Ex Taq Buffer 2.5 μL, MgCl2 0.5 µL, dNTP Mix 2 µL, cDNA 1 μL, Primer forward 1 μL, Primer reverse 1 μL, dd H2O补齐至25 μL. COX-2引物(上游: 5'-TCCAGATCACATTTGATTGACAG-3', 下游: 5'-TGTGGGAGGATACATCTCTCC-3'); β-actin为内参(上游: 5'-GGACTTCGAGCAGGAGATGG-3', 下游: 5'-GCACCGTGTTGGCGTAGAGG-3'). PCR产物扩增条件为: 94 ℃ 5 min; 94 ℃ 30 s, 60.5 ℃ 30 s, 72 ℃ 1 min, 35个循环; 72 ℃ 5 min. COX-2扩增产物440 bp, β-actin产物322 bp. 电泳后凝胶成像仪紫外成像, Quantity One软件行灰度扫描.
统计学处理 所得数据采用SPSS17.0软件分析. 计量资料以mean±SD表示, 多个样本比较采用单因素方差分析, 两样本均数采用t检验, 以P<0.05为差异有统计学意义.
随着药物浓度升高和时间延长, 2种细胞活性均明显下降, 2种细胞对PCB的反应稍有不同, BxPC-3、AsPC-1的IC50分别为400.98 μmol/L、256.3 μmol/L. 2种细胞IC50值如图1.
BxPC-3、AsPC-1细胞正常对照组、PCB干预BxPC-3、AsPC-1细胞组凋亡率分别为: 5.35%±0.92%、17.52%±0.75%、2.44%±0.57%、20.35%±0.78%, 干预组与对照组比较, 差异有统计学意义(P<0.05, 图2).
PCB是选择性COX-2抑制剂, PCB在癌症领域的研究尚属空白, 其大部分的研究都立足于其极强的术后镇痛作用[10,11], 而COX-2抑制剂CCB早已成为肿瘤界研究的热点. 很多学者[12-21]的研究证明COX-2抑制剂在肿瘤进展过程中发挥重要作用, 其具体机制尚未阐明.
胰腺癌发病后病情隐匿, 早期诊断极为困难, 很多患者晚期时才有明显症状, 且很多药物耐药成为胰腺癌治疗的难点[22]. COX-2抑制剂有望被应用于抗肿瘤药物的范围内. 国内学者[23-28]研究发现, COX-2在胰腺癌中的表达率为74.5%, 认为COX-2可能在胰腺癌的发生、发展及肿瘤的浸润和转移中起重要作用, COX-2的高表达可能是反映胰腺癌预后的有用指标. COX-2在胰腺癌组织中高表达, 而在相邻正常组织中不表达, 其高表达均与胰腺癌细胞增殖、血管生成、抗凋亡有关. 我们曾将CCB与顺铂联合作用于胰腺癌BxPC-3, 可明显抑制细胞的增殖, 诱导细胞凋亡并增加胰腺癌细胞对化疗药物的敏感性. 本研究应用PCB处理胰腺癌细胞, 发现其增殖抑制, 凋亡增加.
COX-2的过度表达具有以下作用: (1)刺激肿瘤细胞的增殖; (2)抗凋亡; (3)促进肿瘤血管形成; (4)促浸润和转移. 因此, COX-2抑制剂是抗胰腺癌很有潜力的药物之一.
本研究中PCB的应用验证了在体外细胞水平上抑制细胞增殖, 并诱导细胞凋亡, 这种作用的可能机制是抑制了COX-2的表达, 从而发挥重要作用. 还有很多分子机制是在整个肿瘤发生发展过程中COX-2表达产生了重要影响. 故此, 对于COX-2抑制剂在肿瘤中的重要作用还有待进一步从体内试验证明.
PCB不仅有强大的镇痛作用, 尤其是外科手术后的镇痛, 而且为胰腺癌的治疗提供了新希望, 本研究为PCB治疗胰腺癌提供理论依据.
硫化氢是存在于哺乳动物体内的第3种新型的内源性气体信号分子, 有着广泛的生物学效应. 近年研究证实其具有调节病理状态下细胞凋亡的作用, 课题组前期研究也表明其在肝纤维化的发生发展过程中及门脉高压的调节方面起着重要作用.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
肝细胞的病理性凋亡是各种肝脏疾病中最重要的影响因素之一, 研究表明其可启动并促进肝纤维化的发生, 因此, 如何能有效阻止肝细胞的病理性凋亡将成为慢性肝病治疗的新方向.
康凯等的研究表明, 在大鼠缺血再灌注损伤模型建立后, 大鼠肝细胞的凋亡明显增加, 而给予H2S代谢酶抑制剂降低组织中H2S含量后, 肝细胞的凋亡进一步增加, 表明H2S缺乏可促进缺血再灌注所引起的这种病理性肝细胞凋亡.
本研究结果表明, 肝硬化大鼠H2S缺乏可促进肝细胞的病理性凋亡, 而病理性凋亡又可能通过相应的途径加快肝纤维化的进展, 甚至增加门静脉压力. 因此, 如何避免体内H2S缺乏甚至增加体内H2S含量可能会成为肝硬化及门脉高压治疗的新的发展方向.
本文设计合理, 结果可靠, 具有一定的学术价值.
编辑: 曹丽鸥 电编: 鲁亚静
| 1. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 2. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 3. | Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ. Cancer statistics, 2005. CA Cancer J Clin. 2005;55:10-30. [PubMed] [DOI] |
| 4. | McKenna S, Eatock M. The medical management of pancreatic cancer: a review. Oncologist. 2003;8:149-160. [PubMed] [DOI] |
| 5. | Molina MA, Sitja-Arnau M, Lemoine MG, Frazier ML, Sinicrope FA. Increased cyclooxygenase-2 expression in human pancreatic carcinomas and cell lines: growth inhibition by nonsteroidal anti-inflammatory drugs. Cancer Res. 1999;59:4356-4362. [PubMed] |
| 6. | Yip-Schneider MT, Barnard DS, Billings SD, Cheng L, Heilman DK, Lin A, Marshall SJ, Crowell PL, Marshall MS, Sweeney CJ. Cyclooxygenase-2 expression in human pancreatic adenocarcinomas. Carcinogenesis. 2000;21:139-146. [PubMed] [DOI] |
| 7. | Franco L, Doria D, Bertazzoni E, Benini A, Bassi C. Increased expression of inducible nitric oxide synthase and cyclooxygenase-2 in pancreatic cancer. Prostaglandins Other Lipid Mediat. 2004;73:51-58. [PubMed] [DOI] |
| 8. | Crowell PL, Schmidt CM, Yip-Schneider MT, Savage JJ, Hertzler DA, Cummings WO. Cyclooxygenase-2 expression in hamster and human pancreatic neoplasia. Neoplasia. 2006;8:437-445. [PubMed] [DOI] |
| 9. | Nasir A, Lopez A, Boulware D, Malafa M, Coppola D. Correlation between COX-2 and APC expression in left versus right-sided human colon cancer. Anticancer Res. 2011;31:2191-2195. [PubMed] |
| 10. | Gehling M, Arndt C, Eberhart LH, Koch T, Krüger T, Wulf H. Postoperative analgesia with parecoxib, acetaminophen, and the combination of both: a randomized, double-blind, placebo-controlled trial in patients undergoing thyroid surgery. Br J Anaesth. 2010;104:761-767. [PubMed] [DOI] |
| 11. | Kyriakidis AV, Perysinakis I, Alexandris I, Athanasiou K, Papadopoulos Ch, Mpesikos I. Parecoxib sodium in the treatment of postoperative pain after Lichtenstein tension-free mesh inguinal hernia repair. Hernia. 2011;15:59-64. [PubMed] [DOI] |
| 12. | Gamradt SC, Feeley BT, Liu NQ, Roostaeian J, Lin YQ, Zhu LX, Sharma S, Dubinett SM, Lieberman JR. The effect of cyclooxygenase-2 (COX-2) inhibition on human prostate cancer induced osteoblastic and osteolytic lesions in bone. Anticancer Res. 2005;25:107-115. [PubMed] |
| 13. | Ferrandina G, Lauriola L, Zannoni GF, Fagotti A, Fanfani F, Legge F, Maggiano N, Gessi M, Mancuso S, Ranelletti FO. Increased cyclooxygenase-2 (COX-2) expression is associated with chemotherapy resistance and outcome in ovarian cancer patients. Ann Oncol. 2002;13:1205-1211. [PubMed] [DOI] |
| 14. | Kim YM, Park SY, Pyo H. Cyclooxygenase-2 (COX-2) negatively regulates expression of epidermal growth factor receptor and causes resistance to gefitinib in COX-2-overexpressing cancer cells. Mol Cancer Res. 2009;7:1367-1377. [PubMed] [DOI] |
| 15. | Liu Z, Wang X, Lu Y, Han S, Zhang F, Zhai H, Lei T, Liang J, Wang J, Wu K. Expression of 15-PGDH is downregulated by COX-2 in gastric cancer. Carcinogenesis. 2008;29:1219-1227. [PubMed] [DOI] |
| 16. | Talar-Wojnarowska R, Gasiorowska A, Olakowski M, Lampe P, Smolarz B, Romanowicz-Makowska H, Malecka-Panas E. Role of cyclooxygenase-2 gene polymorphisms in pancreatic carcinogenesis. World J Gastroenterol. 2011;17:4113-4117. [PubMed] [DOI] |
| 17. | Zhao D, Xu D, Zhang X, Wang L, Tan W, Guo Y, Yu D, Li H, Zhao P, Lin D. Interaction of cyclooxygenase-2 variants and smoking in pancreatic cancer: a possible role of nucleophosmin. Gastroenterology. 2009;136:1659-1668. [PubMed] [DOI] |
| 18. | Zhang XM, Zhong R, Liu L, Wang Y, Yuan JX, Wang P, Sun C, Zhang Z, Song WG, Miao XP. Smoking and COX-2 functional polymorphisms interact to increase the risk of gastric cardia adenocarcinoma in Chinese population. PLoS One. 2011;6:e21894. [PubMed] [DOI] |
| 19. | Bu X, Zhao C, Dai X. Involvement of COX-2/PGE(2) Pathway in the Upregulation of MMP-9 Expression in Pancreatic Cancer. Gastroenterol Res Pract. 2011;2011:214269. [PubMed] |
| 20. | Özhan G, Lochan R, Leathart JB, Charnley R, Daly AK. Cyclooxygenase-2 polymorphisms and pancreatic cancer susceptibility. Pancreas. 2011;40:1289-1294. [PubMed] [DOI] |
| 21. | Lashinger LM, Malone LM, McArthur MJ, Goldberg JA, Daniels EA, Pavone A, Colby JK, Smith NC, Perkins SN, Fischer SM. Genetic reduction of insulin-like growth factor-1 mimics the anticancer effects of calorie restriction on cyclooxygenase-2-driven pancreatic neoplasia. Cancer Prev Res (Phila). 2011;4:1030-1040. [PubMed] [DOI] |
| 22. | Wang Z, Ahmad A, Li Y, Azmi AS, Miele L, Sarkar FH. Targeting notch to eradicate pancreatic cancer stem cells for cancer therapy. Anticancer Res. 2011;31:1105-1113. [PubMed] |
| 24. | 刘 伟, 李 开宗, 窦 科峰. 环氧化酶-2和血管内皮生长因子在胰腺癌组织中的表达及其相关性研究. 中国普外基础与临床杂志. 2003;10:539-541. |
| 26. | 刘 伟, 李 开宗, 窦 科峰, 宋 振顺, 苏 明权, 于 文彬. COX-2抑制剂联合顺铂对胰腺癌细胞增生和凋亡的影响. 世界华人消化杂志. 2004;12:1139-1143. [DOI] |
| 27. | 刘 伟, 张 永久, 李 开宗, 窦 科峰, 许 永华, 张 东, 闫 兵. COX-2抑制剂联合survivin反义寡核苷酸抗胰腺癌BxPC-3细胞的效应. 世界华人消化杂志. 2007;15:3178-3183. [DOI] |
| 28. | 贾 福鑫, 刘 伟, 张 东, 李 鹏, 李 建英, 冯 玉玲, 冯 德元. MMP-9和COX-2蛋白的表达对胰腺癌预后的影响. 中华临床医师杂志(电子版). 2011;5:1917-1922. |