修回日期: 2011-12-19
接受日期: 2012-03-10
在线出版日期: 2012-03-18
目的: 探讨Survivin基因对人胆管癌细胞凋亡信号通路的调节机制.
方法: 构建针对Survivin基因的siRNA和对照siRNA, 分别转染QBC939人胆管癌细胞, Western blot检测siRNA对细胞Survivin的干扰效果. 继而分别用流式细胞仪, 激酶活性测定和Western blot检测不同Survivin表达状态下, QBC939细胞的凋亡状态, caspase-3的活性和caspase-3, caspase-9及procaspase-9凋亡信号分子的表达.
结果: siRNA-Survivin显著抑制Survivin在QBC939细胞的表达(P<0.05). Survivin表达抑制后, QBC939细胞凋亡明显增加(18.9%±2.3%, P<0.05), caspase-3活性显著升高(0.83±0.15, P<0.01), caspase-3和caspase-9表达明显上调(P<0.05), 而procaspase-9表达降低(P<0.05). 未转染和转染对照siRNA的QBC939细胞上述变化无显著性差异(P>0.05).
结论: Survivin基因通过促进procaspase-9的活化以阻止caspase-3和caspase-9的激活从而抑制胆管癌细胞的凋亡.
引文著录: 卢昕, 肖新波. Survivin对人胆管癌细胞凋亡相关信号通路的作用机制. 世界华人消化杂志 2012; 20(8): 644-648
Revised: December 19, 2011
Accepted: March 10, 2012
Published online: March 18, 2012
AIM: To explore the mechanisms by which survivin regulates apoptosis-related signaling in human cholangiocarcinoma cells.
METHODS: SiRNA targeting the survivin gene and control siRNA were constructed and transfected into human cholangiocarcinoma cell line QBC939. The knockdown of survivin expression in QBC939 cells was confirmed by Western blot. Apoptosis rate was evaluated by flow cytometry. Capase-3 activity was determined using a commercial kit, and expression of caspase-3, caspase-9 and procaspase-9 in QBC939 cells was detected by Western blot.
RESULTS: Transfection of siRNA targeting the survivin gene significantly inhibited survivin expression in QBC939 cells (P < 0.05). Inhibition of survivin significantly increased apoptosis rate (18.9% ± 2.3%, P < 0.05) and caspase-3 activity (0.83 ± 0.15, P < 0.01), up-regulated the expression of caspase-3 and caspase-9 (both P < 0.05), and down-regulated the expression of procaspase-9 (P < 0.05) in QBC939 cells. No significant differences were observed in the above parameters between non-transfected QBC939 cells and cells transfected with control siRNA (all P > 0.05).
CONCLUSION: Survivin inhibits apoptosis of cholangiocarcinoma cells possibly by inhibiting caspase-3 and caspase-9 activities through activating procaspase-9.
- Citation: Lu X, Xiao XB. Investigation of mechanisms underlying inhibition of apoptosis-related signaling inhibited by survivin in human cholangiocarcinoma cells. Shijie Huaren Xiaohua Zazhi 2012; 20(8): 644-648
- URL: https://www.wjgnet.com/1009-3079/full/v20/i8/644.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i8.644
胆管癌是一种对标准化治疗(包括手术疗法、化学疗法和放射疗法)反应较差的恶性肿瘤, 其发生发展的机制还不十分确切[1,2]. Survivin基因是新近发现的凋亡抑制蛋白基因家族成员, 其通过抑制细胞凋亡促进肿瘤发生发展[3]. 既往有学者研究发现Survivin基因在胆管癌细胞中也呈现高表达状态, 且其表达状态与患者预后相关[4]. 但是Survivin基因在胆管癌发生机制中的作用还不明确. 目前研究认为Survivin通过直接抑制凋亡终末效应器caspase-3和caspase-9的活性阻断细胞凋亡过程[5,6]. 本研究通过siRNA干扰Survivin基因在胆管癌细胞中的表达, 拟阐明其对胆管癌细胞凋亡的调节机制.
QBC939胆管癌细胞系由西南医院王曙光教授惠赠. Survivin, caspase-3, caspase-9和procaspase-9兔抗人单克隆一抗均购自Santa Cruz Biotechnology公司(USA); β-actin兔抗人单克隆一抗及相应辣根过氧化物酶标记二抗购自武汉博士德公司; 蛋白裂解液和ECL发光试剂盒购自Pierce公司; caspase-3活性测定试剂盒购自Clontech公司(USA); Annexin V-FITC凋亡检测试剂盒购自南京凯基生物公司; siRNA转染试剂盒购自北京全式金生物技术公司.
1.2.1 siRNA设计构建及细胞转染: Survivin基因cDNA序列为: 5'-GGACCACCGCATCTCTACATTCAAGAGATGTAGAGATGCGGTGGTCC-3'. 其siRNA靶序列为: 5'-AAGGACCACCGCATCTCTACA-3'. 阴性对照siRNA序列为随机序列: 5'-AAGCTTCATAAGGCGCATAGC-3', siRNA设计参考本课题前期研究结论[7]. 设计的siRNA由上海吉玛制药技术有限公司合成纯化. 接种QBC939胆管癌细胞于24孔板内, 待生长至30%-50%融合时, siRNA转染依照北京全式金生物技术公司siRNA转染试剂盒说明书进行.
1.2.2 细胞凋亡检测: QBC939细胞、QBC939/siRNA(-)细胞和QBC939/siRNA(+)细胞接种于100 mL培养瓶中, 待细胞生长至融合度约为80%(1×106)时, 轻微消化细胞, 并及时加入含血清的完全培养基终止反应. 轻微吹打使细胞脱壁, 500 r/min离心5 min收集细胞, 吸弃上清, 用PBS洗涤细胞2次. 后续步骤按照Annexin V FITC凋亡检测试剂盒说明书进行操作, 用流式细胞仪定量分析细胞凋亡水平.
1.2.3 细胞caspase-3活性测定: QBC939细胞、QBC939/siRNA(-)细胞和QBC939/siRNA(+)细胞接种于100 mL培养瓶中, 待细胞生长至融合度约为80%(1×106)时, 消化收集细胞. 细胞重悬于50 µL预冰的细胞裂解缓冲液, 冰上孵育10 min, 再以13 000 r/min 4 ℃离心10 min, 收集上清液置于冰上Ep管中, 后续步骤按caspase-3活性测定试剂盒说明书进行, 最后用酶标仪测定405 nm处底物裂解产生的荧光强度.
1.2.4 Western blot检测: 以冰PBS分别洗QBC939细胞、QBC939/siRNA(-)细胞和QBC939/siRNA(+)细胞2次, 刮取收集细胞并加入蛋白裂解液反复抽提, 冰浴5 min后, 13 000 r/min 4 ℃离心10 min, 收集上清. 蛋白定量后, 30 μg/孔上样, 经10%SDS-PAGE电泳后电转移至NC膜上, 5%脱脂奶粉封闭1 h, 分别加入1:1 000 Survivin, caspase-3, caspase-9和procaspase-9兔抗人单克隆一抗4 ℃孵育过夜, 相应二抗室温孵育1 h后, ECL发光显影.
统计学处理 采用 SPSS12.0软件做统计学分析, 结果以mean±SD表示, 组间数据比较采用方差分析. P<0.05被认为具有统计学意义.
本研究构建的针对Survivin基因的siRNA成功转染QBC939胆管癌细胞后, 经Western-blot证实Survivin蛋白的相对表达量在实验组、阴性对照组、空白对照组分别为0.225±0.028, 0.590±0.043, 0.581±0.023. 转染siRNA-Survivin的QBC939胆管癌细胞Survivin蛋白表达与阴性对照组、空白对照组相比明显减少(P<0.05, 图1).
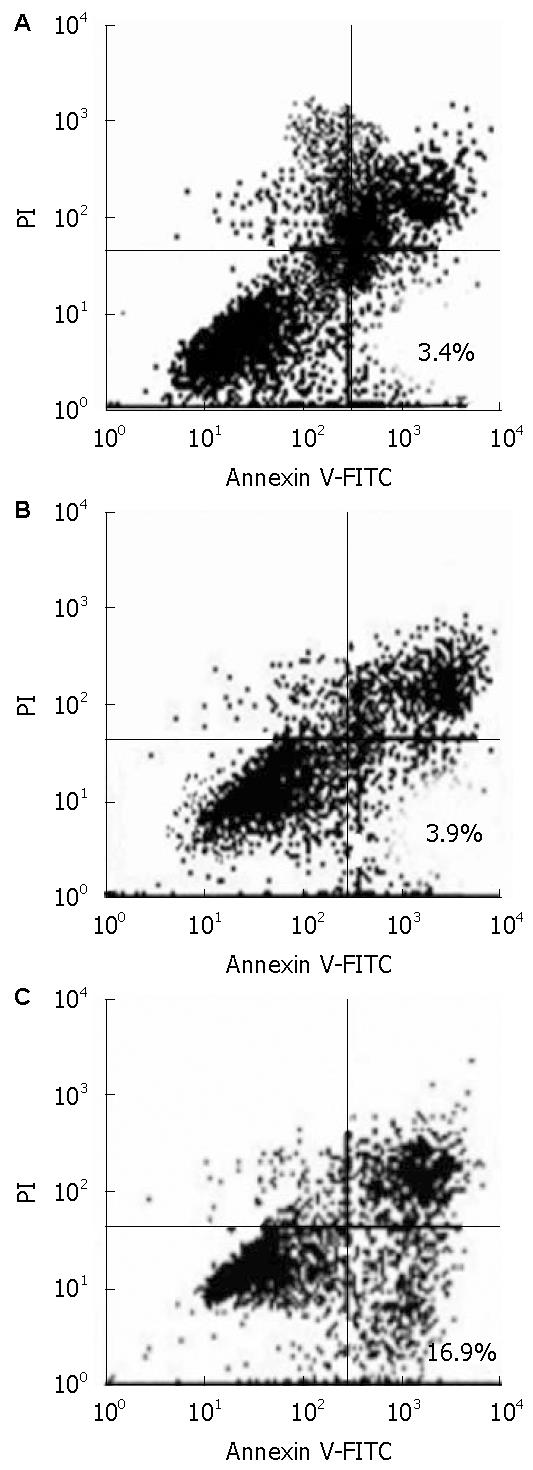
采用流式细胞仪定量分析经Annexin V-FITC和PI染色的QBC939细胞、QBC939/siRNA(-)细胞和QBC939/siRNA(+)的凋亡水平, 结果显示: QBC939/silence(+)凋亡细胞明显增多(18.9%±2.3%), 与QBC939细胞(3.4%±0.9%) 和QBC939/silence(-)细胞(3.9%±1.0%)相比, 差异具有显著性(P<0.01, 图2).
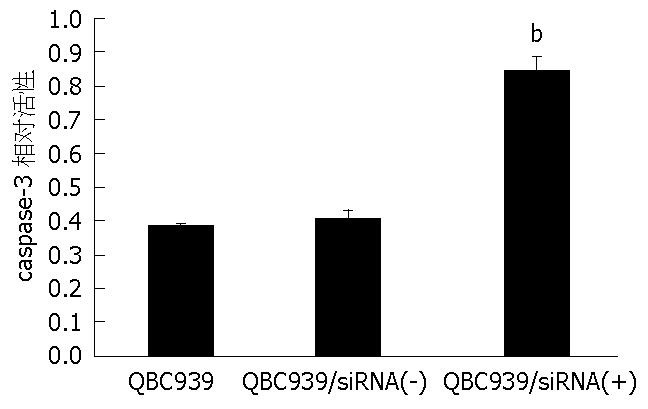
细胞caspase-3活性测定显示QBC939和QBC939/silence(-)细胞吸光度(A)值较低(0.39±0.11 vs 0.41±0.13), 两者之间无显著性差异(P>0.05); 而转染siRNA-Survivin的QBC939细胞的A值较高(0.83±0.15), 与对照组相比有显著差异(P<0.01, 图3).
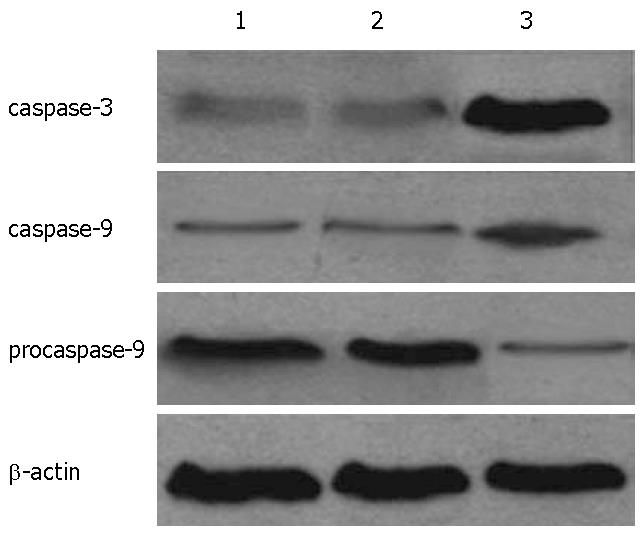
Western blot检测信号分子caspase-3、procaspase-9和caspase-9蛋白的表达显示: caspase-3、caspase-9、procaspase-9 A值在QBC939细胞、QBC939/siRNA(-)、QBC939/siRNA(+)分别为: 0.201±0.014, 0.297±0.015, 0.782±0.021; 0.215±0.013, 0.289±0.009, 0.791±0.081; 1.386±0.112, 0.892±0.043, 0.281±0.011. QBC939/siRNA(+)细胞中caspase-3、caspase-9表达较对照组明显增加(P<0.01), 而procaspase-9表达明显降低(P<0.05, 图4).
肝肿瘤的发生是一种多因素、多阶段、长期相互作用的过程[8,9]. 近年来, 细胞凋亡在肿瘤发展过程中的作用引起了广泛关注[10-12]. 目前研究表明肿瘤细胞中凋亡抑制基因的高表达能明显抑制细胞的凋亡, 逃避机体免疫系统对肿瘤细胞的识别和清除[13,14], 导致细胞增殖、分化、凋亡3者间的平衡失调进而参与肿瘤的发生发展[15,16].
Survivin是1997年发现的凋亡抑制蛋白(inhihibitor of apoptosis protein, IAPs)家族的一个新成员[17]. 他的主要作用是抑制肿瘤细胞凋亡, 促进肿瘤细胞增殖[18]. 目前研究发现胆管癌中Survivin表达明显高于正常组织, 并且参与了胆管癌的发生发展过程[19], 然而Survivin在胆管癌发生发展中的确切机制仍不明确[20].
Caspases是一个特异性的半胱氨酸蛋白酶家族, 其活性是细胞内执行凋亡过程中最关键的环节之一[21]. 其中caspase-3广泛分布于各种类型的细胞中, 是多种刺激诱导的凋亡中最主要的效应分子, 其降解凋亡底物的活性最强[22]. Caspase-3活化后以相同方式作用于另一些成员, 从而构成蛋白酶级联放大系统, 介导细胞核片段化, 并参与凋亡小体的形成[23]. 因此对caspase蛋白级联反应的抑制将导致细胞对凋亡的抵抗[24], 实际上, 许多抗凋亡蛋白都具有抗caspases活性的作用, 如Survivin[25]. 在本实验中我们发现, QBC939细胞高表达Survivin, 而caspase-3的活性水平极低, 这有利于胆管癌细胞逃避凋亡, 维持较高的增殖活性, 促进肿瘤发生发展. 而在siRNA-Survivin转染后, caspase-3活性水平显著升高, 这与以前的研究发现Survivin具有抑制caspase-3活性的功能是一致的. 这一结果说明在QBC939细胞中表达的caspase-3主要以无活性的形式存在, 单独caspase-3的表达不足以诱导凋亡, 以siRNA沉寂Survivin基因的表达可以导致caspase-3的激活, 活化的caspase-3再发挥其介导细胞凋亡的作用. 这一结果也提示在QBC939胆管癌细胞中caspase-3的低活性状态是由于Survivin的表达所致, 在转染siRNA-Survivin诱导QBC939细胞发生的凋亡过程中, caspase-3的活化是一个关键性的步骤.
然而Survivin抑制肿瘤细胞凋亡的信号传导通路至今仍存在争议, 有研究表明Survivin可能是通过以下2条途径来抑制细胞凋亡[26,27]: 其一是通过直接抑制凋亡终末效应器caspase-3和caspase-7的活性阻断各种刺激诱导的细胞凋亡过程[28]; 其二是Survivin与周期蛋白激酶cdk4、p34cdc2相互作用阻断凋亡信号传导通路[29]. Survivin依赖细胞增殖信号进入核内与cdk4结合, 导致Cdk2/CyclinE激活和Rb磷酸化以启动细胞进入生长周期, 加快G1→S期的转换, 同时使p21从cdk4中释放出来并易位到线粒体与procaspase-3形成复合物, 抑制caspase-3的活性, 阻断线粒体释放细胞色素c从而抑制细胞凋亡[30]. Wall等[31]研究发现Survivin是周期蛋白激酶p34cdc-Cyclin B1的有丝分裂期底物, Survivin磷酸化后与caspase-9结合并抑制其活性, 阻断caspase-9依赖性的细胞凋亡信号传导. 由此可见, Survivin抑制肿瘤细胞凋亡的机制还不清楚. 本研究发现, 在QBC939细胞中caspase-9和caspase-3的表达和活性水平均较低, 这有利于胆管癌细胞逃逸凋亡, 维持较高的增殖活性, 促进肿瘤的发生和发展. 而在应用siRNA抑制Survivin表达后, 一些信号分子的表达发生变化, 主要表现在procaspase-9表达减少, 而caspase-9和caspase-3表达增加. 由此推测, 抑制Survivin的表达导致procaspase-9表达减少, 而caspase-9表达增加, 进而激活procaspase-3产生caspase-3, 随后激活caspase级联, 导致细胞的凋亡. 研究认为Survivin抑制肿瘤细胞凋亡的信号传导通路之一是通过促进procaspase-9的活化而阻止caspase-3和caspase-9的激活, 抑制肿瘤细胞的凋亡.
本研究初步阐明了Survivin抑制胆管癌细胞凋亡的相关信号分子变化, 探讨了Survivin凋亡抑制的可能作用机制, 然而本研究所涉及的信号分子有限, Survivin抑制凋亡信号传导的下游通路是我们下一步深入研究的重点.
Survivin基因是新近发现的凋亡抑制蛋白基因家族成员, 其通过抑制细胞凋亡促进肿瘤发生发展. 既往有学者研究发现Survivin基因在胆管癌细胞中也呈现高表达状态, 且其表达状态与患者预后相关. 但是Survivin基因在胆管癌发生机制中的作用还不明确.
秦建民, 主任医师, 上海中医药大学附属普陀医院普外科
有研究已发现Survivin基因在胆管癌细胞中呈现高表达状态, 且其表达状态与患者预后相关.
本研究运用siRNA研究凋亡抑制基因Survivin对胆管癌的抑制作用并初步探讨其机制. 目前国内外尚未见相关文献.
本研究采用siRNA干扰技术观察Survivin基因对胆管癌细胞生长调控作用及其机制, 研究方法得当, 结果可靠, 初步揭示了Survivin基因参与胆管癌细胞生物学行为, 为研究胆管癌的发生与治疗提供重要的理论基础.
编辑: 李军亮 电编: 鲁亚静
| 1. | Friman S. Cholangiocarcinoma--current treatment options. Scand J Surg. 2011;100:30-34. [PubMed] |
| 2. | Charbel H, Al-Kawas FH. Cholangiocarcinoma: epidemiology, risk factors, pathogenesis, and diagnosis. Curr Gastroenterol Rep. 2011;13:182-187. [PubMed] [DOI] |
| 3. | Varfolomeev E, Vucic D. Inhibitor of apoptosis proteins: fascinating biology leads to attractive tumor therapeutic targets. Future Oncol. 2011;7:633-648. [PubMed] [DOI] |
| 4. | 左 克强, 艾 开兴, 郭 兴军, 宋 自芳, 陈 立波, 郑 启昌. Survivin蛋白和mRNA在胆管癌中的表达和意义. 华中科技大学学报(医学版). 2007;36:199-201. |
| 5. | Olie RA, Simões-Wüst AP, Baumann B, Leech SH, Fabbro D, Stahel RA, Zangemeister-Wittke U. A novel antisense oligonucleotide targeting survivin expression induces apoptosis and sensitizes lung cancer cells to chemotherapy. Cancer Res. 2000;60:2805-2809. [PubMed] |
| 6. | Baratchi S, Kanwar RK, Kanwar JR. Novel survivin mutant protects differentiated SK-N-SH human neuroblastoma cells from activated T-cell neurotoxicity. J Neuroimmunol. 2011;233:18-28. [PubMed] [DOI] |
| 8. | Kimmelman AC. The dynamic nature of autophagy in cancer. Genes Dev. 2011;25:1999-2010. [PubMed] [DOI] |
| 9. | Li G, Xiao Z, Liu J, Li C, Li F, Chen Z. Cancer: a proteomic disease. Sci China Life Sci. 2011;54:403-408. [PubMed] [DOI] |
| 10. | Kelly GL, Strasser A. The essential role of evasion from cell death in cancer. Adv Cancer Res. 2011;111:39-96. [PubMed] [DOI] |
| 11. | Plati J, Bucur O, Khosravi-Far R. Apoptotic cell signaling in cancer progression and therapy. Integr Biol (Camb). 2011;3:279-296. [PubMed] [DOI] |
| 12. | Llambi F, Green DR. Apoptosis and oncogenesis: give and take in the BCL-2 family. Curr Opin Genet Dev. 2011;21:12-20. [PubMed] [DOI] |
| 13. | Lheureux S, Le Moulec S. [Molecules involved in apoptosis regulation as therapeutic targets in oncology]. Bull Cancer. 2011;98:1029-1036. [PubMed] |
| 14. | LaCasse EC, Baird S, Korneluk RG, MacKenzie AE. The inhibitors of apoptosis (IAPs) and their emerging role in cancer. Oncogene. 1998;17:3247-3259. [PubMed] [DOI] |
| 15. | Erenpreisa J, Cragg MS. Cancer: a matter of life cycle? Cell Biol Int. 2007;31:1507-1510. [PubMed] [DOI] |
| 16. | Green DR, Evan GI. A matter of life and death. Cancer Cell. 2002;1:19-30. [PubMed] [DOI] |
| 17. | Sela B. [Survivin: anti-apoptosis protein and a prognostic marker for tumor progression and recurrence]. Harefuah. 2002;141:103-107, 123. [PubMed] |
| 18. | Chiou SK, Jones MK, Tarnawski AS. Survivin - an anti-apoptosis protein: its biological roles and implications for cancer and beyond. Med Sci Monit. 2003;9:PI25-PI29. [PubMed] |
| 19. | Qin XL, Xue HZ, Wang ZR, Liu HS, Zhou HB, Ma W. [Expression of Survivin protein in extrahepatic cholangiocarcinoma and its relationship with the prognosis]. Zhonghua Wai Ke Za Zhi. 2009;47:1852-1856. [PubMed] |
| 20. | Altieri DC. Survivin and IAP proteins in cell-death mechanisms. Biochem J. 2010;430:199-205. [PubMed] [DOI] |
| 21. | Strasser A, Cory S, Adams JM. Deciphering the rules of programmed cell death to improve therapy of cancer and other diseases. EMBO J. 2011;30:3667-3683. [PubMed] [DOI] |
| 23. | Takeda K, Naguro I, Nishitoh H, Matsuzawa A, Ichijo H. Apoptosis signaling kinases: from stress response to health outcomes. Antioxid Redox Signal. 2011;15:719-761. [PubMed] [DOI] |
| 24. | Enari M, Talanian RV, Wong WW, Nagata S. Sequential activation of ICE-like and CPP32-like proteases during Fas-mediated apoptosis. Nature. 1996;380:723-726. [PubMed] [DOI] |
| 25. | Suzuki A, Ito T, Kawano H, Hayashida M, Hayasaki Y, Tsutomi Y, Akahane K, Nakano T, Miura M, Shiraki K. Survivin initiates procaspase 3/p21 complex formation as a result of interaction with Cdk4 to resist Fas-mediated cell death. Oncogene. 2000;19:1346-1353. [PubMed] [DOI] |
| 26. | Kebbell MR, Giles DC. Some experimental influences of lawyers' complicated questions on eyewitness confidence and accuracy. J Psychol. 2000;134:129-139. [PubMed] [DOI] |
| 27. | Mesri M, Wall NR, Li J, Kim RW, Altieri DC. Cancer gene therapy using a survivin mutant adenovirus. J Clin Invest. 2001;108:981-990. [PubMed] [DOI] |
| 28. | Cladis FP, Litman RS. Transient cardiovascular toxicity with unintentional intravascular injection of 3% 2-chloroprocaine in a 2-month-old infant. Anesthesiology. 2004;100:181-183. [PubMed] [DOI] |
| 29. | Wittmann S, Bali P, Donapaty S, Nimmanapalli R, Guo F, Yamaguchi H, Huang M, Jove R, Wang HG, Bhalla K. Flavopiridol down-regulates antiapoptotic proteins and sensitizes human breast cancer cells to epothilone B-induced apoptosis. Cancer Res. 2003;63:93-99. [PubMed] |
| 30. | O'Connor DS, Grossman D, Plescia J, Li F, Zhang H, Villa A, Tognin S, Marchisio PC, Altieri DC. Regulation of apoptosis at cell division by p34cdc2 phosphorylation of survivin. Proc Natl Acad Sci U S A. 2000;97:13103-13107. [PubMed] [DOI] |
| 31. | Wall NR, O'Connor DS, Plescia J, Pommier Y, Altieri DC. Suppression of survivin phosphorylation on Thr34 by flavopiridol enhances tumor cell apoptosis. Cancer Res. 2003;63:230-235. [PubMed] |