修回日期: 2012-01-17
接受日期: 2012-03-10
在线出版日期: 2012-03-18
目的: 观察Nesfatin-1对正常及单纯性肥胖大鼠胃排空及离体胃平滑肌条收缩活性的影响.
方法: 高脂饲料喂养♂大鼠6 wk, 制作单纯性肥胖大鼠模型; 正常及肥胖大鼠实验组中枢注入不同浓度Nesfatin-1(0.5 μmol/L、5 μmol/L、50 μmol/L)后测胃排空率; 生理记录仪记录大鼠胃底、胃体平滑肌条自发收缩及不同浓度Nesfatin-1(0.026 μmol/L、0.26 μmol/L、2.6 μmol/L)作用下对乙酰胆碱(Ach)诱导的肌条收缩的影响.
结果: Nesfatin-1可抑制正常及肥胖大鼠胃平滑肌条收缩, 低、中、高浓度组与生理盐水对照组相比差异均有统计学意义(q = 3.93-15.72, P<0.05-0.01). 随Nesfatin-1浓度的增高, 其抑制作用呈明显剂量依赖关系(q = 3.45-5.69, P<0.05-0.01). 低浓度Nesfatin-1抑制正常大鼠、肥胖大鼠胃底平滑肌条收缩作用无显著性差异(P>0.05), 中、高浓度对正常大鼠胃底平滑肌条抑制作用强于肥胖大鼠(t = 2.14, P<0.05; t = 2.63, P<0.05). 低、中浓度Nesfatin-1抑制正常大鼠、肥胖大鼠离体胃体平滑肌条收缩作用无显著性差异(P>0.05), 但高浓度抑制正常大鼠离体胃体平滑肌条收缩作用显著强于肥胖大鼠(t = 2.53, P<0.05).
结论: Nesfatin-1可抑制正常及肥胖大鼠胃排空, 胃排空率随Nesfatin-1浓度增加而降低. Nesfatin-1可抑制乙酰胆碱诱导的单纯性肥胖大鼠离体胃平滑肌条的收缩活动, 其抑制作用随Nesfatin-1浓度增高而增强; 相同Nesfatin-1浓度抑制正常大鼠离体平滑肌条收缩作用强于肥胖大鼠.
引文著录: 李娜, 田字彬, 孙桂荣, 魏良洲, 徐珞, 王百惠, 孔心涓, 丁雪丽, 崔铭娟. Nesfatin-1对肥胖大鼠胃排空及胃平滑肌条收缩性的影响. 世界华人消化杂志 2012; 20(8): 631-637
Revised: January 17, 2012
Accepted: March 10, 2012
Published online: March 18, 2012
AIM: To observe the impact of treatment with Nesfatin-1 on gastric emptying and stomach smooth muscle contraction in obese rats.
METHODS: Obese rats were fed a high-nutrition diet for 6 weeks, while control rats were fed a normal diet. Different concentrations of Nesfatin-1 (0.5, 5, 50 μmol/L) were injected into the dorsal vagal complex (DVC). Gastric emptying was then determined, and the spontaneous contraction of isolated circular smooth muscle of gastric fundus and gastric body was recorded. In addition, the impact of different concentrations of Nesfatin-1 (0.026, 0.26, 2.6 μmol/L) on acetylcholine (Ach)-induced muscle contraction was observed.
RESULTS: Various concentrations of Nesfatin-1 significantly inhibited the contraction of gastric smooth muscle strips isolated from both normal and obese rats compared to rats treated with normal saline (q = 3.93-15.72, all P < 0.05 or 0.01). Compared to normal rats, low-concentration Nesfatin-1 showed no significant relaxing effect on stomach fundus smooth muscle in obese rats (P > 0.05); however, medium and high concentrations of Nesfatin-1 significantly inhibited the contraction of gastric fundus smooth muscle of obese rats (t = 2.14, 2.63; both P < 0.05). Compared to normal rats, low and medium concentrations of Nesfatin-1 showed no significant relaxing effect on stomach corpus smooth muscle in obese rats (both P > 0.05); however, high-concentration Nesfatin-1 significantly inhibited the contraction of gastric corpus smooth muscle of obese rats (t = 2.53, P < 0.05).
CONCLUSION: Nesfatin-1 inhibits gastric emptying in normal and obese rats and acetylcholine-induced gastric smooth muscle contraction in obese rats in a concentration-dependent manner. The inhibitory effect of Nesfatin-1 is stronger in normal rats than in obese ones.
- Citation: Li N, Tian ZB, Sun GR, Wei LZ, Xu L, Wang BH, Kong XJ, Ding XL, Cui MJ. Effect of Nesfatin-1 on gastric emptying and contraction of gastric smooth muscle strips in obese rats. Shijie Huaren Xiaohua Zazhi 2012; 20(8): 631-637
- URL: https://www.wjgnet.com/1009-3079/full/v20/i8/631.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i8.631
肥胖症是高血压病、冠心病、糖尿病等常见疾病的危险因子, 严重影响现代人的生活质量, 防治肥胖具有非常重要的意义[1-4]. 大脑对机体能量的调节是通过一系列复杂多样的化学信号分子传递的, 在维持能量平衡中发挥重要作用[5-8]. Nesfatin-1是新发现的一种摄食调节肽, 可参与能量代谢, 其前体是NEFA基因编码的420个氨基酸组成的多肽(nucleobindinⅡ, NUCB2), 脑室注射给予Nesfatin-1抑制摄食呈剂量依赖性, 而同时给予其特异性抗体可使摄食量增多[9]. 研究表明Nesfatin-1有一定的抑制摄食作用, 但是否也具有调节大鼠胃排空的作用目前尚无报道, 本实验观察Nesfatin-1对离体胃平滑肌条收缩的作用及中枢注射Nesfatin-1对正常及肥胖大鼠胃排空的影响, 探讨肥胖状态下Nesfatin-1对胃排空及平滑肌条活性影响的作用机制.
酚红、三氯乙酸购自国药集团化学试剂有限公司; 氯化乙酰胆碱购自上海三爱思试剂有限公司; Nesfatin-1购自Phoenix Pharmaceuticals, USA; 四道生理记录仪RM6240 BD型及四腔器官浴槽系统购自成都仪器厂.
1.2.1 动物准备: 128只♂Wistar大鼠, 体质量在100-120 g(青岛药检所提供), 随机各分成8个正常饲料组及模型组. 正常组喂以正常饲料, 模型组喂以高脂高营养性饲料, 配方为100 g基础饲料中加入全脂奶15 g、猪油5 g、鸡蛋黄50 g、黄豆15 g、鱼肝油10滴, 每周观察大鼠体质量、身长、Lee's指数[(体质量)1/3×103/体长cm], 6 wk后内眦取血检测甘油三酯和胃排空的变化[10]. 正常饲料组及模型组大鼠均在22 ℃±2 ℃室温条件下饲养, 每天8:00-20:00光照, 自由饮水, 湿度保持在55%±10%.
1.2.2 迷走复合体(DVC)区埋置套管: 取♂Wistar正常及肥胖大鼠, 用400 mg/kg水合氯醛腹腔注射麻醉, 将大鼠俯卧位固定于脑立体定位仪上, 头部正中切口, 用3%的双氧水腐蚀软组织, 充分暴露颅骨, 使前后囟位于同一水平线, 根据大鼠脑部立体定位图谱(Paxinos&Watson, 第5版)确定DVC的位置(L+0.4, F-13.8, H+8.0), 用三棱针钻开颅骨, 清除硬脑膜及蛛网膜, 将长15 mm, 内径3 mm, 外径4 mm的自制不锈钢套管垂直置入左侧DVC区, 用502胶及牙托粉固定金属套管, 并插入不锈钢内芯防止阻塞.
1.2.3 中枢注射Nesfatin-1测胃排空率: DVC置管手术后大鼠单笼饲养, 恢复7 d, 每天予腹腔注射2万单位青霉素预防感染. 将正常及肥胖大鼠禁食8 h不禁水. 分别予实验组大鼠DVC区微量注射Nesfatin-1: 0.5 μmol/L、5 μmol/L、50 μmol/L各0.5 μL, 2 min内注完, 留针1 min. 生理盐水对照组大鼠同样方法注入等容积生理盐水(NS)0.5 μL. 2.5 h后每只大鼠给予50 mg/dL酚红2 mL灌胃, 15 min后将大鼠颈椎脱臼, 打开腹腔, 结扎贲门和幽门, 取出整个鼠胃, 沿胃大弯切开, 以蒸馏水冲洗胃内容物, 定容为20 mL. 再加入0.5 mol/L NaOH 20 mL搅拌混匀, 静置1 h后取5 mL上清液, 加入20%三氯乙酸0.5 mL去蛋白, 以3500 r/min(离心半径0.1 m)离心10 min, 取上清液用分光光度计在560 nm波长下测定吸光度值. 另取酚红溶液2 mL, 先后加入蒸馏水18 mL、0.5 mol/L NaOH 20 mL、20%三氯乙酸4 mL搅拌混匀, 测定吸光度值. 大鼠胃排空率 = (1-实测酚红吸光度/标准酚红吸光度)×100%.
1.2.4 检验埋管位置准确性: 实验结束后, 正常及肥胖大鼠均经套管微量注射0.2 μL滂胺天蓝于DVC, 打开胸腔予心脏灌流生理盐水及4%多聚甲醛固定脑组织, 将脑组织切成50 μm冠状冰冻切片, 观察DVC置管定位. 定位不准确的实验结果不予统计.
1.2.5 平滑肌条制备及体外肌条舒缩实验: 实验前大鼠禁食24 h不禁水, 颈椎脱臼法处死, 剖腹取胃, 沿胃小弯剪开. 用Krebs液(mmol/L: 137.5 Na+, 5.9 K+, 2.5 Ca2+, 1.2 Mg2+, 134.2 Cl-, 15.5 HCO3-, 1.2 H2PO4-, 11.5 glucose)洗净胃内容物后放入盛有Krebs液的硅胶盘中, 去掉黏膜及黏膜下层, 分别取胃体、胃底大小约2 mm×10 mm[11]的环行肌条, 放入37 ℃恒温浴槽中, 并通入含950 mL/L O2和50 mL/L CO2的混合气体. 将肌条一端固定于浴槽通气侧弯钩上, 另一端悬挂于张力换能器上, 并连接生理记录仪, 稳定1 h, 并记录肌条张力曲线, 待肌条的自发收缩活动稳定后加入乙酰胆碱, 待收缩曲线稳定后实验组加入Nesfatin-1, 对照组加入等容积的生理盐水, 观察不同浓度Nesfatin-1(0.026 μmol/L、0.26 μmol/L、2.6 μmol/L)对肌条张力的影响.
统计学处理 应用SPSS18.0统计学软件进行数据处理, 两组数据间比较采用t检验, 多组间比较采用单因素方差分析法. 以乙酰胆碱(5×10-7 mol/L)诱导产生的收缩波之后平台期的张力为对照值(g), 以加入药物后平滑肌舒张至最低波谷为效应值(g). 结果以张力变化百分率表示(张力变化百分率 = 效应值/对照值×100%). 所有结果用mean±SD表示, P<0.05差异有统计学意义.
用2种不同饲料喂养的大鼠, 高脂饲料组体质量增长较快, 明显超过正常对照组, 两组差异有统计学意义(t = 6.34, P<0.01). 高脂饲料组大鼠身长、Lee's指数及甘油三酯含量均明显高于正常对照组(t = 3.41, P<0.05; t = 5.89, P<0.01; t = 2.72, P<0.05, 表1).
低浓度Nesfatin-1(0.5 μmol/L)对正常大鼠胃排空有显著抑制作用(q = 3.45, P<0.05), 但对肥胖大鼠胃排空无显著影响(q = 2.95, P>0.05); 中浓度和高浓度Nesfatin-1(5.0 μmol/L、50 μmol/L)均可显著抑制正常大鼠和肥胖大鼠胃排空作用(P<0.01), 且呈显著量效依赖关系(q = 3.03-5.20, P<0.05-0.01, 表2).
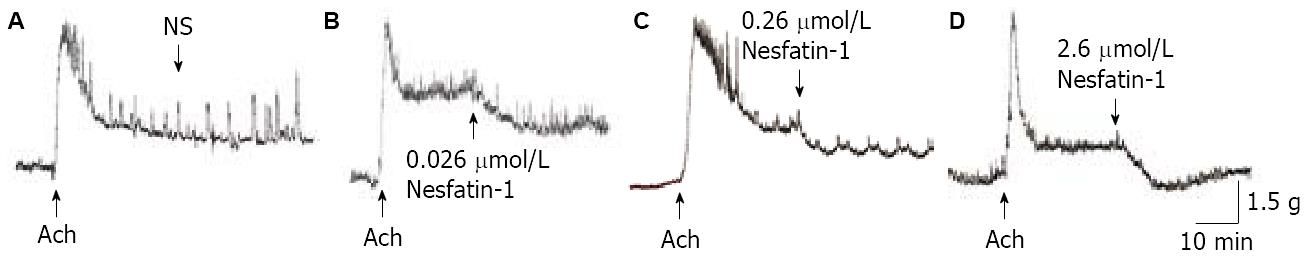
2.3.1 Nesfatin-1对大鼠胃底平滑肌条收缩活动的影响: 低、中或高浓度Nesfatin-1对由乙酰胆碱(5×10-7 mol/L)诱导的正常大鼠胃底离体平滑肌条的收缩活动均有抑制作用(q = 6.43, P<0.01; q = 10.03, P<0.01; q = 15.72, P<0.01), 随Nesfatin-1浓度的增高, 其抑制作用显著加强, 呈明显剂量依赖关系(q = 3.60-5.69, P<0.05-0.01, 图1, 表3).
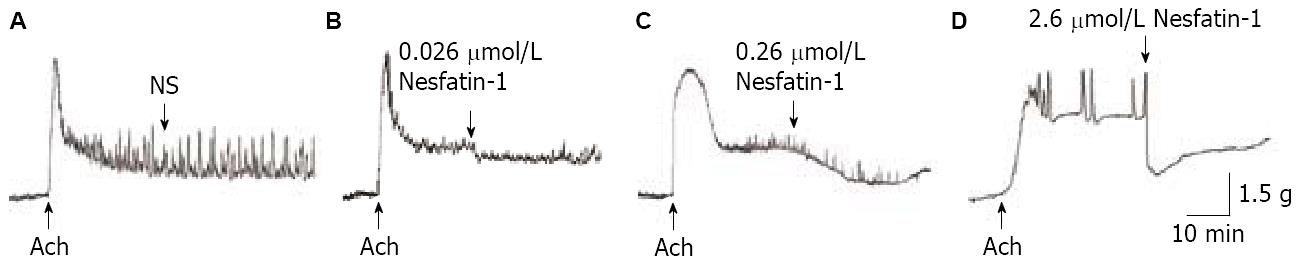
低、中、高浓度的Nesfatin-1可明显抑制由乙酰胆碱(5×10-7 mol/L)诱导的肥胖大鼠胃底离体平滑肌条的收缩活动(q = 4.18, P<0.01; q = 6.70, P<0.01; q = 11.74, P<0.01). 中浓度组(0.26 µmol/L)与低浓度组(0.026 µmol/L)相比较, 差异无显著性(P>0.05), 高浓度组(2.6 µmol/L)与中浓度组(0.26 µmol/L)相比较差异有统计学意义(q = 5.04, P<0.01, 图2, 表3).
低浓度Nesfatin-1(0.026 µmol/L)对正常大鼠、肥胖大鼠胃底平滑肌条收缩抑制作用无显著性差异(P>0.05); 但中浓度Nesfatin-1(0.26 µmol/L)和高浓度Nesfatin-1(2.6 µmol/L)对肥胖大鼠胃底平滑肌条的舒缩张力的抑制作用弱于正常大鼠 (t = 2.14, P<0.05; t = 2.63, P<0.05).
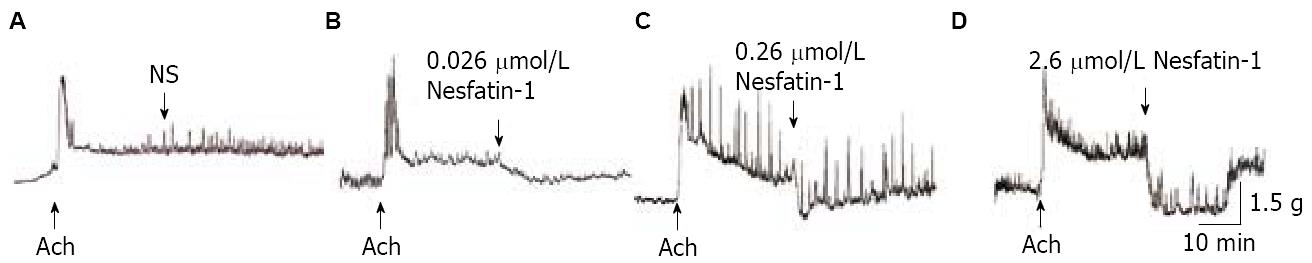
2.3.2 Nesfatin-1对大鼠胃体平滑肌条收缩活动的影响: 低、中、高浓度Nesfatin-1对由乙酰胆碱(5×10-7 mol/L)诱导的正常大鼠胃体离体平滑肌条的收缩活动均有抑制作用(q = 6.18, P<0.01; q = 9.85, P<0.01; q = 14.86, P<0.01), 随Nesfatin-1浓度的增高, 其抑制作用呈剂量依赖关系(q = 3.67-5.01, P<0.05-0.01, 图3, 表3).
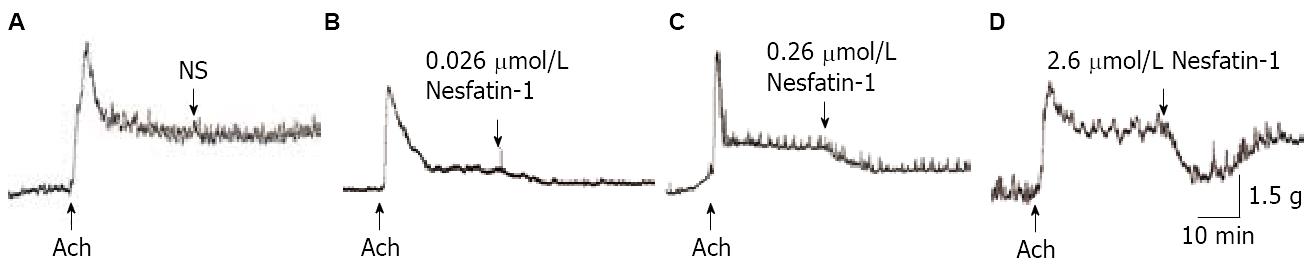
低、中、高浓度Nesfatin-1对由乙酰胆碱(5×10-7 mol/L)诱导的肥胖大鼠胃体离体平滑肌条的收缩活动均有抑制作用(q = 3.93, P<0.05; q = 7.39, P<0.01; q = 11.37, P<0.01), 随Nesfatin-1浓度的增高, 其抑制作用显著加强, 呈明显剂量依赖关系(q = 3.45-3.99, P<0.05, 图4, 表3).
低浓度(0.026 µmol/L)及中浓度(0.26 µmol/L)Nesfatin-1对正常大鼠、肥胖大鼠离体胃体平滑肌条作用无显著性差异(P>0.05), 但高浓度Nesfatin-1(2.6 µmol/L)对肥胖大鼠离体胃体平滑肌条收缩抑制作用低于正常大鼠(t = 2.53, P<0.05).
肝目前Nesfatin-1/NUCB2的功能及机制等方面仍有很多未知领域, 但是从大鼠、小鼠到人的Nesfatin-1序列具有高度保守性[12]. NUCB2在激肽原转化酶的作用下可裂解为Nesfatin-1、Nesfatin-2及Nesfatin-3 3个片段, 但只有Nesfatin-1对摄食有抑制作用[9]. 已有研究表明中枢注射NUCB2重组蛋白可使大鼠体质量降低, 摄食量也呈剂量依赖性的减少[9,13,14]. Nesfatin-1在中枢及外周均有表达, 在中枢Nesfatin-1主要表达于下丘脑, 包括下丘脑弓形核(arcuate nucleus, ARC)、室旁核(paraventricu1ar nucleus, PVN)、视上核和下丘脑外侧区. 此外Nesfatin-1也存在于脑干, 如迷走神经背核、孤束核等部位[15-18]. 迷走神经背核大部分神经元参与调节胃肠道反应, 所以迷走神经背核释放Nesfatin-1可能参与调控胃肠道收缩活动, 从而参与摄食调节[19,20]. 已有研究证明, 下丘脑和孤束核的葡萄糖感受神经元均参与摄食调控[21,22]. 最近Maejima等[28]报道, 第3脑室注射Nesfatin-1诱发c-Fos的表达主要位于室旁核和孤束核(nucleus tractus solitarius, NTS). 这种选择性c-Fos表达, 提示除室旁核之外, NTS是Nesfatin-1抑制摄食的重要靶点之一. 形态学的研究已证明, 室旁核催产素神经元发出下行纤维支配NTS[23]. 目前认为瘦素和促黑细胞皮质素产生的α-促黑细胞刺激素(alpha-melanocyte-stimulating hormone, α-MSH)是摄食调节系统中的关键信号分子[24]. 动物实验表明[25-28], Nesfatin-1能明显抑制瘦素受体突变小鼠的摄食, 考虑其作用可能与瘦素信号系统关系不大. 然而, 注射α-MSH能增加下丘脑室旁核中NUCB2基因表达, 这表明黑皮质素对摄食行为的调节, 可能通过NUCB2 Nesfatin-1这一信号通路发挥作用, Nesfatin-1可能是与下丘脑中黑皮质素信号表达有关的一种饱食因子. 本实验研究显示中枢注射Nesfatin-1呈剂量依赖性抑制大鼠胃排空. 较低剂量Nesfatin-1组即可抑制正常大鼠胃排空, 但对肥胖大鼠胃排空无明显抑制作用, 推测正常与肥胖大鼠胃排空机制可能存在差异.
既往研究表明在外周胰腺、胃、十二指肠均可发现Nesfatin-1免疫阳性细胞高表达, 而且胃黏膜NUCB2 mRNA的表达比脑组织高十几倍[29]. 本实验观察了Nesfatin-1对正常及肥胖大鼠离体胃平滑肌条收缩活性的影响, 结果显示Nesfatin-1可呈剂量依赖性地抑制正常及肥胖大鼠离体平滑肌条收缩. 低浓度Nesfatin-1对肥胖和正常大鼠胃底、胃体平滑肌条舒缩抑制作用无显著性差异; 中浓度Nesfatin-1对肥胖和正常大鼠离体胃体平滑肌条抑制作用无显著性差异, 对肥胖大鼠胃底平滑肌条舒缩张力抑制作用弱于正常大鼠. 高浓度Nesfatin-1对肥胖大鼠离体胃底及胃体平滑肌条抑制作用均弱于正常大鼠. 简言之, Nesfatin-1对正常大鼠平滑肌条抑制作用强于肥胖大鼠. 但因Nesfatin-1受体目前尚未发现, 关于Nesfatin-1抑制平滑肌条作用机制有待于进一步研究.
总之, Nesfatin-1能抑制正常及单纯性肥胖大鼠胃排空及离体胃底和胃体平滑肌条的收缩. 在相同药物浓度下, Nesfatin-1对肥胖大鼠胃平滑肌条的抑制作用比正常大鼠作用弱, 这可能与肥胖大鼠体内Nesfatin-1基础水平及对外源性注入Nesfatin-1后的敏感性不同有关, 具体原因未明. 通过上述实验, 对肥胖大鼠胃肠动力等方面进行实验研究, 为进一步减轻肥胖提供理论帮助.
Nesfatin-1是新发现的多肽, 他可通过减少摄食、调节能量代谢平衡等减轻大鼠体质量, 其对胃排空及平滑肌条收缩亦有影响.
任建林, 教授, 厦门大学附属中山医院消化内科 厦门市消化疾病研究所
Nesfatin-1对肥胖大鼠胃动力的影响报道较少, Nesfatin-1对胃排空及离体胃平滑肌条收缩的影响及机制有待进一步研究.
Oh-I等研究表明Nesfatin-1对摄食有抑制作用, 中枢注射NUCB2重组蛋白可使大鼠体重降低, 摄食量也呈剂量依赖性的减少; Stengel等动物实验表明, Nesfatin-1能明显抑制瘦素受体突变小鼠的摄食, 考虑其作用可能与α-促黑素细胞刺激素(α-MSH)有关.
Nesfatin-1对正常及肥胖大鼠胃排空及离体胃平滑肌条收缩活动均有抑制作用, 且对正常大鼠抑制作用较强, 可对临床上肥胖患者胃动力障碍方面的研究提供参考.
本文的先进性、科学性均好, 结果结论可靠, 对临床上肥胖患者胃动力障碍方面的研究可提供参考.
编辑: 张姗姗 电编: 鲁亚静
| 1. | Qureshi K, Abrams GA. Metabolic liver disease of obesity and role of adipose tissue in the pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol. 2007;13:3540-3553. [PubMed] [DOI] |
| 2. | Dai Z, Xu YC, Niu L. Obesity and colorectal cancer risk: a meta-analysis of cohort studies. World J Gastroenterol. 2007;13:4199-4206. [PubMed] [DOI] |
| 3. | Piretta L, Alghisi F, Anzini F, Corazziari E. Prevalence of overweightedness in patients with gastro-esophageal reflux. World J Gastroenterol. 2007;13:4602-4605. [PubMed] [DOI] |
| 4. | Kenny PJ. Reward mechanisms in obesity: new insights and future directions. Neuron. 2011;69:664-679. [PubMed] [DOI] |
| 5. | Saper CB, Chou TC, Elmquist JK. The need to feed: homeostatic and hedonic control of eating. Neuron. 2002;36:199-211. [PubMed] [DOI] |
| 6. | Kenny PJ. Common cellular and molecular mechanisms in obesity and drug addiction. Nat Rev Neurosci. 2011;12:638-651. [PubMed] [DOI] |
| 7. | Liu Y, von Deneen KM, Kobeissy FH, Gold MS. Food addiction and obesity: evidence from bench to bedside. J Psychoactive Drugs. 2010;42:133-145. [PubMed] [DOI] |
| 8. | Wilson GT. Eating disorders, obesity and addiction. Eur Eat Disord Rev. 2010;18:341-351. [PubMed] [DOI] |
| 9. | Oh-I S, Shimizu H, Satoh T, Okada S, Adachi S, Inoue K, Eguchi H, Yamamoto M, Imaki T, Hashimoto K. Identification of nesfatin-1 as a satiety molecule in the hypothalamus. Nature. 2006;443:709-712. [PubMed] [DOI] |
| 11. | Zhao P, Huang X, Wang ZY, Qiu ZX, Han YF, Lu HL, Kim YC, Xu WX. Dual effect of exogenous hydrogen sulfide on the spontaneous contraction of gastric smooth muscle in guinea-pig. Eur J Pharmacol. 2009;616:223-228. [PubMed] [DOI] |
| 12. | Shimizu H, Oh-I S, Okada S, Mori M. Nesfatin-1: an overview and future clinical application. Endocr J. 2009;56:537-543. [DOI] |
| 13. | García-Galiano D, Navarro VM, Gaytan F, Tena-Sempere M. Expanding roles of NUCB2/nesfatin-1 in neuroendocrine regulation. J Mol Endocrinol. 2010;45:281-290. [PubMed] [DOI] |
| 14. | Stengel A, Goebel M, Taché Y. Nesfatin-1: a novel inhibitory regulator of food intake and body weight. Obes Rev. 2011;12:261-271. [PubMed] [DOI] |
| 15. | Brailoiu GC, Dun SL, Brailoiu E, Inan S, Yang J, Chang JK, Dun NJ. Nesfatin-1: distribution and interaction with a G protein-coupled receptor in the rat brain. Endocrinology. 2007;148:5088-5094. [PubMed] [DOI] |
| 16. | Zhang AQ, Li XL, Jiang CY, Lin L, Shi RH, Chen JD, Oomura Y. Expression of nesfatin-1/NUCB2 in rodent digestive system. World J Gastroenterol. 2010;16:1735-1741. [PubMed] [DOI] |
| 17. | Foo KS, Brismar H, Broberger C. Distribution and neuropeptide coexistence of nucleobindin-2 mRNA/nesfatin-like immunoreactivity in the rat CNS. Neuroscience. 2008;156:563-579. [PubMed] [DOI] |
| 18. | Goebel-Stengel M, Wang L, Stengel A, Taché Y. Localization of nesfatin-1 neurons in the mouse brain and functional implication. Brain Res. 2011;1396:20-34. [PubMed] [DOI] |
| 19. | Goebel M, Stengel A, Wang L, Lambrecht NW, Taché Y. Nesfatin-1 immunoreactivity in rat brain and spinal cord autonomic nuclei. Neurosci Lett. 2009;452:241-246. [PubMed] [DOI] |
| 21. | Levin BE, Dunn-Meynell AA, Routh VH. Brain glucose sensing and body energy homeostasis: role in obesity and diabetes. Am J Physiol. 1999;276:R1223-R1231. [PubMed] |
| 22. | Routh VH. Glucose-sensing neurons: are they physiologically relevant? Physiol Behav. 2002;76:403-413. [PubMed] [DOI] |
| 23. | Blevins JE, Schwartz MW, Baskin DG. Evidence that paraventricular nucleus oxytocin neurons link hypothalamic leptin action to caudal brain stem nuclei controlling meal size. Am J Physiol Regul Integr Comp Physiol. 2004;287:R87-R96. [PubMed] [DOI] |
| 24. | Kalra SP, Dube MG, Pu S, Xu B, Horvath TL, Kalra PS. Interacting appetite-regulating pathways in the hypothalamic regulation of body weight. Endocr Rev. 1999;20:68-100. [PubMed] [DOI] |
| 25. | Price TO, Samson WK, Niehoff ML, Banks WA. Permeability of the blood-brain barrier to a novel satiety molecule nesfatin-1. Peptides. 2007;28:2372-2381. [PubMed] [DOI] |
| 26. | Shimizu H, Ohsaki A, Oh-I S, Okada S, Mori M. A new anorexigenic protein, nesfatin-1. Peptides. 2009;30:995-998. [PubMed] [DOI] |
| 27. | Shimizu H, Oh-I S, Hashimoto K, Nakata M, Yamamoto S, Yoshida N, Eguchi H, Kato I, Inoue K, Satoh T. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 2009;150:662-671. [PubMed] [DOI] |
| 28. | Maejima Y, Sedbazar U, Suyama S, Kohno D, Onaka T, Takano E, Yoshida N, Koike M, Uchiyama Y, Fujiwara K. Nesfatin-1-regulated oxytocinergic signaling in the paraventricular nucleus causes anorexia through a leptin-independent melanocortin pathway. Cell Metab. 2009;10:355-365. [PubMed] [DOI] |
| 29. | Stengel A, Goebel M, Yakubov I, Wang L, Witcher D, Coskun T, Taché Y, Sachs G, Lambrecht NW. Identification and characterization of nesfatin-1 immunoreactivity in endocrine cell types of the rat gastric oxyntic mucosa. Endocrinology. 2009;150:232-238. [PubMed] [DOI] |