修回日期: 2012-01-17
接受日期: 2012-02-19
在线出版日期: 2012-03-08
目的: 探讨食管鳞癌组织中的乏氧诱导因子-1a(HIF-1a)、T淋巴瘤侵袭转移诱导因子1(Tiam1)表达对食管癌侵袭性、淋巴结转移以及放疗疗效的影响.
方法: 应用免疫组织化学染色法(SP)检测HIF-1a、Tiam1在33例食管癌组织、15例正常食管黏膜的表达水平, 并分析其与食管癌临床病理因素之间的关系, 以及对食管癌放疗疗效和预后的影响.
结果: 食管癌组织HIF-1α及Tiam1蛋白阳性表达率分别是66.7%和72.7%, 均明显高于正常组织(阳性表达率为6.7%, P<0.05); HIF-1a蛋白的表达程度与N分期有显著正相关性(P<0.05), Tiam1蛋白表达程度与临床分期及N分期有显著正相关性(P<0.05), 而两者均与年龄、性别、病变长度、组织学分级、T分期无明显相关性; HIF-1a蛋白表达阳性组和阴性组放疗后近期完全缓解率及中位生存期分别是9.1%, 9 mo和63.6%, 25 mo, 两者比较有统计学意义(P<0.05), HIF-1a蛋白阳性组与阴性组放疗后1、2、3年生存率分别为40.9%、13.6%、6.8%和90.9%、54.5%、36.4%, log-rank检验他们之间生存曲线有显著性差异(P<0.01); 经相关分析, HIF-1a及Tiam1蛋白具有一定的相关性(r = 0.433, P<0.05).
结论: HIF-1a及Tiam1蛋白过表达对食管癌的淋巴结转移有促进作用; HIF-1a过表达对食管癌放疗有抗拒作用, 因此影响了放疗的疗效.
引文著录: 范小玲, 刘文其, 毛艳, 康敏. HIF-1α、Tiam1表达对食管癌侵袭、淋巴结转移以及放疗的影响. 世界华人消化杂志 2012; 20(7): 590-595
Revised: January 17, 2012
Accepted: February 19, 2012
Published online: March 8, 2012
AIM: To investigate the association of expression of hypoxia inducible factor-1 alpha (HIF-1a) and T-cell lymphoma invasion and metastasis factor1 (Tiam1) with tumor invasion, lymph node metastasis, and prognosis in patients with esophageal carcinoma.
METHODS: The protein expression of HIF-1a and Tiam1 was detected by immunohistochemistry in 33 esophageal carcinoma specimens and 15 normal esophageal mucosal specimens.
RESULTS: The positive rates of HIF-1a and Tiam1 protein expression in esophageal carcinoma were significantly higher than those in normal esophageal mucosa (66.7% vs 6.7%, 72.7% vs 6.7%, both P < 0.05). High expression of HIF-1a was positively correlated with N stage (P < 0.05), while high expression of Tiam1 was positively correlated with TNM stage and N stage (both P < 0.05). The expression of HIF-1a and Tiam1 did not correlate with age, gender, tumor length or T stage. The complete effective rate and mean survival period after radiotherapy were significantly lower in HIF-1a-positive patients than in HIF-1α-negative ones (9.1% vs 63.6%, 9 months vs 25 months, both P < 0.05). The 1-, 2-, and 3-year survival rates were also significantly lower in the HIF-1a-positive group than in the HIF-1a-negative group (40.9% vs 90.9%, 13.6% vs 54.5%, 6.8% vs 36.4%), and log-rank test suggested that the difference was significant (P = 0.007). The expression of HIF-1a protein was significantly correlated with that of Tiam1 protein in esophageal carcinoma (r = 0.433, P = 0.012).
CONCLUSION: High expression of HIF-1a and Tiam1 proteins is associated with lymph node metastasis in patients with esophageal carcinoma. Overexpression of HIF-1a may be linked to resistance to radiotherapy in patients with esophageal carcinoma and may affect the efficacy of radiotherapy.
- Citation: Fan XL, Liu WQ, Mao Y, Kang M. Association of HIF-1a and Tiam1 expression with tumor invasion, lymph node metastasis, and prognosis in patients with esophageal carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(7): 590-595
- URL: https://www.wjgnet.com/1009-3079/full/v20/i7/590.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i7.590
长期以来食管癌治疗疗效一直不佳, 其主要原因是食管癌具有高侵袭性、高转移性的特点, 因此大多数食管癌患者确诊时已是中晚期, 失去了手术指证. 放射治疗是治疗食管癌的主要方法, 尽管近年来放疗技术及设备不断更新, 但迄今为止疗效仍不满意, 而影响治疗疗效的内在因素是受到基因的调控. 乏氧诱导因子-1a(hypoxia inducible factor-1 alpha, HIF-1a)是细胞在缺氧状态下的一种转录因子, 在动物以及人体许多肿瘤中有大量表达, 在多种细胞事件中如细胞凋亡、能量代谢、血管活性、细胞黏附、细胞骨架、放化疗抗拒等起着重要作用. T淋巴瘤侵袭转移诱导因子1(T-cell lymphoma invasion and metastasis factor1, Tiam1)是一个细胞骨架调节因子, 而细胞骨架结构的重排是引起细胞侵袭运动的重要因素. 因此, 我们推测: HIF-1a和Tiam1在肿瘤的侵袭及迁移中发挥一定的作用. 本实验采取免疫组织化学的方法探讨食管癌组织中HIF-1a和Tiam1蛋白表达在食管癌侵袭与转移以及放疗后预后中的作用及临床意义.
收集广西医科大学第一附属医院放疗科2006-08/2010-08经胃镜活检病理证实为食管鳞状细胞癌患者33例, 其中男26例, 女7例, 年龄范围39-89岁, 平均年龄62岁. 所有患者卡氏评分≥70分, 无放化疗禁忌证; 无恶性肿瘤病史; 对象为拒绝手术或不宜进行手术的食管癌初治患者. 所有患者均做了放射治疗前常规胸部CT扫描、腹部B超或者CT扫描、常规血生化和外周血象检查. 按万钧等[1]提出的非手术治疗食管癌临床分期标准, 33例中Ⅰ-Ⅱ期12例, Ⅲ-Ⅳ期21例; T1-2期2例, T3期13例, T4期18例; N0期13 例, N1期13例(均为纵膈淋巴结转移), N2期7例(纵膈和锁骨上淋巴结转移4例, 仅锁骨上淋巴结转移3例). 所有活检标本均经85%酒精固定, 常规脱水后石蜡包埋, 部分连续切片5-6张, 每张切片厚5 mm, 采用SP法进行免疫组织化学染色. 一抗HIF-1a为兔抗人单克隆抗体, 购于博奥森生物技术有限公司; Tiam1抗体为兔抗人多克隆抗体, 购于美国Santa Cruz公司; SP免疫组织化学试剂盒及DAB显色剂购自福州迈新有限公司.
1.2.1 治疗方案: 患者均采用西门子6MV-15MV的电子直线加速器进行三维适形放射治疗: 先真空垫进行体位固定, CT模拟扫描后进行靶区勾画、三维放射治疗计划的设计, GTV为CT扫描所见的结合食管造影、食管镜检查所显示的原发肿瘤及区域肿大的淋巴结, CTV为GTV周围0.5-1.0 cm的区域, 包括GTV及其临近的区域、相应的淋巴引流区、肿瘤上下外扩3.0 cm的正常食管, PTV为在CTV的基础上外扩0.5-1.0 cm. 处方剂量5 400-7 000 cGy, 中位处方剂量6400 cGy, 单次剂量200 cGy, 1次/d, 5次/wk. 其中24例患者采用同步放化疗, 化疗方案: 顺铂(DDP)80 mg/m2, 分第1、2天, 5-氟脲嘧啶(5-FU) 500 mg/m2, 第1-5天, 或紫杉醇135-175 mg/m2, 第1天, 顺铂80 mg/m2, 分第2、3天. 21 d化疗为1周期, 化疗共1-3个周期.
1.2.2 标本检测: 采用SP法, HIF-1a与Tiam1一抗的工作浓度均为1:100, DAB显色, 苏木素复染, 其余步骤均按SP试剂盒说明书进行. 以PBS缓冲液代替一抗作阴性对照组, 用已知的阳性标本作为阳性对照.
1.2.3 结果判定: (1)放疗结束时及结束后3 mo内, 参照X线片评价标准评价疗效[2]: 完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、无效(no remission, NR); (2)HIF-1a蛋白表达的阳性判断标准: (-)未着色或<1%的细胞核着色, (+)1%-10%的细胞核着色或/和较弱的胞质着色, (++)11%-50%的细胞核着色或/和明显的胞质着色, (+++)>50%的细胞核着色或/和较强的胞质着色; (3)Tiam1蛋白表达的阳性评判标准: 着色强度: 无色0分, 浅黄1分, 棕黄2分, 黄褐色3分; 阳性细胞数: 在400倍光学显微镜下至少计数200个肿瘤细胞, <10%为0分, 10%-25%为1分, 25%-50%为2分, >50%为3分. 两项相乘得分结果0分为阴性(-), 1-2分为弱阳性(+), 3-4分为阳性(++), >5分为强阳性(+++).
1.2.4 随访: 通过查阅病历及影像学资料, 电话和信访的方式, 随访至2011-10-25, 随访率100%. 全组27例患者死亡, 6例患者仍在随访中.
统计学处理 应用SPSS17.0统计软件, 单个抗体与临床病理特征的关系采用秩和检验, 相关分析用Spearman等级相关检验, 生存率计算采用Kaplan-Meier生存分析, 预后采用Cox模型多因素分析, P<0.05为差异有统计学意义.
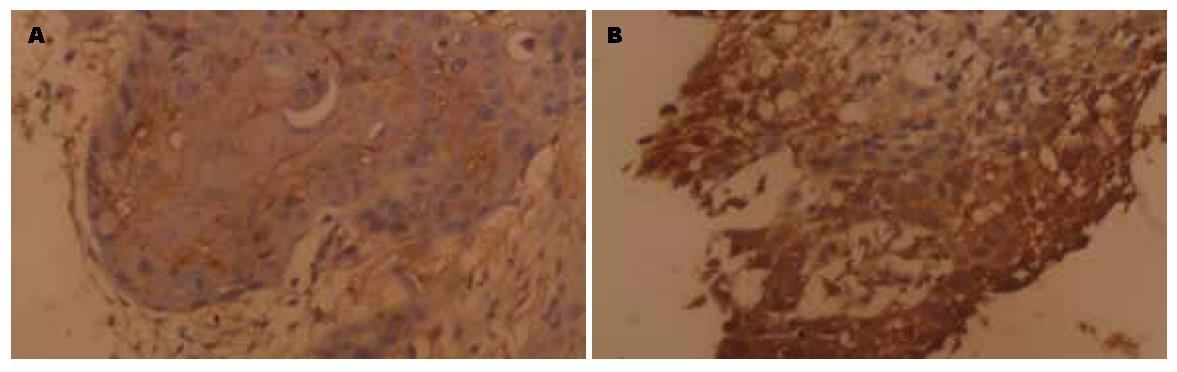
食管癌组织中, HIF-1a蛋白阳性表达主要见于细胞质和(或)细胞核中, 肿瘤坏死组织周围表达明显增多; Tiam-1蛋白阳性表达仅见于细胞质中(图1), 本组患者中阳性表达率分别是66.7%(22/33)及72.7%(24/33), 明显高于15例食管正常黏膜(阳性表达均为6.7%), 比较均有显著性差异(均P<0.01), 经Spearman等级相关性分析, HIF-1a与Tiam1蛋白在食管癌组织中表达有一定相关性(r = 0.433, P<0.05).
HIF-1a蛋白的表达程度与N分期有显著正相关性(P<0.05), Tiam1蛋白的表达程度与临床分期及N分期有显著正相关性(P<0.05), 而与性别、年龄、病变长度、组织学分级、T分期均无明显相关性(P>0.05, 表1).
| 因素 | n | HIF-1α | P值 | Tiam1 | P值 | ||||||
| - | + | ++ | +++ | - | + | ++ | +++ | ||||
| 年龄(岁) | |||||||||||
| ≤60 | 15 | 4 | 5 | 4 | 2 | 4 | 4 | 2 | 2 | ||
| >60 | 18 | 7 | 3 | 3 | 5 | 0.955 | 5 | 3 | 7 | 5 | 0.295 |
| 性别 | |||||||||||
| 男 | 26 | 9 | 8 | 5 | 4 | 7 | 10 | 4 | 5 | ||
| 女 | 7 | 2 | 0 | 2 | 3 | 0.186 | 2 | 1 | 1 | 3 | 0.423 |
| 临床分期 | |||||||||||
| Ⅰ-Ⅱ | 12 | 5 | 2 | 4 | 2 | 6 | 3 | 2 | 1 | ||
| Ⅲ-Ⅳ | 21 | 6 | 6 | 3 | 5 | 0.760 | 3 | 8 | 3 | 7 | 0.037 |
| N分期 | |||||||||||
| N1+N2 | 20 | 6 | 2 | 5 | 7 | 3 | 6 | 4 | 7 | ||
| N0 | 13 | 5 | 6 | 2 | 0 | 0.047 | 6 | 5 | 1 | 1 | 0.034 |
| 病变长度 | |||||||||||
| ≤5 | 7 | 4 | 0 | 1 | 2 | 2 | 3 | 1 | 1 | ||
| >5-7 | 13 | 4 | 4 | 3 | 2 | 5 | 3 | 2 | 3 | ||
| >7 | 13 | 3 | 4 | 3 | 3 | 0.758 | 2 | 5 | 2 | 4 | 0.561 |
| 组织学分级 | |||||||||||
| Ⅰ | 10 | 5 | 2 | 2 | 1 | 4 | 1 | 1 | 4 | ||
| Ⅱ | 14 | 5 | 3 | 2 | 4 | 4 | 5 | 2 | 3 | ||
| Ⅲ | 9 | 1 | 2 | 3 | 2 | 0.291 | 1 | 5 | 2 | 1 | 0.784 |
| T分期 | |||||||||||
| T2-3 | 15 | 6 | 1 | 3 | 4 | 6 | 3 | 3 | 3 | ||
| T4 | 18 | 5 | 6 | 4 | 3 | 0.937 | 3 | 8 | 2 | 5 | 0.398 |
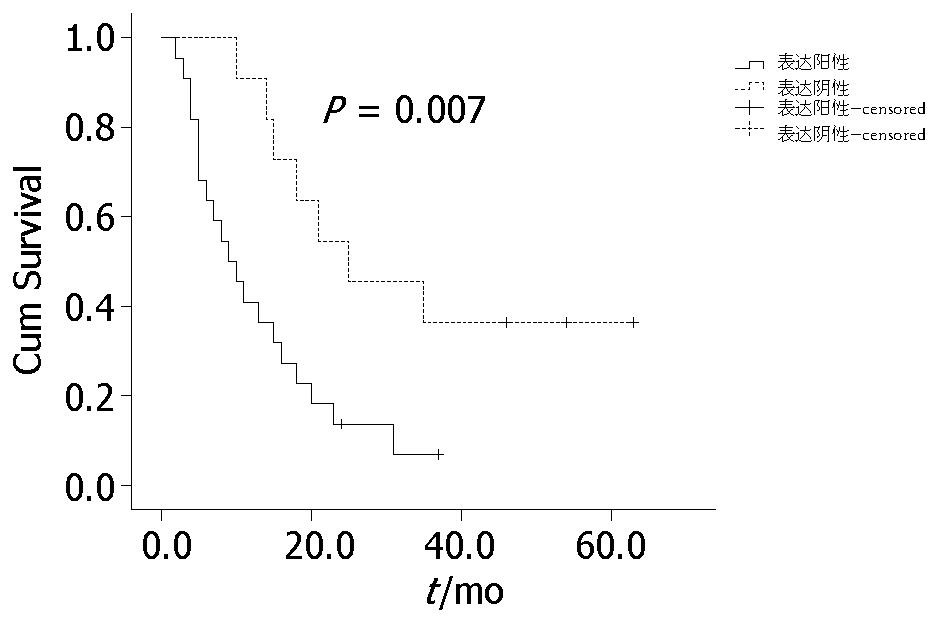
33例食管癌放疗后近期有效率(CR+PR)为90.9%, HIF-1a蛋白表达阳性组和阴性组的放疗后近期完全缓解率及中位生存期分别是9.1%, 9 mo和63.6%, 25 mo, 两者比较有统计学学意义(P<0.05, 表2). HIF-1a蛋白阳性组与阴性组放疗后1、2、3年生存率分别为40.9%、13.6%、6.8%和90.9%、54.5%、36.4%, Log-rank检验二者之间生存曲线有显著性差异(P<0.01, 图2). 单因素分析临床分期、T分期、N分期、是否化疗、Tiam1均与生存期无关, 与HIF-1a蛋白的过表达有关(表3). Cox模型多因素分析结果显示HIF-1a为独立的预后因素(P<0.05, b = 1.163, SE = 0.453, OR = 6.579, P = 0.01, 95%CI 0.129-0.760).
| HiF-1α | n | CR | PR | NR | P值 | 中位生存期(t/mo) | P值 |
| 阳性 | 22 | 2 | 17 | 3 | 10 | ||
| 阴性 | 11 | 7 | 4 | 0 | 0.02 | 25 | 0.007 |
| 影响因素 | n | 生存率(%) | χ2值 | P值 | ||
| 1年 | 2年 | 3年 | ||||
| 临床分期 | ||||||
| Ⅰ-Ⅱ | 12 | 58.3 | 41.7 | 25.0 | ||
| Ⅲ-Ⅳ | 21 | 57.1 | 19.0 | 12.7 | 0.556 | 0.456 |
| T分期 | ||||||
| T2-3 | 15 | 53.3 | 40.0 | 20.0 | ||
| T4 | 18 | 61.1 | 16.7 | 16.7 | 0.257 | 0.612 |
| N分期 | ||||||
| N1+N2 | 20 | 55.0 | 25.0 | 12.5 | ||
| N0 | 13 | 61.5 | 36.9 | 27.7 | 0.475 | 0.491 |
| 治疗方式 | ||||||
| 放化疗组 | 23 | 60.9 | 30.4 | 20.3 | ||
| 单纯放疗组 | 10 | 50.0 | 20.0 | 10.0 | 1.079 | 0.299 |
| Tiam1蛋白 | ||||||
| 阳性 | 24 | 54.2 | 20.8 | 15.6 | ||
| 阴性 | 9 | 66.7 | 44.4 | 22.2 | 1.086 | 0.297 |
| HIF-1α蛋白 | ||||||
| 阳性 | 22 | 45.5 | 13.6 | 6.8 | ||
| 阴性 | 11 | 81.8 | 54.5 | 36.4 | 6.626 | 0.010 |
大量研究证明, 乏氧在实体肿瘤普遍存在, 影响肿瘤的形成、侵袭和转移, 并影响着放化疗的疗效, 而在这个过程中HIF-1被认为是起着关键性的作用. HIF-1是细胞在缺氧条件下产生的一种转录因子, 于1992年首次被Semenza和Wang在缺氧诱导的细胞核提取物中发现的一种蛋白[3]. HIF-1a是HIF-1的1个亚单位, 研究表明HIF-1a对氧的依赖性较强, 当周围环境的氧浓度降低时, HIF-1a表达明显呈指数增加, 并且其表达增加表现在多个水平上, 包括转录及蛋白等水平, 但主要是蛋白水平表达的改变[4] . 已有很多学者在宫颈癌、口咽癌、头颈部肿瘤等多数恶性肿瘤中均发现HIF-1a蛋白的表达上调, 并且认为HIF-1a蛋白可作为预测放疗疗效及预后的一个肿瘤标志物[5-7]. 本研究采用了免疫组织化学的方法检测了HIF-1a在食管癌组织中的表达, 结果发现33例患者中有22例食管癌患者有阳性表达, 其表达率是67.7%, 明显高于食管正常黏膜组织(P<0.05), 说明HIF-1a在食管癌发生发展中可能起到重要促进作用. 本实验显示HIF-1a蛋白的表达程度与淋巴结转移是有显著相关性(P<0.05), 可以认为HIF-1a蛋白高表达的食管癌患者具有较高的淋巴结转移率, 与Katsuta等[8]的研究结论相一致. Katsuta等在研究中认为其转移机制是HIF-1a通过诱导VEGF-C促进淋巴管浸润及淋巴结的转移. 我们的研究中发现HIF-1a与病变长度、临床分期、T分期等无明显相关性, 因而认为可能HIF-1a对肿瘤的侵袭性所起的作用不大, 而对淋巴结转移有明显的促进作用.
本研究还显示HIF-1a蛋白表达阳性组和阴性组的放疗后近期完全缓解率及中位生存期分别是9.1%, 9 mo和63.6%, 25 mo, 两者比较有统计学学意义(P<0.05), 阳性表达的患者总生存率明显低于阴性表达的患者(P<0.01), 提示HIF-1a在食管癌患者的预后中有重要价值. 经Cox模型多因素分析后发现HIF-1a为独立的预后因素(OR = 6.579, P<0.05), 这一结果与Ogane等[9]研究结果一致, 说明HIF-1a蛋白阳性表达在食管癌患者中是预后不良的一个重要危险因素, 其高表达说明肿瘤放疗不敏感, 近期疗效差, 预后不佳. Kurokawa等[10]报道HIF-1a高表达的患者的生存率明显低于低表达的患者, 只是HIF-1a并不是独立的预后因素.
Tiam1是T细胞淋巴瘤侵袭转移诱导因子, 是RhoA、Rac1、Cdo42等Rho样GTPase的鸟苷酸交换因子. Tiam1蛋白具有胞质蛋白亲水性, 含有许多重要功能区域, 其中主要结构功能区域是DH和PH, DH主要发挥鸟核苷酸交换因子功能, 与PH串联参与激活RhoGTP酶活性, Rho样小GTP酶改变肌动蛋白调节细胞骨架的组成和排列, 对于控制细胞形态、黏附及运动、信号传导都有重要作用, 这些功能影响了细胞迁移, 增加了肿瘤的侵袭性. Hordijk等[11]研究发现Tiam1在上皮细胞中能通过持续活化Rho样蛋白, 并使Rho样蛋白高表达促进肿瘤细胞的侵袭、转移. 本研究中发现Tiam1在食管癌组织中的阳性表达明显高于食管正常黏膜组织, Tiam1蛋白表达的程度与临床分期及N分期有显著正相关性(P<0.05), 与大多数文献报道基本一致[12-14], 证实Tiam1对食管癌的侵袭、转移有促进作用.
另外研究[15,16]发现Rho蛋白活性的上调引起HIF-1a的升高, 从而引起肿瘤细胞的乏氧. 说明在乏氧状态之下, 可以影响骨架蛋白的重排而影响肿瘤的侵袭、转移. 本研究对两者进行相关性分析显示HIF-1a与Tiam1蛋白在食管癌组织中表达呈正相关(r = 0.433, P<0.05), 提示HIF-1a与Tiam1蛋白在食管癌的发生发展中密切相关, 可能是他们共同调节Rho蛋白的活性促进肿瘤的侵袭、转移.
总之, 本研究初步探讨HIF-1a和Tiam1表达对食管癌的侵袭、淋巴结转移影响, 二者都对淋巴结的转移有显著促进作用, 并且HIF-1a过表达对放疗有抗拒作用, 影响了放疗的疗效, 因此HIF-1a高表达的患者放射治疗后预后较差. 但具体的作用机制仍需深入研究, 进一步发现食管癌侵袭、转移的信息传导以及基因的调控, 寻找到肿瘤治疗的调控基因, 为食管癌的临床预防及治疗提供新的方法.
HIF-1α是细胞在缺氧状态下的一种转录因子, 在动物以及人体许多肿瘤中有大量表达, 在多种细胞事件中如细胞凋亡、能量代谢、血管活性、细胞黏附、细胞骨架、放化疗抗拒等起着重要作用.
程英升, 教授, 上海市, 同济大学附属第十人民医院影像临床医学中心
HIF-1α和Tiam-1在食管癌侵袭、转移及放疗疗效中的作用国内外尚未见有报道, 关于HIF-1α和Tiam-1与恶性肿瘤的关系的研究已成为热点.
已有很多学者在宫颈癌、口咽癌、头颈部肿瘤等多数恶性肿瘤中均发现HIF-1α蛋白的表达上调, 并且认为HIF-1α蛋白可作为预测放疗疗效及预后的一个肿瘤标志物.
本文首次探讨食管癌组织中HIF-1α和Tiam-1蛋白表达的相关性及二者在食管癌肿瘤侵袭转移过程中的共同作用以及与预后的关系.
本研究实验设计合理, 对食管癌的侵袭、转移以及放疗疗效的研究有一定的参考意义.
编辑: 张姗姗 电编: 何基才
| 3. | Semenza GL, Nejfelt MK, Chi SM, Antonarakis SE. Hypoxia-inducible nuclear factors bind to an enhancer element located 3' to the human erythropoietin gene. Proc Natl Acad Sci U S A. 1991;88:5680-5684. [PubMed] [DOI] |
| 4. | Semenza GL. HIF-1: mediator of physiological and pathophysiological responses to hypoxia. J Appl Physiol (1985). 2000;88:1474-1480. [PubMed] |
| 5. | Bachtiary B, Schindl M, Pötter R, Dreier B, Knocke TH, Hainfellner JA, Horvat R, Birner P. Overexpression of hypoxia-inducible factor 1alpha indicates diminished response to radiotherapy and unfavorable prognosis in patients receiving radical radiotherapy for cervical cancer. Clin Cancer Res. 2003;9:2234-2240. [PubMed] |
| 6. | Aebersold DM, Burri P, Beer KT, Laissue J, Djonov V, Greiner RH, Semenza GL. Expression of hypoxia-inducible factor-1alpha: a novel predictive and prognostic parameter in the radiotherapy of oropharyngeal cancer. Cancer Res. 2001;61:2911-2916. [PubMed] |
| 7. | Koukourakis MI, Giatromanolaki A, Sivridis E, Simopoulos C, Turley H, Talks K, Gatter KC, Harris AL. Hypoxia-inducible factor (HIF1A and HIF2A), angiogenesis, and chemoradiotherapy outcome of squamous cell head-and-neck cancer. Int J Radiat Oncol Biol Phys. 2002;53:1192-1202. [PubMed] [DOI] |
| 8. | Katsuta M, Miyashita M, Makino H, Nomura T, Shinji S, Yamashita K, Tajiri T, Kudo M, Ishiwata T, Naito Z. Correlation of hypoxia inducible factor-1alpha with lymphatic metastasis via vascular endothelial growth factor-C in human esophageal cancer. Exp Mol Pathol. 2005;78:123-130. [PubMed] [DOI] |
| 9. | Ogane N, Yasuda M, Shimizu M, Miyazawa M, Kamoshida S, Ueda A, Takata K, Sakuma Y, Miyagi Y, Kameda Y. Clinicopathological implications of expressions of hypoxia-related molecules in esophageal superficial squamous cell carcinoma. Ann Diagn Pathol. 2010;14:23-29. [PubMed] [DOI] |
| 10. | Kurokawa T, Miyamoto M, Kato K, Cho Y, Kawarada Y, Hida Y, Shinohara T, Itoh T, Okushiba S, Kondo S. Overexpression of hypoxia-inducible-factor 1alpha(HIF-1alpha) in oesophageal squamous cell carcinoma correlates with lymph node metastasis and pathologic stage. Br J Cancer. 2003;89:1042-1047. [PubMed] [DOI] |
| 11. | Hordijk PL, ten Klooster JP, van der Kammen RA, Michiels F, Oomen LC, Collard JG. Inhibition of invasion of epithelial cells by Tiam1-Rac signaling. Science. 1997;278:1464-1466. [PubMed] [DOI] |
| 13. | Liu H, Shi G, Liu X, Wu H, Fan Q, Wang X. Overexpression of Tiam1 predicts poor prognosis in patients with esophageal squamous cell carcinoma. Oncol Rep. 2011;25:841-848. [PubMed] |
| 15. | Turcotte S, Desrosiers RR, Béliveau R. HIF-1alpha mRNA and protein upregulation involves Rho GTPase expression during hypoxia in renal cell carcinoma. J Cell Sci. 2003;116:2247-2260. [PubMed] [DOI] |
| 16. | Wojciak-Stothard B, Tsang LY, Paleolog E, Hall SM, Haworth SG. Rac1 and RhoA as regulators of endothelial phenotype and barrier function in hypoxia-induced neonatal pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 2006;290:L1173-L1182. [PubMed] [DOI] |