修回日期: 2011-12-19
接受日期: 2012-02-16
在线出版日期: 2012-02-18
目的: 阐明黄芪、三七及其配伍对萎缩性胃炎大鼠血清前列腺素E2(prostaglandin E2, PGE2)、胃泌素(gastrin, GAS)、胃蛋白酶原Ⅱ(pepsinogen Ⅱ, PGⅡ)、表皮生长因子(epidermal growth factor, EGF)的影响.
方法: 清洁级♂Wistar大鼠40只, 随机分为空白组、假手术组、模型组、替普瑞酮组、黄芪组、三七组、黄芪+三七组. 运用幽门弹簧法制备萎缩性胃炎模型, 灌胃治疗1 mo, 空白组、假手术组、模型组予生理盐水2 mL/d; 黄芪组予黄芪水煎剂3.5 g/(kg•d); 三七组予三七粉冲剂0.7 g/(kg•d); 黄芪+三七组予黄芪三七溶液(黄芪3.5 g/(kg•d), 三七0.7 g/(kg•d)); 替普瑞酮组予替普瑞酮200 mg/(kg•d), 治疗结束后, 放射免疫法测定血清PGE2、GAS、EGF水平, ELISA法测定血清PGⅡ水平, HE染色观察胃黏膜病理改变.
结果: 血清EGF水平各组间无显著差异. 与模型组比较, 黄芪+三七组、三七组血清PGE2升高(41.511 ng/L±5.666 ng/L, 42.033 ng/L±5.150 ng/L vs 30.896 ng/L±5.964 ng/L, P<0.01或P<0.05); 黄芪组血清GAS升高(99.732 ng/L±16.123 ng/L vs 68.207 ng/L±5.866 ng/L, P<0.01), 黄芪、三七组血清PGⅡ升高(9.275 μg/L±0.506 μg/L, 9.268 μg/L±0.931 μg/L vs 7.026 μg/L±0.638 μg/L, P<0.01), 黄芪组、三七组和黄芪+三七组胃黏膜体积构成比升高(P<0.01), 与替普瑞酮比较, 差异无统计学差异(P>0.05), 三个治疗组间亦无统计学差异(P>0.05).
结论: 黄芪、三七及其配伍均可改善萎缩性胃炎大鼠胃黏膜萎缩, 其治疗机制与升高血清PGE2、GAS、PGⅡ水平相关, 但3种组合的治疗机制各有侧重.
引文著录: 史瑞, 李晓红, 刘礼剑, 李健, 方蕾, 蔡大勇, 李军祥. 黄芪、三七及其配伍对萎缩性胃炎大鼠血清PGE2、GAS、PGⅡ和EGF的影响. 世界华人消化杂志 2012; 20(5): 361-367
Revised: December 19, 2011
Accepted: February 16, 2012
Published online: February 18, 2012
AIM: To evaluate the effect of Astragalus, Panax notoginseng and their compatibility on serum levels of prostaglandin E2 (PGE2), gastrin (GAS), pepsinogen II (PGII), and epidermal growth factor (EGF) in rats with atrophic gastritis.
METHODS: Forty healthy male Wistar rats were randomized into 7 groups: control group, sham operation group, model group, teprenone group, Astragalus group, Panax notoginseng group, and Astragalus plus Panax notoginseng group. Atrophic gastritis was induced by implanting a pylorus spring and intragastrically administering hot salty starch paste. In the one-month therapeutic phase, the control, sham operation and model groups were given normal saline 2 mL daily. The Astragalus group was given water decoction of Astragalus containing crude drug 3.5 g/(kg•d). The Panax notoginseng group was infused with Panax notoginseng powder containing crude drug 0.7 g/(kg•d). The Astragalus plus Panax notoginseng group was given both Panax notoginseng powder and Astragalus water decoction. The teprenone group was given teprenone water suspension containing teprenone 200 mg/(kg•d). All drugs were given by gavage for one month. Serum levels of PGE2, gastrin, EGF and PGII were measured by radioimmunoassay or ELISA. Pathological assessment of stomach mucosa was performed using hematoxylin and eosin staining method.
RESULTS: Serum levels of EGF had no significant differences among different groups. Serum levels of PGE2 in the Panax notoginseng group and Astragalus plus Panax notoginseng group were significantly higher than that in the model group (41.511 ng/L ± 5.666 ng/L, 42.033 ng/L ± 5.150 ng/L vs 30.896 ng/L ± 5.964 ng/L, P < 0.01 and 0.05). Serum level of GAS in the Astragalus group was significantly higher than that in the model group (99.732 ng/L ± 16.123 ng/L vs 68.207 ng/L ± 5.866 ng/L, P < 0.01). Serum levels of PGII in the Astragalus group and Panax notoginseng group were signifiantly higher than that in the model group (9.275 μg/L ± 0.506 μg/L, 9.268 μg/L ± 0.931 μg/L vs 7.026 μg/L ± 0.638 μg/L, both P < 0.01). Gastric mucosal volume constituent ratio (GMVR) increased in the Astragalus group, Panax notoginseng group and Astragalus plus Panax notoginseng group compared to the model group, but showed no statistical difference with that in the teprenone group (all P > 0.05).
CONCLUSION: Astragalus, Panax notoginseng and their compatibility improve mucosal atrophy possibly by increasing serum levels of PGE2, GAS and PGII in rats with atrophic gastritis.
- Citation: Shi R, Li XH, Liu LJ, Li J, Fang L, Cai DY, Li JX. Effect of Astragalus, Panax notoginseng and their compatibility on serum levels of prostaglandin E2, gastrin, pepsinogen II, and epidermal growth factor in rats with atrophic gastritis. Shijie Huaren Xiaohua Zazhi 2012; 20(5): 361-367
- URL: https://www.wjgnet.com/1009-3079/full/v20/i5/361.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i5.361
萎缩性胃炎(atrophic gastritis, AG)为我国的常见病和疑难病, 症状多见胃脘隐痛、喜温喜按、面色不华、倦怠乏力、食少便溏、舌淡胖、边有齿痕、脉沉细无力等脾虚证表现. 久病多瘀, AG患者也兼见胃脘隐痛、痛有定处, 舌有瘀斑, 舌下脉络曲张等血瘀证表现, 胃镜下黏膜萎缩呈颗粒状、皱褶变平、血管透见、可有灰色肠上皮化生结节, 故脾胃气虚, 瘀血内停证为AG的常见证型之一. 黄芪、三七分别为健脾益气和活血化瘀药的代表药, 多用于治疗AG, 但在临床实践中多以复方形式存在. 为了阐明黄芪、三七及其配伍治疗萎缩性胃炎的机制, 本文运用黄芪、三七及二者配伍治疗大鼠AG, 旨在阐明黄芪、三七及其配伍对萎缩性胃炎大鼠血清前列腺素E2(prostaglandin E2, PGE2)、胃泌素(gastrin, GAS)、胃蛋白酶原Ⅱ(pepsinogen Ⅱ, PGⅡ)、表皮生长因子(epidermal growth factor, EGF)的影响, 为治疗AG新药开发奠定基础.
Wistar大鼠, 40只, ♂, 体质量200 g±20 g, 清洁级, 由北京维通利华实验动物技术有限公司提供, 实验动物许可证编号: SCXK(京)2006-0009. 黄芪: 产自内蒙古, 三七粉: 产自云南, 均购自北京同仁堂药材有限公司; 替普瑞酮胶囊: 由卫材(中国)药业有限公司生产; PGE2放射免疫分析试剂盒、GAS放免测定盒(北京华英生物技术研究所)、EGF放免盒均购自北京华英生物技术研究所; 大鼠PGⅡ定量检测试剂盒(ELISA)(Rapidbio, 美国).
1.2.1 造模: 造模时间为4 mo, 参考史瑞等[1]研究.
1.2.2 分组及给药: Wistar大鼠, 按体质量随机区组设计法随机分为空白组、假手术组、模型组. 空白组予生理盐水2 mL/d灌胃; 假手术组(未植入幽门弹簧, 余同模型组)予生理盐水2 mL/d灌胃; 模型组模型制备参见史瑞等[1]幽门弹簧置入联合高盐热淀粉糊灌胃法, 模型成功后, 将模型组大鼠按体质量随机区组设计法随机分为模型组、黄芪组、三七组、黄芪+三七组、替普瑞酮组. 模型组予生理盐水2 mL/d灌胃; 黄芪组予黄芪水煎剂3.5 g/(kg•d)灌胃; 三七组予三七粉冲剂0.7 g/(kg•d)灌胃; 黄芪+三七组予黄芪三七溶液灌胃(其中黄芪3.5 g/(kg•d), 三七0.7 g/(kg•d)), 替普瑞酮组予替普瑞酮200 mg/(kg•d), 治疗期为1 mo.
统计学处理 计量资料采用mean±SD表示, 采用单因素方差分析, 数据采用SPSS16.0统计软件包进行统计分析.
空白组和假手术组: 前胃无明显变化, 腺胃黏膜被覆较多黏液, 黏膜红润, 胃壁质地柔软有弹性; 模型组: 前胃无明显变化, 腺胃黏膜表面黄染, 暴露黏膜颜色较空白组和假手术组略白, 胃壁质地较僵硬, 弹性下降, 个别大鼠胃黏膜有瘀点或/和溃疡. 各治疗组大鼠胃黏膜变薄, 黏膜颜色略苍白, 较模型组稍红润, 质地较空白组及假手术组僵硬, 但好于模型组.
2.2.1 PGE2: 模型组血清PGE2水平明显低于假手术组(P<0.01); 阳性药物替普瑞酮可以明显升高AG大鼠血清PGE2水平(P<0.05). 三七、黄芪+三七也可使AG大鼠血清PGE2水平升高(P<0.01), 且该效应与替普瑞酮比较, 差异无统计学意义(P>0.05); 黄芪对血清PGE2的影响无统计学差异(P>0.05, 表1).
| 分组 | n | PGE2(ng/L) | GAS(ng/L) | EGF(μg/L) | PGⅡ(μg/L) |
| 空白组 | 5 | 38.702±6.197 | 88.104±20.752 | 0.995±0.341 | 9.047±0.514 |
| 假手术组 | 6 | 41.509±3.891 | 96.499±14.127 | 1.087±0.380 | 9.212±1.739 |
| 模型组 | 6 | 30.896±5.964b | 68.207±5.866a | 1.044±0.269 | 7.026±0.638b |
| 替普瑞酮组 | 7 | 37.742±5.026c | 108.895±17.935d | 0.827±0.230 | 9.095±1.002d |
| 黄芪组 | 6 | 36.612±3.931 | 99.732±16.123d | 0.723±0.179 | 9.275±0.506d |
| 三七组 | 5 | 42.033±5.150d | 86.931±26.574 | 0.767±0.136 | 9.268±0.931d |
| 黄芪+三七组 | 5 | 41.511±5.666d | 81.989±24.913 | 0.669±0.185 | 7.987±1.197 |
2.2.2 GAS: 模型组血清GAS水平明显低于假手术组(P<0.05), 阳性药物替普瑞酮治疗1 mo可以显著提高AG大鼠血清GAS水平(P<0.01); 黄芪与替普瑞酮作用相似(P>0.05), 亦可提高AG大鼠血清GAS水平(P<0.01), 但三七和黄芪+三七对GAS的影响无统计学意义(P>0.05, 表1).
2.2.3 EGF: 各组大鼠血清EGF水平无统计学差异(P<0.05, 表1).
2.2.4 PGⅡ: 模型组与假手术组比较, 血清PGⅡ水平明显下降(P<0.01), 阳性药物替普瑞酮可以明显提高AG大鼠血清PGⅡ(P<0.01), 黄芪、三七均可显著提高AG大鼠血清PGⅡ水平(P<0.01), 黄芪+三七组中血清中PGⅡ浓度与模型组比较, 差异无统计学意义(P>0.05). 黄芪、三七、替普瑞酮之间比较, 差异无统计学意义(P>0.05, 表1).
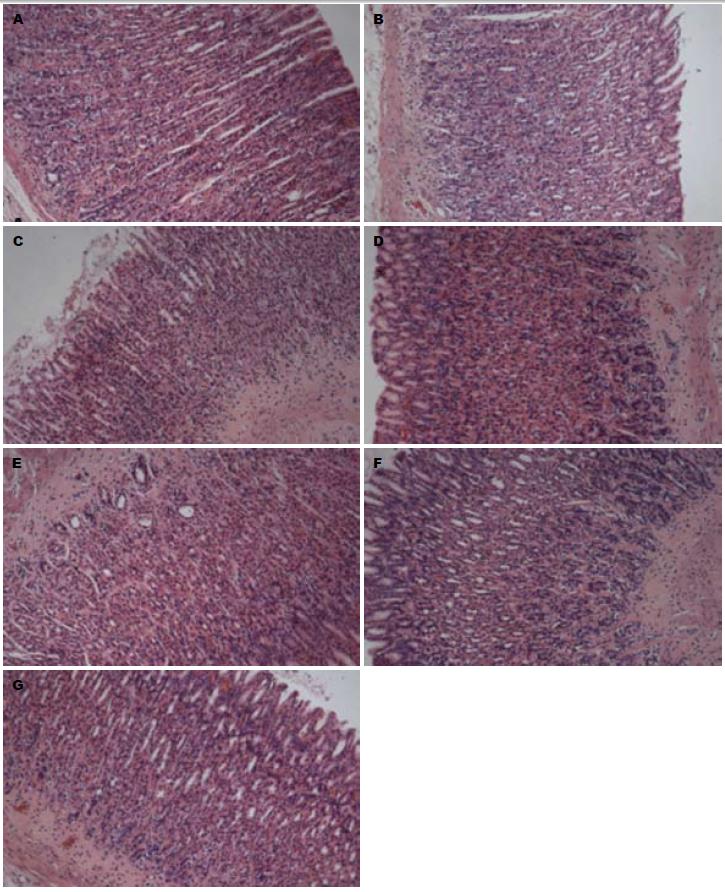
2.3.1 HE染色光镜下观察: (1)空白组: 胃黏膜分为上皮、固有层、黏膜肌层, 层次分明, 结构清晰; 固有层胃底腺主细胞数量最多, 主要分布于腺的体、底部, 细胞呈柱状、核圆形, 位于基部; 胞质基部呈强嗜碱性, 壁细胞主要分布于在腺的颈、体部, 此细胞较大, 多呈圆锥形, 核圆而深染, 居中, 可有双核, 胞质呈均质而明显的嗜酸性(图1A); (2)假手术组: 正常胃黏膜, 胃黏膜分为上皮、固有层、黏膜肌层, 层次分明, 结构清晰; 固有层胃底腺主细胞数量最多, 主要分布于腺的体、底部, 细胞呈柱状、核圆形, 位于基部; 胞质基部呈强嗜碱性, 壁细胞主要分布于在腺的颈、体部, 此细胞较大, 多呈圆锥形, 核圆而深染, 居中, 可有双核, 胞质呈均质而明显的嗜酸性(图1B); (3)模型组: 出现胃黏膜萎缩基本病变. 100倍镜下从黏膜肌层到被覆上皮的腺体显著变薄, 黏膜肌层及黏膜下层结缔组织显著增厚; 200倍镜下从黏膜肌层到被覆上皮的腺体变薄, 腺腔扩大而腺体变小, 内容物质稀薄, 黏膜肌层及黏膜下层结缔组织增厚且血管有不同程度玻璃样变; 被覆上皮连续性缺失、无明显溃疡形成; 400倍镜下萎缩腺体壁细胞数量显著减少, 出现空泡变; 萎缩腺体主细胞数量显著减少; 被覆上皮可找到杯状细胞样细胞和刷状缘明显的小肠样柱状上皮, 管状腺体体部的壁细胞和主细胞显著减少, 管状腺体颈部的未分化细胞数量有增多趋势, 管状腺体底部的增生细胞构成比有增大趋势; 固有层和黏膜下层有浆细胞与淋巴细胞浸润, 很少见到淋巴滤泡样结构; 黏膜下层血管内膜增生性炎症-静脉性充血-水肿-黏膜肌层增厚; 黏膜下层神经纤维束无明显变化(图1C); (4)替普瑞酮组: 固有层细胞萎缩病变改善, 从黏膜肌层到被覆上皮的腺体厚度较薄, 黏膜肌层及黏膜下层较厚, 上皮连续; 管状腺体体部的壁细胞和主细胞减少程度显著减轻, 空泡变少见; 黏膜下层见浆细胞与淋巴细胞浸润, 固有层淋巴细胞浸润不明显(图1D); (5)黄芪组: 固有层细胞萎缩病变改善, 从黏膜肌层到被覆上皮的腺体厚度较薄, 黏膜肌层及黏膜下层较厚, 上皮连续; 管状腺体体部的壁细胞和主细胞减少程度显著减轻, 空泡变少见; 黏膜下层见浆细胞与淋巴细胞浸润, 固有层淋巴细胞浸润不明显(图1E); (6)三七组: 黏膜肌层增厚病变改善, 从黏膜肌层到被覆上皮的腺体厚度较薄, 黏膜肌层及黏膜下层增厚显著改善, 上皮连续性较好; 管状腺体体部的壁细胞和主细胞减少, 空泡变少见; 黏膜下层见浆细胞与淋巴细胞浸润, 固有层淋巴细胞浸润不明显(图1F); (7)黄芪+三七组: 固有层细胞萎缩病变改善, 从黏膜肌层到被覆上皮的腺体厚度较薄, 黏膜肌层及黏膜下层较厚, 上皮连续性较好; 管状腺体体部的壁细胞和主细胞减少, 可见空泡变; 固有层和黏膜下层见浆细胞与淋巴细胞散在浸润(图1G).
2.3.2 形态计量: 胃黏膜体积构成比越小, 其黏膜萎缩程度越重. 治疗萎缩性胃炎1 mo后, 胃黏膜体积构成比空白组0.8464±0.0377, 假手术组0.8300±0.0353, 模型组0.6747±0.0143, 替普瑞酮组0.7430±0.0332, 黄芪组0.7512±0.0257, 三七0.7467±0.0227, 黄芪+三七0.7370±0.0171, 假手术组与空白组相比, 差异无统计学意义(P>0.05), 说明假手术对胃黏膜的体积构成比没有显著影响, 胃黏膜萎缩的改善, 均来自药物的影响. 模型组与假手术组相比, 其胃黏膜体积构成比明显下降(P<0.01); 替普瑞酮可以明显改善萎缩性胃炎大鼠胃黏膜的萎缩状态(P<0.01), 黄芪、三七和黄芪+三七均能明显改善胃黏膜的萎缩状态(P<0.01), 与替普瑞酮比较, 差异不显著(P>0.05). 黄芪、三七、黄芪+三七各组之间亦无显著差异(P>0.05).
黄芪和三七分别是益气健脾法和活血化瘀法的代表中药, 二药配伍是益气活血法的代表. 本实验结果显示, 黄芪、三七均可提高AG大鼠胃黏膜的体积构成比, 即改善胃黏膜萎缩病变, 二药单用与配伍使用相比, 其改善萎缩的程度并无统计学差异. 中医理论认为, 黄芪性甘, 微温, 归肺、脾经. 日华子云: "黄芪, 助气壮筋骨, 长肉, 补血, 破癥癖". 《名医别录》认为其"无毒, 逐五脏间恶血, 补丈夫虚损, 五劳羸瘦, 腹痛泄利, 益气, 利阴气". 从以上本草记载可知, 黄芪有益气健脾、补虚生肌、"破癥癖"的功效. AG患者多脾胃亏虚, 日久气虚运血无力, 血行迟滞致瘀, 遂致胃黏膜萎缩. 黄芪一味兼具益气健脾、活血化瘀的功效, 与AG的基本病机相吻合, 故能改善胃黏膜萎缩. 三七性甘、微苦, 温, 归肝、胃经, 能散瘀止血, 消肿定痛. 《本草纲目拾遗》云"人参补气第一, 三七补血第一, 味同而功亦等, 故称人参三七, 为中药之最珍贵者", 说明三七除了活血化瘀之外, 还有补血的作用. 事实上, 三七与人参同属五加科植物, 其有效成分有多种类似, 如人参和三七均含有人参皂苷Rg1, 人参皂苷Re, 人参皂苷Rb1, 三七还有较好的滋补强壮作用, 如《药性蒙求》记载"三七, 味甘苦同人参, 故人并称曰参三七, 去疲损, 止吐衄, 补而不峻", 所以三七在活血散瘀的基础上, 还有一定的健益脾胃之效, 从而改善胃黏膜萎缩. 故黄芪、三七及二药配伍均可体现了益气活血的治疗原则, 直接针对AG脾胃气虚, 瘀血内阻的病机, 故可改善AG胃黏膜萎缩.
AG发生时伴随胃分泌功能下降, 本实验显示AG大鼠血清PGE2、GAS、PGⅡ水平明显低于假手术组, 而AG萎缩改善后, 其分泌功能亦有恢复, 如阳性药物替普瑞酮可以提高AG大鼠血清PGE2、GAS、PGⅡ水平, 改善胃黏膜萎缩. 血清PGE2、GAS、PGⅡ水平的提高与萎缩的改善是同步的. 黄芪、三七以及二药配伍在改善AG大鼠胃黏膜萎缩的同时, 对胃的分泌功能亦有改善. 黄芪与三七均能提高AG大鼠PGⅡ水平, 同时黄芪还可促进GAS分泌, 三七可促进PGE2分泌, 二药纠正萎缩的机制不尽相同. 黄芪三七配伍可以通过提高血清PGE2水平改善胃黏膜萎缩. AG模型大鼠血清PGE2、GAS、PGⅡ较假手术组降低, 三七、黄芪+三七可提高其血清PGE2水平, 黄芪可提高GAS水平, 黄芪、三七均能提高PGⅡ水平, 而该法制备的AG大鼠模型, 其血清EGF水平与假手术组比较无明显变化.
PGⅡ为主细胞和黏液颈细胞分泌, 主要功能是合成胃蛋白酶原这一胃蛋白酶的前体, 间接提高胃消化蛋白的能力, 同时目前测定血清胃蛋白酶原水平已成为评价胃黏膜萎缩的标志物之一[2]. 人类有2种胃蛋白酶原由主细胞和黏液颈细胞分泌, PGⅠ由泌酸腺分泌, PGⅡ由泌酸黏膜和胃窦黏膜分泌. 有阳性胃癌家族史时低血清胃蛋白酶原反应胃萎缩, 可能作为筛选胃癌高危人群的标志物[3]. AG患者中进行PGⅠ和PGⅡ检测以及PGⅠ与PGⅡ比值的连续测定, 有助于评价治疗的有效性[4], 血清胃蛋白酶原一定程度上反应胃黏膜萎缩程度. 同时, 因为大鼠体内并没有与人同源的PGⅠ, 只有PGⅡ[5], 故单纯测定PGⅡ. 黄芪和三七均能促进PGⅡ的合成, 进而促进蛋白消化, 改善其嗳气、腹胀、痞满等消化不良的症状.
前列腺素是胃黏膜局部防御机制中的重要因素[6], 内源性PGE2主要来源于膜甘油磷脂, 甘油磷脂在环氧合酶(COX-1 或 COX-2)的作用下生成PGH2, PGH2在前列腺素E合成酶(PGE synthase, PGES)的作用下生成PGE2, 其对胃酸分泌和胃黏膜营养、保护等方面起着重要作用[7,8]. PGE2有4个不同的受体, EP1, EP2, EP3, EP4[9], 该受体为G蛋白耦联受体, PGE2发挥不同的功能其利用的受体不同. PGE2的细胞保护表现在直接抑制壁细胞分泌胃酸(EP3)[10], 间接抑制组胺引起的胃酸分泌[11,12], 直接舒张胃黏膜血管[13], 增加胃黏膜血流量[14], 促进生成黏液[15](EP4[16]), 保护胃黏膜免于胃酸损伤[17], 促进碳酸氢盐分泌[18](EP1[19]), 在胃上皮表面形成黏液-碳酸氢盐保护层[20], 中和氢离子, 防止胃腔氢离子反向弥散到胃黏膜, PGE2促进黏液及碳酸氢盐的剂量远低于抑制胃酸的剂量. 胃黏膜表面上皮细胞一旦受损, PGE2即促进胃黏膜细胞从未损伤的小凹和颈腺区移动到损伤部位进行快速重建[21,22], 并且迅速使表皮生长因子受体(epidermal growth factor receptor, EGFR)磷酸化, 激活细胞外信号调节激酶(extracellular signal-regulated kinase 2, ERK2)-有丝分裂(mitogenic)信号通路, 该受体及其所介导的信号转导参与调节胃黏膜上皮更新和修复过程[23], 可以营养胃黏膜细胞[24].
GAS由胃窦部G细胞分泌, 由于胃窦黏膜的萎缩, G细胞数量减少, 胃泌素的分泌也下降[25], 可以反映胃黏膜萎缩的情况[26-28]. GAS主要功能为促进胃酸分泌, 生理剂量的胃酸可以使胃蛋白酶原活化成胃蛋白酶, 促进蛋白消化, 同时还可以促进食物中铁质、钙质和维生素B12的吸收, 防止细菌过度生长、防止肠源性感染、减少或消除食物的致敏性[29]. 还具有营养, 保护胃黏膜, 增强胃黏膜保护因子, 增强胃动力的作用[30-32]. 可见黄芪和三七均可提高AG大鼠胃黏膜的胃蛋白酶原合成能力, 黄芪还可促进胃酸分泌, 三七对胃黏膜细胞有保护作用. 二者纠正胃黏膜萎缩的机制各有偏重.
黄芪与三七单用和配伍用于纠正AG大鼠胃黏膜萎缩, 其疗效相似, 但配伍后的作用机制并不是二药机制的简单叠加, 也不是二药各自机制的简单增强, 二药配伍后的作用机制可能是二药各自多种成分更复杂的相互作用的结果, 有待于进一步研究.
萎缩性胃炎(atrophic gastritis, AG)为我国的常见病和疑难病, 黄芪、三七分别为健脾益气和活血化瘀药的代表药, 多用于治疗AG, 但在临床实践中多以复方形式存在.
任建林, 教授, 厦门大学附属中山医院消化内科; 郑鹏远, 教授, 郑州大学第二附属医院消化科
黄芪与三七单用和配伍用于纠正AG大鼠胃黏膜萎缩, 其疗效相似, 但配伍后的作用机制并不是二药机制的简单叠加, 也不是二药各自机制的简单增强, 二药配伍后的作用机制可能是二药各自多种成分更复杂的相互作用的结果, 有待于进一步研究.
中医理论认为, 黄芪性甘, 微温, 归肺、脾经. 日华子云: "黄芪, 助气壮筋骨, 长肉, 补血, 破癥癖". 《名医别录》认为其"无毒, 逐五脏间恶血, 补丈夫虚损, 五劳羸瘦, 腹痛泄利, 益气, 利阴气".
AG患者中进行胃蛋白酶原Ⅰ和Ⅱ检测以及胃蛋白酶原Ⅰ与胃蛋白酶原Ⅱ比值的连续测定, 有助于评价治疗的有效性, 胃蛋白酶原一定程度上反应胃黏膜萎缩程度.
本研究设计合理, 方法先进, 具有一定的理论意义和潜在的临床价值.
编辑: 曹丽鸥 电编:闫晋利
| 1. | 史 瑞, 李 晓红, 方 蕾, 李 健, 蔡 大勇, 李 军祥, 刘 礼剑. 弹簧幽门植入术结合高盐热淀粉糊灌胃诱导大鼠萎缩性胃炎模型的方法及评价. 世界华人消化杂志. 2011;19:1001-1008. [DOI] |
| 2. | Lomba-Viana R, Dinis-Ribeiro M, Fonseca F, Vieira AS, Bento MJ, Lomba-Viana H. Serum pepsinogen test for early detection of gastric cancer in a European country. Eur J Gastroenterol Hepatol. 2012;24:37-41. [PubMed] [DOI] |
| 3. | Fock KM, Talley N, Moayyedi P, Hunt R, Azuma T, Sugano K, Xiao SD, Lam SK, Goh KL, Chiba T. Asia-Pacific consensus guidelines on gastric cancer prevention. J Gastroenterol Hepatol. 2008;23:351-365. [PubMed] [DOI] |
| 4. | Xiaoping Lin, Qingsheng Wang. Application of meta-analysis in evidence-based oncology. Chin J Clin Oncol. 2008;5:1-9. [DOI] |
| 5. | Lai KH, Wyckoff JB, Samloff IM. Aspartic proteinases in gastric mucosa of the rat: absence of pepsinogen I, genetic polymorphism of pepsinogen II, and presence of slow-moving proteinase. Gastroenterology. 1988;95:295-301. [PubMed] |
| 6. | Izgüt-Uysal VN, Derin N, Agaç A. Protective effect of L-carnitine on gastric mucosal barrier in rats exposed to cold-restraint stress. Indian J Gastroenterol. 2001;20:148-150. [PubMed] |
| 7. | Cryer B. Mucosal defense and repair. Role of prostaglandins in the stomach and duodenum. Gastroenterol Clin North Am. 2001;30:877-94, v-vi. [PubMed] [DOI] |
| 8. | Wallace JL. Nonsteroidal anti-inflammatory drugs and the gastrointestinal tract. Mechanisms of protection and healing: current knowledge and future research. Am J Med. 2001;110:19S-23S. [PubMed] [DOI] |
| 9. | Simmons DL, Botting RM, Hla T. Cyclooxygenase isozymes: the biology of prostaglandin synthesis and inhibition. Pharmacol Rev. 2004;56:387-437. [PubMed] [DOI] |
| 10. | Holm L, Jägare A. Role of prostaglandins in regulation of gastric mucosal blood flow and acid secretion. Am J Physiol. 1992;263:G446-G451. [PubMed] |
| 11. | Konturek PC, Brzozowski T, Raithel M, Sliwowski Z, Konturek SJ, Neurath MF. Acute gastric lesions induced by the administration of histamine to rats with partial vascular occlusion: evidence for the gastroprotective effect of prostaglandin. Inflamm Res. 2010;59 Suppl 2:S239-S241. [PubMed] [DOI] |
| 12. | Robert A, Nezamis JE, Lancaster C, Hanchar AJ. Cytoprotection by prostaglandins in rats. Prevention of gastric necrosis produced by alcohol, HCl, NaOH, hypertonic NaCl, and thermal injury. Gastroenterology. 1979;77:433-443. [PubMed] |
| 13. | Konturek SJ, Robert A, Hanchar AJ, Nezamis JE. Comparison of prostacyclin and prostaglandin E2 on gastric secretion, gastrin release, and mucosal blood flow in dogs. Dig Dis Sci. 1980;25:673-679. [PubMed] [DOI] |
| 14. | Whittle BJ, Boughton-Smith NK, Moncada S, Vane JR. Actions of prostacyclin (PGI2) and its product, 6-oxo-PGF1alpha on the rat gastric mucosa in vivo and in vitro. Prostaglandins. 1978;15:955-967. [PubMed] [DOI] |
| 15. | Johansson C, Kollberg B. Stimulation by intragastrically administered E2 prostaglandins of human gastric mucus output. Eur J Clin Invest. 1979;9:229-232. [PubMed] [DOI] |
| 16. | Takahashi S, Takeuchi K, Okabe S. EP4 receptor mediation of prostaglandin E2-stimulated mucus secretion by rabbit gastric epithelial cells. Biochem Pharmacol. 1999;58:1997-2002. [PubMed] [DOI] |
| 17. | Allen A, Garner A. Mucus and bicarbonate secretion in the stomach and their possible role in mucosal protection. Gut. 1980;21:249-262. [PubMed] [DOI] |
| 18. | Takeuchi K, Ukawa H, Kato S, Furukawa O, Araki H, Sugimoto Y, Ichikawa A, Ushikubi F, Narumiya S. Impaired duodenal bicarbonate secretion and mucosal integrity in mice lacking prostaglandin E-receptor subtype EP(3). Gastroenterology. 1999;117:1128-1135. [PubMed] [DOI] |
| 19. | Takeuchi K, Tanaka A, Kato S, Aihara E, Amagase K. Effect of (S)-4-(1-(5-chloro-2-(4-fluorophenyoxy)benzamido)ethyl) benzoic acid (CJ-42794), a selective antagonist of prostaglandin E receptor subtype 4, on ulcerogenic and healing responses in rat gastrointestinal mucosa. J Pharmacol Exp Ther. 2007;322:903-912. [PubMed] [DOI] |
| 20. | Bahari HM, Ross IN, Turnberg LA. Demonstration of a pH gradient across the mucus layer on the surface of human gastric mucosa in vitro. Gut. 1982;23:513-516. [PubMed] [DOI] |
| 21. | Lacy ER, Ito S. Microscopic analysis of ethanol damage to rat gastric mucosa after treatment with a prostaglandin. Gastroenterology. 1982;83:619-625. [PubMed] |
| 22. | Tarnawski A, Hollander D, Stachura J, Krause WJ, Gergely H. Prostaglandin protection of the gastric mucosa against alcohol injury--a dynamic time-related process. Role of the mucosal proliferative zone. Gastroenterology. 1985;88:334-352. [PubMed] |
| 24. | Pai R, Soreghan B, Szabo IL, Pavelka M, Baatar D, Tarnawski AS. Prostaglandin E2 transactivates EGF receptor: a novel mechanism for promoting colon cancer growth and gastrointestinal hypertrophy. Nat Med. 2002;8:289-293. [PubMed] [DOI] |
| 25. | Germaná B, Di Mario F, Cavallaro LG, Moussa AM, Lecis P, Liatoupolou S, Comparato G, Carloni C, Bertiato G, Battiestel M. Clinical usefulness of serum pepsinogens I and II, gastrin-17 and anti-Helicobacterpylori antibodies in the management of dyspeptic patients in primary care. Dig Liver Dis. 2005;37:501-508. [PubMed] [DOI] |
| 26. | Broutet N, Plebani M, Sakarovitch C, Sipponen P, Mégraud F. Pepsinogen A, pepsinogen C, and gastrin as markers of atrophic chronic gastritis in European dyspeptics. Br J Cancer. 2003;88:1239-1247. [PubMed] [DOI] |
| 27. | Mårdh E, Mårdh S, Mårdh B, Borch K. Diagnosis of gastritis by means of a combination of serological analyses. Clin Chim Acta. 2002;320:17-27. [PubMed] [DOI] |
| 28. | 李 红涛, 吴 开春, 李 彩宁, 乔 泰东, 郭 学刚, 王 新, 郝 志明, 宋 瑛, 丁 杰, 樊 代明. 血清胃泌素对老年人慢性萎缩性胃炎的诊断. 中华老年医学杂志. 2004;23:238-240. |
| 29. | Schubert ML. Gastric exocrine and endocrine secretion. Curr Opin Gastroenterol. 2009;25:529-536. [PubMed] [DOI] |
| 30. | Adamu MA, Weck MN, Gao L, Brenner H. Incidence of chronic atrophic gastritis: systematic review and meta-analysis of follow-up studies. Eur J Epidemiol. 2010;25:439-448. [PubMed] [DOI] |