修回日期: 2012-01-03
接受日期: 2012-02-06
在线出版日期: 2012-02-08
目的: 观察人大肠癌和癌旁正常大肠黏膜组织中T淋巴瘤侵袭转移诱导因子1(Tiam1)和Rac GTP酶激活蛋白1(Rac1)的表达, 并探讨其与大肠癌根治术后发生远隔脏器转移的相关性.
方法: 应用SP免疫组织化学法检测87例大肠癌及40例癌旁正常组织标本中Tiam1/Rac1的表达情况; 应用竞争性RT-PCR检测上述标本中Tiam1 mRNA的表达情况; 应用配体沉淀法检测上述标本中Rac1蛋白活性.
结果: Tiam1/Rac1在大肠癌细胞胞质内呈阳性染色. Tiam1 mRNA在大肠癌中表达明显增强(0.6±0.02 vs 0.24±0.02, P<0.0005), 并且在术后发生远隔转移患者中的表达要高于未发生远隔转移者(0.91±0.02 vs 0.52±0.02, P<0.0005). Rac1蛋白活性的表达情况与Tiam1一致, 在大肠癌中表达高于正常黏膜(0.17±0.01 vs 0.07±0.05, P<0.0005), 并且在有远隔转移的大肠癌组织中活性要高于无远隔转移者(0.25±0.02 vs 0.15±0.01, P<0.0005). 对于不同分化程度的大肠癌组织, Tiam1/Racl的含量均没有统计学差异(0.63±0.04, 0.60±0.04, 0.57±0.04, P = 0.613; 0.18±0.06, 0.17±0.05, 0.15±0.05, P = 0.558).
结论: Tiam1/Racl是大肠癌根治术后患者发生远隔转移的正性因子, 可以作为预测大肠癌根治术后患者发生远隔脏器转移的有效指标.
引文著录: 崔巍, 张勇. Tiam1、Rac1在评估大肠癌远隔脏器转移中的意义. 世界华人消化杂志 2012; 20(4): 346-350
Revised: January 3, 2012
Accepted: February 6, 2012
Published online: February 8, 2012
AIM: To observe the expression of T lymphoma invasion and metastasis-inducing factor1 (Tiam1) and Rac GT-Pase activating protein1 (Rac1) in colorectal cancer and to investigate the relationship between Tiam1/Rac1 expression and remote organ metastasis of postoperative colorectal cancer.
METHODS: Tiam1/Rac1 expression in 87 colorectal cancer specimens and 40 tumor-adjacent colorectal tissue specimens was detected by immunohistochemistry. Tiam1 mRNA expression was detected by competitive RT-PCR. Activity of Rac1 protein was detected by precipitation method.
RESULTS: Tiam1 and Rac1 were positively stained in colorectal tissue, and positive signals were mainly distributed in the nucleus. Tiam1 mRNA expression was significantly increased in colorectal cancer (0.6 ± 0.02 vs 0.24 ± 0.02, P < 0.0005), and Tiam1 expression was higher in postoperative patients with remote organ metastasis than in those without remote organ metastasis (0.91 ± 0.02 vs 0.52 ± 0.02, P < 0.0005). Activity of Rac1 was also significantly increased in colorectal cancer tissue (0.17±0.01 vs 0.07±0.05, P < 0.0005) and was higher in postoperative patients with remote organ metastasis than in those without remote organ metastasis (0.25 ± 0.02 vs 0.15 ± 0.01, P < 0.0005). There was no significant correlation between Tiam1/Rac1 expression and tumor differentiation in colorectal cancer (0.63 ± 0.04, 0.60 ± 0.04, 0.57 ± 0.04, P = 0.613; 0.18 ± 0.06, 0.17 ± 0.05, 0.15 ± 0.05, P = 0.558).
CONCLUSION: Tiam1 and Rac1 expression positively correlates with remote organ metastasis of colorectal cancer and can be used to predict remote organ metastasis of postoperative patients with colorectal cancer.
- Citation: Cui W, Zhang Y. Significance of Tiam1 and Rac1 expression in assessing remote organ metastasis of colorectal cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(4): 346-350
- URL: https://www.wjgnet.com/1009-3079/full/v20/i4/346.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i4.346
远隔转移是大肠癌根治术后患者死亡的主要原因, 据统计大约10%-15%的患者在手术时即已存在血行转移, 约20%患者在术后2年内发生远隔脏器转移, 占大肠癌术后患者死亡原因的85%[1]. 但到目前为止, 临床上还缺乏能够预测大肠癌患者发生远隔脏器转移的有效指标. Tiam1/Rac1是小GTP酶家族成员, 能够促进裸鼠模型中大肠癌的转移生长及体外培养大肠癌细胞的转移[2,3], 并且与大肠癌的Dukes分期和淋巴管转移有关[4], 但是与远隔脏器转移的关系还不十分清楚. 本文检测了大肠癌患者癌组织中Tiam1/Rac1的表达情况, 并分析其与患者发生远隔脏器转移的相关性.
兔抗Tiam1多克隆抗体购自美国Santa Cruz公司; 小鼠抗Rac-1多克隆抗体购自美国Upstate公司; 小鼠抗β-actin单克隆抗体购自美国Introvigen公司; PAK-GST protein Beads购自美国Cytoskeleton公司; Rec-protein G-Sepharose 4B购自美国Zymed公司; RT-PCR试剂盒购自大连宝生物工程有限公司; 即用型SP免疫组化检测试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 病例选择: 选取中国医科大学肿瘤外科2003-03/2005-03行大肠癌根治术的患者87例, 其中男51例, 女36例, 年龄29-85岁, 平均年龄53.6岁. 所有病例均经术后病理组织学确诊为大肠腺癌, 其中, 高分化腺癌27例, 中分化腺癌31例, 低分化腺癌29例; 伴淋巴结转移者56例, 无淋巴结转移者31例, 大肠癌病理诊断参照全国大肠癌病理研究协作组制定的改良Duke分期法(2002年). 所有患者术前均未行放疗或化疗, 术前影像学检查均未发现远隔脏器转移. 留取手术切除的新鲜大肠癌组织、周围淋巴结标本及距肿瘤约3-5 cm的正常大肠黏膜组织, 并对所有患者随访2年, 记录其转归. 按照随访结束时是否发生远隔脏器转移(肝、肺、脑、骨等)将患者分为2组.
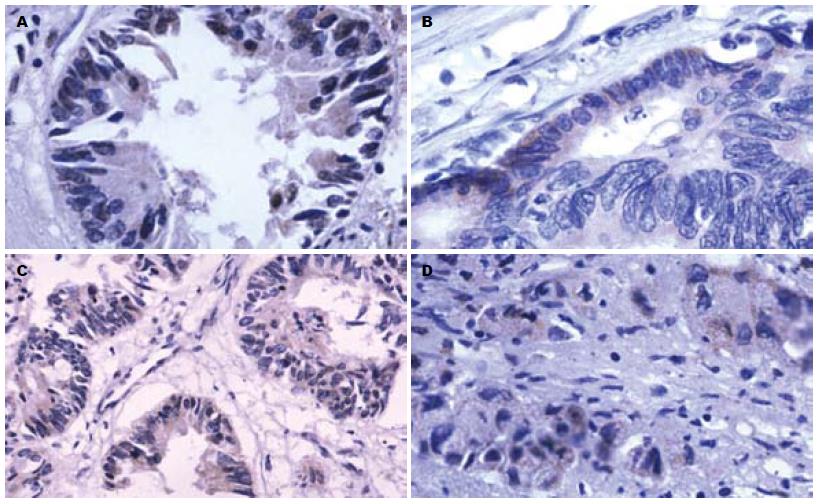
1.2.2 Tiam1、Rac1免疫组织化学染色: 所有新鲜标本均经40 g/L中性甲醛固定, 常规制备石蜡切片, 分别做HE及Tiam1、Rac1免疫组织化学染色. 免疫组织化学染色采用链酶亲和素一生物素过氧化物酶(SP)法, 具体步骤参照说明书进行. 抗原修复采用高温高压修复5 min, 一抗稀释浓度Tiaml为1:50, Racl为1:200, DAB显色, 苏木精复染, 中性树胶封片. 用PBS缓冲液代替一抗作为阴性对照. 结果判定标准高倍镜下每张切片选择5个有代表性的视野, 每个视野计数100个肿瘤细胞, 共计数500个细胞. Tiaml和Racl蛋白表达评估标准为: (1)按染色强度计分: 0分为无色, 1分为淡黄色, 2分为棕黄色, 3分为黄褐色; (2)按阳性染色细胞百分率计分: 0分为阳性细胞数<10%, 1分为阳性细胞数10%-25%, 2分为25%-50%, 3分为≥50%. 然后将2类计分结果的乘积分为以下等级: 0分为阴性(-), 1-2分为弱阳性(+), 3-4分为阳性(++), ≥5分为强阳性(+++).
1.2.3 Tiam1 mRNA检测: 采用TRIzol一步法提取87例大肠腺癌及20例癌旁组织的新鲜大肠组织标本总RNA, 紫外下定量, 各标本取500 ng总RNA进行竞争性RT-PCR, 具体步骤参照说明书进行. PCR反应体系中Tiam1引物和内参(GAPDH)引物间比例为7:1, PCR反应参数为: 94 ℃变性2 min; 94 ℃变性30 s, 58 ℃退火45 s, 72 ℃延伸45 s, 扩增30个循环; 72 ℃继续延长2 min . 取10 µL PCR反应产物进行1.2%琼脂糖电泳, 结果用天能图像分析系统进行分析, 目的基因mRNA含量 = 样本目的基因条带灰度值/同一样本内参条带灰度值. Tiam1引物序列为: 5'-AAGACGTACTCAGGCCATGTCC-3', 5'-GACCCAAATGTCGCAGTCAG-3', 共253 bp; GAPDH引物序列为: 5'-AAATGGTGAAGGT CGGTGTG-3', 5'-TGAAGGGGTCGTTGATGG-3', 共144 bp.
1.2.4 Rac-1活性测定: 参照文献[5], 利用活化形式的Rac-1可以与PAK(p21 active kinase)特异性结合, 并且不容易解离的特性测定Rac-1活性. 所有新鲜标本剪碎后用冰PBS洗3遍, 加入蛋白裂解液(0.5 mL/100 mg)冰上裂解20 min, 4 ℃离心12 000 g 15min, 取上清移入Eppendorf管内; 将蛋白调成相同浓度(1 mg/mL), 留取100 µL裂解产物测定总Rac-1含量, 400 µL裂解产物加入PBD-PAK- Sepharose 20 µL, 4 ℃轻摇120 min, 12 000 g 4 ℃离心1 min收集琼脂糖珠; 应用洗涤缓冲液800 µL, 反复洗涤琼脂糖珠3次; 离心收集琼脂糖珠, 加入2×SDS蛋白上样缓冲液20 µL, 沸水煮5 min, 12 000 g 4 ℃离心1 min收集上清; 取20 µL上清及20 µL最初的裂解产物进行15% SDS-PAGE凝胶电泳, 应用抗Rac-1抗体进行蛋白印迹杂交(抗Rac-1抗体浓度为1:1 000, 辣根过氧化物酶标记的羊抗兔IgG为1:5 000), ECL显色, 结果用天能图像分析系统进行分析, 以同一样本中活性Rac-1(GTP-Rac1)占总Rac-1的比值代表Rac-1活性. 实验设立阳性及阴性对照, 阳性对照向300 µL细胞裂解产物中加入30 µL EDTA (终浓度15 mmol/L)和3 µL GTPγS (终浓度0.2 mmol/L), 阴性对照加入30 µL EDTA和3 µL GDP(终浓度1.0 mmol/L), 室温孵育15 min, 然后加入30 µL MgCl2(终浓度60 mmol/L)终止反应, 再加入20 µL PBD-PAK- Sepharose进行同上的后续操作.
统计学处理 采用SPSS13.0统计软件包进行处理, 样本等级资料的比较采用非参数Kruskal-Wallis Test; 灰度值比较采用单因素方差分析(AVONA)的LSD检验对各组间数据进行比较. P≤0.05为差异有统计学意义.
在正常大肠黏膜组织中Tiaml和Racl蛋白染色均为阴性(0%), 而在87例大肠腺癌组织中65例Tiaml和64例Racl蛋白呈阳性染色(74.7%, 73.6%), 表现为在细胞内(胞膜或胞质)呈黄色颗粒, 界限清楚(表1, 图1), 两者间差异有统计学意义(P<0.0005). 随访2年结束时, 87例大肠癌患者中有18例发生远隔脏器转移(肝转移13例, 72%; 肺转移4例, 22%; 骨转移1例, 6%), 这18例患者Tiaml和Racl均呈阳性表达, 与未发生远隔转移的大肠癌患者Tiaml、Racl阳性表达评分比较有统计学差异(P = 0.001, P = 0.003). Tiaml阳性表达随肿瘤分化程度的降低而呈下降趋势, 但差异没有统计学意义(P = 0.078); Racl在不同分化程度的大肠癌组织中阳性表达情况基本一致, 没有统计学差异(P = 0.463).
| 项目 | Tiam1表达阳性 | P值 | Racl表达阳性 | P值 | ||||||||
| n | - | + | ++ | +++ | - | + | ++ | +++ | ||||
| 分化程度 | 高 | 27 | 0 | 5 | 10 | 12 | 0.078 | 1 | 5 | 14 | 7 | 0.463 |
| 中 | 31 | 2 | 5 | 13 | 11 | 1 | 7 | 15 | 8 | |||
| 低 | 29 | 2 | 8 | 14 | 5 | 2 | 7 | 16 | 4 | |||
| 随访2年内 | ||||||||||||
| 远隔转移 | 有 | 18 | 0 | 1 | 6 | 11 | 0.001 | 0 | 2 | 7 | 9 | 0.003 |
| 无 | 69 | 4 | 18 | 32 | 15 | 4 | 17 | 38 | 10 | |||
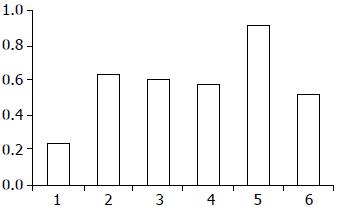
在正常大肠黏膜中Tiam1 mRNA含量很少(0.24±0.02), 但在大肠癌组织中Tiam1 mRNA表达量明显增高(0.6±0.02), 两者相比具有明显的统计学意义(P<0.0005). 进一步分析发现Tiam1 mRNA的含量在有远隔转移的大肠癌组织中(0.91±0.02)明显高于没有远隔转移者(0.52±0.02, P<0.0005), 而与肿瘤的分化程度无关(0.63±0.04, 0.60±0.04, 0.57±0.04, P = 0.613, 图2).
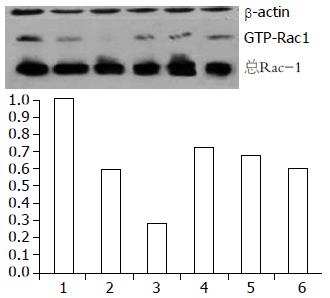
在大肠癌组织中活性Racl蛋白的含量明显高于正常大肠黏膜组织(0.17±0.01 vs 0.07±0.05, P<0.0005), 且在有远隔转移的大肠癌组织中活性Racl蛋白含量要高于无远隔转移者(0.25±0.02 vs 0.15±0.01, P<0.0005). 对于不同分化程度的大肠癌组织, 活性Racl蛋白的含量没有统计学差异(0.18±0.06, 0.17±0.05, 0.15±0.05, P = 0.558, 图3).
大肠癌是消化系常见肿瘤, 恶性程度较高, 易发生血行性、淋巴性转移和消化系种植播散. 临床上约20%以上的大肠癌患者在行根治性手术前已有了无法检测出的微小转移, 他是大肠癌术后转移和复发的直接原因. 因此, 预测患者发生远隔转移的风险对于判断预后及指导综合治疗具有重要意义. 传统的TNM分期不能充分反应大肠癌的生物学特性, 需要进一步寻找分子指标来预测患者远隔转移的风险. 肿瘤转移机制十分复杂, 涉及癌细胞和宿主两方面, 癌细胞首先通过黏附分子与细胞外基质(extracellular matrix, ECM)黏附, 进一步通过水解酶破坏组织间隙向局部浸润或经血管和淋巴管向远处纵深发展, 并需要逃避宿主免疫系统的攻击才能在新的微环境中生长, 在这一过程中基质金属蛋白酶、血管内皮生长因子、Tiam1等多种转移相关分子发挥了重要作用[6-10].
Tiam1最初是从小鼠T淋巴瘤细胞中分离鉴定出来的基因, 属高度保守基因, 人体内除脑和睾丸组织外其他组织表达很低. 已有研究证实Tiam1与皮肤癌、乳腺癌等多种肿瘤侵袭和转移密切相关[11-13]. 近年研究显示Tiaml基因与大肠癌转移也有密切关系. 孙青等[14]应用基因芯片和文献轮廓挖掘的生物信息学方法证实Tiaml与大肠癌转移密切相关; Minard等[2]发现在裸鼠模型中Tiaml可促进结肠癌转移生长; 钟大平等[4]发现Tiaml在人大肠癌组织中表达增高, 并且与肿瘤分化程度、淋巴结转移密切相关. 但影响大肠癌根治术后患者预后的重要因素在于远隔转移的发生, 而Tiaml在人大肠癌远隔转移中的作用尚不清楚, 因此本文随访了87例大肠癌术后患者, 观察Tiaml表达是否能够预测大肠癌根治术后患者远隔转移的发生.
结果表明, Tiaml在大肠癌组织中的表达无论从转录水平还是蛋白水平均明显高于正常大肠黏膜组织, 并且在大肠癌根治术后出现远隔转移患者中的表达比未发生转移的患者要明显增强, 说明Tiaml与大肠癌远隔转移高度相关, 是大肠癌的促转移因子, 可以作为评估大肠癌预后的分子指标. Tiaml基因也可能成为大肠癌基因治疗的新靶点.
Tiaml促进肿瘤转移的机制可能有以下几个方面: (1)Tiaml蛋白包括Dbl同源功能区, 是Rho GTPase家族成员Rac1特异性的鸟苷酸转换因子, 促进其由Racl-GDP(失活状态)向Racl-GTP(激活状态)转变, 进而调节细胞骨架结构重组, 影响细胞的形体极化过程, 促进细胞运动和迁移[15]; (2)Tiaml蛋白还包括pleckstrin同源功能区, 介导蛋白复合物的形成以及Tiaml蛋白的膜定位, 诱导膜皱褶形成, 后者是肿瘤细胞运动和转移的一个指标; (3)Tiaml还可与多种肿瘤转移相关信号分子发生联系, 如Src、Myc、CD44等. 在这3方面的作用中, Tiaml促进Racl蛋白活化最为重要, 因此我们又检测了不同标本中Racl蛋白活性的变化情况. 结果表明与Tiaml表达具有一致性, 在大肠癌组织中要明显高于正常黏膜, 并且在大肠癌根治术后发生远隔转移患者中的活性要明显高于未发生转移者, 说明Tiaml促转移作用是通过Racl蛋白的活化来完成的.
大肠癌远隔转移是影响其预后的重要因素, 如何预测大肠癌远隔转移的发生具有重要意义. Tiam1在大肠癌组织中表达增高, 并认为其与大肠癌局部淋巴结转移密切相关.
颜宏利, 教授, 中国人民解放军第二军医大学
Tiam1及Rac1蛋白在大肠癌中的表达及其与淋巴结转移的关系已有研究, 其机制及在远隔脏器转移中的作用尚不清楚, 并且多数研究集中在动物实验及体外细胞培养.
Zhong等报道, Tiam1与大肠癌的淋巴转移有密切关系. Choi等在体外实验中进一步证实, Tiam1/Rac1参与大肠癌细胞的转移.
关于Tiam1及Rac1蛋白, 尤其是Rac1蛋白活性在预测大肠癌远隔转移中的作用国内外尚未见报道.
联合检测Tiam1及Rac1蛋白表达可望成为判断大肠癌远隔转移的分子指标之一, 对大肠癌预后判断具有重要意义.
本文发现Tiam1的表达水平与肿瘤转移具有正相关性,具有一定的新颖性和临床意义.
编辑: 张姗姗 电编:闫晋利
| 2. | Minard ME, Herynk MH, Collard JG, Gallick GE. The guanine nucleotide exchange factor Tiam1 increases colon carcinoma growth at metastatic sites in an orthotopic nude mouse model. Oncogene. 2005;24:2568-2573. [PubMed] [DOI] |
| 3. | Choi Y, Kim H, Chung H, Hwang JS, Shin JA, Han IO, Oh ES. Syndecan-2 regulates cell migration in colon cancer cells through Tiam1-mediated Rac activation. Biochem Biophys Res Commun. 2010;391:921-925. [PubMed] |
| 5. | Ren XD, Schwartz MA. Determination of GTP loading on Rho. Methods Enzymol. 2000;325:264-272. [PubMed] [DOI] |
| 6. | Liu L, Zhao L, Zhang Y, Zhang Q, Ding Y. Proteomic analysis of Tiam1-mediated metastasis in colorectal cancer. Cell Biol Int. 2007;31:805-814. [PubMed] [DOI] |
| 7. | Zhong D, Li Y, Peng Q, Zhou J, Zhou Q, Zhang R, Liang H. Expression of Tiam1 and VEGF-C correlates with lymphangiogenesis in human colorectal carcinoma. Cancer Biol Ther. 2009;8:689-695. [PubMed] [DOI] |
| 8. | Barresi V, Reggiani-Bonetti L, Di Gregorio C, Vitarelli E, Ponz De Leon M, Barresi G. Neutrophil gelatinase-associated lipocalin (NGAL) and matrix metalloproteinase-9 (MMP-9) prognostic value in stage I colorectal carcinoma. Pathol Res Pract. 2011;207:479-486. [PubMed] [DOI] |
| 9. | Dragutinović VV, Radonjić NV, Petronijević ND, Tatić SB, Dimitrijević IB, Radovanović NS, Krivokapić ZV. Matrix metalloproteinase-2 (MMP-2) and -9 (MMP-9) in preoperative serum as independent prognostic markers in patients with colorectal cancer. Mol Cell Biochem. 2011;355:173-178. [PubMed] [DOI] |
| 11. | Chen B, Ding Y, Liu F, Ruan J, Guan J, Huang J, Ye X, Wang S, Zhang G, Zhang X. Tiam1, overexpressed in most malignancies, is a novel tumor biomarker. Mol Med Report. 2012;5:48-53. [PubMed] |
| 12. | Liu H, Shi G, Liu X, Wu H, Fan Q, Wang X. Overexpression of Tiam1 predicts poor prognosis in patients with esophageal squamous cell carcinoma. Oncol Rep. 2011;25:841-848. [PubMed] |
| 15. | Mula RV, Bhatia V, Falzon M. PTHrP promotes colon cancer cell migration and invasion in an integrin α6β4-dependent manner through activation of Rac1. Cancer Lett. 2010;298:119-127. [PubMed] [DOI] |