修回日期: 2011-12-19
接受日期: 2012-02-06
在线出版日期: 2012-02-08
目的: 阐明黄芪、三七及其配伍对萎缩性胃炎大鼠胃黏膜热休克蛋白70基因表达的影响.
方法: 健康、清洁级♂Wistar大鼠64只, 随机分为空白组9只、假手术组10只, 模型组9只, 替普瑞酮组9只, 黄芪组9只, 三七组9只, 黄芪+三七组9只. 运用幽门弹簧配合高盐热淀粉糊灌胃法制备萎缩性胃炎模型, 治疗期共1 mo, 治疗期间空白组、假手术组、模型组予生理盐水2 mL/d灌胃; 黄芪组予黄芪水煎剂3.5 g/(kg•d)灌胃; 三七组予三七粉冲剂0.7 g/(kg•d)灌胃; 黄芪+三七组予黄芪三七溶液灌胃[其中黄芪3.5 g/(kg•d), 三七0.7 g/(kg•d)]; 替普瑞酮组治疗期予200 mg/(kg•d), 治疗结束后, 各组取3只, 实时定量PCR法测定各组大鼠胃黏膜中Hsp70 mRNA表达量, Western blot法测定Hsp70/Hsp72蛋白表达量, 余大鼠HE法观察胃黏膜病理变化.
结果: 模型组与假手术组相比, 其胃黏膜体积构成比明显下降(P<0.01); 替普瑞酮组较模型组胃黏膜体积构成比明显升高(P<0.01), 黄芪组、三七组和黄芪+三七组与模型组相比, 可以明显提高胃黏膜体积构成比(P<0.01), 与替普瑞酮比较, 差异无统计学差异(P>0.05), 黄芪组、三七组、黄芪+三七组之间亦没有统计学差异(P>0.05). 黄芪组、三七组胃黏膜中Hsp70 mRNA表达与模型组比较显著升高(P<0.01). 各组Hsp70/72蛋白表达差异无统计学意义(P>0.05).
结论: 黄芪、三七及其配伍可以明显改善萎缩性胃炎大鼠胃黏膜的萎缩状态. 诱导热休克蛋白70基因表达可能是黄芪、三七治疗萎缩性胃炎的作用机制之一.
引文著录: 史瑞, 李晓红, 刘礼剑, 李健, 李军祥. 黄芪、三七及其配伍对萎缩性胃炎大鼠胃黏膜热休克蛋白70基因表达的影响. 世界华人消化杂志 2012; 20(4): 310-313
Revised: December 19, 2011
Accepted: February 6, 2012
Published online: February 8, 2012
AIM: To evaluate the effect of Astragalus, Panax notoginseng and their compatibility on expression of the heat shock protein 70 (Hsp70) gene in rats with atrophic gastritis.
METHODS: Sixty-four male healthy Wistar rats were randomized into seven groups: control group (n = 9), sham operation group (n = 10), model group (n = 9), teprenone group (n = 9), Astragalus group (n = 9), Panax notoginseng group (n = 9), and Astragalus plus Panax notoginseng group (n = 9). Atrophic gastritis was induced by implanting a pylorus spring and intragastrically administering hot salty starch paste. In the one-month therapeutic phase, the control, sham operation and model groups were given normal saline 2 mL daily. The Astragalus group was given water decoction of Astragalus containing crude drug 3.5 g/(kg• d). The Panax notoginseng group was infused with Panax notoginseng powder containing crude drug 0.7 g/(kg• d). The Astragalus plus Panax notoginseng group was given both Panax notoginseng powder and Astragalus water decoction. The teprenone group was given teprenone water suspension containing teprenone 200 mg/(kg• d). All drugs were given by gavage for one month. Three rats of each group were randomly selected for real-time PCR detection of Hsp70 mRNA and Western blot analysis of Hsp70/72 protein. The remaining rats were used for pathological assessment of stomach mucosa by hematoxylin and eosin staining method.
RESULTS: Gastric mucosal volume constituent ratio (GMVR) in the model group decreased compared to that in the sham operation group (P < 0.01). The GMVR in the teprenone group increased compared to that in the model group (P < 0.01). The GMVR in the Astragalus, Panax notoginseng, and Astragalus plus Panax notoginseng groups increased compared to the model group, but showed no statistical difference with that in the teprenone group (P > 0.05). Hsp70 mRNA expression in gastric mucosa of rats in the Astragalus group and Panax notoginseng group was higher than that in the model group (both P < 0.01). The expression of Hsp70/72 protein in all groups showed no statistical differences (all P > 0.05).
CONCLUSION: Astragalus, Panax and their combination can improve mucosal atrophy in rats with atrophic gastritis. Inducing Hsp70 gene expression may be one of therapeutic mechanisms for Astragalus and Panax notoginseng in treating atrophic gastritis.
- Citation: Shi R, Li XH, Liu LJ, Li J, Li JX. Effect of Astragalus, Panax notoginseng and their compatibility on expression of the heat shock protein 70 gene in rats with atrophic gastritis. Shijie Huaren Xiaohua Zazhi 2012; 20(4): 310-313
- URL: https://www.wjgnet.com/1009-3079/full/v20/i4/310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i4.310
萎缩性胃炎(atrophic gastritis, AG)是临床消化系统的常见病和疑难病, 是胃癌前疾病之一, 防治该病有利于预防胃癌的发生. 近几年来应用胃黏膜保护剂替普瑞酮治疗AG的研究越来越多, 临床研究发现, 其能改善AG患者的症状、内镜表现和病理改变[1-5]. 诱导热休克蛋白70(heat shock protein 70, Hsp70)表达, 可能是替普瑞酮保护胃黏膜的机制之一[6,7]. 李军祥等[8]运用基因芯片技术研究益气活血法治疗AG癌前病变大鼠前后胃黏膜基因表达谱变化, 发现益气活血法药物黄芪三七配伍治疗AG的靶基因之一可能是Hsp70基因. 本文在此基础上进一步从转录和翻译水平研究黄芪、三七及其配伍对AG胃黏膜Hsp70基因表达的影响, 以进一步阐明中药益气活血法治疗AG的分子机制.
Wistar♂大鼠, 64只, 体质量200 g±20 g, 清洁级, 由北京维通利华实验动物技术有限公司提供, 实验动物许可证编号: SCXK(京)2006-0009. 黄芪: 产自内蒙古, 购自北京同仁堂药材有限公司, 北京中医药大学中药学院中药鉴定系张媛教授鉴定为蒙古黄芪; 三七粉: 产自云南, 购自北京同仁堂药材有限公司; 替普瑞酮胶囊(商品名施维舒): 由卫材(中国)药业有限公司生产; TRIzol试剂盒(美国Invitrogen); M-MLV反转录试剂盒(日本Takara公司); Real-time PCR扩增试剂盒(瑞士Roche公司); PCR引物(生物工程(上海)有限公司)见表1, 抗Hsp70/72小鼠单克隆抗体(美国Assay Designs公司); 二抗为辣根酶标记兔抗小鼠IgG(北京中杉金桥生物技术有限公司).
| 引物 | 序列 | 位点[Toledo] |
| 147U3A | 5'AGCTGAATCGTCAGGAAGTG 3' | 10093 |
| 148D1 | 5'CGGTGACAGGGTGTATCGTA 3' | 11449 |
| 148D3 | 5'GTGCAATGCATATACTGTCC 3' | 10845 |
| 147UP | 5'GGGAGATCCGGTTACAAAG 3' | 9318 |
| 147LOW | 5'TCCACAGAAGATGAGGAGC 3' | 10148 |
1.2.1 大鼠饲养条件: 大鼠饲养于清洁级实验室, 恒温(20 ℃±1 ℃)恒湿(50%-60%), 分笼饲养, 常规喂养清洁级标准颗粒饲料, 自由饮用除菌水.
1.2.2 萎缩性胃炎模型制备: 造模时间为4 mo, 参考史瑞等[9]研究.
1.2.3 分组及给药: Wistar大鼠, 按体质量随机区组设计法随机分为空白组、假手术组、模型组. 空白组予生理盐水2 mL/d灌胃; 假手术组(未植入幽门弹簧, 余同模型组)予生理盐水2 mL/d灌胃; 模型组模型制备参见史瑞等幽门弹簧置入联合高盐热淀粉糊灌胃法[9]. 模型成功后, 将模型组大鼠按体质量随机区组设计法随机分为模型组、黄芪组、三七组、黄芪+三七组、替普瑞酮组. 模型组予生理盐水2 mL/d灌胃; 黄芪组予黄芪水煎剂3.5 g/(kg•d)灌胃; 三七组予三七粉冲剂0.7 g/(kg•d)灌胃; 黄芪+三七组予黄芪三七溶液灌胃[其中黄芪3.5 g/(kg•d), 三七0.7 g/(kg•d)], 替普瑞酮组予替普瑞酮200 mg/(kg•d), 治疗期为1 mo.
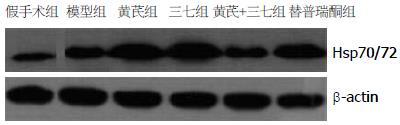
1.2.4 检测方法: HE染色后, 各组10倍物镜下随机采图10张, 使用Image-Pro Plus6.0图像分析系统, 对胃黏膜体积构成比进行形态计量. Real-time PCR法测定Hsp70 mRNA表达水平(引物序列见表1), 从ABI 7500实时荧光定量PCR仪上直接读取各个样本Ct值, 用相对定量2-△△CT法分析结果. Western blot法测定热休克蛋白70/72(Hsp70/72)表达水平, 用Image-Pro Plus6.0图像分析系统对扫描图像的目的条带进行灰度分析, 目的基因相对表达量为目的基因灰度与β-actin灰度的比值.
统计学处理 计量资料采用mean±SD表示, 采用单因素方差分析, 数据采用SPSS16.0统计软件包进行统计分析.
胃黏膜体积构成比越小, 其黏膜萎缩程度越重. 假手术组与空白组相比, 差异无统计学意义(0.8300±0.0353 vs 0.8464±0.0377, P>0.05), 说明假手术对胃黏膜的体积构成比没有显著影响, 胃黏膜萎缩的改善均来自药物的影响. 模型组与假手术组相比, 其胃黏膜体积构成比明显下降(0.6747±0.0143 vs 0.8300±0.0353, P<0.01); 替普瑞酮可以明显改善AG大鼠胃黏膜的萎缩状态(P<0.01), 黄芪、三七和黄芪+三七均能明显改善胃黏膜的萎缩状态(P<0.01), 与替普瑞酮比较, 差异不显著(0.7512±0.0257, 0.7467±0.0227, 0.7370±0.0171 vs 0.7430±0.0332, P>0.05). 黄芪、三七、黄芪+三七各组之间亦无显著差异(P>0.05).
假手术组与空白组比较, 其胃黏膜Hsp70 mRNA相对表达量相似, 差异无统计学意义(0.2772±0.1625 vs 0.2765±0.3120, P>0.05), 模型组较假手术组Hsp70 mRNA表达升高, 但差异无统计学意义(0.5489±0.2339 vs 0.2772±0.1625, P>0.05). 黄芪组、三七组与模型组比较, 胃黏膜Hsp70 mRNA表达量显著升高(2.9444±1.0466, 2.4104±1.1943 vs 0.5489±0.2339, P<0.01), 替普瑞酮也可以增加Hsp70 mRNA表达, 但与模型组比较, 差异无统计学意义(1.1111±0.5072 vs 0.5489±0.2339, P>0.05). 黄芪+三七组Hsp70 mRNA的表达(0.4520±0.1889), 与空白组、假手术组、模型组比较, 差异均无统计学意义(P>0.05). 黄芪组与替普瑞酮组相比, 差异十分显著(P<0.01), 三七组与替普瑞酮组相比, 差异显著(P<0.05).
假手术组、模型组、替普瑞酮组、黄芪组、三七组、黄芪+三七组大鼠胃黏膜Hsp70/72蛋白相对表达量分别为0.6496±0.4122、0.8231±0.3619、1.1912±0.4099、1.2127±0.2693、1.2162±0.2655、0.9639±0.7940, 各组间表达差异无统计学意义(P>0.05, 图1).
Hsp70是具有细胞保护作用的一类蛋白, 广泛存在于真核和原核生物中, 用于维持细胞内环境的稳态. 他可分为组成型Hsp70/Hsc70和诱导型Hsp70/Hsp72. 在正常生理状态下诱导型Hsp70/Hsp72表达水平很低, 一旦受到外面环境的刺激, 便会迅速被激活, 发挥分子伴侣作用及时清除没有折叠的或错误折叠的异常蛋白, 多种途径抑制细胞凋亡[10]和抑制炎症, 实现对胃黏膜的适应性细胞保护[11]. 通过热休克或给予替普瑞酮或瑞巴派特等方法诱导Hsp70表达, 可以抵御随后而来的细胞致死性刺激物如100%乙醇[12]和机械损伤[13]、吲哚美辛[14]、束缚-水浸应激[15]、0.1%氨水、60%乙醇和20 mmol/L脱氧胆酸[7]、强的松[16]对胃黏膜的损伤. 故对人体无毒的Hsp70诱导剂可能是非常有潜力的胃黏膜保护剂, 同时结合近期临床研究结果[1-5], 这种无毒的Hsp70诱导剂很可能可以改善AG的病变, 用于防治AG.
本实验所用的Hsp70抗体为诱导型Hsp70/72, 造模方法中运用到的造模措施均非致死性刺激, 但仍会使胃黏膜产生一系列的蛋白变性、聚集、折叠出错等, 此时Hsp70基因感受到这些异常的刺激便会迅速启动, 表现为Hsp70 mRNA略高于假手术组, 但差异无统计学意义, 说明Hsp70/72的表达量尚不足以抵御造模带来的胃黏膜损伤. 用益气健脾的黄芪和活血化瘀的三七分别作用, 能明显促进AG大鼠胃黏膜中Hsp70 mRNA转录, 同时促进Hsp70/72蛋白的表达, 虽然蛋白水平的表达与模型组比较差异无统计学意义, 但是从Western blot实验的胶片中可以发现黄芪组和三七组Hsp70/72蛋白的表达量明显高于模型组, 甚至超过替普瑞酮组, 且病理结果显示其胃黏膜较模型组明显改善, 推测可能只有当Hsp70/72蛋白表达量达到一定水平时, 才能有效对抗造模带来的损伤, 本实验中治疗组Hsp70/72的蛋白表达量仍然不够, 尚未将萎缩的胃黏膜恢复至正常水平. 黄芪三七以5:1配伍与黄芪、三七单用比较, 黄芪三七配伍并未表现出加强其各自在诱导Hsp70mRNA及Hsp70/72蛋白表达方面的作用, 但二者配伍治疗AG在病理方面与二药单用无统计学差异, 推测黄芪三七配伍治疗AG可能激活了其他细胞保护通路, 从而保证了最终疗效, 此方面有待于进一步研究.
萎缩性胃炎是临床消化系统的常见病和疑难病, 是胃癌前疾病之一, 防治该病有利于预防胃癌的发生. 替普瑞酮是常用的胃黏膜保护剂, 可用于治疗萎缩性胃炎, 其作用机制之一可能是诱导热休克蛋白70表达.
王富春, 教授, 长春中医药大学
对人体无毒的Hsp70诱导剂可能是非常有潜力的胃黏膜保护剂, 同时无毒的Hsp70诱导剂很可能可以改善萎缩性胃炎的病变, 用于防治萎缩性胃炎.
研究黄芪、三七代表的益气活血法治疗萎缩性胃炎的分子机制为临床运用二药提供科学依据, 同时二药很有希望作为无毒的Hsp70诱导剂应用于包括萎缩性胃炎在内的其他疾病的治疗.
本文科学性较强, 对于进一步明确黄芪与三七相配伍, 治疗萎缩性胃炎提供了实验依据, 是一篇较好的科学实验论文.
编辑: 曹丽鸥 电编:闫晋利
| 4. | 曹 丽君, 阳 学风. 胃复春、替普瑞酮联合治疗慢性萎缩性胃炎. 南华大学学报(医学版). 2008;36:617-619. |
| 7. | Liu WL, Chen SJ, Chen Y, Sun LM, Zhang W, Zeng YM, Zhou TH, Si JM. Protective effects of heat shock protein70 induced by geranylgeranylacetone in atrophic gastritis in rats. Acta Pharmacol Sin. 2007;28:1001-1006. [PubMed] [DOI] |
| 9. | 史 瑞, 李 晓红, 方 蕾, 李 健, 蔡 大勇, 李 军祥, 刘 礼剑. 弹簧幽门植入术结合高盐热淀粉糊灌胃诱导大鼠萎缩性胃炎模型的方法及评价. 世界华人消化杂志. 2011;19:1001-1008. [DOI] |
| 10. | Rokutan K. Role of heat shock proteins in gastric mucosal protection. J Gastroenterol Hepatol. 2000;15 Suppl:D12-D19. [PubMed] [DOI] |
| 11. | Van Molle W, Wielockx B, Mahieu T, Takada M, Taniguchi T, Sekikawa K, Libert C. HSP70 protects against TNF-induced lethal inflammatory shock. Immunity. 2002;16:685-695. [PubMed] [DOI] |
| 12. | Nakamura K, Rokutan K, Marui N, Aoike A, Kawai K. Induction of heat shock proteins and their implication in protection against ethanol-induced damage in cultured guinea pig gastric mucosal cells. Gastroenterology. 1991;101:161-166. [PubMed] |
| 13. | Odashima M, Otaka M, Matsuhashi T, Jin M, Horikawa Y, Ohba R, Itoh H, Watanabe S. Mechanical strain stress suppresses expression of HSP70 and wound restoration in gastric mucosal cells. Dig Dis Sci. 2007;52:3087-3091. [PubMed] [DOI] |
| 14. | Hirata I, Naito Y, Handa O, Hayashi N, Mizushima K, Adachi S, Omatsu T, Okayama T, Kishimoto E, Ichikawa H. Heat-shock protein 70-overexpressing gastric epithelial cells are resistant to indomethacin-induced apoptosis. Digestion. 2009;79:243-250. [PubMed] [DOI] |
| 15. | Hirakawa T, Rokutan K, Nikawa T, Kishi K. Geranylgeranylacetone induces heat shock proteins in cultured guinea pig gastric mucosal cells and rat gastric mucosa. Gastroenterology. 1996;111:345-357. [PubMed] [DOI] |
| 16. | Lü B, Zhang L, Fan YH, Xu Y. [Effects of teprenone on expression of heat shock protein 70 and c-fos in stomach following prednisolone ingestion: experiment with rats]. Zhonghua Yixue Zazhi. 2008;88:220-224. [PubMed] |