修回日期: 2011-08-20
接受日期: 2011-09-01
在线出版日期: 2012-02-08
目的: 探讨人巨细胞病毒(human cytomegalov-irus, HCMV)UL147基因在婴儿巨细胞病毒肝炎临床株中的多态性及其与致病性之间的关系.
方法: 对25株经荧光定量PCR方法检测HCMV DNA为阳性的临床株的尿液上清液进行HCMV UL147全序列PCR扩增, 并对PCR扩增产物进行序列测定及分析.
结果: 25株临床株扩增阳性产物进行HCMV UL147全序列PCR扩增, 结果有19株PCR扩增阳性; 与HCMV Toled株进行序列比较分析, 所有UL147开放读码框架(open-reading-fraem, ORF)长度在477-480 bp, 序列呈现较高多态性, UL147基因变异率为2.7%-10.9%; 氨基酸变异集中在30-40氨基酸位点, 变异率为4.3%-8.75%; 所有研究标本中没有序列与Toledo完全一致. 序列差异多位于序列的5'端, 巨细胞病毒肝炎患儿和无症状患儿之间的UL147基因DNA序列是一致的. NCBI PROS数据库预测UL147编码蛋白功能区显示几乎所有的UL147序列中都存在1个CKP和1个PKC位点.
结论: 巨细胞病毒肝炎患儿临床株中的HCMV UL147基因序列呈现高度多态性. UL147基因多态性与其对肝脏损害的程度无关.
引文著录: 尹晓波, 毛志芹, 常淑婷, 吉耀华, 何蓉, 齐莹, 阮强, 孙梅, 马艳萍, 孙峥嵘. 人巨细胞病毒UL147基因在婴儿巨细胞病毒肝炎临床株中的多态性. 世界华人消化杂志 2012; 20(4): 282-288
Revised: August 20, 2011
Accepted: September 1, 2011
Published online: February 8, 2012
AIM: To investigate the sequence polymorphisms in the open reading frame (ORF) of the UL147 gene in clinical strains of cytomegalovirus and to identify the relationship between UL147 sequence polymorphism and cytomegalovirus hepatitis.
METHODS: The ORF of the UL147 gene in 19 cytomegalovirus strains isolated from infants with cytomegalovirus hepatitis was amplified by PCR and sequenced.
RESULTS: In comparison with the sequence of the Toledo strain, strain-specific polymorphisms were present in the 5' end of the UL147 ORF, and the polymorphisms were located in the 5' end of sequence. The UL147 ORF varied from 477-480 kb. No sequence differences were found between strains isolated from infants with cytomegalovirus hepatitis and asymptomatic patients.
CONCLUSION: The ORF of the UL147 gene is hypervariable in different cytomegalovirus strains. The conservation of predicted UL147 product in clinical strains suggests that UL147 gene polymorphisms have no relationship with the severity of cytomegalovirus hepatitis.
- Citation: Yin XB, Mao ZQ, Chang ST, Ji YH, He R, Qi Y, Ruan Q, Sun M, Ma YP, Sun ZR. Sequence polymorphisms of the UL147 gene in clinical strains of human cytomegalovirus. Shijie Huaren Xiaohua Zazhi 2012; 20(4): 282-288
- URL: https://www.wjgnet.com/1009-3079/full/v20/i4/282.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i4.282
人巨细胞病毒(human cytomegalovirus, HCMV)感染在儿科临床疾病中很常见, 尤其是婴儿期. 我国HCMV先天感染患儿占新生儿的0.9%-3.5%. 人类巨细胞病毒感染后, 有的表现为无症状、长期的潜伏感染, 有的则表现为多种明显的临床症状. 常见的疾病有巨细胞病毒肝炎(cytomegalovirus hepatitis)、先天性巨结肠(Hirschsprung,s disease)、小头畸形、胆道闭锁、脐疝、耳聋、智力低下等多器官、多系统疾病[1-5]. HCMV感染也与血管性疾病的加重有关[6], 尤其在器官移植后. HCMV感染后, 临床表现及病情轻重的不同, 既可能与宿主自身因素有关, 也可能与病毒自身基因多态性有关. 关于HCMV先天感染的致畸机制尚不清楚. 有研究表明HCMV在体内存在不同的细胞嗜性, 提示不同临床症状的HCMV分离株的基因结构可能存在差异. Cha等[7]对HCMV实验室株AD169株和1株命名为Toledo的临床分离株进行了核酸序列比较, 结果发现Toledo株含有19个在AD169株不存在的基因, 表明HCMV此段序列为高度可变区. 这个发现提示这些基因的编码产物可能与HCMV的致病性有关, UL147也是其中的1个基因. 本文着重研究HCMV UL147基因在巨细胞病毒肝炎患儿临床分离株中的多态性, 探讨其与致病性的关系.
HCMV临床株(25株)均来自2007-2009年我院住院患儿, 患儿年龄均小于3 mo. 其中转氨酶明显升高, 肝功能出现异常的19例, 无症状或者轻度黄疸, 以间接胆红素升高为主, 但转氨酶于正常范围内的作为对照组6例. 此25例患儿血清HCMV-IgM阳性, 尿液经QPCR检测HCMV-DNA均为阳性, 排除其他病毒如风疹病毒、单纯疱疹病毒、弓形虫、EB病毒、传染性肝炎病毒、HIV、梅毒螺旋体感染及相关遗传代谢性疾病. 尿标本于-70 ℃保存备用.
1.2.1 PCR扩增: (1)标本处理: 取HCMV-DNA阳性尿标本上清液0.5 mL, 加裂解液50 μL, 100 ℃沸水浴15 min, 室温下离心15 000 r/min, 10 min; (2)引物设计: 按照Toledo株序列, 应用引物设计软件primer premier 5.0设计用于扩增HCMV UL147全序列的引物并由上海生工公司合成. 半巢式扩增产物全长为752 bp, 巢式扩增产物全长为345 bp. 引物序列见表1; (3)PCR全序列扩增: 反应体系: Buffer 5 μL, dNTP mixture 4 μL, 上、下游引物各1 μL, rTaq酶0.25 U, 用双蒸水补至总反应体积50 μL; PCR循环条件: 预变性95 ℃ 5 min, 变性 95 ℃ 30 s, 退火50 ℃ 30 s, 延伸72 ℃ 1.5 min, 30个循环, 终延伸72 ℃ 10 min. 应用巢式半巢式PCR对包含UL147 ORF的DNA序列进行扩增. 半巢式一扩引物为147U3A和148D1, 二扩引物为147U3A和148D3. 巢式一扩引物为147UP和148D3, 二扩引物为147U3A和147low; (4)1.2%琼脂糖凝胶电泳后EB染色, 紫外检测仪下观察扩增结果. 采用半巢式扩增阳性标本于752 bp处出现目的产物带, 采用巢式扩增阳性标本于345 bp处出现产物带, 电脑下查看结果, 拍摄照片.
1.2.2 PCR扩增阳性标本测序: 由北京华大基因公司完成. 对于一扩产物可以通过正反2个方向分别对目的基因的正链及负链进行测序, 以增加实验结果的可信性. 对于二扩产物通过正向测序即可.
1.2.3 序列分析: 应用DNASTAR、Genedoc等软件进行序列分析.
25株临床株扩增阳性产物进行HCMV UL147全序列PCR扩增, 结果有19株PCR扩增阳性, 阳性率为76%; 其中健康对照组6例, 标号为my40、y26、y85、y87、y89和y7, 其余13例为巨细胞病毒肝炎患儿组. 与HCMV Toled株进行序列比较分析, 所有UL147开放读码框架(open reading frame, ORF)长度在477-480 bp, 序列呈现较高的多态性, 所有研究标本中没有序列与Toledo完全一致. 序列差异多位于序列的5'端的90-129 bp处.
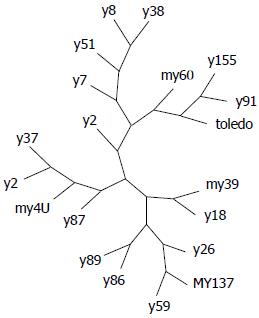
2.2.1 测序及进化树分析: 测序显示19株临床株之间存在高度多态性; 种系进化树分析结果分为4个基因型, 我们称之为G1、G2、G3和G4型. G1型包括y91和y155 2个序列, G2型包括4个序列, 即y7、y51、y8和y38. G3型只有my60, G4型包括余12个序列. 19个氨基酸序列的种系进化树分析见图1.
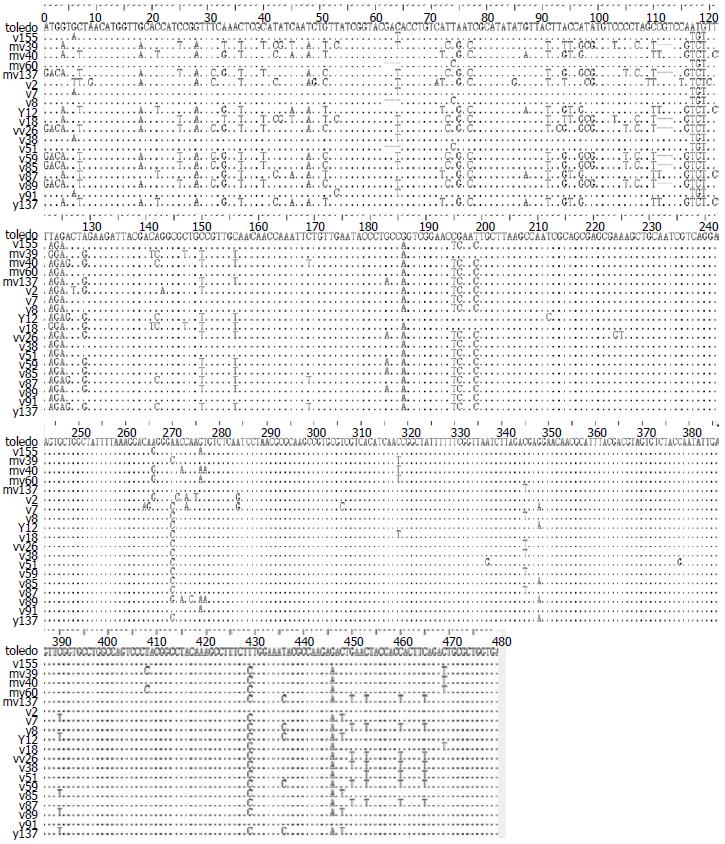
2.2.2 核苷酸序列及氨基酸序列比较分析: 与Toledo株(参考株U33331)相比, G1型中my155和my91株的UL147 ORF为480 bp, 编码蛋白为159个氨基酸. G1型中的my60株和G2型的y8、y51于Toledo的62-64位点的碱基出现缺失, UL147 ORF缩短为477 bp, 编码蛋白为158个氨基酸; G2型中的y7和y38于64位点的碱基由C变成T, UL147 ORF为480 bp, 编码蛋白为159氨基酸. G4型中的y2、y12、y87、my40、y137的UL147 ORF为480 bp, 编码蛋白为159个氨基酸; 余7株均于Toledo的111-113位点的碱基出现缺失, UL147 ORF为477 bp, 编码蛋白为158个氨基酸. 19株临床株的序列差异多位于5'端的90-129 bp处, UL147基因变异率为2.7%-10.9%; 氨基酸变异集中在30-40氨基酸位点, 变异率为4.3%-8.75%. 19株临床株的碱基序列及氨基酸比较见图2, 3.
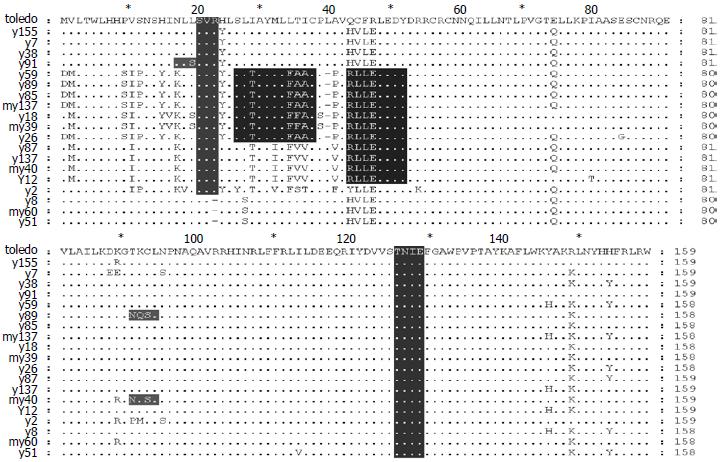
NCBI PROS数据库预测UL147编码蛋白功能区显示几乎所有的UL147序列中都存在1个CKP和1个PKC位点. 本研究19序列中均含有CKP位点. 与Toledo相比, G3型中的my60和G2型的y8和y51于62-64位点的碱基出现缺失, 导致21位点氨基酸缺失, 从而失去了PKC位点. y89、y40和y91因在位置273-276出现碱基替换, 使y89在91-93位点的氨基酸由原来的T、K和C变为N、Q和S, my40在91和93位点的T和C变成N和S, y91在10位点的L变为S, 使这3个序列增加了1个ASN(N-glycosylation site)功能位点. y59、y89、y85、my137、y18、my39和y26在93-99位置出现碱基替换, 使位于氨基酸26位点的I变成T, 31-33位点的T、I和C变成F、A和A, 而增加1个ACP功能位点; 此外, 这7个序列和y12、y87、my40和my137在116-127位置的碱基出现大量替换, 使氨基酸39-42位点的Q、C、F和R变成R、L、L和E, 这11个序列增加了TYR(Tyrosine kinase phosphorylation)(图4).
HCMV感染在全球广泛存在, 其感染率高达70%-100%[8], 发展中国家感染率为80%-100%, 发达国家感染率也多达60%-80%[9], 且具有种属特异性. 有的表现为持续的潜伏感染, 有的则表现出多种临床症状的严重感染[10]. 巨细胞病毒感染在新生儿期引起先天性感染; 在正常人可以引起单核细胞增多症; 在免疫缺陷患儿, 如未成熟患儿、艾滋病或者接受器官移植者, 则巨细胞病毒感染可以引起严重的疾病综合征. HCMV是宫内感染中最常见的病原, 先天性巨细胞病毒感染约占新生儿的1%-2%. 绝大多数先天性感染的胎儿在出生时无临床症状, 约10%新生儿在出生时或出生后不久就表现出较严重的甚至危及生命的临床症状. 巨细胞病毒感染分为先天性感染、围生期感染及生后获得性感染. 其中先天性感染对对患儿危害最大, 严重威胁优生优育. 通过摄入带病毒的母乳是生后感染的重要途径[11]. 有学者注意到: 巨细胞病毒感染所致肝炎中92%为先天性和围生期感染, 先天性感染畸形率、后遗症率和病死率也明显高于围生期及生后获得性感染患儿. 在婴儿, 由人类巨细胞病毒引起以黄疸、肝脏肿大、肝功能损害为主要临床表现的疾病称为婴儿巨细胞病毒肝炎[12,13], 需除外其他病原引起的肝炎(甲肝病毒、乙肝病毒、丙肝病毒、EB、风疹病毒及弓形体等). 巨细胞病毒肝炎分为黄疸型肝炎、胆汁淤积性肝炎、胆汁淤积症、无黄疸型肝炎和亚临床型肝炎. 其中前2种是婴儿巨细胞病毒肝炎的重症. 巨细胞病毒肝炎一般预后良好, 少数可发展为肝功能衰竭和肝硬化. 巨细胞病毒感染后所表现出的临床症状和病情的轻重程度不一, 既可能与宿主自身因素有关系, 也可能与病毒自身基因多态性有关系. 关于HCMV先天感染的致畸机制尚不清楚. 有研究表明HCMV在体内存在不同的细胞嗜性, 提示不同临床症状的HCMV分离株的基因结构可能存在差异.
近年国际上多个研究组已经开始从基因水平上研究人类巨细胞病毒感染的机制. 人类巨细胞病毒属于疱疹病毒β亚科, 他是一种复杂的病毒, 包含230-235 kb的双连DNA及200多个预测的开发阅读框架(open reading frames, ORF)[14]. 1996年, Cha等[2]对HCMV实验室株AD169株和Towne株及1株命名为Toledo的临床分离株进行了核酸序列比较, 结果发现Towne株含有4个, Toledo株含有19个在AD169株不存在的基因, 且Towne株中有4个新基因, 只有1个基因与Toledo株的基因相同(为UL147), 表明HCMV此段序列为高度可变区. Toledo株的19个新基因被分别命名为HCMVUL133、UL134......UL151, 此区域被称为UL/b区. 根据小鼠动物模型研究结果, Toledo株的复制水平是实验株的2-3个数量级[15]. 推测此19个基因可能在病毒的复制、潜伏和对宿主的致病性方面起重要作用, 其中一些基因具有编码糖蛋白的能力, 可能在体内病毒对细胞受体的吸附方面起重要作用, 决定病毒的组织细胞嗜性. 已有学者进行了有关HCMV UL/b'区基因多态性及蛋白功能的研究, 如UL144[16,17]、UL146[18,19]、UL148[20]及UL149[21]等相关性研究.
已有学者研究UL146、UL147分别编码118、160个氨基酸, 其蛋白具有趋化因子功能域的保守的信号肽序列, 4个适当间隔的半胱氨酸和相应的分子大小[22]. 根据半胱氨酸的位置和数量的不同分为4种类型: CXC、CC、XC和CX3X, X代表除半胱氨酸外的任何一种氨基酸[23]. 预测的UL146基因编码产物VCXC-1是在病毒中发现的第1个α趋化因子. 包含有1个ELR功能区(谷-精-亮氨酸)与CXC残基相邻, 具有趋化粒细胞的化学趋化功能. 有研究证实ELR残基对与IL-8活性和受体的结合非常重要[24]. UL147编码产物VXCXL-2不含有ELR功能域, 但具有无ELR的CXC趋化因子的4个半胱氨酸残基. 2者与α趋化因子IL28有相同的信号肽及半胱氨酸空间位置, 氨基酸线性序列的同源性分别为26%、16%[18]. 具有ELR功能区的趋化因子能趋化中性粒细胞, 而没有ELR功能区的趋化因子作用于T和B细胞[25]. 有研究表明HCMV临床分离株许多基因都具有多态性. 2009年, 何蓉等[26]研究UL147基因测序分析结果显示序列之间存在多态性, 序列变异集中在5'端. 部分序列存在不同程度的碱基缺失, 但均未引起移码突变. 研究发现不同CMV分离株的UL146基因编码的氨基酸序列有很大变异[27-29], 但所有的VCXC-1分离株均含有保守的ELRCXC功能域, 这个基因是CMV基因中变化最大的之一. UL147编码氨基酸相对保守, 没有UL146发生的大量的氨基酸替换.
我们所选取的25个临床标本患儿年龄均小于3 mo, 25株临床株进行HCMV-UL47全序列PCR扩增, 结果有19株PCR扩增阳性, 阳性率为76%, 13例来自临床程度不同的巨细胞病毒肝炎患儿, 其中有胆汁淤积患儿, 有直接胆红素和间接胆红素均明显增高的肝炎患儿, 最重的为胆道闭锁患儿, 对照组HCMV感染患儿的标本为6例, 余6例经多次扩增未见产物, 不能排除UL-147基因的丢失. 与HCMV Toledo株进行序列比较分析, 所有UL147 ORF长度在477-480 bp, 序列呈现较高的多态性, 共分为3个型, 所有研究的标本中没有序列与Toledo株完全一致. 序列差异多位于序列的5'端的90-129 bp处. 所有标本序列的117和119位点发生碱基置换, 117位点的碱基A被碱基T替换, 119位点的碱基G被碱基T替换, 124位点的碱基A被G替换, 125位点的G被A替换. 与Toledo株比较, 有3株因为出现碱基缺失, 从而失去了PKC位点. 有3个序列因为出现碱基替换, 使这3个序列增加了1个ASN位点. 7个序列因为出现碱基替换, 而增加1个ACP功能位点; 有11个序列在相对于Toledo 116-127位置的碱基出现大量替换, 增加了TYR功能位点. 本文研究19序列中均含有CKP磷酸化位点, 16个序列含有PKC功能位点, 提示这2个区域在病毒作用机制中起重要作用. 目前关于ASN、ACP和TYR功能位点与HCMV在临床致病性方面是否有关还不清楚, 有待进一步研究.
通过对13例巨细胞病毒肝炎标本和同年龄组6名无症状患儿标本的临床株进行的UL147序列分析的比较, 未发现UL147序列多态性的差异, 说明UL147基因多态性与HCMV引起肝脏损害的轻重无关.
总之, 通过本研究可得出如下结论: (1)HCMV-UL147广泛存在于临床株中, 序列呈现多态性, 但UL147基因多态性与其对肝脏损害的程度无关; (2)临床标本的UL147编码蛋白序列具有1个保守的CKP磷酸化位点, 提示HCMV-UL147可能在病毒感染中起重要作用; (3)不同临床症状的临床株HCMV-UL147蛋白的氨基酸序列具有一定的结构特点, 并与基因型呈一定相关性, 提示HCMV-UL147基因及其所编码的蛋白在HCMV致病性上可能有一定的作用.
HCMV感染后, 临床表现及病情轻重不同, 既可能与宿主自身因素有关, 也可能与病毒自身基因多态性有关. 关于HCMV先天感染的致畸机制尚不清楚.
任浩, 副教授, 中国人民解放军第二军医大学微生物学教研室
有研究表明HCMV在体内存在不同的细胞嗜性, 提示不同临床症状的HCMV分离株的基因结构可能存在差异.
Cha等对HCMV实验室株AD169株和1株命名为Toledo的临床分离株进行了核酸序列比较, 结果发现Toledo株含有19个在AD169株不存在的基因, 表明HCMV此段序列为高度可变区.
本研究结果显示, UL147基因多态性与HCMV引起肝脏损害的轻重无关, 为从基因水平上揭示HCMV与肝损伤之间的关系提供了一些依据, 具有一定的研究意义.
编辑: 张姗姗 电编:闫晋利
| 2. | 刘 兰青, 吕 绳敏, 吴 佩英. 巨细胞病毒感染引起的小头畸形及其他神经损害. 实验和临床病毒学杂志. 1989;3:40-42. |
| 3. | Tam PK, Quint WG, van Velzen D. Hirschsprung's disease: a viral etiology? Pediatr Pathol. 1992;12:807-810. [PubMed] [DOI] |
| 4. | Macris MP, Nahmias AJ, Bailey PD, Lee FK, Visintine AM, Brann AW. Electron microscopy in the routine screening of newborns with congenital cytomegalovirus infection. J Virol Methods. 1981;2:315-320. [PubMed] [DOI] |
| 5. | Demmler GJ. Infectious Diseases Society of America and Centers for Disease Control. Summary of a workshop on surveillance for congenital cytomegalovirus disease. Rev Infect Dis. 1991;13:315-329. [PubMed] [DOI] |
| 6. | Miller DM, Espinosa-Heidmann DG, Legra J, Dubovy SR, Sũner IJ, Sedmak DD, Dix RD, Cousins SW. The association of prior cytomegalovirus infection with neovascular age-related macular degeneration. Am J Ophthalmol. 2004;138:323-328. [PubMed] [DOI] |
| 7. | Cha TA, Tom E, Kemble GW, Duke GM, Mocarski ES, Spaete RR. Human cytomegalovirus clinical isolates carry at least 19 genes not found in laboratory strains. J Virol. 1996;70:78-83. [PubMed] |
| 8. | Söderberg-Nauclér C. Does cytomegalovirus play a causative role in the development of various inflammatory diseases and cancer? J Intern Med. 2006;259:219-246. [PubMed] [DOI] |
| 10. | Keegan A, Morecroft I, Smillie D, Hicks MN, MacLean MR. Contribution of the 5-HT(1B) receptor to hypoxia-induced pulmonary hypertension: converging evidence using 5-HT(1B)-receptor knockout mice and the 5-HT(1B/1D)-receptor antagonist GR127935. Circ Res. 2001;89:1231-1239. [PubMed] [DOI] |
| 14. | Chee MS, Bankier AT, Beck S, Bohni R, Brown CM, Cerny R, Horsnell T, Hutchison CA, Kouzarides T, Martignetti JA. Analysis of the protein-coding content of the sequence of human cytomegalovirus strain AD169. Curr Top Microbiol Immunol. 1990;154:125-169. [PubMed] [DOI] |
| 15. | Brown JM, Kaneshima H, Mocarski ES. Dramatic interstrain differences in the replication of human cytomegalovirus in SCID-hu mice. J Infect Dis. 1995;171:1599-1603. [PubMed] [DOI] |
| 16. | Lurain NS, Kapell KS, Huang DD, Short JA, Paintsil J, Winkfield E, Benedict CA, Ware CF, Bremer JW. Human cytomegalovirus UL144 open reading frame: sequence hypervariability in low-passage clinical isolates. J Virol. 1999;73:10040-10050. [PubMed] |
| 17. | 毛 志芹, 黄 英, 孙 梅, 何 蓉, 黄 郁晶, 吉 耀华, 齐 莹, 马 艳萍, 孙 峥嵘, 高 红. 先天性巨结肠患者人类巨细胞病毒UL144基因多态性的研究. 中华微生物和免疫学杂志. 2006;26:348-353. |
| 18. | Penfold ME, Dairaghi DJ, Duke GM, Saederup N, Mocarski ES, Kemble GW, Schall TJ. Cytomegalovirus encodes a potent alpha chemokine. Proc Natl Acad Sci U S A. 1999;96:9839-9844. [DOI] |
| 19. | 何 蓉, 阮 强, 齐 莹, 马 艳萍, 孙 峥嵘, 吉 耀华, 黄 郁晶. 人类巨细胞病毒编码趋化因子HCMV UL146序列在临床低传代分离株中的多态性研究. 中华微生物和免疫学杂志. 2007;27:65-68. |
| 20. | 吉 耀华, 阮 强, 卢 颖, 齐 莹, 何 蓉, 刘 庆, 陈 淑荣, 马 艳萍. 人巨细胞病毒148基因在临床低传代分离株中的多态性研究. 中华实验和临床病毒学杂志. 2004;18:154-157. |
| 21. | 吉 耀华, 阮 强, 何 蓉, 齐 莹, 马 艳萍, 孙 峥嵘, 刘 庆, 陈 淑荣, 周 艳丽. 人类巨细胞病毒149基因在临床低传代分离株中的多态性研究. 中华微生物和免疫学杂志. 2004;24:977-980. |
| 22. | Baggiolini M, Dewald B, Moser B. Human chemokines: an update. Annu Rev Immunol. 1997;15:675-705. [PubMed] [DOI] |
| 23. | Baggiolini M, Loetscher P. Chemokines in inflammation and immunity. Immunol Today. 2000;21:418-420. [PubMed] [DOI] |
| 24. | Clark-Lewis I, Dewald B, Loetscher M, Moser B, Baggiolini M. Structural requirements for interleukin-8 function identified by design of analogs and CXC chemokine hybrids. J Biol Chem. 1994;269:16075-16081. [PubMed] |
| 25. | Mukaida N. Interleukin-8: an expanding universe beyond neutrophil chemotaxis and activation. Int J Hematol. 2000;72:391-398. [PubMed] |
| 27. | Prichard MN, Penfold ME, Duke GM, Spaete RR, Kemble GW. A review of genetic differences between limited and extensively passaged human cytomegalovirus strains. Rev Med Virol. 2001;11:191-200. [PubMed] [DOI] |
| 28. | Stanton R, Westmoreland D, Fox JD, Davison AJ, Wilkinson GW. Stability of human cytomegalovirus genotypes in persistently infected renal transplant recipients. J Med Virol. 2005;75:42-46. [PubMed] [DOI] |
| 29. | Hassan-Walker AF, Okwuadi S, Lee L, Griffiths PD, Emery VC. Sequence variability of the alpha-chemokine UL146 from clinical strains of human cytomegalovirus. J Med Virol. 2004;74:573-579. [PubMed] [DOI] |