修回日期: 2012-11-11
接受日期: 2012-12-20
在线出版日期: 2012-12-28
目的: 探讨结直肠癌(colorectal cancer, CRC)线粒体DNA(mitochondrial DNA, mtDNA)非编码区及编码区的微卫星不稳定.
方法: 选取50例新鲜CRC及相应癌旁组织标本, 提取基因组DNA. 利用荧光标记聚合酶链反应及短重复序列位点扫描的方法, 对线粒体DNA编码区及非编码区微卫星不稳定进行比较分析.
结果: 共检出19例线粒体微卫星不稳定(mitochondrial microsatellite instability, mtMSI), 发生率为38%(19/50), 线粒体非编码区微卫星与编码区微卫星不稳定有显著相关性(P<0.05).
结论: 结直肠癌患者肠黏膜细胞mtDNA中存在较高频率的微卫星不稳定, 在一些结直肠癌的发生中可能起一定作用.
引文著录: 崔海宏, 黄平, 赵婷, 张振华, 徐伟, 王小鹏, 韩英. 结直肠癌线粒体基因组的微卫星不稳定性. 世界华人消化杂志 2012; 20(36): 3811-3815
Revised: November 11, 2012
Accepted: December 20, 2012
Published online: December 28, 2012
AIM: To investigate microsatellite instability in the non-coding region and coding regions of mitochondrial DNA in colorectal cancer.
METHODS: Mitochondrial DNA was extracted from 50 cases of fresh CRC samples and matched tumor-adjacent noncancerous tissue. Fluorescence polymerase chain reaction and short tandem repeat locus scanning were conducted to analyze microsatellite instability.
RESULTS: Mitochondrial DNA microsatellite instability was detected in 19 of 50 (38%) patients with CRC. The microsatellite instability in the non-coding region and coding region of mitochondrial DNA had a significant correlation (χ² = 4.929, P = 0.026).
CONCLUSION: There is a high frequency of microsatellite instability in mitochondrial DNA of CRC patients, and mitochondrial DNA microsatellite instability may play a role in the occurrence of colorectal cancer.
- Citation: Cui HH, Huang P, Zhao T, Zhang ZH, Xu W, Wang XP, Han Y. Mitochondrial DNA microsatellite instability in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3811-3815
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3811.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3811
微卫星不稳定(microsatellite instability, MSI)是指由于复制错误(replication error, RER)引起的简单重复序列增加或丢失. 在肿瘤组织中, 也就是肿瘤与其相应非肿瘤组织相比, 其结构性等位基因的大小发生改变. 其发生主要是由于参与错误修复的基因功能缺陷, 而产生一种缺陷蛋白质, 其不能正常的校正复制错误, 从而引起微卫星DNA的改变, 使其不能正常地发挥调控作用, 导致细胞增殖及分化异常, 促发恶性肿瘤形成. 早期报道在遗传性非息肉性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)连锁的D2S123位点上, 发现微卫星不稳定性[1], 表现为发生(CA)n双核苷酸电泳迁移率的改变, 出现与正常基因组长度不同的等位基因条带以后, 在许多散发性肿瘤中均出现频率不等的MSI, 如结肠癌、胰腺癌、膀胱癌等. MSI包括细胞核MSI和线粒体MSI. 线粒体微卫星不稳定性(mitochondrial microsatellite instability, mtMSI)即线粒体基因组内短的碱基重复序列长度的改变. 有关线粒体基因组微卫星不稳定在结直肠癌发生中的作用, 尚未深入研究. 本研究采用荧光标记聚合酶链反应(PCR)及STR(short tandem repeat)位点扫描的方法, 对结直肠癌组织线粒体微卫星不稳定进行了分析.
收集本院2008-01/2008-06手术切除的50例大肠癌组织, 其中男27例, 女23例, 年龄27-85岁, 平均年龄59.8岁±11.7岁. 手术前均未接受放疗或化疗. 取材后部分标本用10%甲醛固定, 其余立即放置于-80 ℃超低温冰箱保存备用. 将固定的大肠癌及距肿瘤1 cm以上正常黏膜连续冰冻切片20张(5 μm), HE染色, 显微镜下观察, 证实大肠癌组织中肿瘤细胞占70%以上. 全部患者术前均未接受放射治疗和化学治疗. 大肠癌及正常基因组DNA的提取采取酚/氯仿异戊醇提取法.
1.2.1 mtMSI的检测: 选择微卫星位点引物序列见表1[2,3], 由上海英俊公司合成. 荧光PCR反应体积10 μL, 包括10×缓冲液, 1.5 mmol/L MgCl2, 200 μmol/L dNTP, 上下游引物各0.5 μmol/L, 0.75 UTaq DNA多聚酶(宝生物公司)和100 ng基因组DNA. PCR反应条件为起始变性温度94 ℃, 5 min, 以下过程94 ℃ 30 s, 58 ℃ 45 s, 72 ℃ 30 s, 35个循环, 最后72 ℃延伸30 min. 变性后产物经ABIPRISM 3730(Applied Biosystems)毛细管电泳45 min. Datacollection软件自动进行数据收集和处理, 并生成原始的样品数据文件. GeneMarker分析软件对配对产物数据自动分析检测mtMSI阳性率.
| 位置 | 引物 | 重复序列 | 退火温度(℃) | 片段长度(bp) |
| ND1F-FAM | CCGACCTTAGCTCTCACCAT | (C)6 | 55 | 85 |
| ND1R | AATAGGAGGCCTAGGTTGAG | |||
| ND2F-TET | CCTGAGTAGGCCTAGAAATAAA | (A)7 | 55 | 90 |
| ND2R | ACTTGATGGCAGCTTCTGTG | |||
| COIIIF-FAM | CCAAAAAGGCCTTCGATACG | (T)7 | 57 | 96 |
| COIIIR | GCTAGGCTGGAGTGGTAAAA | |||
| ND5-1F-ROX | CACCCTGACCCTGACTTCC | (C)6and(A)8 | 57 | 106 |
| ND5-1R | GGTGGATGCGACAATGGATT | |||
| ND5-2F-FAM | GCCCTTCTAAACGCTAATCC | (CCT)3&(AGC)3 | 58 | 93 |
| ND5-2R | TCAGGGGTGGAGACCTAATT | |||
| D303F-FAM | GCACAGCCACTTTCCACA | (C)7 | 55 | 106 |
| D303R | TTTTGGGGTTTGGCAGAG | |||
| D514F-FAM | TCCCATACTACTAATCTCA | (CA)8 | 55 | 102 |
| D514R | TGTCTTTGGGGTTTGGTT | |||
| D16184F-FAM | AAAACCCAATCCACATCA | (C)9 | 55 | 105 |
| D16184R | GGTGAGGGGTGGCTTTGG |
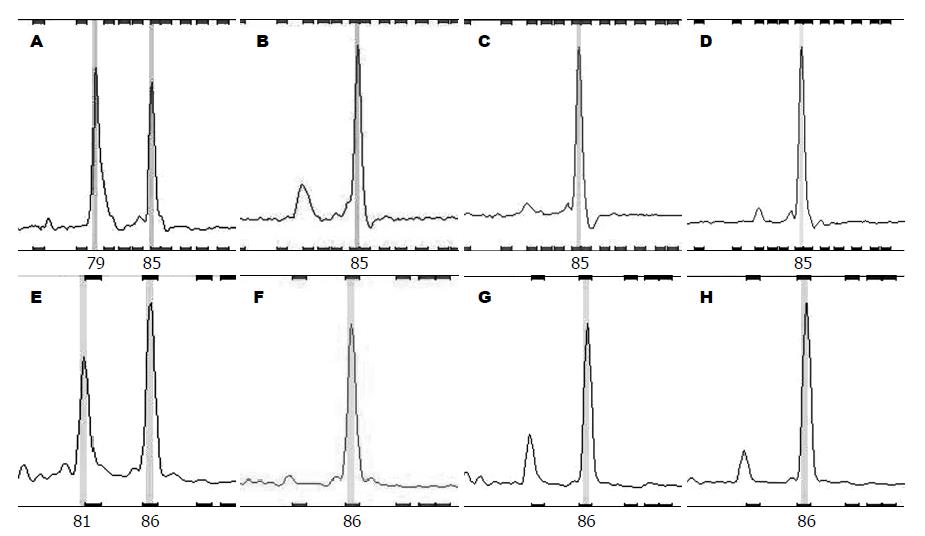
1.2.2 数据处理: 荧光扫描结果用GeneMarker V1.7(Applied Biosystems, Inc.)软件进行基因型判读. 肿瘤组织与正常组织相对照, 出现条带的迁移、缺失或电泳图的形状改变判为MSI.
统计学处理 实验数据分析采用χ2 Pearson检验, 单向有序等级资料的非参数检验,使用SPSS16.0统计学分析软件进行处理, P<0.05时认为有显著性差异.
对3个线粒体非编码区及5个线粒体编码区微卫星位点检测结果显示(图1, 图2): 共检出mtMSI 19例, 发生率为38%(19/50), 1例升结肠癌患者全部位点均阳性, 11例患者D303阳性, 2例患者D514阳性, 2例患者D16184位点阳性, 6例患者ND1阳性, 2例患者ND2阳性, 1例患者COⅢ阳性, 2例患者ND5-1阳性, 8例患者ND5-2阳性. 根据卡方检验, 线粒体非编码区微卫星与编码区微卫星不稳定有显著相关性χ2 = 4.929, P = 0.026(表2).
| 编号 | 线粒体微卫星位点 | |||||||
| ND1 | ND2 | COIII | ND5-1 | ND5-2 | D310 | D514 | D16184 | |
| 1 | + | + | ||||||
| 2 | + | + | + | + | + | + | + | + |
| 4 | + | + | ||||||
| 9 | + | |||||||
| 13 | + | |||||||
| 14 | + | + | ||||||
| 17 | + | + | ||||||
| 18 | + | |||||||
| 20 | + | |||||||
| 24 | + | |||||||
| 25 | + | + | + | |||||
| 30 | + | |||||||
| 32 | + | |||||||
| 37 | + | |||||||
| 40 | + | |||||||
| 41 | + | |||||||
| 43 | + | |||||||
| 45 | + | + | + | |||||
| 49 | + | |||||||
| 合计 | 6 | 2 | 1 | 2 | 8 | 11 | 2 | 2 |
微卫星DNA可能参与基因表达调控、基因重排与变异、维持基因组稳定等重要生命活动. 他具有以下特点: (1)微卫星重复单位数目的改变可以引起高度多态性, 微卫星位点在不同个体间有明显的差异; (2)微卫星具有较高程度的不稳定性, 且在遗传上高度保守, 在家系中可以稳定地传递, 是一种很好的遗传标志; (3)微卫星有较高突变率, 容易引发线粒体病和癌症. 微卫星异常是基因组不稳定的重要分子标志. 主要表现为: 微卫星不稳定性; 杂合性丢失(loss of heterozygosity, LOH). 微卫星不稳定性(microsatellite instability, MSI)与肿瘤之间的关系是近年来肿瘤学研究的热点之一, 产生微卫星不稳定性的机制及其与肿瘤发生发展关系得到深入研究[4,5]. 微卫星的不稳定产生的主要原因: (1)DNA损伤, 包括点突变、缺失、串联重复、碱基替代和移码突变等变异; (2)滑链错配(slipped- strand mispairing), 即复制时l条DNA链发生滑动错误(slippage), 导致重复序列中1个或多个碱基的错误配对, 使微卫星结构区域发生改变; (3)错配修复基因(mis-match repair, MMR)功能缺陷. 不能正常地发挥修复作用, 导致基因组不稳定; (4)不等价交换(unequal crossing-over)使重复拷贝数目发生变化, 表现为微卫星简单重复序列的增加或丢失. 目前发现的参与错配修复功能的基因有6个: hMSH2、hMSH6(GTBP)、hMSH3、hMLH1、hPMS1、hPMS2[6]. 有学者认为, MSI是错配修复缺陷的标志, 而错配修复缺陷可能使癌基因、抑癌基因及一些对细胞生长起调控作用的基因的复制错误得不到修复, 从而使细胞生长失控, 最终发生肿瘤. 在胃肠道肿瘤, 高频率微卫星不稳定肿瘤几乎均表现为BAT-26改变, 故BAT25、BAT26为研究结直肠癌MSI的首选位点[7].
MSI包括细胞核MSI和线粒体MSI. 人类基因组中以双核苷酸重复, 即(CA)n和(GT)n最多. 总共有5×104-5×105个, 平均每5-50 kb DNA就存在1个(CA)n. 微卫星多位于基因非编码区, 即基因内含子或非翻译区, 但在编码序列及外显子也可找到. 其高度多态性主要来源于重复数目的不同. 在微卫星区域出现的突变率远高于非重复DNA序列. 大量研究表明: 在许多肿瘤中核MSI和肿瘤的临床特征有密切的联系. 一些研究证明: 核MSI与肿瘤细胞的生存优势有显著的相关性, 而与肿瘤的转移能力呈负相关[8]. 线粒体是细胞核外唯一的遗传物质, 他只有37个基因, 核基因组编码线粒体的大约900个基因产物, 随即送到细胞浆中. 线粒体也存在微卫星位点, 所以可能受控于核基因组的调控[9]. mtMSI被定义为线粒体基因组内短的碱基重复序列长度的变化. 线粒体基因组中含有多个单和双核苷酸重复序列(mono-and dinucleotide repeats), 即微卫星位点. 线粒体微卫星位点重复次数较核基因组少的多, 一般为7-9次. 用来检测线粒体基因组非编码区不稳定性最常用的位点为: D303、D514和D16184位. 但在编码区也存在微卫星位点. Santos等的研究表明mtDNA D-环区的突变与编码区的突变有关, 从而影响线粒体的功能[10]. 在MMR缺陷细胞中, MSI发生在非编码区通常被认为是与生物学无关, 属于中性突变, 但近期很多学者认为非编码区调控编码区的转录和转录和翻译, 也有重要作用. 所以微卫星序列在非编码区及编码区域中发生插入或缺失几个核酸碱基均被认为是肿瘤形成的重要分子机制[11]. 通过核酸碱基的插入或缺失促使大量的包括控制细胞增殖和存活的基因移码突变, 在负性选择的压力下, 可使细胞向恶性转变.
mtMSI在肿瘤的发生发展过程中可能也起一定作用. Habano等[12]最近报道, 在一些胃癌中, 核MSI与线粒体DNA(PolyC)n重复区的微卫星不稳定有关. 同时还发现, 线粒体微卫星不稳定与线粒体基因突变有相关性. 到目前为止, 在前列腺癌、胃癌、乳腺癌、肝癌中, mtMSI被发现是一个非常普遍的现象, 被认为在这些恶性肿瘤的癌变过程中起重要作用[13-16]. 然而, 有关线粒体基因组微卫星不稳定在结直肠癌的发生率, 以及用多重荧光PCR方法检测编码区及非编码区MSI未见文献报道. 在本研究中, 我们分析了50例结直肠癌样本及对照的正常组织, 共检出mtMSI 19例(占总数的38%), mtMSI发生率低于乳腺癌中的42.5%[17]而高于肝癌中的21.2%[16]、胃癌中的16%[12]. 线粒体微卫星不稳定检出率高于以往我们研究的核基因组中的发生率[18]. mtMSI编码区MSI高发于ND1及ND5-2位点. 可能表明mtMSI显型的结直肠癌患者中有线粒体基因组(ND1及ND5)不稳定的倾向. ND1及ND5是线粒体呼吸链中重要分子, 不稳定的编码基因表达异常, 可直接或间接地为线粒体的复制或细胞的增殖提供选择性的生长优势. 我们研究发现编码区mtMSI与非编码区mtMSI有相关性, 可能是机体内存在错配修复基因产生的缺陷蛋白, 可同时引起非编码区及编码区的基因发生微卫星不稳定. 因非编码区调控编码区基因的转录和翻译, 可能对线粒体的功能产生影响. 研究认为线粒体基因组的不稳定或突变影响了线粒体的呼吸功能, 释放高水平的氧化物而致细胞核肿瘤相关基因的损伤或突变, 另一途径影响线粒体对细胞凋亡的调控功能而致细胞恶变. 上述结果说明, 线粒体微卫星不稳定也以较高比例存在于结直肠癌中, 在一些结直肠癌的发生中可能起一定作用. 在今后的研究中, 我们将对肿瘤细胞线粒体的功能异常做进一步探讨, 证实基因的突变对其细胞器功能的影响.
微卫星不稳定性与肿瘤之间的关系是近年来肿瘤学研究的热点之一, 结肠癌细胞中线粒体基因组微卫星不稳定的情况, 也值得进行深入研究.
赵春玲, 副教授, 潍坊医学院细胞生物学教研室
线粒体微卫星不稳定以较高比例存在于结直肠癌中, 在一些结直肠癌的发生中可能起一定作用. 在今后的研究中, 我们将对肿瘤细胞线粒体的功能异常做进一步探讨, 证实基因的突变对其细胞器功能的影响.
多项研究证明, 各种实体瘤中, 均存在线粒体DNA的微卫星不稳定的现象, 其被认为在这些恶性肿瘤的癌变过程中起重要作用.
本研究采用荧光标记聚合酶链反应及短重复序列位点扫描的方法, 对线粒体DNA编码区及非编码区微卫星不稳定进行比较分析, 从而发现结肠癌细胞中线粒体基因不稳定的情况, 为结肠癌的研究提供理论依据.
本研究发现结肠癌细胞线粒体DNA的非编码区及编码区均存在微卫星不稳定,为揭示结肠癌的发病机制奠定基础.
微卫星不稳定性与肿瘤的发生发展关系密切, 该研究符合伦理学要求, 比较新颖, 有一定的意义.
编辑: 田滢 电编:鲁亚静
| 1. | Aaltonen LA, Peltomäki P, Leach FS, Sistonen P, Pylkkänen L, Mecklin JP, Järvinen H, Powell SM, Jen J, Hamilton SR. Clues to the pathogenesis of familial colorectal cancer. Science. 1993;260:812-816. [PubMed] [DOI] |
| 2. | Boland CR, Thibodeau SN, Hamilton SR, Sidransky D, Eshleman JR, Burt RW, Meltzer SJ, Rodriguez-Bigas MA, Fodde R, Ranzani GN. A National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition: development of international criteria for the determination of microsatellite instability in colorectal cancer. Cancer Res. 1998;58:5248-5257. [PubMed] |
| 3. | Habano W, Nakamura S, Sugai T. Microsatellite instability in the mitochondrial DNA of colorectal carcinomas: evidence for mismatch repair systems in mitochondrial genome. Oncogene. 1998;17:1931-1937. [PubMed] [DOI] |
| 4. | Iacopetta B, Grieu F, Amanuel B. Microsatellite instability in colorectal cancer. Asia Pac J Clin Oncol. 2010;6:260-269. [PubMed] [DOI] |
| 5. | Boland CR, Goel A. Microsatellite instability in colorectal cancer. Gastroenterology. 2010;138:2073-2087.e3. [PubMed] |
| 6. | Worthley DL, Leggett BA. Colorectal cancer: molecular features and clinical opportunities. Clin Biochem Rev. 2010;31:31-38. [PubMed] |
| 7. | Deschoolmeester V, Baay M, Wuyts W, Van Marck E, Van Damme N, Vermeulen P, Lukaszuk K, Lardon F, Vermorken JB. Detection of microsatellite instability in colorectal cancer using an alternative multiplex assay of quasi-monomorphic mononucleotide markers. J Mol Diagn. 2008;10:154-159. [PubMed] [DOI] |
| 8. | Corso G, Pedrazzani C, Marrelli D, Pascale V, Pinto E, Roviello F. Correlation of microsatellite instability at multiple loci with long-term survival in advanced gastric carcinoma. Arch Surg. 2009;144:722-727. [PubMed] [DOI] |
| 9. | Gryfe R, Kim H, Hsieh ET, Aronson MD, Holowaty EJ, Bull SB, Redston M, Gallinger S. Tumor microsatellite instability and clinical outcome in young patients with colorectal cancer. N Engl J Med. 2000;342:69-77. [PubMed] [DOI] |
| 10. | Santos C, Montiel R, Arruda A, Alvarez L, Aluja MP, Lima M. Mutation patterns of mtDNA: empirical inferences for the coding region. BMC Evol Biol. 2008;8:167. [PubMed] [DOI] |
| 11. | Gologan A, Krasinskas A, Hunt J, Thull DL, Farkas L, Sepulveda AR. Performance of the revised Bethesda guidelines for identification of colorectal carcinomas with a high level of microsatellite instability. Arch Pathol Lab Med. 2005;129:1390-1397. [PubMed] |
| 12. | Habano W, Sugai T, Nakamura SI, Uesugi N, Yoshida T, Sasou S. Microsatellite instability and mutation of mitochondrial and nuclear DNA in gastric carcinoma. Gastroenterology. 2000;118:835-841. [PubMed] [DOI] |
| 13. | Jerónimo C, Nomoto S, Caballero OL, Usadel H, Henrique R, Varzim G, Oliveira J, Lopes C, Fliss MS, Sidransky D. Mitochondrial mutations in early stage prostate cancer and bodily fluids. Oncogene. 2001;20:5195-5198. [PubMed] [DOI] |
| 14. | Jeong CW, Lee JH, Sohn SS, Ryu SW, Kim DK. Mitochondrial microsatellite instability in gastric cancer and gastric epithelial dysplasia as a precancerous lesion. Cancer Epidemiol. 2010;34:323-327. [PubMed] [DOI] |
| 15. | Alazzouzi H, Farriol M, Espín E, Armengol M, Pena M, Zeh K, Schwartz S, Schwartz S. Molecular patterns of nuclear and mitochondrial microsatellite alterations in breast tumors. Oncol Rep. 2003;10:1561-1567. [PubMed] |
| 17. | Richard SM, Bailliet G, Páez GL, Bianchi MS, Peltomäki P, Bianchi NO. Nuclear and mitochondrial genome instability in human breast cancer. Cancer Res. 2000;60:4231-4237. [PubMed] |