修回日期: 2012-12-07
接受日期: 2012-12-20
在线出版日期: 2012-12-28
目的: 探讨原发性食管鳞癌(esophageal squamous cell carcinoma, ESCC)组织中mir-21的表达及其与ESCC临床病理行为的关系.
方法: 应用Real-time RT-PCR法及2-∆∆CT分析法检测ESCC患者组织及相对应癌旁组织中mir-21的表达及其与ESCC临床病理行为的关系.
结果: 96例ESCC标本中, 40例(41.6%)mir-21存在高表达, mir-21高表达与患者分化程度、淋巴结转移及TNM分期密切相关(均P<0.05).
结论: 在原发性ESCC中, mir-21有较高的表达率, 与肿瘤的分化程度、淋巴结转移及TNM分期密切相关, 可能在ESCC的发生发展中有重要作用.
引文著录: 赵俊刚, 任开明, 汤隽, 张磊. mir-21在食管鳞癌中的表达及其与临床病理行为的关系. 世界华人消化杂志 2012; 20(36): 3773-3776
Revised: December 7, 2012
Accepted: December 20, 2012
Published online: December 28, 2012
AIM: To investigate mir-21 expression in esophageal squamous cell carcinoma (ESCC) and to analyze its relationship with the clinical and pathological features of ESCC.
METHODS: Real-time RT-PCR and the 2-∆∆CT method were used to detect the expression of mir-21 in 96 cases of ESCC and tumor-adjacent tissue. The relationship between expression of mir-21 and clinical and pathological features of ESCC was analyzed.
RESULTS: Of 96 cases of ESCC specimens, mir-21 was highly expressed in 40 cases (41.6%). High mir-21 expression was closely related with the degree of tumor differentiation and TNM stage (both P < 0.05).
CONCLUSION: The high expression of mir-21 may play an important role in the occurrence and development of ESCC.
- Citation: Zhao JG, Ren KM, Tang J, Zhang L. Relationship between mir-21 expression and clinical and pathological features of esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3773-3776
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3773.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3773
食管癌是世界范围内第6大导致死亡的恶性肿瘤, 在我国居第1位, 并且80%以上是食管鳞癌(esophageal squamous cell carcinoma, ESCC), 随着基础及临床研究的进展, ESCC的治疗有一定进步, 但术后生存率仍不容乐观[1,2]. MicroRNAs(miRNAs)是最近发现的一组天然丰富的小RNA, 长度为17-25个核苷酸[3]. 大量研究提示及证实miRNAs在恶性肿瘤的发生发展中扮演重要角色[4]. mir-21是miRNAs家族成员, 有研究表明mir-21与恶性肿瘤的发生发展关系密切[5,6], 但mir-21与ESCC的关系尚不明确. 本研究运用Real-time RT-PCR及2-∆∆Ct分析法, 检测96例ESCC组织及相对应癌旁组织中mir-21的表达变化, 探讨ESCC患者组织中mir-21的表达情况及其与ESCC临床病理行为的关系.
收集2006-09/2011-09中国医科大学附属盛京医院胸外科食管癌手术切除标本96例. 癌旁组织取自距肿瘤边缘5 cm以上食管黏膜组织, 并且经病理诊断证实为癌旁正常食管组织. 其中男69例, 女27例, 年龄42-79岁(中位年龄63.2岁). 按照国际抗癌联盟(UICC)2009年标准, 高中分化71例, 低分化25例. 病变位于食管上中段27例, 下段69例. 伴有淋巴结转移53例, 无淋巴结转移43例. TNM分期Ⅰ/Ⅱ期45例, Ⅲ/Ⅳ期51例. 全部肿瘤标本术后病理诊断为鳞状细胞癌, 所有患者术前未接受放化疗. 上述组织切除后, 用液氮冷冻并放置于-80 ℃冰箱中备用. RNA提取试剂盒购自QiQgen公司; 反转录试剂盒购自Promega(美国)公司; RT-PCR试剂盒购自TakaRa(日本)公司, 引物由南京金斯瑞公司提供.
总RNA提取和Real-time RT-PCR检测mir-21的表达: 总RNA采用TRIzol reagent提取, 按照说明书的操作方法进行常规操作; 然后使用RevertAidTM reverse transcriptase将这些RNA样品逆转录为cDNA. 然后进行PCR扩增, 反应条件: 50 ℃ 2 min, 95 ℃ 10 min, 95 ℃ 15 s, 50个循环, 60 ℃ 1 min. GAPDH作为内参, 上游引物: 5'-CAATGACCCCTTCATTGACC-3', 下游引物: 5'-TGGAAGATGGTGATGGGATT-3'; mir-21上游引物: 5'-TGACCACAGTCCATGCCATC-3', 下游引物: 5'-CCACCCTGTTGCTGTAGCC-3'.
统计学处理 GAPDH mRNA作为内参来监控, 通过2-∆∆Ct法计算ESCC与癌旁组织胞之间目标miRNA表达水平的差异, mir-21的mRNA水平表示为2-∆∆Ct, 其中∆Ct = Ct(mir-21)-Ct(GAPDH), ∆∆Ct = ∆Ct(肿瘤组织)-∆Ct(正常组织). 采用SPSS11.5统计学软件, 使用Student's t-test进行数据统计. 以P<0.05判定有显著统计学意义.
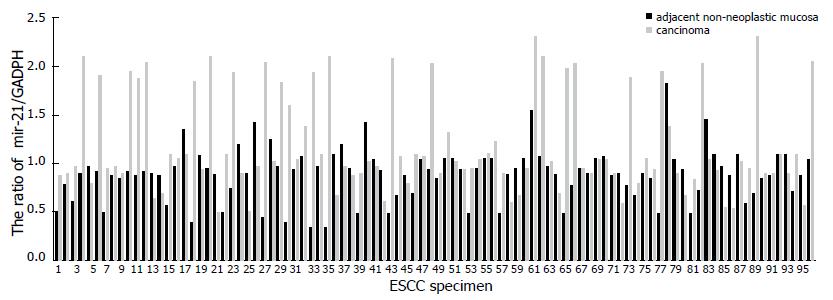
我们通过Real- time RT-PCR方法检测了96例ESCC标本组织及相对应癌旁组织中mir-21的表达情况, 在96例ESCC标本中有40例(41.6%)出现了相对于癌旁组织的mir-21高表达(∆∆Ct<-1). 14例(14.6%)出现了低表达(∆∆Ct>1), 42例(43.7%)表达无明显差异(-1<∆∆Ct<1); mir-21在ESCC及相对应癌旁组织中的表达差异有统计学意义(P<0.05, 图1).
经统计学分析发现, mir-21的高表达与患者分化程度、淋巴结转移及TNM分期密切相关, 有淋巴结转移的ESCC标本中mir-21的表达明显高于无淋巴结转移组(χ2 = 5.913, P<0.05), 低分化组ESCC标本中mir-21的表达明显高于高分化组(χ2 = 5.647, P<0.05), 与患者的年龄、性别和肿瘤的位置无关(表1).
| 临床资料 | n | mean±SD | P值 |
| 年龄(岁) | >0.05 | ||
| ≥60 | 63 | 0.9927±0.1312 | |
| <60 | 33 | 0.7275±0.2039 | |
| 性别 | >0.05 | ||
| 男 | 69 | 0.9735±0.1513 | |
| 女 | 27 | 0.8279±0.1987 | |
| 分化程度 | 0.039 | ||
| 低 | 25 | 1.5031±0.5832 | |
| 中、高 | 71 | 0.7402±0.0401 | |
| 肿瘤位置 | >0.05 | ||
| 食管上中段 | 27 | 1.2135±0.4423 | |
| 下段 | 69 | 1.0321±0.2578 | |
| 淋巴转移 | 0.026 | ||
| N0 | 43 | 0.8313±0.0399 | |
| N1/N2 | 53 | 1.6234±0.7232 | |
| TNM分期 | 0.017 | ||
| Ⅰ/Ⅱ | 45 | 1.3372±0.4989 | |
| Ⅲ/Ⅳ | 51 | 1.5343±0.5129 |
许多miRNA可作为原癌基因或抑癌基因, 在肿瘤的发生发展中扮演着重要的角色[7,8], 其中mir-21最受人重视[9,10], 大量实验证明在多种肿瘤细胞中mir-21的表达均出现显著异常, 揭示mir-21作为一个致癌的miRNA[11], 在多种肿瘤的发生发展中起重要作用, mir-21可以抑制细胞凋亡而促进肿瘤增殖[12,13].
Wong等[14]发现, 在原发性胶质母细胞瘤组织中mir-21表达上调, 证明mir-21不仅影响神经胶质瘤的形成, 还能抑制神经胶质瘤对化疗药物的敏感性. Kurashige等[15]发现ESCC患者血清中mir-21表达下调, 化疗敏感者mir-21的水平明显下降, 提示血清mir-21的表达水平可能成为潜在的ESCC诊断生物标志物, 也可能作为化疗的反应标志物.
本研究采用Real-time RT-PCR法检测了96例ESCC患者组织中及相对应癌旁组织中mir-21的表达, 并用2-∆∆Ct分析法分析96例ESCC患者组织及癌旁组织中mir-21的表达差异情况. 结果显示, 相对于癌旁组织, 96例ESCC标本中有40例(41.6%)出现mir-21的高表达, mir-21在ESCC及相对应癌旁组织中的表达差异有统计学意义. 研究结果表明, 在原发性ESCC中, mir-21有较高的表达率, 与肿瘤的分化程度、淋巴结转移及TNM分期密切相关, mir-21基因在ESCC发生发展中可能扮演着癌基因的角色.
mir-21与ESCC的关系的研究尚处于初步阶段, 对其深入研究有助于ESCC发生发展机制的探索, 将可能为ESCC的早期诊断、临床诊疗、提高化疗敏感性、提供更多理论依据[16-18].
miRNAs在恶性肿瘤的发生发展中扮演重要角色. mir-21是miRNAs家族成员, 有研究表明mir-21与恶性肿瘤的发生发展关系密切, 但mir-21与ESCC的关系尚不明确.
姜春萌, 教授, 主任, 大连医科大学附属第二医院消化科; 郭炜, 教授, 河北医科大学第四医院河北省肿瘤研究所病理研究室; 李瑗, 教授,广西肿瘤研究所实验研究部
本研究运用Real- time RT-PCR及2-∆∆Ct分析法, 检测96例ESCC组织及相对应癌旁组织中mir-21的表达变化, 探讨原发性ESCC患者组织中mir-21的表达情况及其与ESCC临床病理行为的关系.
Wong等发现, 在原发性胶质母细胞瘤组织中mir-21表达上调, 证明mir-21不仅影响神经胶质瘤的形成, 还能抑制神经胶质瘤对化疗药物的敏感性.
探讨原发性ESCC患者组织中mir-21的表达情况及其与ESCC临床病理行为的关系.
mir-21与ESCC的关系的研究尚处于初级阶段, 对其深入研究有助于ESCC发生发展机制的探索, 将可能为ESCC的早期诊断、临床诊疗、提高化疗敏感性、提供更多理论依据.
本文探讨食管鳞癌组织中mir-21的表达及其与ESCC临床病理行为的关系, 文章有一定的新颖性、科学性和可读性.
编辑: 李军亮 电编:鲁亚静
| 1. | Hao M, Chen X, Zhang T, Shen T, Xie Q, Xing X, Gu H, Lu F. Impaired nuclear export of tumor-derived c-terminal truncated cyclin D1 mutant in ESCC cancer. Oncol Lett. 2011;2:1203-1211. [PubMed] |
| 2. | Hasan R, Chauhan SS, Sharma R, Ralhan R. siRNA-mediated downregulation of TC21 sensitizes esophageal cancer cells to cisplatin. World J Gastroenterol. 2012;18:4127-4135. [PubMed] [DOI] |
| 3. | Das N. MicroRNA Targets - How to predict? Bioinformation. 2012;8:841-845. [PubMed] [DOI] |
| 4. | Wan SM, Lv F, Guan T. Identification of genes and microRNAs involved in ovarian carcinogenesis. Asian Pac J Cancer Prev. 2012;13:3997-4000. [PubMed] |
| 5. | Kanaan Z, Rai SN, Eichenberger MR, Roberts H, Keskey B, Pan J, Galandiuk S. Plasma miR-21: a potential diagnostic marker of colorectal cancer. Ann Surg. 2012;256:544-551. [PubMed] [DOI] |
| 6. | Han M, Wang Y, Liu M, Bi X, Bao J, Zeng N, Zhu Z, Mo Z, Wu C, Chen X. MiR-21 regulates epithelial-mesenchymal transition phenotype and hypoxia-inducible factor-1α expression in third-sphere forming breast cancer stem cell-like cells. Cancer Sci. 2012;103:1058-1064. [PubMed] [DOI] |
| 8. | Leonardo TR, Schultheisz HL, Loring JF, Laurent LC. The functions of microRNAs in pluripotency and reprogramming. Nat Cell Biol. 2012;14:1114-1121. [PubMed] [DOI] |
| 10. | Bose D, Jayaraj G, Suryawanshi H, Agarwala P, Pore SK, Banerjee R, Maiti S. The tuberculosis drug streptomycin as a potential cancer therapeutic: inhibition of miR-21 function by directly targeting its precursor. Angew Chem Int Ed Engl. 2012;51:1019-1023. [PubMed] [DOI] |
| 11. | Li Y, Li W, Ouyang Q, Hu S, Tang J. Detection of lung cancer with blood microRNA-21 expression levels in Chinese population. Oncol Lett. 2011;2:991-994. [PubMed] |
| 12. | Tavano F, di Mola FF, Piepoli A, Panza A, Copetti M, Burbaci FP, Latiano T, Pellegrini F, Maiello E, Andriulli A. Changes in miR-143 and miR-21 expression and clinicopathological correlations in pancreatic cancers. Pancreas. 2012;41:1280-1284. [PubMed] [DOI] |
| 13. | Han L, Yue X, Zhou X, Lan FM, You G, Zhang W, Zhang KL, Zhang CZ, Cheng JQ, Yu SZ. MicroRNA-21 expression is regulated by β-catenin/STAT3 pathway and promotes glioma cell invasion by direct targeting RECK. CNS Neurosci Ther. 2012;18:573-583. [PubMed] [DOI] |
| 14. | Wong ST, Zhang XQ, Zhuang JT, Chan HL, Li CH, Leung GK. MicroRNA-21 inhibition enhances in vitro chemosensitivity of temozolomide-resistant glioblastoma cells. Anticancer Res. 2012;32:2835-2841. [PubMed] |
| 15. | Kurashige J, Kamohara H, Watanabe M, Tanaka Y, Kinoshita K, Saito S, Hiyoshi Y, Iwatsuki M, Baba Y, Baba H. Serum microRNA-21 is a novel biomarker in patients with esophageal squamous cell carcinoma. J Surg Oncol. 2012;106:188-192. [PubMed] [DOI] |
| 16. | Cai EH, Gao YX, Wei ZZ, Chen WY, Yu P, Li K. Serum miR-21 expression in human esophageal squamous cell carcinomas. Asian Pac J Cancer Prev. 2012;13:1563-1567. [PubMed] [DOI] |
| 17. | Zhu L, Yan W, Rodriguez-Canales J, Rosenberg AM, Hu N, Goldstein AM, Taylor PR, Erickson HS, Emmert-Buck MR, Tangrea MA. MicroRNA analysis of microdissected normal squamous esophageal epithelium and tumor cells. Am J Cancer Res. 2011;1:574-584. [PubMed] |