修回日期: 2012-11-15
接受日期: 2012-12-20
在线出版日期: 2012-12-28
目的: 比较培美曲塞腹腔用药与静脉用药两种途径对荷H22腹水瘤小鼠恶性腹水的抑制作用.
方法: ♂昆明小鼠腹腔内注射密度为1×107/mL H22瘤细胞悬液0.2 mL(含H22细胞数2×106)制备恶性腹水小鼠模型. 小鼠造模为第0天, 荷瘤小鼠出现腹水(第5天)后立即按体质量随机分成3组, 每组18只. 分别为: 空白对照组(等体积生理盐水, 腹腔用药)、培美曲塞腹腔用药组(培美曲塞300 mg/kg, 腹腔用药)、培美曲塞静脉用药组(培美曲塞300 mg/kg, 静脉用药), 用药时间均为d 5、d 8. 每天测量小鼠的体质量、腹围, 并观察其日常生活状态, 第11天处死各组8只小鼠测量腹水量. 其余剩下小鼠观察其生存时间, 计算生命延长率.
结果: 空白对照组、培美曲塞腹腔用药及静脉用药组小鼠腹水量分别为15.74 mL±1.71 mL、13.31 mL±2.45 mL、8.58 mL±1.89 mL. 与空白对照组比较, 培美曲塞用药两组小鼠腹水量均可减少(P<0.05), 但培美曲塞静脉用药组小鼠腹水量明显较培美曲塞腹腔用药组减少(P<0.01). 培美曲塞腹腔用药及静脉用药组小鼠平均生存时间分别为15.10 d±0.46 d、17.90 d±0.71 d, 较空白对照组14.20 d±0.44 d延长, 生命延长率分别为6.34%、26.06%. 培美曲塞腹腔用药组小鼠生存时间与空白对照组无差异(P>0.05), 而培美曲塞静脉用药组与空白对照组及培美曲塞腹腔用药组比较, 均可明显延长小鼠生存时间(P<0.01).
结论: 培美曲塞腹腔用药途径治疗荷H22腹水瘤小鼠疗效并不优于传统静脉用药.
引文著录: 李永强, 潘琦津, 刘志辉, 胡晓桦, 廖小莉, 黄世庆. 利用荷H22腹水瘤小鼠恶性腹水模型比较培美曲塞腹腔用药与静脉用药的疗效. 世界华人消化杂志 2012; 20(36): 3767-3772
Revised: November 15, 2012
Accepted: December 20, 2012
Published online: December 28, 2012
AIM: To compare the effectiveness of intraperitonea and intravenous administration of pemetrexed (PEM) in the management of malignant ascites in mice bearing hepatoma-22 (H22).
METHODS: A mouse model of ascites was established by intraperitoneal injection of 0.2 mL of H22 cell suspension (at a density of 1 × 107/mL cells). The mice were randomly divided into three groups at random on day 5 after induction of ascites (n = 18 per group): normal control group (normal saline), intraperitoneal pemetrexed group (PEM 300 mg/kg), and intravenous pemetrexed group (PEM 300 mg/kg). Pemetrexed was injected intraperitoneally or intravenously on days 5 and 8. The body weight, abdomen circumference and behavior of the mice were measured daily. Eight mice of each group were sacrificed on day 11 to measure the volume of ascites. The survival time of rest mice were recorded.
RESULTS: The mean volumes of ascites in the normal control group, intraperitoneal pemetrexed group and intravenous pemetrexed group were 15.74 mL ± 1.71 mL, 13.31 mL ± 2.45 mL and 8.58 mL ± 1.89 mL, respectively. In comparison to the normal control group, the two pemetrexed treatment group had significantly less production of ascites in (both P < 0.05). The mean volume of ascites in the intraperitoneal pemetrexed group was significantly lower than that in the intravenous administration group (P < 0.01). The mean survival times of mice in the intraperitoneal pemetrexed group, intravenous pemetrexed group, and normal control group were 15.10 d ± 0.46 d, 17.90 d ±0.71 d, and 14.20 d ± 0.44 d, respectively. The survival time was prolonged by 6.34% and 26.06% in the intraperitoneal pemetrexed group and intravenous pemetrexed group compared to the normal control group. There was no significant difference in the survival time between the intraperitoneal pemetrexed group and normal control group (P > 0.05), but the mean survival time was significantly longer in the intravenous pemetrexed group than in the normal control group and intraperitoneal pemetrexed group (both P < 0.01).
CONCLUSION: Intraperitoneal administration of pemetrexed is not superior to traditional intravenous administration in the management of malignant ascites in mice bearing ascitic hepatoma-22.
- Citation: Li YQ, Pan QJ, Liu ZH, Hu XH, Liao XL, Huang SQ. Efficacy of intraperitoneal versus intravenous pemetrexed administration in management of malignant ascites in mice bearing ascitic hepatoma-22. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3767-3772
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3767
培美曲塞(pemetrexed, PEM)为新型多靶点抗代谢类药物, 其在晚期恶性胸膜间皮瘤、晚期非小细胞肺癌化疗中得到广泛应用, 且在腹部肿瘤(如结肠癌、胰腺癌、胃癌、卵巢癌等)中亦显示出抗瘤作用[1]. 晚期腹部肿瘤常出现腹腔扩散, 而腹腔内化疗在腹部肿瘤中治疗中占有重要地位, 其与系统化疗相比, 具有腹腔药物高浓度及系统低浓度的优点而提高疗效及降低全身不良反应[2]. 然而, 并非所有化疗药物均适合腹腔内给药, 理想腹腔内使用药物应具备以下特点: 对腹膜刺激小、高分子量、低脂溶性、不需肝脏活化、能直接或通过肿瘤组织内代谢杀死肿瘤细胞[3]. 目前基础研究认为培美曲塞的药理学特点符合上述条件, 其可用于腹腔内用药[4]. 但培美曲塞腹腔用药的研究现仅处于药理学研究阶段, 目前国内外尚无培美曲塞腹腔用药与静脉用药的药效学比较研究报道. 本研究利用荷H22腹水瘤小鼠恶性腹水模型, 旨在比较培美曲塞腹腔用药与静脉用药两种途径对荷H22腹水瘤小鼠恶性腹水的抑制作用.
培美曲塞二钠(江苏豪森), 台盼蓝(Sigma), 叶酸(Sigma). 净化工作台(苏州净化), 台式离心机(上海安亭), 倒置显微镜(南京江南). SPF级♂昆明(KM)小鼠54只, 4-5周龄, 体质量16-18 g, 由广西医科大学实验动物中心提供, 动物许可证号: SCXK桂2011-0003. 荷肝癌H22腹水瘤模型小鼠购自广西中医药研究所, 现由本实验室KM小鼠腹腔内接种保存. 实验小鼠饲养于室温24 ℃±2 ℃, 相对湿度40%-60%, 12 h光照、12 h黑暗的实验室中, 自由摄取食物和水. 动物适应性饲养3 d, 实验过程中喂食小鼠标准颗粒饲料(购自广西医科大学实验动物中心)并给予叶酸15 mg/(kg•d)灌胃.
1.2.1 荷鼠肝癌H22腹水瘤小鼠模型的制作: 取传代第7天荷鼠肝癌H22腹水瘤模型小鼠1只, 颈椎脱臼法处死, 于超净台下无菌操作吸取小鼠腹腔乳白色瘤液3 mL, 移入离心管离心(1 000 r/min, 5 min), 收集H22细胞. 用生理盐水轻轻吹打后离心(1 000 r/min, 5 min), 弃上清, 生理盐水调整瘤细胞悬液浓度为1×107/mL, 经0.4%台盼蓝染色镜检细胞存活率≥95%. 用75%乙醇消毒小鼠腹部, 小鼠腹腔注射瘤细胞悬液0.2 mL/只(相当于瘤细胞数2×106/只). 整个过程严格无菌操作, 接种于1 h内完成.
1.2.2 实验小鼠分组与用药: 荷瘤小鼠开始出现腹水(第5天)时, 利用EXCEl产生随机数字法按体质量随机分成3组, 每组18只, 分别为: 空白对照组(等剂量生理盐水)、培美曲塞腹腔用药组(培美曲塞300 mg/kg, 腹腔用药)、培美曲塞静脉用药组(培美曲塞300 mg/kg, 静脉用药). 小鼠腹腔内接种H22瘤细胞为第0天, 小鼠分组后立即给予用药, 第8天亦用药一次, 即用药时间为d 5、d 8[5].
1.2.3 观测指标: (1)一般观测指标: 用药期间观察各组小鼠毛色, 活动状况及精神状态等一般生活状况, 称量体质量、测量腹围, 连续观察其变化; (2)测量各组小鼠腹水量: 实验进行第11天时, 颈椎脱位法随机处死各组8只小鼠, 利用无菌注射器抽取腹水并测量腹水量; (3)各组小鼠生存期观察: 其余剩下各组实验小鼠记录死亡时间, 并计算生命延长率. 生命延长率ILS(%) = [(给药组平均生存天数/空白对照组平均生存天数)-1]×100%.
统计学处理 采用SPSS13.0 for windows统计软件进行统计学处理, 数据采取均数±标准差(mean±SD)表示, 组间比较采用完全随机设计的方差分析, 方差齐时用LSD法进行两两比较, 方差不齐时用Games-Howell法进行两两比较. 采用Kaplan-Meier曲线描述生存时间, 并使用Log-rank检验进行生存期分析. 以α = 0.05为检验水准, P<0.05认为差异有统计学意义, P<0.01认为差异显著性.
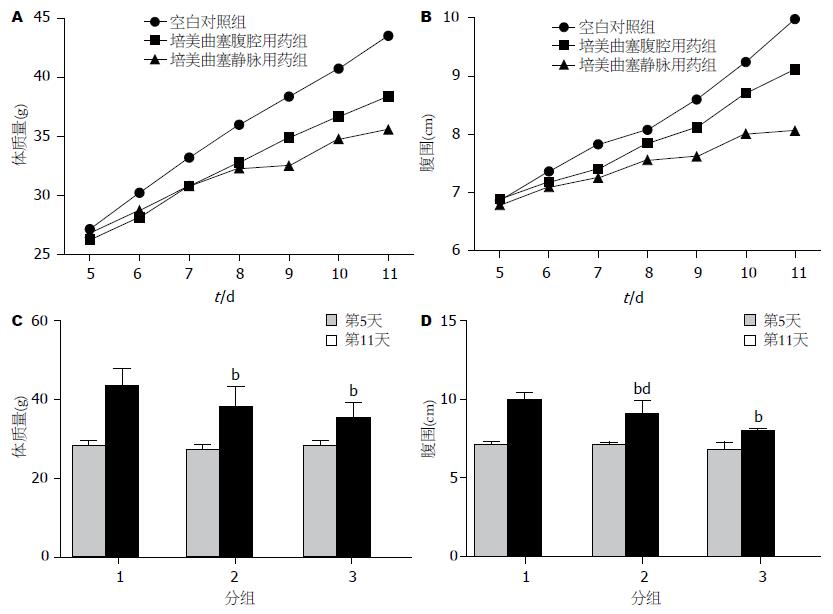
荷H22腹水瘤小鼠生存时间短, 短期内因大量腹水生成而至体质量及腹围值变化大, 因此其体质量和腹围值可间接反映荷瘤小鼠腹水量. 空白对照组小鼠体质量及腹围值增长迅速, 曲线呈陡直直线. 培美曲塞腹腔用药组小鼠体质量及腹围值增长亦较迅速, 曲线亦呈陡直直线, 但斜率较空白对照组小. 而培美曲塞静脉用药组小鼠体质量、腹围增长缓慢, 曲线较另外两组低平. 第11天培美曲塞腹腔用药及静脉用药组小鼠体质量均显著低于空白对照组(P<0.01), 而培美曲塞静脉用药组体质量低于培美曲塞腹腔用药组, 但差异未达统计学意义(P = 0.07). 培美曲塞腹腔用药及静脉用药组小鼠腹围均显著低于空白对照组(P<0.01), 而培美曲塞静脉用药组体质量低于培美曲塞腹腔用药组, 差异具有统计学意义(P<0.01, 图1).
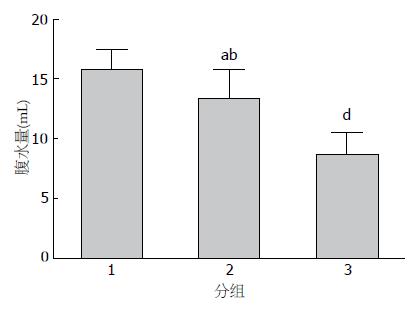
空白对照组、培美曲塞腹腔用药组及培美曲塞静脉用药组小鼠腹水量分别为15.74 mL±1.71 mL、13.31 mL±2.45 mL、8.58 mL±1.89 mL. 与空白对照组比较, 培美曲塞不同用药途径均可抑制荷瘤小鼠腹水的生成(P<0.05), 但培美曲塞静脉用药组小鼠腹水量明显较培美曲塞腹腔用药组减少(P<0.01, 图2).
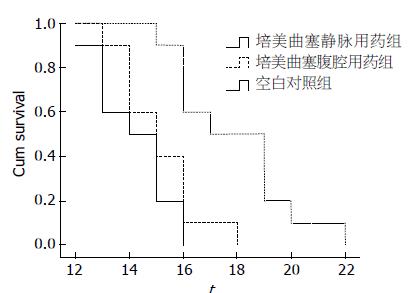
培美曲塞腹腔用药组及静脉用药组小鼠平均生存时间分别为15.10 d±0.46 d、17.90 d±0.71 d, 不同程度上较空白对照组14.20 d±0.44 d延长, 生命延长率分别为6.34%、26.06%. 培美曲塞腹腔用药组小鼠生命延长无统计学差异(P>0.05), 而培美曲塞静脉用药组与空白对照组及培美曲塞静脉用药比较, 生存时间差异均具有统计学意义(P<0.01, 图3).
恶性腹水是恶性肿瘤引起腹膜腔内液体异常蓄积[6]. 常引起恶性腹水的肿瘤有卵巢癌(36.7%)、胰腺癌(21.0%)、胃癌(8.3%)、食管癌及结直肠癌(各4.0%)、乳腺癌(3.0%)等[7]. 恶性腹水患者预后差, 除乳腺癌及卵巢癌患者外, 其中位生存期为1-4 mo. 目前, 临床上治疗恶性腹水仍缺乏特效的手段, 而腹腔内化疗占有重要的地位. 腹腔内化疗本身亦具有其局限性, 如出现腹腔感染、肠黏连、肠穿孔、肠出血等不良反应的机率增加[8]. 因此腹腔内化疗必须衡量疗效与不良反应两方面, 其对药物的选择较为严格.
培美曲塞分子量为471.384, 为高分子量药物. 其具有脂溶性低的物理特点, 有报道动物静脉使用培美曲塞后中枢神经系统内药物浓度极低[9]. 培美曲塞不需肝脏代谢, 可直接通过还原型叶酸载体(reduced folate carrier, RFC)、叶酸盐受体(folate receptor, FR)、质子偶联叶酸转运体(proton-coupled folate transporter, PCFT)3种途径进入肿瘤细胞内, 在细胞内叶酰多聚谷氨酸合酶(folypolyglutamate synthetase, FPGS)的作用下, 转化为多聚谷氨酸盐, 后者和其单体共同抑制细胞体内和与嘌呤、胸腺合成有关的多种酶系, 进而干扰DNR及RNA合成而达到抑制肿瘤生长的作用[10]. 因此, 从培美曲塞药物学特征考虑其符合腹腔内使用药物的特点.
Pestieau等[4]使用正常大鼠比较培美曲塞腹腔用药与静脉用药的药物代谢动力学、机体组织药物浓度的差异. 结果表明培美曲塞腹腔用药与静脉用药相比, 可以减少SD大鼠培美曲塞系统暴露的同时增加腹腔脏器表面暴露(约为静脉用药的24倍). 此外, 对比培美曲塞两种不同用药途径给药3 h后, 腹腔用药组大鼠肠系膜淋巴结和腹壁药物浓度亦较静脉用药组高, 而肾脏药物浓度明显低于静脉用药组(约1/2). 从而提出培美曲塞腹腔用药可能存在临床前景.
目前临床使用培美曲塞是通过静脉滴注给药. 在前临床研究中, 有报道动物使用培美曲塞于腹膜腔内[4]、胸膜腔内[11]、膀胱内[12]、鞘内用药[9]的药理学研究以及使用培美曲塞肝动脉/门静脉栓塞化疗治疗大鼠结肠癌肝转移的探索[13]. 而培美曲塞腹腔用药现仅处于药理学研究阶段, 目前国内外尚无培美曲塞腹腔用药的药效学研究报道. 本研究利用荷H22腹水瘤小鼠恶性腹水模型, 比较培美曲塞腹腔用药与静脉用药两种途径对荷H22腹水瘤小鼠恶性腹水的抑制作用.
荷H22腹水瘤小鼠恶性腹水模型已广泛应用于肿瘤学的基础研究[13], 但在多数研究中, 动物腹腔接种H22细胞24 h后开始用药, 届时荷瘤小鼠尚无出现腹水, 与临床上治疗恶性腹水模式不同. 在本研究中, 小鼠腹腔接种瘤细胞后第5天开始给药, 此时荷瘤小鼠已开始出现腹水, 因此更能真实反映药物治疗恶性腹水的疗效. 在前期实验中我们发现腹腔使用培美曲塞10、50、90 mg/kg具有抑制H22腹水瘤小鼠腹水形成的作用, 但同时亦出现明显的不良反应(特别是血液学毒性)而致动物的死亡, 考虑可能与昆明小鼠体内叶酸贮存量及利用度小相关[15]. Backus等[16]认为在基础实验中细胞培养液及动物体内的叶酸水平应与人类血清浓度相近时才可真实反映抗代谢药物的抗肿瘤活性. 韩慧兰等[17]测定昆明小鼠食用普通饲料(叶酸含量约2 mg/kg)后血清叶酸浓度为28.38 nmol/L, 与人类叶酸值相近. 而国外报道裸鼠及Balb/c鼠食用叶酸含量为6 mg/kg的饲料后, 血清叶酸浓度分别约为700 nmol/L、250 nmol/L, 明显高于人类水平[18,19]. 因此, 本研究中动物选择为昆明小鼠较为真实反映培美曲塞的抗肿瘤活性. 但Worzalla等[20]使用CD 1 nu/nu和DBA/2小鼠分别给予标准饲料和低叶酸饲料(low folate diet, LFD)喂养. 经LFD喂养2 wk后, CD 1 nu/nu和DBA/2小鼠培美曲塞半数致死量(LD50)分别为1.6、10.0 mg/kg. 而使用标准饲料喂养时上述两系小鼠培美曲塞半数致死量分别是LFD组的250倍和60倍. 由此可见, 小鼠对培美曲塞最大耐受剂量跟小鼠品系及补充叶酸量有关. 在治疗皮下荷淋巴瘤DBA/2小鼠时, 添加叶酸仍可保留培美曲塞的抗瘤活性, 之后临床研究亦得到了证实[21].
本研究中培美曲塞通过腹腔及静脉途径给药均可抑制荷H22腹水瘤小鼠腹水的生成, 减缓了小鼠出现大量腹水而致活动受限、呼吸急促等症状出现的时间, 提高小鼠的生存质量. 但培美曲塞静脉用药在小鼠腹水量的减少及生命时间的延长上相比腹腔用药更具有优势, 提示培美曲塞腹腔用药治疗荷H22腹水瘤小鼠疗效并不优于传统的静脉用药. 临床上开展培美曲塞腹腔用药尚需进一步的研究以提供基础理论支持.
恶性肿瘤患者腹水的出现常作为预后不良的指标之一. 虽然目前治疗腹水的方法较多, 但至今仍缺乏特效的手段, 腹腔内化疗是局部治疗腹水的常用方法之一. 培美曲塞腹腔内用药仅处于药物代谢动力学研究阶段, 目前国内外尚无培美曲塞腹腔内用药的药效学研究报道. 本研究旨在比较培美曲塞腹腔用药与静脉用药两种途径对荷H22腹水瘤小鼠恶性腹水的抑制作用. 为进一步临床开展培美曲塞腹腔用药治疗恶性腹水提供理论基础.
金瑞, 教授, 首都医科大学附属北京佑安医院消化科
腔隙内给药可提高腔隙内药物浓度并可能降低血浆中药物浓度, 进而可能获得相对静脉用药时更高的疗效及较低的全身不良反应. 培美曲塞对多种实体瘤的生长具有抑制作用. 在基础研究中, 培美曲塞腔隙内用药的药物代谢动力学研究成为近年肿瘤研究领域的热点, 旨在为进一步药效学实验研究及临床研究提供依据.
在前临床试验中, 有报道动物使用培美曲塞于腹膜腔内、胸膜腔内、膀胱内、鞘内用药的药理学研究以及使用培美曲塞肝动脉/门静脉栓塞化疗治疗大鼠结肠癌肝转移的探索. Pestieau等使用正常大鼠比较培美曲塞腹腔用药与静脉用药的药物代谢动力学、机体组织药物浓度的差异. 提出培美曲塞腹腔用药可能存在临床前景.
本研究利用鼠肝癌H22细胞株建立小鼠恶性腹水模型, 然后比较培美曲塞腹腔用药与静脉用药对恶性腹水的抑制作用. 用药时间为小鼠出现腹水后, 与临床上治疗恶性腹水模式相同, 更能真实反映药物治疗恶性腹水的疗效.
本研究提示培美曲塞腹腔用药治疗荷H22腹水瘤小鼠疗效并不优于传统的静脉用药. 临床上开展培美曲塞腹腔用药尚需进一步的实验研究.
本研究立题依据充分, 实验设计严谨, 实验动物和材料规范, 技术流程合理, 结果可信, 统计方法正确, 观点明确, 所引用的参考文献可以朔原, 对恶性肿瘤腹腔积液治疗的理论研究和临床治疗有一定参考价值.
编辑: 田滢 电编:鲁亚静
| 1. | Hanauske AR, Chen V, Paoletti P, Niyikiza C. Pemetrexed disodium: a novel antifolate clinically active against multiple solid tumors. Oncologist. 2001;6:363-373. [PubMed] [DOI] |
| 2. | Barni S, Cabiddu M, Ghilardi M, Petrelli F. A novel perspective for an orphan problem: old and new drugs for the medical management of malignant ascites. Crit Rev Oncol Hematol. 2011;79:144-153. [PubMed] [DOI] |
| 3. | Markman M. Intraperitoneal antineoplastic drug delivery: rationale and results. Lancet Oncol. 2003;4:277-283. [PubMed] [DOI] |
| 4. | Pestieau SR, Stuart OA, Sugarbaker PH. Multi-targeted antifolate (MTA): pharmacokinetics of intraperitoneal administration in a rat model. Eur J Surg Oncol. 2000;26:696-700. [PubMed] [DOI] |
| 5. | Bertino P, Piccardi F, Porta C, Favoni R, Cilli M, Mutti L, Gaudino G. Imatinib mesylate enhances therapeutic effects of gemcitabine in human malignant mesothelioma xenografts. Clin Cancer Res. 2008;14:541-548. [PubMed] [DOI] |
| 7. | Ayantunde AA, Parsons SL. Pattern and prognostic factors in patients with malignant ascites: a retrospective study. Ann Oncol. 2007;18:945-949. [PubMed] [DOI] |
| 9. | Dai H, Chen Y, Elmquist WF. Distribution of the novel antifolate pemetrexed to the brain. J Pharmacol Exp Ther. 2005;315:222-229. [PubMed] [DOI] |
| 10. | Nutt JE, Razak AR, O'Toole K, Black F, Quinn AE, Calvert AH, Plummer ER, Lunec J. The role of folate receptor alpha (FRalpha) in the response of malignant pleural mesothelioma to pemetrexed-containing chemotherapy. Br J Cancer. 2010;102:553-560. [PubMed] [DOI] |
| 11. | Greillier L, Monjanel-Mouterde S, Fraticelli A, Devictor-Pierre B, Bouvenot J, Coltel N, Lamarche G, Astoul P. Intrapleural administration of pemetrexed: a pharmacokinetic study in an animal model. J Thorac Oncol. 2009;4:404-408. [PubMed] [DOI] |
| 12. | Hendricksen K, Moonen PM, van der Heijden AG, Molkenboer-Kuenen J, Hulsbergen-van de Kaa CA, Witjes JA. Potential and toxicity of intravesical pemetrexed: a preclinical study in pigs. Clin Cancer Res. 2006;12:2597-2601. [PubMed] [DOI] |
| 13. | Rodenbach M, Eyol E, Seelig MH, Berger MR. Combination treatment of CC531-lac-Z rat liver metastases by chemoembolization with pemetrexed disodium and gemcitabine. J Cancer Res Clin Oncol. 2005;131:289-299. [PubMed] [DOI] |
| 14. | 李 海燕, 方 肇勤, 梁 尚华. 小鼠移植性肝癌(H_(22))模型的研究及在中医药抗肿瘤中的应用. 中国中医基础医学杂志. 2000;6:27-30. |
| 16. | Backus HH, Pinedo HM, Wouters D, Padrón JM, Molders N, van Der Wilt CL, van Groeningen CJ, Jansen G, Peters GJ. Folate depletion increases sensitivity of solid tumor cell lines to 5-fluorouracil and antifolates. Int J Cancer. 2000;87:771-778. [PubMed] [DOI] |
| 18. | Mathias CJ, Wang S, Lee RJ, Waters DJ, Low PS, Green MA. Tumor-selective radiopharmaceutical targeting via receptor-mediated endocytosis of gallium-67-deferoxamine-folate. J Nucl Med. 1996;37:1003-1008. [PubMed] |
| 19. | Leamon CP, Reddy JA, Dorton R, Bloomfield A, Emsweller K, Parker N, Westrick E. Impact of high and low folate diets on tissue folate receptor levels and antitumor responses toward folate-drug conjugates. J Pharmacol Exp Ther. 2008;327:918-925. [PubMed] [DOI] |
| 20. | Worzalla JF, Shih C, Schultz RM. Role of folic acid in modulating the toxicity and efficacy of the multitargeted antifolate, LY231514. Anticancer Res. 1998;18:3235-3239. [PubMed] |
| 21. | Nakagawa K, Kudoh S, Matsui K, Negoro S, Yamamoto N, Latz JE, Adachi S, Fukuoka M. A phase I study of pemetrexed (LY231514) supplemented with folate and vitamin B12 in Japanese patients with solid tumours. Br J Cancer. 2006;95:677-682. [PubMed] [DOI] |