修回日期: 2012-11-08
接受日期: 2012-11-23
在线出版日期: 2012-12-28
目的: 探讨肝细胞凋亡及其相关因素Fas/FasL、Bcl-2/Bax蛋白及Caspase-8 mRNA的表达在大鼠非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)中的作用.
方法: 采用改良高脂饮食建立大鼠NAFLD模型, 以正常饮食设立对照组. HE染色观察肝脏脂肪变、炎症活动和纤维化程度, 采用流式细胞仪法测肝细胞凋亡百分数; 免疫组织化学法检测Fas、FasL、Bcl-2及Bax在肝组织中表达情况; 实时荧光定量PCR法检测肝脏Caspase-8 mRNA的表达.
结果: NAFLD模型组脂肪变性明显, 纤维化和炎症活动度记分均显著高于正常对照组. 流式细胞仪检测显示, 与对照组比较, 实验组大鼠肝细胞凋亡百分数增加, 随造模时间延长凋亡率增加更明显(均P<0.01); 免疫组织化学染色显示随着肝脏脂肪变加重, Fas、FasL蛋白染色加深, 阳性细胞数增加; Bcl-2、Bax在对照组的表达均为散在弱阳性, 实验组4、8、12 wk阳性细胞数渐增加, 并在脂肪变明显的部位着色深且随着脂肪肝的进展, Bcl-2/Bax比率进行性下降. 实时荧光定量PCR法显示Caspase-8 mRNA 表达量在高脂组中显著高于对照组(均P<0.01), 且随肝脏脂肪变及炎症加重呈进行性上升.
结论: 在NAFLD发生过程中, 肝细胞凋亡促进NAFLD大鼠病情进展; Fas、FasL、Caspase-8 mRNA相关调控蛋白的活化是引起NAFLD脂肪变性、炎症及纤维化的重要因素. 细胞凋亡调节蛋白Bax、Bcl-2表达上调, 二者表达的相对比例发生异常, 这可能是NAFLD中肝细胞发生凋亡的重要原因之一.
引文著录: 何双艳, 李珏宏, 李昌平, 李鹏, 钟晓琳. Fas/FasL、Bcl-2/Bax、Caspase-8在大鼠非酒精性脂肪性肝病中的作用机制. 世界华人消化杂志 2012; 20(36): 3761-3766
Revised: November 8, 2012
Accepted: November 23, 2012
Published online: December 28, 2012
AIM: To investigate the role of hepatocyte apoptosis-related factors Fas, FasL, Bcl-2, Bax and caspase-8 in the pathogenesis of nonalcoholic fatty liver disease (NAFLD) in rats.
METHODS: A rat model of experimental NAFLD was created by feeding a fat rich diet (NAFLD group). Control animals were fed a standard diet (control group). The percentage of apoptotic cells was detected by flow cytometry (FCM). The expression levels of Fas, Fas L, Bcl-2 and Bax proteins in the liver were determined by immunohistochemistry. The mRNA level of caspase-8 was measured by real-time fluorescence quantitative polymerase chain reaction.
RESULTS: In the NAFLD group, steatosis was more obvious and fibrosis and inflammation activity scores were significantly higher than those in the control group. The percentage of apoptotic hepatocytes increased more significantly in the NAFLD group compared with the control group. With the increase in the severity of fat liver, Fas and FasL expression was enhanced in the model group and the number of positive cells increased. The expression of Bcl-2 and Bax proteins was weakly positive in the control group, while the number of positive cells in the model group gradually increased from week 4 to week 12. Bcl-2 and Bax proteins were more deeply stained in locations where fatty changes were more severe. With the progression of fatty liver, Bcl-2/Bax ratio progressively decreased in the NAFLD group. Caspase-8 mRNA expression in the NAFLD group was significantly higher than that in the control group. Caspase-8 mRNA expression progressively increased with the aggravation of steatosis and inflammation.
CONCLUSION: The degree of hepatocyte apoptosis is closely related to the degree of liver injury in rats with NAFLD. Pathological hepatocyte apoptosis promotes the progression of NAFLD. The activation of Fas, FasL, and caspase-8 is an important cause of steatosis, inflammation and fibrosis in NAFLD. Up-regulation of Bax and Bcl-2 and abnormal Bax/Bcl-2 ratio may be important factors responsible for hepatocyte apoptosis in NAFLD.
- Citation: He SY, Li JH, Li CP, Li P, Zhong XL. Role of Fas/FasL, Bcl-2/Bax and caspase-8 in the pathogenesis of nonalcoholic fatty liver disease in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3761-3766
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3761.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3761
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是指除酒精和其他明确的损肝因素所致的, 以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[1,2]. 随着生活水平的提高、生活习惯的变化, 肥胖和糖尿病的发病率增加, NAFLD的发病率呈上升趋势, 在我国亦已成为仅次于病毒性肝炎的第2大肝病[3], 其可进展至肝硬化、肝功能衰竭、原发性肝细胞癌[4-6], 严重危害人民健康. 尽管NAFLD的发病机制仍不十分清楚, 但有证据显示肝细胞凋亡及其相关因素Fas/FasL、Bcl-2/Bax蛋白及Caspase-8在其发生发展中发挥着重要作用[7-9]. 本实验通过改良高脂饮食建立NAFLD大鼠模型, 检测Fas/Fasl, Bcl-2、Bax蛋白在肝组织的表达情况及检测肝脏Caspase-8 mRNA的表达, 从而进一步阐明和探讨他们在其发病机制中的作用及相互关系.
健康成年SPF级♂SD大鼠40只, 体质量150-180 g, 购自重庆腾鑫生物技术有限公司. 兔抗大鼠Fas多克隆抗体、兔抗大鼠FasL多克隆抗体、兔抗大鼠Bcl-2多克隆抗体、兔抗大鼠Bax多克隆抗体、二抗羊抗兔IgG 、SP免疫组织化学染色试剂盒(北京中杉金桥公司); Annexin V/PI双染试剂盒(美国Beckman公司); Taq DNA PCR反应试剂盒(TaKaRa大连宝生); TRIzol购自美国Invitrogen; dNTP购自美国普洛麦格(Promega)公司; 引物合成及探针修饰(上海生物工程有限公司).
1.2.1 分组及造模: 适应性喂养1 wk后, 40只大鼠按随机表法随机分为2组: 正常对照组20只(简称C组); NAFLD实验组20只(简称F组). 每组分为2、4、8、12 wk小组, 每小组各5只. 正常组以普通饲料喂养, 实验组以改良高脂饮食(即胆固醇2%+胆酸钠0.5%+丙硫氧嘧啶0.2%+蔗糖5%+猪油10%+基础饲料82.3%[10])喂养. 实验动物自由进食和饮水.
1.2.2 取材: 大鼠处死前1天禁食12 h, 自由饮水, 第2天称质量后以20 g/L戊巴妥钠溶液1 mL/kg腹腔内注射麻醉, 先进行心脏采血, 留取血清; 然后迅速取下肝脏测量肝湿质量, 以备计算肝指数(肝湿质量/体质量×100%); 在肝左叶中部切取1.0 cm×l.0 cm×l.0 cm大小肝组织, 浸泡于4%多聚甲醛中固定, 备做病理切片, 其余肝脏组织-80 ℃冰箱保存备用.
1.2.3 各组大鼠血脂及肝功能检测: 由全自动生化分析仪检测定血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST).
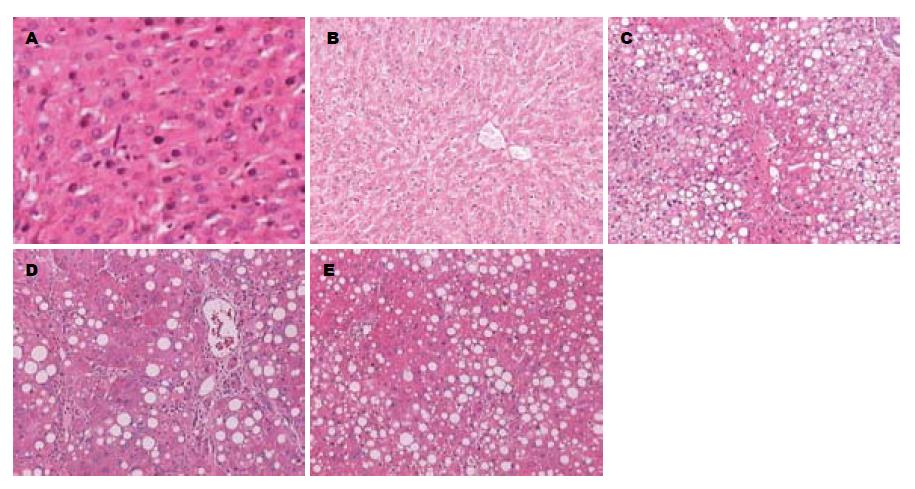
1.2.4 肝组织病理观察: 将取出的新鲜肝组织用4%多聚甲醛固定、石蜡包埋、HE 染色, 在显微镜下观察肝组织的脂肪变、炎症活动以及纤维化情况.
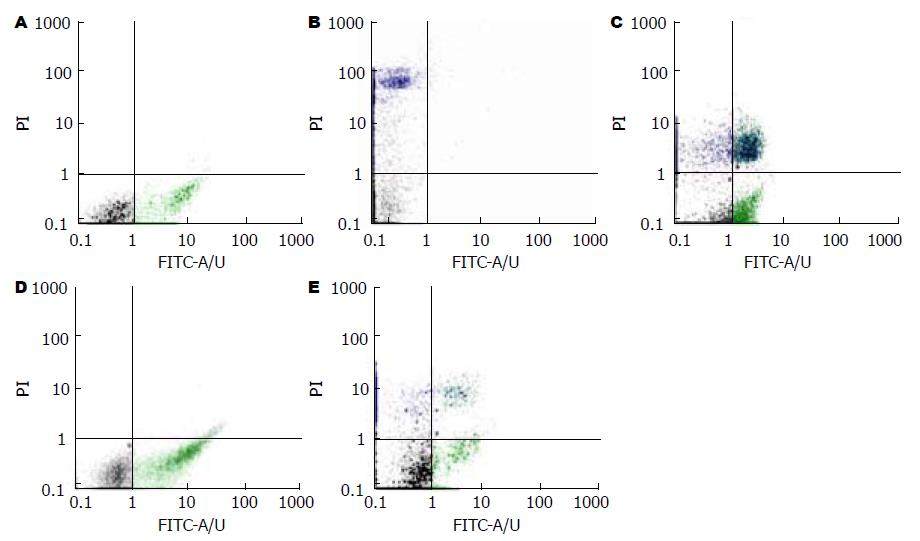
1.2.5 流式细胞仪Annexin V/PI法测肝细胞凋亡百分数: 取实验大鼠新鲜肝脏组织约1 g, 置于预冷的PBS中, 立即剪碎, 数次PBS悬浮、洗涤, 400目滤网过滤, 获得悬浮肝细胞, 加入红细胞裂解液冰上裂解10 min, 1 000 r/min离心5 min, 弃上清; PBS重新悬浮肝细胞, 计数, Annexin-Ⅴ/PI 染色, 上机检测.
1.2.6 免疫组织化学检测Fas、FasL、Bcl-2、Bax蛋白在肝组织中的表达: 按照SP免疫组织化学染色试剂盒及DAB显色试剂盒说明书按步骤进行操作. 阳性判断标准为: 细胞膜或细胞浆出现棕褐色染色. 用Image plus 5.0软件进行图像分析, 作积分吸光度(IA)值半定量分析.
1.2.7 实时荧光定量PCR检测肝脏Caspase-8 mRNA的表达: 按TRIzol试剂说明书提取肝组织中的总RNA, 测定RNA 的浓度及纯度. 将提取的总mRNA逆转录为cDNA, 收集数据, 确定每个样品管中荧光强度增加到某一特定阈值时的扩增循环数(Ct值), 进行分析绘制每一反应管的扩增动力学曲线, 根据Ct值与标准模板初始拷贝的对数值作图, 得到该样品的标准曲线. GAPDH上游引物序列为: 5'-TGA CAT CAA GAA GGT GGT GA-3', 下游引物序列为: 5'-TCA TAC CAG GAA ATG AGC TT-3'. Caspase-8基因上游引物序列为: 5'-GAT GAG GCA GAC TTT CT G CT-3', 下游引物序列为: 5'-CAT AGT TCA CGC CAG TCA GGA T-3'. Caspase-8阳性结果为163 bp, Caspase-8的扩增条件为: 94 ℃ 2 min, 94 ℃ 20 s, 54 ℃ 20 s, 74 ℃ 20 s, 共45个循环.
统计学处理 数据使用SPSS13.0软件进行统计学分析. 计量资料用用mean±SD表示, C组与F组比较采用两样本均数比较的t检验; C组与F组间比较采用方差分析; 计数资料比较采用Fisher精确检验; 两者相关性分析采用直线相关分析. P<0.05为差异有统计学意义.
2.1.1 大鼠血脂和肝功能: 随造模时间延长, F组血脂及肝功能各组指标呈进行性升高, 其中以ALT最为明显, 各时间点F组ALT值与C组比较及F组间比较均有明显差异(均P<0.01); TG水平F组在4 wk时显著升高, 相对C组及F组2 wk有差异(P<0.01); 各时相点F组TC值与C组比较及F组间比较均有明显差异(均P<0.05); AST水平F组与C组间差异显著(P<0.01), 而F组组间比较在4 wk相对F组2 wk有差异(P<0.01), 其余4、8、12 wk F组间则无明显差异.
2.1.2 大鼠肝组织病理情况: HE染色结果显示, C组大鼠肝脏无异常发现, 各时相点F组肝组织炎症活动度评分均高于C组(均P<0.05); F组间比较: F组4 wk与2 wk差异显著(P<0.01); F组12 wk与8 wk比较差异显著(P<0.05, 图1)
F组2 wk与C组比较略有增加但差异不显著; F组4 wk、 8 wk、12 wk与C组相同时相点比较肝细胞凋亡百分数明显著增加(均P<0.01). F组间比较肝细胞凋亡百分数增加显著(P<0.01); 而C组各时相点之间差异无统计学意义(图2).
2.3.1 大鼠肝组织Fas、FasL蛋白表达: C组间比较差异不显著, F组Fas及FasL含量随造模时间延长逐步升高, 与C组比较差异明显(P<0.01), 其中F组间比较以12 wk升高较明显, 8 wk、12 wk间差异较小(表1).
| 分组 | Fas | FasL | Bcl-2 | Bax | Bcl-2/Bax | Caspase-8 mRNA (2-△△Ct) |
| C组 | ||||||
| 2 wk | 5.43±0.97b | 6.10±0.48 | 3.87±0.76 | 7.98±0.34 | 0.48±0.17 | 1.03±0.24b |
| 4 wk | 4.68±1.24b | 6.35±0.58b | 4.13±0.97b | 8.70±0.66b | 0.46±0.16 | 1.10±0.36b |
| 8 wk | 6.70±1.82b | 8.25±1.59b | 5.63±1.31b | 8.70±0.74b | 0.63±0.18 | 1.87±0.56b |
| 12 wk | 4.51±2.26b | 9.43±1.75b | 6.42±2.25 | 29.45±1.45b | 0.67±0.21 | 1.92±0.65a |
| F组 | ||||||
| 2 wk | 9.90±3.93 | 8.87±0.76d | 4.74±0.37 | 9.53±1.51d | 0.48±0.24 | 2.54±0.32d |
| 4 wk | 11.90±5.49 | 17.00±1.34f | 6.18±1.58 | 24.60±2.81f | 0.29±0.14 | 5.46±0.93f |
| 8 wk | 14.42±6.31 | 30.10±7.31 | 8.94±1.56 | 37.90±1.69h | 0.21±0.12 | 8.15±1.48h |
| 12 wk | 18.43±5.47 | 39.57±6.43 | 9.16±3.42 | 46.00±3.22 | 0.18±0.08 | 17.40±1.97 |
2.3.2 大鼠肝组织Bcl-2/Bax蛋白表达: F组Bcl-2、Bax蛋白的表达随着时间延长增高, 与C组比较, 差异具有统计学意义(P<0.01); 随着脂肪肝的进展, F组Bcl-2/Bax 比率逐渐下降, 尤以F 组8 wk及12 wk最为加明显(表1).
Caspase-8 mRNA相对表达量在F组中随脂肪肝程度的加重呈进行性上升, F组各时相点Caspase-8 mRNA相对表达量均显著高于C组(均P<0.01), 且F组间比较也存在明显差异(均P<0.01, 表1).
肝细胞凋亡是多种肝脏疾病的共同病理表现, 近年来关于其在NAFLD发生发展中的作用取得较大进展, 揭示了肝细胞凋亡在NAFLD向非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)及肝纤维化乃至肝硬化、肝癌进展中扮演的至关重要角色[11,12]. 本实验成功诱导NAFLD大鼠模型, 表现为血清ALT、AST、TC、TG升高, 肝组织学上有肝细胞脂肪变、坏死、炎症细胞浸润或伴有肝纤维化, 且随着造模时间的延长肝细胞凋亡显著增加.
肝细胞是否发生凋亡主要受死亡受体信号转导通路、线粒体信号通路和内质网途径调控[13-15]. 死亡受体信号转导通路中的Fas是一种跨膜蛋白, 属于肿瘤坏死因子受体超家族成员, 在细胞凋亡中具有信号传导作用[16]. 他与FasL结合可以启动致死性凋亡信号的转导促进细胞凋亡, 细胞高表达的Fas蛋白与组织中可溶性FasL结合[17], 导致Fas相关死亡域蛋白(Fas-associated death domain protein, FADD)的募集, 形成死亡诱导信号复合体(death-inducing signaling complex, DISC), 激活proCaspase-8, 引起上游启始Caspase-8[18,19], 既而活化Caspase-3、Caspase-6、Caspase-7等, 从而启动了Caspase家族酶链反应[20,21], 最终作用于细胞的结构蛋白, 导致细胞凋亡的发生[22]. Caspase-8是细胞凋亡上游关键酶, 是重要的凋亡启动因子, 其几乎能激活所有凋亡级联反应下游的Caspase而诱发凋[23,24]. 本实验结果显示, F组Fas、FasL及Caspase-8 mRNA表达随着NAFLD的肝脂肪变程度加重, 其表达量都逐渐升高, 且与NAFLD的肝脂肪变程度和肝细胞凋亡百分数水平均呈正相关, 表明肝脏病变的发生、发展与Fas、FasL及Caspase-8的表达上调有关, 其可能的机制为: 高脂饮食造成肝脂肪变性, 脂肪分解产生游离脂肪酸(free fatty acids, FFA), FFA的脂毒性能诱导致肝细胞脂性凋亡, 诱发氧化应激, 产生大量的活性氧(reactive oxygen species, ROS), ROS的产生可激活Fas/FasL系统, 进一步导致Fas致死区结构蛋白募聚下游Caspase家族成员[25,26], 形成蛋白酶促级联反应, 导致肝细胞凋亡.
在线粒体调控细胞凋亡的体系中, Bcl-2及其家族成员共同构成一个非常复杂的相互作用的网络, 调控细胞凋亡[27]. 其中Bcl-2、Bax是最重要的代表. 在NAFLD形成过程中, 脂肪变性与氧应激使Bax合成增加并移至线粒体外膜, 改变构型形成同源二聚体后诱导线粒体PT孔开放、细胞色素C释放, 引起细胞凋亡; 而Bcl-2主要分布于线粒体外膜上, 他的同源二聚体抑制PT孔开放, 而且他与Bax结合后可以防止Bax构型改变从而起到抗凋亡的作用[28,29]. 因此Bcl-2抑制凋亡, Bax促进凋亡, Bcl-2蛋白与Bax蛋白的比值与细胞凋亡的发生有直接关系, 有学者甚至将Bcl-2和Bax的比值称作"凋亡开关". Bax蛋白占优时细胞凋亡, Bcl-2蛋白占优时则细胞存活[30]. 本实验显示, Bcl-2蛋白、Bax蛋白在NAFLD肝细胞中的表达均较正常对照组增加, 二者均被诱导活化, 但在肝脏脂肪变及炎变发展的过程中, Bax蛋白的表达较Bcl-2蛋白增加明显, Bcl-2/Bax比值进行性降低, 而肝细胞的凋亡百分数则显著增加, 且Bcl-2/Bax相对比值与肝细胞凋亡百分数水平呈负相关. 由此可推测Bcl-2、Bax比例失调可能是肝细胞凋亡增加的重要原因之一.
总之, 本实验通过动态肝细胞凋亡百分数、肝脏Fas/FasL、Bcl-2/Bax、Caspase-8的表达, 细胞凋亡分子因素Fas/FasL、Bcl-2/Bax、Caspase-8与肝细胞凋亡亦紧密相连, 随着对NAFLD中肝细胞凋亡的深入研究, 能够进一步探明NAFLD的发病机制, 为细胞凋亡运用于NAFLD的诊治提供有力的理论依据, 给临床NAFLD的诊断、治疗、及预后判定开辟一条新的途径.
非酒精性脂肪性肝病(NAFLD)是2l世纪全球重要的公共健康问题之一, 也是肝功能异常最常见的原因, 人群发病率高达25%, 脂肪肝可发展为肝细胞坏死, 肝纤维化和肝硬化, 其发病机制尚未阐明.
任晓峰, 教授, 东北农业大学动物医学学院微生物室
肝细胞凋亡及相关调节因素在NAFLD发病及其进展中的作用是目前NAFLD研究的热点之一, 但关于其致病机制仍不清楚.
赵和平和解燕茹在非酒精性脂肪性肝病动物实验研究中, 发现在NAFLD发生过程中, 细胞凋亡调节蛋白Bax表达上调, Bcl-2表达减少, 二者表达的相对比例发生异常.
本实验应用改良高脂饮食建立NAFLD大鼠模型, 通过研究细胞凋亡调控蛋白Fas/FasL、Bcl-2/Bax及Caspase-8的表达与NAFLD进展的关系, 以期对其发病机制有新的认识, 从而揭示他们在NAFLD中的作用.
Fas、FasL、Caspase-8相关调控蛋白的活化是引起NAFLD脂肪变性、炎症及纤维化的重要因素. 细胞凋亡调节蛋白Bax、Bcl-2表达上调, 二者表达的相对比例发生异常, 这可能是NAFLD中肝细胞发生凋亡的重要原因之一.
本文对于研究非酒精性脂肪性肝病发病机制很有意义, 具有一定的指导意义.
编辑: 翟欢欢 电编:鲁亚静
| 1. | Björnsson E, Angulo P. Non-alcoholic fatty liver disease. Scand J Gastroenterol. 2007;42:1023-1030. |
| 2. | Duvnjak M, Lerotić I, Barsić N, Tomasić V, Virović Jukić L, Velagić V. Pathogenesis and management issues for non-alcoholic fatty liver disease. World J Gastroenterol. 2007;13:4539-4550. |
| 3. | Manco M, Bottazzo G, DeVito R, Marcellini M, Mingrone G, Nobili V. Nonalcoholic fatty liver disease in children. J Am Coll Nutr. 2008;27:667-676. |
| 4. | Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest. 2004;114:147-152. |
| 5. | Smith BW, Adams LA. Non-alcoholic fatty liver disease. Crit Rev Clin Lab Sci. 2011;48:97-113. |
| 6. | Argo CK, Northup PG, Al-Osaimi AM, Caldwell SH. Systematic review of risk factors for fibrosis progression in non-alcoholic steatohepatitis. J Hepatol. 2009;51:371-379. |
| 7. | Feldstein AE, Canbay A, Angulo P, Taniai M, Burgart LJ, Lindor KD, Gores GJ. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 2003;125:437-443. |
| 8. | Nan YM, Wu WJ, Yao XX, Wang L. [The role of apoptosis and the related genes in non-alcoholic steatohepatitis]. Zhonghua Ganzangbing Zazhi. 2007;15:41-46. |
| 11. | Wieckowska A, Zein NN, Yerian LM, Lopez AR, McCullough AJ, Feldstein AE. In vivo assessment of liver cell apoptosis as a novel biomarker of disease severity in nonalcoholic fatty liver disease. Hepatology. 2006;44:27-33. |
| 12. | Canbay A, Friedman S, Gores GJ. Apoptosis: the nexus of liver injury and fibrosis. Hepatology. 2004;39:273-278. |
| 13. | Harper N, Hughes M, MacFarlane M, Cohen GM. Fas-associated death domain protein and caspase-8 are not recruited to the tumor necrosis factor receptor 1 signaling complex during tumor necrosis factor-induced apoptosis. J Biol Chem. 2003;278:25534-25541. |
| 16. | Contassot E, Gaide O, French LE. Death receptors and apoptosis. Dermatol Clin. 2007;25:487-501, vii. |
| 17. | Iwase M, Kondo G, Watanabe H, Takaoka S, Uchida M, Ohashi M, Nagumo M. Regulation of Fas-mediated apoptosis in neutrophils after surgery-induced acute inflammation. J Surg Res. 2006;134:114-123. |
| 18. | Wong GH, Goeddel DV. Fas antigen and p55 TNF receptor signal apoptosis through distinct pathways. J Immunol. 1994;152:1751-1755. |
| 19. | Yin XM, Ding WX. Death receptor activation-induced hepatocyte apoptosis and liver injury. Curr Mol Med. 2003;3:491-508. |
| 20. | Chen M, Orozco A, Spencer DM, Wang J. Activation of initiator caspases through a stable dimeric intermediate. J Biol Chem. 2002;277:50761-50767. |
| 21. | Kim K, Fisher MJ, Xu SQ, el-Deiry WS. Molecular determinants of response to TRAIL in killing of normal and cancer cells. Clin Cancer Res. 2000;6:335-346. |
| 22. | Fan TJ, Han LH, Cong RS, Liang J. Caspase family proteases and apoptosis. Acta Biochim Biophys Sin (Shanghai). 2005;37:719-727. |
| 24. | Häcker G, Paschen SA. Therapeutic targets in the mitochondrial apoptotic pathway. Expert Opin Ther Targets. 2007;11:515-526. |
| 26. | Begriche K, Igoudjil A, Pessayre D, Fromenty B. Mitochondrial dysfunction in NASH: causes, consequences and possible means to prevent it. Mitochondrion. 2006;6:1-28. |
| 27. | Akcali KC, Dalgic A, Ucar A, Haj KB, Guvenc D. Expression of bcl-2 gene family during resection induced liver regeneration: comparison between hepatectomized and sham groups. World J Gastroenterol. 2004;10:279-283. |
| 28. | Pastorino JG, Shulga N, Hoek JB. TNF-alpha-induced cell death in ethanol-exposed cells depends on p38 MAPK signaling but is independent of Bid and caspase-8. Am J Physiol Gastrointest Liver Physiol. 2003;285:G503-G516. |
| 29. | Chen DF, Wang CH. [The relationship between the opening of mitochondrial permeability transition pores of cultured hepatocytes with their apoptoses in a non-alcoholic fatty liver disease model]. Zhonghua Ganzangbing Zazhi. 2007;15:837-839. |
| 30. | Panasiuk A, Dzieciol J, Panasiuk B, Prokopowicz D. Expression of p53, Bax and Bcl-2 proteins in hepatocytes in non-alcoholic fatty liver disease. World J Gastroenterol. 2006;12:6198-6202. |