修回日期: 2012-11-22
接受日期: 2012-12-20
在线出版日期: 2012-12-28
目的: 检测慢性乙型肝炎、慢性丙型肝炎和非酒精性脂肪性肝炎中Caspase-3的表达, 探讨其临床及病理学意义.
方法: 应用免疫组织化学方法检测Caspase-3在70例慢性乙型肝炎, 50例慢性丙型肝炎, 50例非酒精性脂肪性肝炎和15例正常肝组织的表达.
结果: (1)Caspase-3在慢性乙型肝炎、慢性丙型肝炎、非酒精性脂肪性肝炎中的表达(57.1%、72.0%、82.0%), 高于其在正常肝组织中表达(18.8%), 差异有统计学意义(P<0.05); 并与肝细胞凋亡密切相关(r = 0.356, P<0.001); (2)Caspase-3在慢性乙型肝炎、慢性丙型肝炎和非酒精性脂肪性肝炎随病理损伤程度加重其阳性表达率增高, 有统计学意义(P<0.05).
结论: Caspase-3与慢性乙型肝炎、丙型肝炎和非酒精性脂肪性肝炎的肝细胞凋亡密切相关, 并参与肝炎的发病过程.
引文著录: 杨海峰, 薛玲, 郑彩娟, 幺作义, 张艳淑, 姚林, 李佳. Caspase-3在慢性病毒性乙、丙型肝炎及非酒精性肝炎中的表达及意义. 世界华人消化杂志 2012; 20(36): 3701-3706
Revised: November 22, 2012
Accepted: December 20, 2012
Published online: December 28, 2012
AIM: To determine the expression of caspase-3 in liver tissues of patients with chronic hepatitis B (CHB), chronic hepatitis C (CHC), or nonalcoholic steatohepatitis (NASH) and to analyze their clinical and pathological significance.
METHODS: Immunohistochemistry was used to determine the expression of caspase-3 in liver tissues from 70 patients with CHB, 50 patients with CHC, 50 patients with NASH, and 15 normal people.
RESULTS: The positive rates of caspase-3 expression in CHB, CHC and NASH were significantly higher than that in normal hepatic tissue (57.1%, 72.0%, 82.0% vs 18.8%; all P < 0.05). Caspase-3 expression was closely related with hepatic cell apoptosis (r = 0.356, P < 0.001). The positive rates of caspase-3 expression increased with the increase in the degree of pathological injury (all P < 0.05).
CONCLUSION: The expression of caspase-3 in CHB, CHC and NASH is closely related with liver cell apoptosis. Overexpression of caspase-3 may play an important role in the development of hepatitis.
- Citation: Yang HF, Xue L, Zheng CJ, Yao ZY, Zhang YS, Yao L, Li J. Significance of expression of caspase-3 in chronic hepatitis B and C and nonalcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3701-3706
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3701.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3701
慢性乙型肝炎、慢性丙型肝炎和非酒精性脂肪性肝炎常可引起肝硬化、肝癌[1-5], 严重危害人们的健康[6-8]. 其发病机制目前尚不详. 近年来, 细胞凋亡调控机制的研究成为研究肝炎发病机制的热点. 细胞凋亡(apoptosis)又称程序性细胞死亡(programmed cell death, PCD), 是机体在生理和病理性刺激下为保持内环境稳定, 由基因控制和酶促反应下的一种自主有序的死亡[9-12]. Caspase-3是导致细胞凋亡发生的关键步骤凋亡信号传导的共同通路[13,14]. 本研究应用免疫组织化学检测Caspase-3在慢性乙型肝炎、慢性丙型肝炎和非酒精性脂肪性肝炎中的表达, 探索其与肝细胞凋亡的关系, 与肝组织炎症活动度、肝纤维化程度的关系, 探讨其在肝炎的病理生理过程中的作用.
收集2011-012/2012-05唐山市传染病医院就诊的慢性乙型病毒性肝炎患者70例, 慢性丙型肝炎50例(以上诊断标准符合2000年修订的病毒性肝炎防治方案[15]), 非酒精性脂肪肝肝炎50例(以上诊断标准符合2010年修订的非酒精性脂肪性肝病诊疗指南[16]), 研究对象总数170人, <30岁组38人, 30岁组114人, 45岁组18人. 另选用同期15例非肝脏疾病死亡的正常肝组织作对照. 所选病例行肝穿活检, 标本常规用40 g/L中性甲醛固定, 石蜡包埋. 兔抗人多克隆抗体Caspase-3试剂盒、凋亡检测试剂盒均购自北京中杉金桥生物技术有限公司.
1.2.1 临床肝脏活检: 170例患者均进行1秒钟肝脏穿刺术, 所获取标本用40 g/L甲醛溶液固定, 常规石蜡切片, 行HE染色, 免疫组织化学检测丙肝病毒标志物, 依据2000年修订的病毒性肝炎防治方案及2010年修订的非酒精性脂肪性肝病诊疗指南进一步将肝脏损害程度分为轻度、中度、重度.
1.2.2 Caspase-3免疫组织化学检测: 采用免疫组织化学染色PV两步法检测肝组织中Caspase-3的表达. 按常规程序操作, 一抗工作液浓度: Caspase-3 1:50, DAB显色. 设阳性和阴性对照. 阴性对照采用PBS代替一抗. Caspase-3的表达阳性为细胞浆和细胞核中有棕黄色颗粒. 每个切片随机选取不重叠5个高倍视野(400倍), 用Motic Med数码医学图像分析系统分别测定每个视野阳性染色部位的光密度, 取其平均值即得切片的平均光密度值. 用平均光密度代表Caspase-3在肝组织中的表达水平. 每例组织切片随机观察5个高倍视野, 阳性细胞数≤10%为阴性(-), >10%为阳性(+).
1.2.3 细胞凋亡的检测: 采用TdT介导的脱氧核甘酸切口末端标记法(TdT-mediated x-dUTP nicke-nd labeling, TUNEL)检测肝细胞凋亡.
统计学处理 采用SPSS16.0软件对数据进行χ2检验, Fisher's test及Spearman等级相关分析, P<0.05有统计学意义.
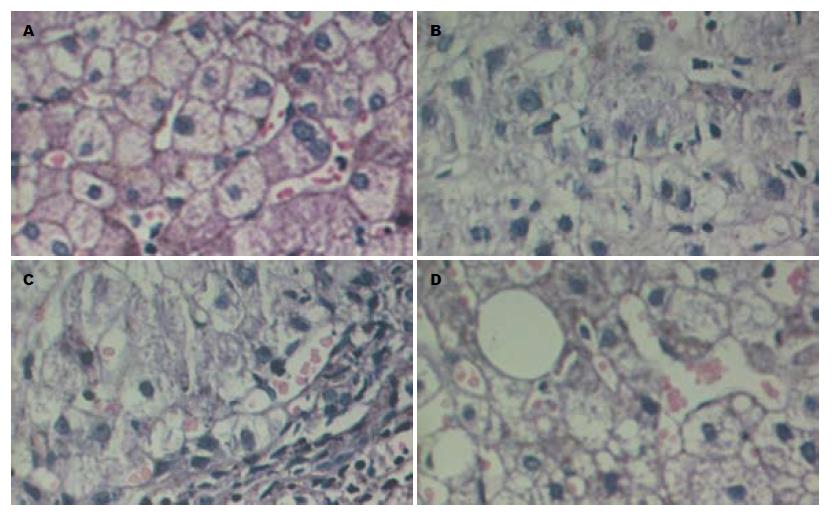
研究对象年龄构成见表1, 不同肝炎类型患者的年龄构成未见差异(χ2 = 3.928, P = 0.416), 表明3组研究对象年龄组成结构基本相同, 具有可比性. 在慢性乙型肝炎、慢性丙型肝炎及非酒精性脂肪性肝炎3组肝炎肝组织病理分型比较差异无统计学意义(χ2 = 0.191, P = 0.996, 图1, 表2). 表明3组研究对象病理组成结构基本相同, 具有可比性.
| 年龄(岁) | 慢性乙型肝炎 | 慢性丙型肝炎 | 非酒精性脂肪性肝炎 | |||
| n | % | n | % | n | % | |
| >30 | 13 | 18.6 | 10 | 20.0 | 15 | 30.0 |
| 30- | 47 | 67.1 | 35 | 70.0 | 32 | 64.0 |
| 45- | 10 | 14.3 | 5 | 10.0 | 3 | 6.0 |
| 合计 | 70 | 100.0 | 50 | 100.0 | 50 | 100.0 |
| 病理分型 | 慢性乙型肝炎 | 慢性丙型肝炎 | 非酒精性脂肪性肝炎 | |||
| n | % | n | % | n | % | |
| 轻度 | 30 | 42.0 | 21 | 42.0 | 20 | 40.0 |
| 中度 | 28 | 40.0 | 20 | 40.0 | 20 | 40.0 |
| 重度 | 12 | 17.1 | 9 | 18.0 | 10 | 20.0 |
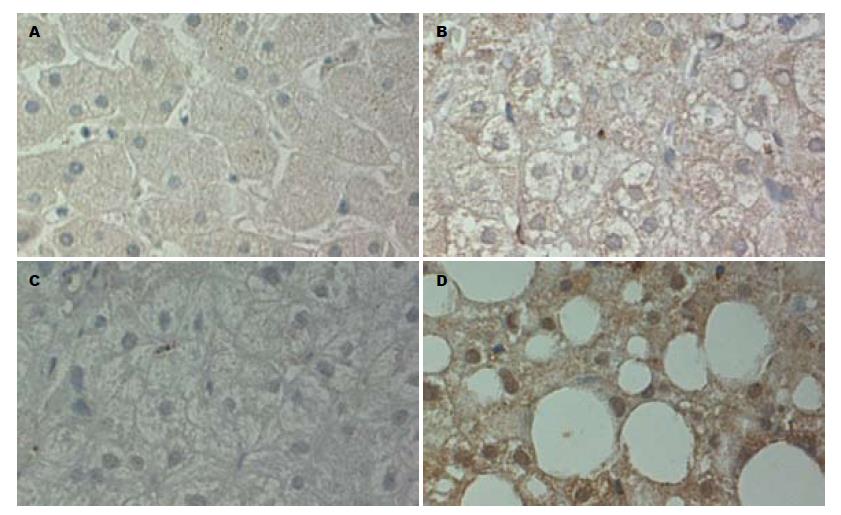
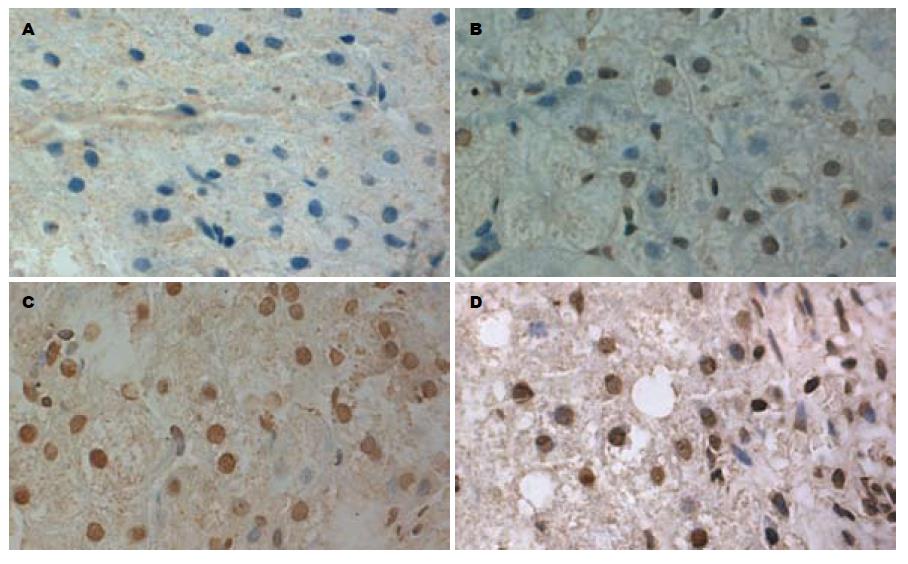
Caspase-3在慢性乙型肝炎、慢性丙型肝炎及非酒精性脂肪性肝炎肝组织中的表达(表3, 图2)与TUNEL检测的肝细胞凋亡的表达(图3)具有相关性(r = 0.356, P<0.001). Caspase-3在慢性乙型肝炎、慢性丙型肝炎及非酒精性脂肪性肝炎中的表达明显高于正常肝组织, 差异有统计学意义(P<0.001). Caspase-3在非酒精性脂肪性肝炎中表达明显高于慢性乙型肝炎, 差异有统计学意义(P<0.05); Caspase-3在慢性乙型肝炎和慢性丙型肝炎中的表达未见异常, 无统计学意义(P>0.05). 无论何种类型的肝炎, Caspase-3在各病理类型的表达存在差异(P<0.05, 表4), 进一步分析Caspase-3在重型肝炎中的表达阳性率高, 轻型肝炎表达阳性率最少, 差异有统计学意义.
| 肝炎类型 | n | TUNEL阳性 | Caspase-3阳性 | ||
| n | % | n | % | ||
| 慢性乙型肝炎 | 70 | 45 | 64.3 | 40 | 57.1 |
| 慢性丙型肝炎 | 50 | 40 | 80.0 | 36 | 72.0 |
| 非酒精性脂肪性肝炎 | 50 | 45 | 90.0 | 41 | 82.0 |
| 正常肝组织 | 15 | 4 | 26.7 | 3 | 20.0 |
| 肝炎类型 病理分型 | n | Caspase-3 | |
| 阳性数(n) | 阳性率(%) | ||
| 慢性乙型肝炎 | 30 | 12 | 40.0 |
| 轻型 | 28 | 18 | 64.3 |
| 中型 | |||
| 重型 | 12 | 10 | 83.3 |
| χ2 | 7.544 | ||
| P | 0.023 | ||
| 慢性丙型肝炎 | |||
| 轻型 | 21 | 12 | 57.1 |
| 中型 | 20 | 15 | 75.0 |
| 重型 | 9 | 9 | 100.0 |
| χ2 | Fisher's Exact Test | ||
| P | 0.049 | ||
| 非酒精性脂肪性肝炎 | |||
| 轻型 | 20 | 13 | 65.0 |
| 中型 | 20 | 18 | 90.0 |
| 重型 | 10 | 10 | 100.0 |
| χ2 | Fisher's Exact Test | ||
| P | 0.034 | ||
随着细胞凋亡概念的引入, 人们开始从细胞凋亡的角度来审视肝炎的发生、发展. 目前认为, 肝细胞凋亡增加是肝炎发病的一个重要途径, 研究发现许多酶参与凋亡, 半胱天冬酶是其中重要的一种.
细胞凋亡是受细胞外微环境和细胞内基因调控的一种细胞主动性死亡方式[17,18]. 其中Caspase-3是最关键的蛋白酶, 不仅是凋亡的关键执行者, 也是细胞凋亡过程中的主要效应因子[19-21], 本组资料用TUNEL法检测细胞凋亡显示: 在肝细胞凋亡的细胞中多有Caspase-3表达, 且肝细胞凋亡随Caspase-3表达的增高而增加. 发生凋亡的细胞的染色质浓缩、边缘化, 核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态. 本组资料显示: Caspase-3的表达与肝细胞凋亡分布区基本一致, 具有显著相关性, 说明Caspase-3参与肝细胞凋亡的信号传递过程.
肝细胞凋亡发生在肝细胞更新时, 凋亡小体(apoptotic bodies)很快被邻近的吞噬细胞所吞噬, 不引起炎症反应[22-24]. 但在慢性乙型肝炎、慢性丙型肝炎、等多种肝病时, 机体为维持自身生理状态, 细胞结构发生变化: 细胞质和染色体浓缩, DNA断裂成200 bp左右的片段, 大量凋亡小体形成, 可见大量点状坏死及碎屑样坏死的肝小叶, 即以细胞凋亡的形式停止细胞代谢, 阻止病毒的复制, 清除病毒感染的细胞, 同时肝脏功能受影响. 可见肝损伤实质主要是肝细胞凋亡[25,26]. 因此, 慢性乙型肝炎和慢性丙型肝炎的发病机制均与细胞凋亡有关[27,28]. NASH起因很复杂, 但认为此病最初的损伤是由于继发于外周胰岛素抵抗而发生的脂解作用增加和高胰岛素血症所导致的肝细胞脂肪沉积. 进一步的损伤则是因为脂肪过氧化造成肝细胞脂肪变性时产生活性氧族(reactive oxygen species, ROS)而引起氧化应激. 这导致了细胞凋亡的Caspase家族级联反应的发生、并生成一些细胞因子引起炎症反应和出现肝星状细胞激活而引起纤维化[29,30]. 本组资料显示: 在慢性乙型肝炎、慢性丙型肝炎和非酒精性脂肪性肝炎中存在大量肝细胞凋亡, 说明肝细胞凋亡是慢性乙型肝炎、慢性丙型肝炎和非酒精性脂肪性肝炎的一种重要病理变化. 本组资料还显示: 在慢性肝炎的肝组织中, 凋亡细胞越多, 肝脏损伤程度越重. 提示如果凋亡细胞增多至能足够抗拒机体吞噬作用, 过剩凋亡的肝细胞可能激发肝脏损伤, 这与Leist等[31]研究结果一致.
本研究显示, 慢性乙型肝炎、慢性丙型肝炎、非酒精性脂肪性肝炎病理损伤程度与Caspase-3的表达呈正相关, 表明Caspase-3凋亡系统的激活, 可能促进了肝脏炎症反应. 本研究还显示, Caspase-3在非酒精性脂肪性肝炎中表达明显高于慢性乙型肝炎, 非酒精性脂肪性肝炎除直接或通过促进并存的其他肝病的进展,导致肝衰竭和肝细胞癌外, 还参与2型糖尿病和动脉硬化的发病, 多种因素可能是导致Caspase-3表达增高, 有待进一步研究, Caspase-3在慢性乙型肝炎和慢性丙型肝炎中的表达未见异常, Caspase-3在不同肝炎中的表达为Caspases抑制剂应用于肝炎治疗提供理论和实验依据.
慢性乙型肝炎、慢性丙型肝炎和非酒精性脂肪性肝炎常可引起肝硬化、肝癌, 严重危害人们的健康. 其发病机制目前尚不详. 目前, 对于细胞凋亡调控机制的研究成为肝炎发病机制研究的热点.
王怡, 主任医师, 天津市传染病医院, 天津市肝病研究所
肝细胞凋亡是造成肝脏损伤和肝脏疾病最基本的中心环节, Caspase家族是肝细胞凋亡过程中重要的启动者和执行者之一. 而Caspase抑制剂的临床研究、应用可能成为下一步研究的前沿和热点.
Ribeiro等通过实验发现NASH肝组织中凋亡越明显, 炎症程度越加重. 表明凋亡与炎症有着高度的相关性. Zender等报道, 急性肝功能衰竭常由肝炎病毒引起, 预后较差. 对于如何防治肝细胞的凋亡和维持肝脏的正常功能是当前的关注焦点.
Caspases家族的研究多集中在肿瘤方面, 肝炎领域的相关研究较少, 且大多局限在动物实验阶段.
基础研究证实, 细胞凋亡在炎症的发生和发展过程中起重要作用. 因此, 检测Caspase-3在肝炎中的表达, 结合临床生化指标为深入研究肝炎发病机制提供实验依据, 对肝炎的诊断、治疗、疗效、观察、预后监测具有重要的临床价值, 为Caspase抑制剂应用于肝炎治疗提供理论依据.
本文通过对细胞凋亡关键酶Caspase-3的检测, 来探讨慢性乙型肝炎、丙型肝炎及非酒精性脂肪性肝炎的发病机制, 选材好, 立题新颖, 视角独特.
编辑: 翟欢欢 电编:鲁亚静
| 1. | Billaud JN, Peterson D, Lee BO, Maruyama T, Chen A, Sallberg M, Garduño F, Goldstein P, Hughes J, Jones J. Advantages to the use of rodent hepadnavirus core proteins as vaccine platforms. Vaccine. 2007;25:1593-1606. [PubMed] [DOI] |
| 2. | Kwon JA, Rho HM. Transcriptional repression of the human p53 gene by hepatitis B viral core protein (HBc) in human liver cells. Biol Chem. 2003;384:203-212. [PubMed] [DOI] |
| 3. | Kim JH, Kang S, Kim J, Ahn BY. Hepatitis B virus core protein stimulates the proteasome-mediated degradation of viral X protein. J Virol. 2003;77:7166-7173. [PubMed] [DOI] |
| 4. | Feldstein AE, Canbay A, Guicciardi ME, Higuchi H, Bronk SF, Gores GJ. Diet associated hepatic steatosis sensitizes to Fas mediated liver injury in mice. J Hepatol. 2003;39:978-983. [PubMed] [DOI] |
| 6. | Bellentani S, Saccoccio G, Masutti F, Crocè LS, Brandi G, Sasso F, Cristanini G, Tiribelli C. Prevalence of and risk factors for hepatic steatosis in Northern Italy. Ann Intern Med. 2000;132:112-117. [PubMed] |
| 7. | Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, Grundy SM, Hobbs HH. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40:1387-1395. [PubMed] [DOI] |
| 8. | Fan JG, Zhu J, Li XJ, Chen L, Li L, Dai F, Li F, Chen SY. Prevalence of and risk factors for fatty liver in a general population of Shanghai, China. J Hepatol. 2005;43:508-514. [PubMed] [DOI] |
| 9. | Ji Y, Lu G, Chen G, Huang B, Zhang X, Shen K, Wu S. Microcystin-LR Induces Apoptosis via NF-κB/iNOS Pathway in INS-1 Cells. Int J Mol Sci. 2011;12:4722-4734. [PubMed] [DOI] |
| 10. | Shannan B, Seifert M, Leskov K, Willis J, Boothman D, Tilgen W, Reichrath J. Challenge and promise: roles for clusterin in pathogenesis, progression and therapy of cancer. Cell Death Differ. 2006;13:12-19. [PubMed] [DOI] |
| 11. | Hossain MZ, Kleve MG. Nickel nanowires induced and reactive oxygen species mediated apoptosis in human pancreatic adenocarcinoma cells. Int J Nanomedicine. 2011;6:1475-1485. [PubMed] [DOI] |
| 12. | Tamura R, Kanda T, Imazeki F, Wu S, Nakamoto S, Tanaka T, Arai M, Fujiwara K, Saito K, Roger T. Hepatitis C Virus nonstructural 5A protein inhibits lipopolysaccharide-mediated apoptosis of hepatocytes by decreasing expression of Toll-like receptor 4. J Infect Dis. 2011;204:793-801. [PubMed] [DOI] |
| 13. | Marani M, Tenev T, Hancock D, Downward J, Lemoine NR. Identification of novel isoforms of the BH3 domain protein Bim which directly activate Bax to trigger apoptosis. Mol Cell Biol. 2002;22:3577-3589. [PubMed] [DOI] |
| 14. | Woo M, Hakem A, Elia AJ, Hakem R, Duncan GS, Patterson BJ, Mak TW. In vivo evidence that caspase-3 is required for Fas-mediated apoptosis of hepatocytes. J Immunol. 1999;163:4909-4916. [PubMed] |
| 17. | Silva KL, Vasconcellos DV, Castro ED, Vasconcelos FC, Bigni R, Maia RC. Bisphosphonates induce apoptosis in CLL cells independently of MDR phenotype. Cancer Chemother Pharmacol. 2008;62:165-171. [PubMed] [DOI] |
| 18. | Sun W, Wang W, Kim J, Keng P, Yang S, Zhang H, Liu C, Okunieff P, Zhang L. Anti-cancer effect of resveratrol is associated with induction of apoptosis via a mitochondrial pathway alignment. Adv Exp Med Biol. 2008;614:179-186. [PubMed] [DOI] |
| 19. | Gao C, Tsuchida N. Activation of caspases in p53-induced transactivation-independent apoptosis. Jpn J Cancer Res. 1999;90:180-187. [PubMed] [DOI] |
| 21. | Fernandes-Alnemri T, Litwack G, Alnemri ES. CPP32, a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1 beta-converting enzyme. J Biol Chem. 1994;269:30761-30764. [PubMed] |
| 27. | Ji C, Kaplowitz N. Betaine decreases hyperhomocysteinemia, endoplasmic reticulum stress, and liver injury in alcohol-fed mice. Gastroenterology. 2003;124:1488-1499. [PubMed] [DOI] |
| 28. | Tardif KD, Mori K, Siddiqui A. Hepatitis C virus subgenomic replicons induce endoplasmic reticulum stress activating an intracellular signaling pathway. J Virol. 2002;76:7453-7459. [PubMed] [DOI] |
| 29. | Leclercq IA, Farrell GC, Field J, Bell DR, Gonzalez FJ, Robertson GR. CYP2E1 and CYP4A as microsomal catalysts of lipid peroxides in murine nonalcoholic steatohepatitis. J Clin Invest. 2000;105:1067-1075. [PubMed] [DOI] |
| 30. | Chitturi S, Farrell GC. Etiopathogenesis of nonalcoholic steatohepatitis. Semin Liver Dis. 2001;21:27-41. [PubMed] [DOI] |
| 31. | Leist M, Gantner F, Bohlinger I, Tiegs G, Germann PG, Wendel A. Tumor necrosis factor-induced hepatocyte apoptosis precedes liver failure in experimental murine shock models. Am J Pathol. 1995;146:1220-1234. [PubMed] |